கரிமம்
அணு எண் 6 கொண்ட தனிமம் From Wikipedia, the free encyclopedia
கரிமம் (கார்பன், Carbon, வேதியல் குறியீடு C) என்பது ஒரு தனிமப் பொருள். நிகழ்வுகளைப் பதிவு செய்யும் வழக்கம் இல்லாத காலத்திற்கும் முன்பிருந்தே கரிமத்தின் பயன்பாடு இருந்து வந்ததால் அது எப்போது, யாரால் கண்டுபிடிக்கப்பட்டது என்பது தெரியாதிருக்கிறது. கரிமம் இயற்கையில் தனித்தும் கூட்டுப்பொருளாகவும் கிடைக்கிறது. தனிமமாகக் கரிமம் வைரமாகவும் (diamond) காரீயப் படிவுகளாகவும், நிலக்கரியாகவும் கிடைக்கின்றது. கரிமத்தின் கூட்டுப்பொருள்கள் பல உள்ளன. வளிம நிலையில் இருக்கும் காபனீரொட்சைட்டானது (கார்பன் டை ஆக்சைடு) கரிமம், ஒட்சிசன் என்பவற்றின் சேர்க்கையாலானதாகும். நாம் மூச்சுவிடும்போது காபனீரொட்சைட்டைக் கழிவாக வெளியேற்றினாலும் தாவரங்களின் வளர்ச்சிக்கு இது இன்றியமையாததாகும். ஐதரோக்கார்பன்களாக இது எரிவளிமத்திலும் (natural gas) பெற்றோலியத்திலும் உள்ளது. சுண்ணாம்புக்கல், சலவைக்கல் போன்றவற்றில் காபனேற்றுகளாகக் (கார்பனேட்டுகளாகக்) காணப்படுகிறது.[11] விலங்கினங்களின் உடலாகட்டும், தாவரங்களின் இழையங்களாகட்டும், கரிமத்தின் கலப்பு இல்லாதது எதுவும் இல்லை. அதனால் எப்பொருளைக் காற்றில் எரித்தாலும் காபனீரொட்சைட்டு உண்டாவதும், முழுமையாக எரியாத நிலையில் கரியாவதும் காபனோரொட்சைட்டாவதும் இயல்பாகின்றது. வைரத்தில் ஒவ்வோர் அணுவும் மற்ற நான்கு அணுக்களுடன் உறுதியாகப் பிணைந்துள்ளது. இந்த நான்கில் ஒவ்வொன்றும் வேறு நான்கு அணுக்களுடன் இணைந்துள்ளது. ஆகவே, கரிம அணுக்களைப் பிரிப்பது கடினம்.[12] கரியின் பலவகைகள் கரிமத்தையே குறிக்கின்றன.[13][14] கரிமத்தில் படிக வடிவம் கொண்டவை, படிக வடிவம் இல்லாதவை என இரு வகைகள் உள்ளன. வைரமும் காரீயமும் படிக வடிவம் கொண்டவை. கரிமமானது, மற்ற தனிமங்கள், சேர்மங்களுடன் எளிதில் சேராது. எனினும் மிக உயர்ந்த வெப்பநிலையில் மற்றத் தனிமங்களுடன் வினை புரியும். அங்கக வேதியியல் (கரிம வேதியியல்) என்ற ஒரு பிரிவு உண்டாகக் காரணமே கரிமம் தான். விண்ணிலும் கரிம உடுக்கள் என்று தனியுடுக்களே உள்ளன.[15] எல்லா உயிரினங்களிலும், எல்லாப் பொருள்களிலும் குறைந்தது ஒரு விழுக்காடாவது இத்தனிமம் உள்ளது. வைரம், காரீயம், கரி ஆகிய யாவும் கரிமத்தின் வடிவங்களே.[16] ஒட்சிசனுக்கு அடுத்தபடியாக, உயிரினங்கள் வாழக் கரிமம் இன்றியமையாதது.[17][18] கரிமமோ அதன் சேர்மங்களோ இல்லாத பொருள்களே இல்லை.[சான்று தேவை]
| கார்பன் | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
6C | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||||||||
தெளிவானது (வைரம்) & கருமையானது (காரீயம்) வைரம் (இடது), காரீயம் (வலது), நன்கு அறியப்பட்ட காபனின் பிறதிருப்பங்கள் | |||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | கார்பன், C, 6 | ||||||||||||||||||||||||||||||
| உச்சரிப்பு | /ˈkɑːrbən/ | ||||||||||||||||||||||||||||||
| தனிம வகை | அலோகம் | ||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 14, 2, p | ||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
12.0107(8) | ||||||||||||||||||||||||||||||
| இலத்திரன் அமைப்பு | 1s2 2s2 2p2 அல்லது [He] 2s2 2p2 2,4 | ||||||||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||||||||
| கண்டுபிடிப்பு | எகிப்தியர்களும் சுமோரியர்களும்[1] (கிமு 3750) | ||||||||||||||||||||||||||||||
| தனிமமாக அடையாளங் கண்டவர் | அந்துவான் இலவாசியே[2] (1789) | ||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||||||||
| நிலை | திண்மம் | ||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | amorphous:[3] 1.8–2.1 g·cm−3 | ||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | வைரம்: 3.515 g·cm−3 | ||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | காரீயம்: 2.267 g·cm−3 | ||||||||||||||||||||||||||||||
| பதங்கமாகும் நிலை | 3915 K, 3642 °C, 6588 °F | ||||||||||||||||||||||||||||||
| மும்மைப் புள்ளி | 4600 K (4327°C), 10800[4][5] kPa | ||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 117 (காரீயம்) கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 6.155 (வைரம்) 8.517 (காரீயம்) யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 4, 3[6], 2, 1[7], 0, -1, -2, -3, -4[8] | ||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 2.55 (பாலிங் அளவையில்) | ||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 1086.5 kJ·mol−1 | ||||||||||||||||||||||||||||||
| 2வது: 2352.6 kJ·mol−1 | |||||||||||||||||||||||||||||||
| 3வது: 4620.5 kJ·mol−1 | |||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 77(sp³), 73(sp²), 69(sp) pm | ||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 170 பிமீ | ||||||||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||||||||
| படிக அமைப்பு | வைரம்
(வைரம், தெளிவானது) | ||||||||||||||||||||||||||||||
| simple hexagonal
(காரீயம், கருமை) | |||||||||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic[9] | ||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 900-2300 (வைரம்) 119-165 (காரீயம்) W·m−1·K−1 | ||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 0.8 (வைரம்)[10] µm·m−1·K−1 | ||||||||||||||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 18350 (வைரம்) மீ.செ−1 | ||||||||||||||||||||||||||||||
| யங் தகைமை | 1050 (வைரம்)[10] GPa | ||||||||||||||||||||||||||||||
| நழுவு தகைமை | 478 (வைரம்)[10] GPa | ||||||||||||||||||||||||||||||
| பரும தகைமை | 442 (வைரம்)[10] GPa | ||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.1 (வைரம்}[10] | ||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
10 (வைரம்) 1-2 (காரீயம்) | ||||||||||||||||||||||||||||||
| CAS எண் | 7440-44-0 | ||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: கார்பன் இன் ஓரிடத்தான் | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
1985ஆம் ஆண்டு பந்து போன்ற ஒரு கூண்டு வடிவில் 60 கரிம அணுக்கள் கொண்ட ஒரு பெருவிந்தையான வடிவிலும் கரிமம் உள்ளது என்று கண்டுபிடிக்கப்பட்டது. இதற்கு பக்குமினிசிடர் உல்லரீன் என்று பெயர் (சுருக்கமாகப் பக்கிப் பந்து என்றும் அழைப்பர்). எனவே, கரிமம் பல மாற்றுவடிவங்களில் இருப்பதை அறிஞர்கள் கண்டுபிடித்துள்ளனர். இக்கரிமம் உயிர்வாழ்வன எல்லாவற்றிலும் (மரஞ்செடிகொடிகள், புழு பூச்சிகள் எல்லாம்) உள்ள ஒரு பொருளாகும். இப்படிப் பரவலாக இருந்தபொழுதிலும் நில உலகில் 0.03% மட்டுமே கரிம அணுக்களால் ஆனது. 1 மில்லியனுக்கும் அதிகமான கரிமங்களினாலான வெவ்வேறு மூலக்கூறுகளை வேதியியல் துறையினர் அறிவர். நாம் மூச்சு வெளிவிடும் பொழுது அதில் காபனீரொட்சைட்டு என்னும் வளிமம் உள்ளது. இது ஒரு கரிம அணு இரு ஒட்சிசன் அணுக்களுடன் சேர்ந்த ஒரு மூலக்கூறு (CO2). கரிம அணுக்கள் நீரிய (hydrogen) அணுக்களுடன் வெவ்வேறு விகிதத்தில் இணைந்து கரிம-நீரதை (ஐதரோக்காபன்) கூட்டணுப் பொருள்கள் உண்டாக்குகின்றன. இவை எரிபொருள்களாகப் பயன்பட்டு நமக்குப் பல வடிவங்களில் ஆற்றல் தருகின்றது.
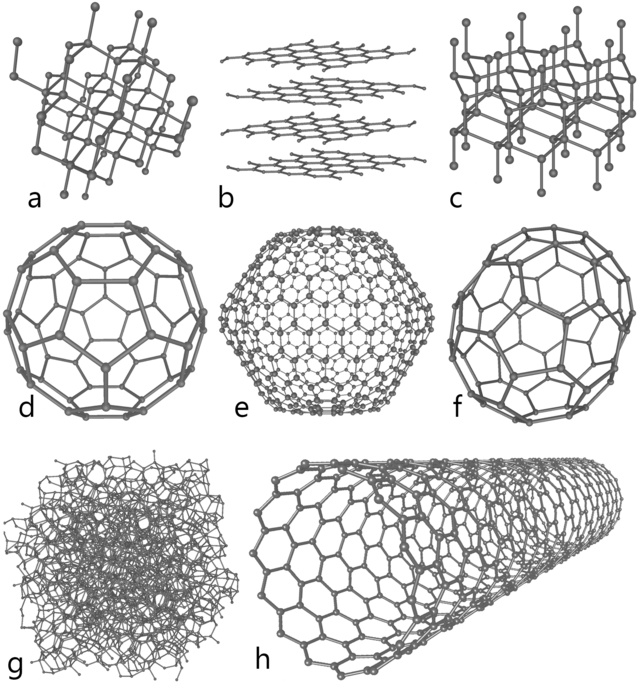
கார்பனின் வேற்றுருக்கள்
கார்பன் ஓர் அலோகமாகும். இயற்கையில் காணப்படும் கார்பனில் படிக உருவமற்ற (amorphous) கரி, கிராபைட், வைரம் என மூன்று வேற்றுருக்கள் உள்ளன.வெள்ளைக் கார்பன் (White Carbon) என்று நான்காவது வேற்றுரு இருக்கலாம் என்று அறிந்துள்ளனர். இது சிறிய கார்கள் மற்றும் ஸ்கூட்டர்களின் உடல் கட்டமைக்கப் பயன்படுகிறது 1969 ல் கார்பனின் இந்த நான்காவது வேற்றுரு இனமறியப்பட்டது. ஆவியாக்கப்பட்ட கிராபைட்டை, தாழ்ந்த வெப்ப நிலையில் திண்மமாக உறையச் செய்யும் போது இது காணப்பட்டது. வெள்ளைக் கார்பன் வழிச் செலுத்தப் படும் ஒளி இரு கூறாகத் தளவாகம் (Polarization) செய்யப்பட்டு உடுருவிச் செல்கிறது. கிராபைட் மிகவும் மென்மையான பொருட்களில் ஒன்று ஆனால் வைரம் மிகவும் கடினமான பொருள். எல்லாப் பொருட்களிலும் வைரமே கடினத் தன்மை (hardness) மிக்கது, கிராபைட்டும் ஆல்பா, பீட்டா என இரு வகைப்படுகிறது. இவை ஒத்த இயற்பியல் பண்புகளைப் பெற்றிருந்தாலும் இவற்றின் படிகக் கட்டமைப்பு மாறுபட்டிருக்கிறது. இயற்கையில் கிடைக்கும் கிராப்பைட்டில் ஆறு செவ்வகப் புறத் தளமுடைய (rhombohedral) பீட்டா வடிவம் 30 % க்கு மேல் உள்ளது. ஆனால் செயற்கையாக உற்பத்தி செய்யப்படும் கிராபைட்டில் ஆறுமுக புறத்தளமுடைய (hexagonal) ஆல்பா வடிவம் மட்டுமே உள்ளது. இயந்திரப் பண்டுவத்தினால் ஆல்பா கிராபைட்டை பீட்டா கிராபைட்டாக்க முடியும். 1000 டிகிரி C மேல் சூடு படுத்தும் போது பீட்டா கிராபைட் ஆல்பா கிராபைட்டாக உருமாறுகிறது.
1985 ஆம் ஆண்டுகுரோடோ (kroto) மற்றும் ஸ்மாலே (smalley) என்ற விஞ்ஞானிகள் நீள் வட்டப் பந்து வடிவ C 60, C 70 என்று குறிப்பிடப் படும் 60, 70 கார்பன் அணுக்களால் ஆன புல்லரின் (Fullerene) என்ற குடும்பம் சார்ந்த மூலக்கூறைக் கண்டறிந்தனர். கார்பன் அணுக்களால் மட் டுமே கட்டமைக்கப்பட்ட எந்த மூலக்கூறும் புல்லரின் எனப்படும் இது கோள வடிவில் இருந்தால் அதைப் பந்து வடிவ மூலக் கூறு (bucky ball) [19] என்றும் நீள் உருளை வடிவில் இருந்தால் அதை கார்பன் நானோ குழல் (Carbon nano tube)[20] அல்லது குழல் வடிவ மூலக்கூறு(Bucky tube) என்றும் கூறுவர்.[21] C60 , C70 மட்டுமின்றி C 72, C76 , C82 , C84 C100 போன்ற புல்லரின்களையும் அறிந்துள்ளனர்.[22][23] மிகச் சிறிய புல்லரின் ஆக C 20 உள்ளது 6500 ஒளி ஆண்டுகளுக்கு அப்பாலுள்ள ஒரு விண்மீனைச் சுற்றி யுள்ள தூசி மண்டலத் தாலான நெபுலாவில் 2010ல் C 60 என்ற புல்லரினை கண்டறிந்தனர்.
பின்னர் இதைப் போல கிராபீன் (Graphene) என்றொரு பொருளையும் உருவாக்கினார்கள் பென்சீன் கட்டமைப்பைப் போல உள்ள இதில் கார்பன் அணுக்கள் எல்லாம் ஒரே தளத்தில் அமைந்திருக்கும். கிராபீன் ,தேன் கூடு போன்ற படிக அணித் தளத்தில், ஒன்றை அணு தடிப்புடன் வெறும் கார்பன் அணுக்களின் பிணைப்பால் கட்டமைக்கப்பட்டது இதில் கார்பன் - கார்பன் பிணைப்பின் நீளம் ௦.142 நானோ மீட்டராகும். கிராபீன் தளங்களை அடுக்கி கிராபைட்டை உருவாக்கினால் அணித்தள இடைவெளி ௦.35 நானோ மீட்டராக இருக்கும்.இதன் வலிமையும் நிலைப்புத் தன்மையும் மிகவும் அதிகம்[24] . மெல்லியதாக இருந்தாலும் எஃகைக் காட்டிலும் உறுதியானதாக இருக்கின்றது. இதைக் கண்டுபிடித்து அதன் பண்புகளைத் தெரியப் படுத்தியதற்காக 2010 ல் இயற்பியலுக்கான நோபெல் பரிசு மான்செஸ்டர் பல்கலைக் கழகத்தைச் சேர்ந்த ஆண்ட்ரே கிம் (Andre Geim) மற்றும் கோன்ஸ்டன்டின் நோவோசெலோவ் (Konstantin Novoselov, Константин Новоселов) ஆகியோருக்கு வழங்கப்பட்டது.
கார்பனின் இயற்பியல் பண்புகள்
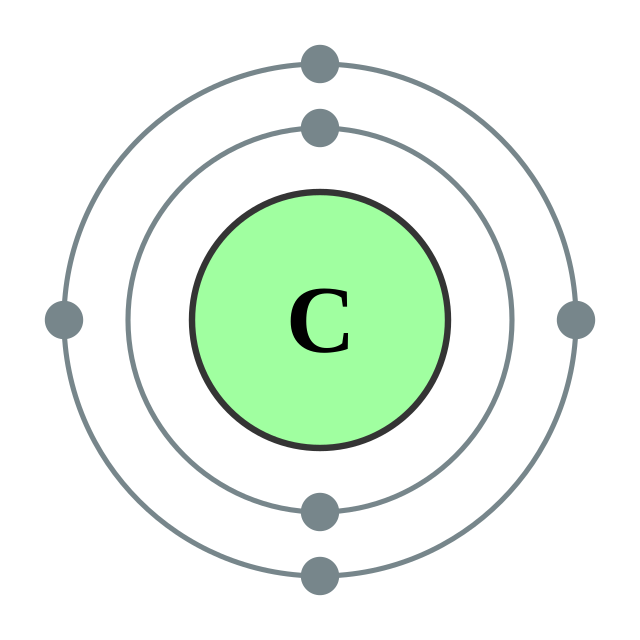
C என்ற குறியீட்டுடன் குறிப்பிடப்படுகின்ற கரிமத்தின் அணு எண் 6. எனவே இதனுள் ஆறு நேர்மின்னியும் (புரோட்டானும்), ஆறு எதிர்மின்னியும் (மின்னணு, எலக்ட்ரான்) உள்ளன. இதன் அணு எடை 12. அணுக்கருவுள், 6 நொதுமின்னியும் (நியூட்ரான்) உண்டு. கரிமம் தன் கெட்டியான திண்ம நிலையில் இருந்து உருகுவதில்லை, ஆனால் 3500 C வெப்ப நிலையில், நேரடியாய் வளிம நிலையை அடைகின்றது. இவ்வகையாக உருகாமல் நேரடியாய் வளிமமாக மாறுவதற்கு பொசுங்குதல் என்று பெயர். கரிமத்தின் அடர்த்தி 2.25 கி/கன செ. மீ. கொதி நிலை 4173 K.[25][26] C-14 என்பது இக்கரிம அணுவின் சமதானி (அணுவெண் மாறாமல், அணுவெடை மட்டும் மாறி உள்ள வடிவம்). அணுவின் நிறையை அணுத்திணிவு அலகால் (automic mass unit) குறிப்பிடுவார்கள். இதற்கு கார்பன் படித்தரமாகக் கொள்ளப்பட்டுள்ளது கார்பன் சில உலோகங்களுடன் கூடி கார்பைடுகளை ஏற்படுத்துகின்றது. இவை உலோகப் பண்பில் சிறிதளவும்,அலோகப் பண்பில் சிறிதளவும் கொண்டுள்ளன.கால்சியம், அலுமினியம்,சிலிகான் கார்பைடுகள் பெரிதும் அறியப்பட்டுள்ளன. இவை உறுதி மிக்கதாகவும், உயர் உருகு நிலை கொண்டதாகவும் இருப்பதால் உயர் வெப்பநிலையைத் தாக்குப் பிடிக்கும் பயன்பாட்டிற்கு உகந்ததாக இருக்கிறது.
வேதிப் பண்புகள்
கார்பன் மந்தமாக வினை புரியக் கூடிய ஒரு தனிமமாகும். காற்றில் எரிக்கும் போது ஆக்சிஜனுடன் கூடி கார்பன் டை ஆக்சைடை உண்டாக்குகின்றது. கந்தக ஆவியில் இது கார்பன் டை சல்பைடாக மாறுகிறது. புளோரினுடன் நேரடியாகக் கூடுகிறது. ஆனால் பிற ஹாலஜன்களுடனும், நைட்ரஜனுடனும் வினை புரிவதில்லை. ஹைட்ரஜனுடன் கூடி பல ஆயிரக் கணக்கான வேதிப் பொருட்களை உண்டாக்கி இருக்கிறது. உயிரியல் மூலக் கூறுகள் பெரும்பாலும் இவ்வகையின. இதனால் கரிம வேதியியல் (Organic Chemistry) என்ற தனிப் பிரிவே தோற்றுவிக்கப்பட்டது.
பயன்கள்
வைரம்
கார்பனின் ஒரு வடிவம் வைரமாகும். இது மிகவும் உறுதியானது.[27] வைரத்தின் ஒளி விலகல் எண் ணும் (refractive index), பிரிகைத் திறனும் (dispersive power) மிகவும் அதிகம். அதனால் அது பிரகாசமாய் ஒளியைச் சிந்துகிறது. வைரம், அமிலம், காரம் மற்றும் ஆக்சிஜனூட்டிகளால் பாதிக்கப் படுவதில்லை. 800 டிகிரி C வரை சூடுபடுத்தும் போது கார்பன்டை ஆக்சைடாக மாறி விடுகிறது. இது அணிகலண் தயாரிப்பிலும் கண்ணாடிகளை அறுக்கவும் பயன்படுகிறது.



கிராபைட்
கிராபைட் ஒரு மென்மையான கரிமப் பொருளாகும்.[28] கரியையும் மணலையும் மின் உலையில் வைத்து தொடர்ந்து சூடு படுத்த கார்பன் சிலிகேட் உண்டாகி சிலிகான் ஆவியாக்கப் பட்டு கிராபைட் உண்டாகிறது. கிராபைட் செறிவூட்டப் பட்ட நைட்ரிக் அமிலத்தால் பாதிக்கப்படுகின்றது. மின்சாரத்தைக் கடத்தினாலும் வெப்பத்தைச் சிறிதும் கடத்தாத கிராபைட் தீச்செங்கல், உலோகங்களை உருக்க உதவும் மண் குப்பிகள் போன்றவற்றைத் தயாரிக்கப் பயன்படுகிறது. கிரபைட்டுடன் களிமண் கலந்து பென்சில் தயாரிக்கின்றாகள். இதில் சிறிதளவு ஈயமும் கலக்கப்படும். கிராபைட் ஒரு மசகுப்பொருளாகவும் பயன்தருகிறது. வர்ணங்களின் தயாரிப்பு முறையிலும் மின் சாதனங்கள் மற்றும் மின்கலங்களில் மின்வாயாகவும் (electrode) பயன்படுகிறது.[29]
மரக்கரி
மரக்கரி சில வளிமங்களை உட்கவர்ந்து கொள்கிறது. இப்படி உட்கவரப்படும் வளிமம் இயல்பான நிலையில் இருக்கும் போது இருப்பதை விட கூடுதல் தீவிரமிக்கதாய் இருக்கிறது. இப் பண்பு உயர் வெற்றிட வெளியை உண்டாக்கவும் உட்கவரப்படாத நீயான், ஹீலியம் வளிமத்திலிருந்து எளிதில் உட்கவரப்படும் வளிமங்களை பிரித்தெடுக்கவும் பயன்படுத்தப்படுகிறது. வயிற்றில் சேர்ந்துள்ள வளிமத்தை அகற்ற கரி சேர்க்கப்பட்ட ரொட்டித் துண்டுகளை மருந்தாகக் கொடுக்கும் பழக்கம் கை வைத்திய முறையில் இன்றைக்கும் பின்பற்றப்படுகிறது. குடிநீரை மணம் அகற்றி கிருமிகளை நீக்கி கழிவு நீரைச் சுத்தப்படுத்தும் முறையிலும் கரி பயன்படுத்தப்படுகிறது. உலோகங்களின் ஆக்சைடு கனிமத்திலிருந்து ஆக்சிஜனிறக்கம் செய்து உலோகத்தைத் தனித்துப் பிரிக்கக் கரி பெரிதும் உதவுகிறது. கரிப்புகைப் படிவு, இசைத்தட்டுகள், கார்பன்தாள், தார்ப்பாய்கள் போன்றவற்றின் தயாரிப்பு முறையில் பயன்படுகிறது. எலும்புக்கரி கரைசலின் நிறமிப் பொருளைக் கவர்ந்து வெண்மையூட்டுவதால் சக்கரைக் கரைசலிலிருந்து சீனி (சர்க்கரை) தயாரிக்கப் பயன்படுத்தப்படுகிறது.
நிலக்கரி
நிலக்கரி என்பது முழுமையான கார்பன் இல்லை. அதில் கார்பன் தவிர்த்து எப்போதும் நைட்ரஜன், ஆக்சிஜன், கந்தகம் போன்றவைகளும் மேலும் சிலிகா, அலுமினா மற்றும் பெரிக் ஆக்சைடு போன்றவைகளும் சேர்ந்திருக்கும். தொல்படிவு படிப்படியாகப் பெற்ற சிதைவுகளைப் பொறுத்து அதில் கார்பனின் அளவு இருக்கும். மரத்தில் 40 விழுக்காடும், அடுப்புக் கரியில் 60 விழுக்காடும், பழுப்பு நிலக்கரியில் 70 விழுக்காடும் கருப்பு நிலக்கரியில் 78 விழுக்காடும், ஆந்திரசைட் நிலக்கரியில் 90 விழுக்காடும் கார்பன் உள்ளது. நிலக்கரி தொழிற்சாலைகளில் எரி பொருளாகப் பயன்படுகிறது. அனல் மின்சாரம் தயாரிக்க நிலக்கரி ஆதரவாய் உள்ளது.
பிற பயன்கள்
தார்ச் சாலைகள் போடப் பயன்படுகிறது. தாரிலிருந்து பல வேதிப்பொருட்களைப் பிரித்தெடுத்து அவற்றைக் கொண்டு வண்ணமூட்டிகள், மருந்துகளுக்கான மூலப்பொருட்கள், வெடிபொருட்கள், நறுமணப் பொருட்கள், இனிப்புப் பொருட்கள் போன்றவற்றை உற்பத்தி செய்கிறார்கள்.
கார்பன் கால மதிப்பீட்டு முறை
கார்பனின் மற்றொரு பயன்பாடு கார்பன் கால மதிப்பீட்டு முறை (Carbon dating) ஆகும். உயிர் வாழும் மரத்தில் நிலைத்த கார்பன்-12 உடன் கார்பன்-14 என்ற கதிரியக்க அணுவும் உட்கவரப்பட்டு நிலைப்படுகின்றன. இவை இரண்டும் ஒரு சம நிலையில் இருக்கும். ஆனால் மரம் வெட்டப்பட்டவுடன், கார்பன் உட்கவருதல் இல்லாததால் கார்பன்-14 சிதைவுற்று அதன் செழுமை குறையும் இதன் செழுமையை அளவிட்டறிந்து மரத்தின் காலத்தை மதிப்பிட முடியும்.

இவற்றையும் பார்க்க
மேற்கோள்
வெளி இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.