பிசுமத்
வேதியியல் உலோகம் From Wikipedia, the free encyclopedia
பிசுமத் (Bismuth) ஒரு வேதியியல் உலோகம் ஆகும். இதன் தனிம அட்டவணைக் குறியீடு Bi. இதன் அணுவெண் 83. இது ஒரு மென்மையன உலோகம் அகும். பிசுமத் இயற்கையாகவே தனிம வடிவில் காணப்படுகின்றது. பிசுமத்தின் ஒக்சைட்டுகளும், சல்பைடுகளும் இயற்கையில் காணப்படுகின்றன. . இது ஈயத்தை விட சிறிது அடர்த்தி குறைந்தது, அதாவது ஈயத்தின் அடர்த்தியின் 86% அடர்த்தியைக் கொண்டது. உருவாக்கியவுடன் வெள்ளை நிறங்கலந்த வெள்ளிப் பளபளப்பை உடையது. எனினும் வளியில் திறந்து வைத்தால் உலோக மேற்பரப்பு ஒக்சியேற்றமடைந்து இளஞ்சிவப்பு நிற பளபளப்பை அடையும். இது உலோகங்களுக்குரிய இயல்புகளை மந்தமாகவே வெளிப்படுத்துகின்றது. பிசுமத் மிக மந்தமாகவே வெப்பத்தைக் கடத்தும்.
| பிசுமத் | |||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
83Bi | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||||||||||||||||||||
lustrous silver | |||||||||||||||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | பிசுமத், Bi, 83 | ||||||||||||||||||||||||||||||||||||||||||
| உச்சரிப்பு | /ˈbɪzməθ/ BIZ-məth | ||||||||||||||||||||||||||||||||||||||||||
| தனிம வகை | poor metal | ||||||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 15, 6, p | ||||||||||||||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
208.98040(1) | ||||||||||||||||||||||||||||||||||||||||||
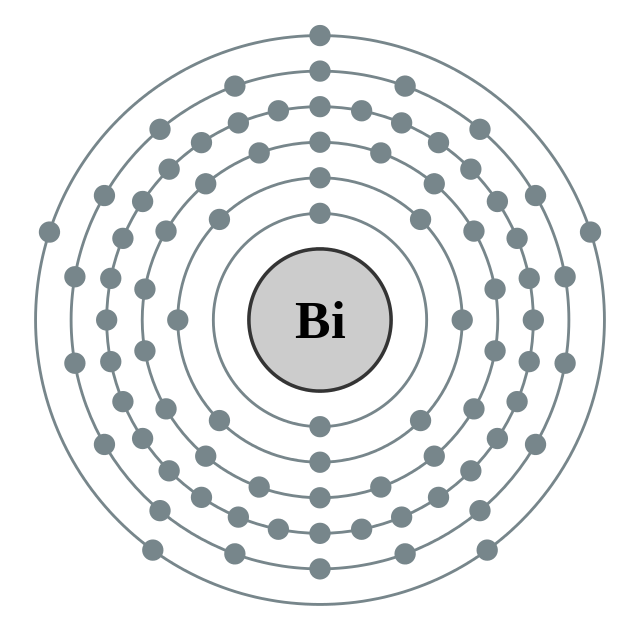
| இலத்திரன் அமைப்பு | [Xe] 4f14 5d10 6s2 6p3 2, 8, 18, 32, 18, 5 | ||||||||||||||||||||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||||||||||||||||||||
| கண்டுபிடிப்பு | Claude François Geoffroy (1753) | ||||||||||||||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||||||||||||||||||||
| நிலை | solid | ||||||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 9.78 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 10.05 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||
| உருகுநிலை | 544.7 K, 271.5 °C, 520.7 °F | ||||||||||||||||||||||||||||||||||||||||||
| கொதிநிலை | 1837 K, 1564 °C, 2847 °F | ||||||||||||||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 11.30 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 151 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 25.52 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 5, 4, 3, 2, 1 (mildly காடிic oxide) | ||||||||||||||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 2.02 (பாலிங் அளவையில்) | ||||||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 703 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||
| 2வது: 1610 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||
| 3வது: 2466 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 156 பிமீ | ||||||||||||||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 148±4 pm | ||||||||||||||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 207 பிமீ | ||||||||||||||||||||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | rhombohedral[1] | ||||||||||||||||||||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic | ||||||||||||||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 1.29 µΩ·m | ||||||||||||||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 7.97 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 13.4 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 1790 மீ.செ−1 | ||||||||||||||||||||||||||||||||||||||||||
| யங் தகைமை | 32 GPa | ||||||||||||||||||||||||||||||||||||||||||
| நழுவு தகைமை | 12 GPa | ||||||||||||||||||||||||||||||||||||||||||
| பரும தகைமை | 31 GPa | ||||||||||||||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.33 | ||||||||||||||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
2.25 | ||||||||||||||||||||||||||||||||||||||||||
| பிரிநெல் கெட்டிமை | 94.2 MPa | ||||||||||||||||||||||||||||||||||||||||||
| CAS எண் | 7440-69-9 | ||||||||||||||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: பிசுமத் இன் ஓரிடத்தான் | |||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||
பிசுமத்தின் நிலைப்புத்தன்மை அதிகமான சமதானி பிசுமத்-209 ஆகும். பிசுமத்தே மிக அதிகமான அணுவெண்ணுடைய ஆனால் நிலையான தனிமமென பலகாலம் கருதப்பட்டு வந்தது. எனினும் 2003ஆம் ஆண்டில் நடத்தப்பட்ட ஆராய்ச்சியின் விளைவாக பிசுமத் சிறிதளவு கதிரியக்கத்தை வெளிப்படுத்துகின்றமை கண்டறியப்பட்டுள்ளது. பிசுமத்-209இன் அரை வாழ்வுக்காலம் பிர்பஞ்சத்தின் வயதை விட ஒரு பில்லியன் மடங்கு அதிகமானது. எனவே பிசுமத் ஆபத்தை விளைவிக்கும் அளவுக்கு கதிரியக்கமுள்ளதல்ல. தற்போது ஈயமே மிகப்பெரிய அணுவெண்ணுடைய நிலையான தனிமமென கருதப்படுகின்றது.
பிசுமத் அதன் தூய வடிவிலும் சேர்மமாகவும் பல்வேறு வகையில் பயன்படுத்தப்படுகின்றது. பிசுமத் உற்பத்தியில் அரைவாசி பிசுமத்தின் சேர்மங்களுக்காக உற்பத்தி செய்யப்படுகின்றது. பிசுமத்தானது அழகு சாதனப்பொருட்களிலும், நிறத்துணிக்கைத் தயாரிப்பிலும் பெப்டோ-பிஸ்மொல் போன்ற சில மருந்து வகைத் தயாரிப்பிலும் பயன்படுத்தப்படுகின்றது. பிசுமத் மிகவும் குறைவான விஷத்தன்மையையே கொண்டது. இது ஈயத்தை விட சிறிதளவே அடர்த்தி குறைந்ததாலும், ஈயம் அதிக விஷத்தன்மை உடையதென்பதாலும் ஈயம் பயன்படுத்தப்பட்ட பிரயோகங்களுக்குப் பதிலீடாக பிசுமத் பயன்படுத்தப்படுகின்றது.
பண்புகள்


இயற்பியல் பண்புகள்
- உடையக்கூடிய உலோகம்
- இளஞ்சிவப்பு நிற வெள்ளிப் பளபளப்புடையது.
- இவ்வுலோகத்தின் மேலுள்ள ஒக்சைட்டுப் படையின் வேறுபட்ட தடிப்பு காரணமாக வானவில் போன்று பல நிறங்களில் ஒளியைத் தெறிப்படையச் செய்கின்றது.
- உலோகங்களுள் அதிக காந்தவெதிர்த்தன்மையுடைய உலோகம்
- வெப்பக்கடத்துதிறன் மிகவும் குறைவானது
- அதிக மின் தடை கொண்ட உலோகம், சில வேளைகளில் குறைகடத்தியாகவும் செயற்படும்.
- பிசுமத்தின் திரவ நிலை திண்ம நிலையை விட அடர்த்தி கூடியதாகும். பிசுமத் திரவமாகும் போது 3.32% கனவளவில் குறைகின்றது.
வேதியியல் பண்புகள்
சாதாரண வெப்பநிலையில் நீருடன் பிசுமத் தாக்கமடையாது. செஞ்சிவப்புச் சூட்டுடன் இருக்கும் போது நீராவியுடன் தாக்கமடைந்து பிசுமத்(III) ஒக்சைட்டைத் தோற்றுவிக்கும்
- 2 Bi + 3 H2O → Bi2O3 + 3 H2
500 °C வெப்பநிலையில் புளோரினுடன் தாக்கமடைந்து பிசுமத்(V) புளோரைடைத் தோற்றுவிக்கும்.இதை விடக் குறைவான வெப்பநிலையில் பிசுமத்(III) புளோரைடைத் தோற்றுவிக்கும். குறைவான வெப்பநிலையில் பொதுவாக பிசுமத் ஹேலோஜன்களுடன் தாக்கமடைந்து பிசுமத்(III) ஹேலைடுக்களைத் தோற்றுவிக்கும்.
- 2 Bi + 3 X2 → 2 BiX3 (X = F, Cl, Br, I)
பிசுமத் செறிவான சல்பூரிக் அமிலத்துடன் தாக்கமடைந்து பிசுமத் சல்பேட்டையும், கந்தகவீரொக்சைட்டையும் தோற்றுவிக்கும்.
- 6 H2SO4 + 2 Bi → 6 H2O + Bi2(SO4)3 + 3 SO2
பிசுமத் நைத்திரிக் அமிலத்துடன் தாக்கமடைந்து பிசுமத்(III) நைத்திரேற்றைத் தோற்றுவிக்கும்.
- Bi + 6 HNO3 → 3 H2O + 3 NO2 + Bi(NO3)3
ஒக்சிசனுடனும் ஐதரோகுளோரிக் அமிலத்துடன் பிசுமத் தாக்கமடைந்து பிசுமத் குளோரைட்டைஉருவாக்கும்.
- 4 Bi + 3 O2 + 12 HCl → 4 BiCl3 + 6 H2O
சமதானிகள்
பிசுமத்-209 சமதானியே பிசுமத்தின் சமதானிகளில் மிகவும் நிலைப்புத்தன்மை உடையதாகும்; அத்தோடு இச்சமதானி என்றும் அழியாத நிலைப்புத்தன்மை உடையதென 2003க்கு முன்னர் கருதப்பட்டு வந்தது. எனினும் அணுக்கருவியல் கொள்கைகளின் அடிப்படையில் இச்சமதானி நிலைப்புத்தன்மையற்றது என்பதால் இது தொடர்பான பல ஆராய்ச்சிகள் மேற்கொள்ளப்பட்டன. 2003ஆம் ஆண்டு பிரான்சின் ஓர்சேயில் நடத்தப்பட்ட பரிசோதனையின் மூலம் 209Bi சமதானியின் அல்பா கதிர் வெளியேற்றல் அரை வாழ்வுக் காலம் ஏறத்தாழ 1.9×1019 வருடங்கள் எனக் கணக்கிடப்பட்டுள்ளது. எனவே பிசுமத் உண்மையாக சொற்பளவு கதிரியக்கம் உடைய தனிமமாகும். எனினும் இதன் அரை வாழ்வுக் காலம் பிரபஞ்சத்தின் கணக்கிடப்பட்ட வயதான 4.5×109 வருடங்களை விட பில்லியன் மடங்குக்கும் அதிகமாகையாலும் பிசுமத் அதிகளவில் பயன்படுத்தப்படுவதாலும், இது பொதுவாக நிலையான தனிமமெனவே தற்போதும் வழங்கப்பட்டு வருகின்றது. பிசுமத்தின் அரை வாழ்வுக்காலமே மிகவும் உயர்வான அல்பாக்கதிர் வெளியேற்றல் அரை வாழ்வுக் காலமாகும். எனினும் இரட்டை-பீட்டா கதிர்களைக் காலும் டெலூரியம்-128 சமதானியின் அரை வாழ்வுக் காலம் 2.2×1024 வருடங்களாகும்.
ரேடியத்தைச் சக்தி வாய்ந்த ஒளியணுக்களால் (போட்டோன்களால்) தாக்குவதன் மூலம் செயற்கையாக பிசுமத்-213 (213Bi) தயாரிக்கப்படுகின்றது. இச்சமதானி புற்றுநோய்ச் சிகிச்சைகளில் பயன்படுத்தப்படும் வாய்ப்புள்ளது.
மேற்கோள்கள்
மேலும் படிக்க
வெளியிணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.