பலேடியம்
வேதியியல் தனிமம் From Wikipedia, the free encyclopedia
பலேடியம் (Palladium) என்பது அரிதாகக் கிடைக்கும் வெள்ளி போன்ற நிறமுடைய ஒரு வேதியியல் தனிமம் ஆகும். இதன் வேதியியல் குறியீடு Pd என்பதாகும். இதன் அணுவெண் 46 மற்றும் இதன் அணுக்கருவினுள் 60 நொதுமிகள் உள்ளன. பலேடியத்தின்வேதியியல் இயல்பில் பிளாட்டினத்தின் வேதியியலை ஒத்திருக்கின்றது. இத்தனிமத்தை 1803 ஆம் ஆண்டு ஆங்கிலேய வேதியியலாளர் வில்லியம் அய்டு வொல்லாசுடன் கண்டுபிடித்தார். கிரேக்கர்களின் அறிவுக் கடவுளாகக் கருதப்படும் பல்லாசு என்னும் தெய்வத்தின் நினைவாகவும், சிறுகோள் பல்லாசு கண்டுபிடிக்கப்பட்டதைத் தொடர்ந்தும் இத்தனிமத்திற்கு பலேடியம் என்ற பெயரைச் சூட்டினார். பலேடியம், பிளாட்டினம், ரோடியம், ருத்தேனியம், இரிடியம் மற்றும் ஒசுமியம் போன்ற தனிமங்கள் ஒன்றாகச்சேர்ந்து பிளாட்டினம் குழுதனிமங்களை உருவாக்குகின்றன. இவையனைத்தும் ஒத்த வேதிப்பண்புகளைக் கொண்டுள்ளன. ஆனால் பலேடியம் மட்டும் குறைவானஉருகுநிலையும் அடர்த்தியும் கொண்டதனிமமாக உள்ளது.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பொது | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| பெயர், குறி எழுத்து, தனிம எண் |
பலேடியம், Pd, 46 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வேதியியல் பொருள் வரிசை | பிறழ்வரிசை மாழைகள் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, வலயம் |
10, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | வெள்ளி போல் வெண்மை  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு நிறை (அணுத்திணிவு) | 106.42(1) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| எதிர்மின்னி அமைப்பு | [Kr] 4d10 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| சுற்றுப் பாதையிலுள்ள எதிர்மின்னிகள் (எலக்ட்ரான்கள்) | 2, 8, 18, 18, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயல்பியல் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயல் நிலை | திண்மம் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அறை வெ.நி அருகில்) | 12.023 கி/செ.மி³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகுநிலையில் நீர்மத்தின் அடர்த்தி | 10.38 g/cm³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகு வெப்பநிலை | 1828.05 K (1554.9 °C, 2830.82 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கொதி நிலை | 3236 K (2963 °C, 5365 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நிலை மாறும் மறை வெப்பம் | 16.74 கி.ஜூ/மோல் (kJ/mol) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வளிமமாகும் வெப்ப ஆற்றல் | 362 கி.ஜூ/மோல் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | (25 °C) 25.98 ஜூ/(மோல்·K) J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | கட்டகம், முகநடு | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஆக்சைடு நிலைகள் | 2, 4 (மென் கார ஆக்ஸைடு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| எதிர்மின்னியீர்ப்பு | 2.20 (பௌலிங் அளவீடு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் | 1st: 804.4 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2nd: 1870 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3rd: 3177 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 140 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுவின் ஆரம் (கணித்) | 169 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கூட்டிணைப்பு ஆரம் | 131 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வான் டெர் வால் ஆரம் | 163 பி.மீ (pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வேறு பல பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| காந்த வகை | no data | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின் தடைமை | (20 °C) 105.4 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கடத்துமை | (300 K) 71.8 வாட்/(மீ·கெ) W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப நீட்சி | (25 °C) 11.8 மைக்.மீ/(மி.மீ·கெ) µm/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஒலியின் விரைவு (மெல்லிய கம்பி வடிவில்) | (20 °C) 3070 மீ/நொடி | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| யங்கின் மட்டு | 121 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 44 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அமுங்குமை | 180 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.39 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மோவின்(Moh's) உறுதி எண் | 4.75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| விக்கர் உறுதிஎண் Vickers hardness | 461 MPa (மெகாபாஸ்) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பிரிநெல் உறுதிஎண் Brinell hardness]] | 37.3 MPa (மெகாபாஸ்) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS பதிவெண் | 7440-05-3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| குறிபிடத்தக்க ஓரிடத்தான்கள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மேற்கோள்கள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
பலேடியமும் மற்றும் அதனைப் பின்தொடரும் பிளாட்டினமும் மோட்டார் வாகன இயந்திரங்களில் வினைத்திறன் மாற்றிகளாகப் பயன்படுத்தப்படுகின்றன, மோட்டார் வாகனங்கள் வெளியிடும் புகையில் காணப்படும் நச்சு வாயுக்களான கார்பனோராக்சைடு, நைட்ரசன்டைஆக்சைடு மற்றும் நச்சுப்பொருள்களான ஐதரோகார்பன்கள் போன்றவற்றை 90% அளவிற்கு நச்சு நீக்கப்பட்ட வேதிப்பொருட்களாக மாற்றி வெளியிட இத்தனிமங்கள்உதவுகின்றன. மேலும் பலேடியம் மின்னணுவியல், பல் மருத்துவம், மருத்துவம், ஐதரசன் சுத்திகரிப்பு, இரசாயனபயன்பாடுகள், நிலத்தடி நீர் சிகிச்சை மற்றும் அணிகலன்கள் ஆகியவற்றிலும் பல்லேடியம் பயன்படுத்தப்படுகிறது. மின்சாரம், வெப்பம், நீர் ஆகியவற்றை உற்பத்திசெய்வதற்கு பயன்படும் எரிபொருள் மின்கலன்களில் இது ஆக்சிசன் மற்றும் ஐதரசனுடன் வினைபுரியும் முக்கிய வேதிப்பொருளாகப்பயன்படுகிறது.
பலேடியம் மற்றும் பிளாட்டினம் தொகுதி தனிமங்களின் தாதுக்கள் மிகவும் அரிதானவையாகும். விரிவான கனிமப்படிவுகள் தென்ஆப்பிரிக்கா, அமெரிக்கா, கனடா உருசியா போன்ற நாடுகளில் காணப்படுகின்றன. வாகனங்களில் பயன்படுத்தப்படும் வினைத்திறன் மாற்றிகளை மறுசுழற்சி செய்து பல்லேடியம் தயாரிப்பதும் ஒர் ஆதார மூலமாகும். அதிகத் தேவையும் குறைவான விநியோகமும் முதலீட்டுத் துறையில் முக்கியத்துவத்தை உருவாக்கிவிட்டது. அண்மையில் (2007ல்) பல்லேடியம் ஓர் அரிய மாழை அல்லது உயர்மதிப்பு மாழையாக சந்தைகளில் (Exchange-traded fund(ETF)) வாங்கி விற்கப்படுகின்றது
பண்புகள்
பலேடியம் தனிம வரிசை அட்டவணையின் பத்தாவது குழுவில் இடம்பெற்றுள்ளது. ஆனால் வெளிவட்டப் பாதையில் உள்ள எலக்ட்ரான் கூட்டில் நிரம்பியுள்ள எலக்ட்ரான் ஒழுங்கமைவு 10 ஆவது தொகுதியின் எலக்ட்ரான் ஒழுங்கமைவுக்கு மாறுபட்டுள்ளது. நையோபியம், ருத்தேனியம், ரோடியம் ஆகிய தனிமங்களின் எலக்ட்ரான் ஒழுங்கமைவைஇதனுடன் ஒப்பிட்டுக் காணலாம். மற்ற தனிமங்களைக் காட்டிலும் குறைவான எலக்ட்ரான் கூடுகளே பலேடியத்திற்கு நிரம்பியுள்ளன. இப்பண்பு பலேடியத்தின் தனிப்பண்பாகும். பலேடியத்தின் இணைதிறன் கூட்டில் 18 எலக்ட்ரான்கள் உள்ளன. நியானுக்கு அடுத்துள்ள மந்தவாயுக்களின் இணைதிறன் கூட்டில் உள்ள எட்டு எலக்ட்ரான்களைக் காட்டிலும் இதில் பத்து எலக்ட்ரான்கள் அதிகமாகும்.
பலேடியம் பிளாட்டினத்தை ஒத்திருக்கும் ஒரு மென்மையான வெள்ளி போன்ற வெள்ளை நிறமான உலோகமாகும். பிளாட்டினம் தொகுதி தனிமங்களுடன் ஒப்பிடுகையில் இது குறைந்த அடர்த்தியும் குறைவான உருகுநிலையும் கொண்டதாகும். காய்ச்சிப் பதனிடும்போது இது மென்மையாகவும் இழுத்து நீட்டும் தன்மையும் பெற்றுள்ளது. குளிர்விக்கும்போது இது கடினமாகிறது. நைட்ரிக் அமிலம், அடர்கந்தக அமிலம், ஐதரோகுளோரிக் அமிலம் போன்றவற்றுடன் பல்லேடியத்தைச் சேர்த்து சூடாக்கினால் சிறிதளவு கரைகிறது[1]. இராச திராவகத்தில் மட்டும் அறைவெப்ப நிலையிலேயே நன்றாகக் கரைகிறது. சாதாரண திட்ட வெப்பநிலையில் பல்லேடியம் ஆக்சிசனுடன் வினைபுரிவதில்லை. எனவே இது காற்றில் ஒளிமங்குவதில்லை. பல்லேடியத்தை 800 பாகை செல்சியசு வெப்பநிலைக்கு சூடாக்கினால் பலேடியம்(II) ஆக்சைடு (PdO) அடுக்கு உருவாகிறது.
சேர்மங்கள்
பலேடியம் சேர்மங்களில் பலேடியம் பொதுவாக 0 மற்றும் +2 ஆக்சிசனேற்ற நிலைகளில் காணப்படுகிறது. இதைவிட குறைவான பொது ஆக்சிசனேற்ற நிலைகளும் அறியப்படுகின்றன. பலேடியம் சேர்மங்கள் அனைத்தும் பிளாட்டினம் சேர்மங்களை ஒத்திருக்கின்றன.
 | 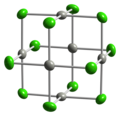 |
பலேடியம்(II)
பலேடியம்(II) குளோரைடு என்பது மற்ற பலேடியம் சேர்மங்களை தயாரிப்பதற்குத் தேவையான முதன்மை தொடக்கப் பொருளாகும். குளோரின் உடன் பலேடியம் வினைபுரிவதால் இது உண்டாகிறது. பேரியம் சல்பேட்டின் மீது பலேடியம், கார்பனின் மீது பலேடியம், கார்பனின் மீது பலேடியம் குளோரைடு போன்ற பல்வகைப்பட்ட பலேடியம் வினையூக்கிகளைத் தயாரிக்க பலேடியம்(II) குளோரைடு பயன்படுகிறது[2] .நைட்ரிக் அமிலத்திலுள்ள PdCl2 கரைசல் அசிட்டிக் அமிலத்துடன் வினைபுரிந்து பலேடியம்(II) அசிட்டேட்டைக் கொடுக்கிறது. இதுவும் ஒரு பல்நோக்கு வினைப்பொருளாகும். ஈந்தணைவிகளுடன் PdCl2 வினைபுரிந்து சமதளக் கட்டமைப்பில் PdCl2L2 என்ற அணைவுச் சேர்மங்களைக் கொடுக்கிறது. பென்சோநைட்ரைல் வழிப்பொருளான PdX2(PhCN)2 என்ற அணைவுச் சேர்மத்தை இதற்கு உதாரணமாகக் கூறலாம்[3][4]
- PdCl2 + 2 L → PdCl2L2 (L = PhCN, PPh3, NH3, etc)
பிசு(டிரைபீனைல்பாசுபீன்)பலேடியம்(II) டைகுளோரைடு என்ற அணைவுச் சேர்மம் ஒரு பயனுள்ள வினையூக்கியாகும்..[5]

பலேடியம்(0)
பலேடியம் பல்வேறு வகையான PdL4, PdL3 மற்றும் PdL2 என்ற வாய்ப்பாடுகள் கொண்ட பூச்சிய இணைதிறன் அணைவுச்சேர்மங்களை உருவாக்குகிறது. உதாரணமாக PdCl2(PPh3)2 மற்றும் PPh3 சேர்மங்களின் கலவையை ஒடுக்குதல் வினைக்கு உட்படுத்தினால் டெட்ராகிசு(டிரைபீனைல்பாசுபீன்)பலேடியம்(0) உருவாகிறது :[6]
- 2 PdCl2(PPh3)2 + 4 PPh3 + 5 N2H4 → 2 Pd(PPh3)4 + N2 + 4 N2H5+Cl−.
டிரிசு(டைபென்சிலிடீனசிட்டோன்)டைபலேடியம்(0) (Pd2(dba)3), என்ற மற்றொரு பிரதானமான பலேடியம்(0) அணைவுச் சேர்மம் சோடியம் டெட்ராகுளோரோபலேடேட்டு சேர்மத்தை டைமென்சிலிடினசிட்டோன் முன்னிலையில் ஒடுக்கப்பட்டு தயாரிக்கப்படுகிறது[7].
பலேடியம்(0) மற்றும் பலேடியம்(II) சேர்மங்கள் இரண்டும் இணைபிணைப்பு வினைகளில் வினையூக்கியாகச் செயல்படுகின்றன. 2010 ஆம் ஆண்டு வேதியலுக்கான நோபல் பரிசு ரிச்சர்டு எப். எக், ஐ-இச்சி நெகிசி மற்றும் ஆகிரா சுசுகி ஆகியோருக்கு இவ்வினை தொடர்பான ஆராய்ச்சிகளுக்காகவே வழங்கப்பட்டது. வேதிப்பொருள்களை தயாரிப்பதற்காக இவ்வினைகள் பரவலாகப் பயன்படுத்தப்படுகின்றன. எக் வினை, சுசுகி வினை, சோனோகாசுகிரா கொடுக்கிணைப்பு வினை, சிடில்லெ வினை, மற்றும் குமாதா கொடுக்கிணைப்பு வினை உள்ளிட்டவை முக்கியமான இன்வகை கொடுக்கிணைப்பு வினைகளாகும். பலேடியம்(II), டெட்ராகிசு(டிரைபீனைல்பாசுபீன்)பலேடியம்(0) (Pd(PPh3)4 மற்றும் டிரிசு(டைபென்சிலிடினசிட்டோன்)டைபலேடியம்(0) இரண்டும் வினையூக்கியாகவும் முன்னோடி வினையூக்கியாகவும் செயற்படுகின்றன [8].
பிற ஆக்சிசனேற்ற வினைகள்
ஒப்பீட்டளவில் Pd(IV) சேர்மங்கள் அரிதானவைகளாகும். சோடியம் எக்சாகுளோரோபலேடேட்டு(IV) (Na2[PdCl6]) ஒரு உதாரணமாகும். பலேடியம்(III) சேர்மங்கள் சிலவும் அறியப்படுகின்றன[9] பலேடியம்(VI) 2002 ஆம் ஆண்டு கண்டறியப்பட்டது[10][11].ஆனால் உடனே அது நிருபிக்கப்படவில்லை[12][13] கலப்பு இணைதிறன் பலேடியம் அணைவுச் சேர்மங்களும் அறியப்படுகின்றன. உதாரணம் Pd4(CO)4(OAc)4Pd(acac)2 ஒரு முடிவில்லாத பலேடியம் சங்கிலி கட்டமைப்பில் உருவாகிறது. Pd4(CO)4(OAc)4 மற்றும் Pd(acac)2 அலகுகள் ஒன்றுடன் ஒன்று இணைக்கப்படாமல் உருவாதல் மாற்று வழிமுறையாகும்[14].
பயன்கள்
பலேடியத்தின் மிகமுக்கியமான பயன் வினையூக்க மாற்று வினைகளைக் குறிப்பிடலாம். ஆபரணங்களாகவும், பல் மருத்துவத்திலும், கைகடிகாரம் உருவாக்கத்திலும், இரத்தச் சர்க்கரை சோதனை கீற்றுகளிலும், விமான தீப்பொறி ஆப்புகளிலும், அறுவைச் சிகிச்சை உபகரணங்கள் தயாரிப்பிலும், மின்னியல் தொடர்புகளிலும் பலேடியம் பயன்படுத்தப்படுகிறது. தொழில்முறை புல்லாங்குழல் போன்ற இசைக்கருவிகள் தயாரிப்பிலும் இது பயன்படுகிறது. நாணயங்களைக் குறிக்கும் சிர்தரக் குறியீடுகளில் பலேடியம் குறியீடும் பயன்படுத்தப்படுகிறது. இத்தகைய குறியீடுகள் பெற்ற நான்கு உலோகங்களில் பலேடியமும் இன்றாகும். தங்கம், பிளாட்டினம், வெள்ளி ஆகியன இதர மூன்று உலோகங்களாகும். பலேடியம் ஐதரசனை ஈர்த்துக் கொள்ளும் திறன் வாய்ந்தது ஆகும். 1989 ஆம் ஆண்டு தொடங்கப்பட்ட சர்ச்சைக்குரிய குளிர் இணைவு சோதனைகளில் பலேடியமே மிக முக்கியமான உட்கூறாகும்.
முன்பாதுகாப்பு
மற்ற பிளாட்டினம்-குழு உலோகங்களைப் போலவே மொத்தமாக பலேடியமும் மந்தவினை தனிமமாக இருந்தாலும் தோல் நோய்களுக்கு காரணமாவதாக அறிவிக்கப்பட்டுள்ளது. பலேடியம் கலந்துள்ள கலப்புலோகங்கள் பல் மருத்துவத்தில் பயன்படுத்தப்படும் போது ஒவ்வாமையை உண்டாக்குவதாகவும் கூறப்படுகிறது. இவற்றைப் பயன்படுத்துவதை தவிர்க்கவும் அறிவுறுத்தப்படுகிறது [15][16][17][18][19].
பலேடியம் அதிக அளவு கொடுக்கப்பட்டால் அது உயிர்கொல்லும் நச்சாக மாறலாம். கொறித்துண்ணிகள் மீதான சோதனைகள் இது புற்றுநோய் ஊக்கியாக இருக்கலாம் என்று கூறுகின்றன. இருப்பினும் மேலே மேற்கோள் காட்டப்பட்ட சமீபத்திய ஆராய்ச்சிகள் இத்தனிமத்தால் மனிதர்களுக்கு தீங்கு உண்டாக்கும் என்பதற்கான தெளிவான சான்றுகள் எதுவும் குறிப்பிடப்படவில்லை.
மேற்கோள்கள்
வெளி இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

