சீசியம்
வேதித் தனிமம் - அணு எண் 55 From Wikipedia, the free encyclopedia
சீசியம் (Caesium) என்பது Cs என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதியியல் தனிமம் ஆகும். இதனுடைய அணு எண் 55 ஆகும் இதன் அணுக்கருவில் 78 நொதுமிகள் உள்ளன. சீசியம் மென்மையான வெள்ளிய தங்கம் போன்ற தோற்றம் கொண்ட கார உலோகங்கள் வரிசையைச் சேர்ந்த ஒரு தனிமம் என்று தனிம வரிசை அட்டவணையில் வகைப்படுத்தப்பட்டுள்ளது. சீசியத்தின் உருகுநிலை அறை வெப்பநிலைக்கு நெருங்கிய வெப்பநிலையான 28 °செல்சியசு வெப்பநிலையாகும். ருபீடியம் (39 °செல்சியசு), பிரான்சியம் (27 °செல்சியசு), காலியம் (30 °செல்சியசு) போன்ற தனிமங்களும் அறை வெப்பநிலைக்கு அருகாமையில் உருகுநிலையைக் கொண்ட நீர்மநிலை தனிமங்களாகும் துல்லிய அணு மணிகாட்டிகளில் சீசியம் அணு பயன்படுகின்றது. சீசியத்தின் இயற்பியல் மற்றும் வேதியியல் பண்புகள் ரூபிடியம் மற்றும் பொட்டாசியம் போன்ற தனிமங்களின் இயற்பியல் மற்றும் வேதியியல் பண்புகளை ஒத்த பண்புகளைக் கொண்டுள்ளது. இக்குழுவில் இடம்பெற்றுள அனைத்து உலோகங்களையும் விட அதிக வினைத்திறன் கொண்ட இவ்வுலோகம் காற்றில் தானே பற்றிக் கொள்ளும் உலோகமாக உள்ளது. -116 ° செல்சியசு வெப்பநிலையிலும் கூட தண்ணீருடன் இது வினைபுரிகிறது. பாலிங் அளவு கோலில் 0.79 என்ற மதிப்பைக் கொண்டுள்ள மிகவும் குறைவான எலக்ட்ரான் கவர் ஆற்றலை சீசியம் கொண்டுள்ளது. சீசியம் -133 என்ற ஒரே ஒரு நிலையான ஐசோடோப்பை சீசியம் பெற்றுள்ளது. சீசியம் பெரும்பாலும் பொலூசைட்டு என்ற கனிமத்தில் இருந்து தயாரிக்கப்படுகிறது. அதே நேரத்தில் கதிரியக்க ஐசோடோப்பான சீசியம்- 137 அணுக்கரு பிளவு மூலம் உருவாகும் விளைபொருளாகும். அணு உலைகளில் இருந்து வெளியேறும் கழிவுகளிலிருந்து இது பிரித்தெடுக்கப்படுகிறது.
| சீசியம் | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
55Cs | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | ||||||||||||||||||||||||||||||||||||||||
வெள்ளி-தங்கம் | ||||||||||||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | சீசியம், Cs, 55 | |||||||||||||||||||||||||||||||||||||||
| உச்சரிப்பு | /ˈsiːziəm/ SEE-zee-əm | |||||||||||||||||||||||||||||||||||||||
| தனிம வகை | கார மாழைகள் | |||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 1, 6, s | |||||||||||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
132.90545196(6) | |||||||||||||||||||||||||||||||||||||||
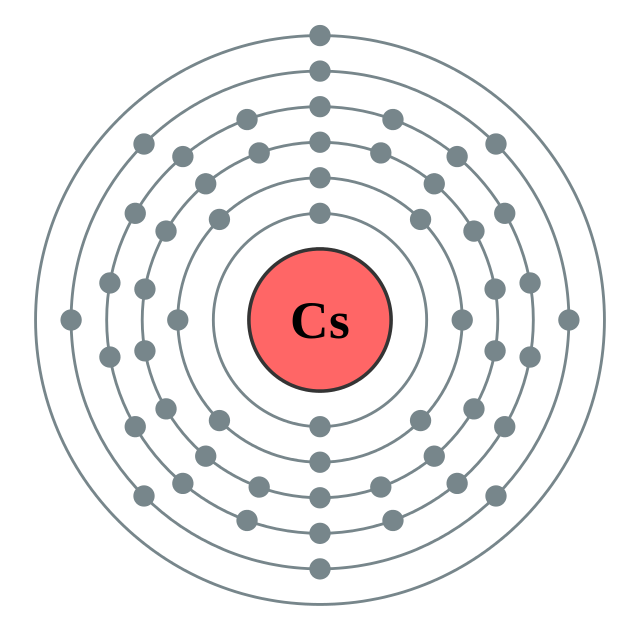
| இலத்திரன் அமைப்பு | [Xe] 6s1 2, 8, 18, 18, 8, 1 | |||||||||||||||||||||||||||||||||||||||
| வரலாறு | ||||||||||||||||||||||||||||||||||||||||
| கண்டுபிடிப்பு | ராபர்ட் பன்சன் மற்றும் குசுத்தாவ் கிர்க்காஃப் (1860) | |||||||||||||||||||||||||||||||||||||||
| முதற்தடவையாகத் தனிமைப்படுத்தியவர் |
கார்ல் செட்டர்பர்க் (1882) | |||||||||||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||
| நிலை | திண்மம் (இயற்பியல்) | |||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 1.93 g·cm−3 | |||||||||||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 1.843 g·cm−3 | |||||||||||||||||||||||||||||||||||||||
| உருகுநிலை | 301.7 K, 28.5 °C, 83.3 °F | |||||||||||||||||||||||||||||||||||||||
| கொதிநிலை | 944 K, 671 °C, 1240 °F | |||||||||||||||||||||||||||||||||||||||
| மாறுநிலை | 1938 K, 9.4[1] MPa | |||||||||||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 2.09 கி.யூல்·மோல்−1 | |||||||||||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 63.9 கி.யூல்·மோல்−1 | |||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 32.210 யூல்.மோல்−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| ஆவி அழுத்தம் | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 1, −1 (கார ஆக்சைடு) | |||||||||||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 0.79 (பாலிங் அளவையில்) | |||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் | 1வது: 375.7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||
| 2வது: 2234.3 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| 3வது: 3400 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 265 பிமீ | |||||||||||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 244±11 pm | |||||||||||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 343 பிமீ | |||||||||||||||||||||||||||||||||||||||
| பிற பண்புகள் | ||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | body-centered cubic | |||||||||||||||||||||||||||||||||||||||
| காந்த சீரமைவு | paramagnetic[2] | |||||||||||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 205 nΩ·m | |||||||||||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 35.9 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 97 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||
| யங் தகைமை | 1.7 GPa | |||||||||||||||||||||||||||||||||||||||
| பரும தகைமை | 1.6 GPa | |||||||||||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
0.2 | |||||||||||||||||||||||||||||||||||||||
| பிரிநெல் கெட்டிமை | 0.14 MPa | |||||||||||||||||||||||||||||||||||||||
| CAS எண் | 7440-46-2 | |||||||||||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | ||||||||||||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: சீசியம் இன் ஓரிடத்தான் | ||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||
செருமானிய வேதியியலாளர் இராபர்ட் புன்சன் மற்றும் இயற்பியலாளர் குசுடாவ் கிர்சாஃப் ஆகியோர் 1860 ஆம் ஆண்டில் புதிதாக உருவாக்கப்பட்ட சுடர் நிறமாலை மூலம் சிசியத்தை கண்டுபிடித்தனர். வெற்றிடக் குழாய்களிலும் ஒளிமின்கலன்களிலும் தொடக்கத்தில் சிரிய அளவில் சீசியம் பயன்படுத்தப்பட்டது. ஒளியின் வேகம் பிரபஞ்சத்தில் மிகவும் மாறாத பரிமாணமாக இருப்பதாக ஐன்சுடீனின் ஆதாரத்தின் மீது 1967 ஆம் ஆண்டில், மேற்கொள்ளப்பட்ட நடவடிக்கை காரணமாக சர்வதேச அலகு அமைப்பு முறைமைகள் சிசியம் -133 ஐசோடோப்பைப் பயன்படுத்தத் தொடங்கியது. அதிலிருந்து, சீசியம் அதிக துல்லியமான அணுக் கடிகாரங்களில் பரவலாக பயன்படுத்தப்பட்டது.
1990 களில் இருந்து சீசியம் தனிமத்தின் மிகப்பெரிய பயன்பாடாகக் கருதப்படுவது துளையிடும் திரவங்களுக்காக இதைப் பயன்படுத்துவது ஆகும். ஆனால் மின்சக்தி உற்பத்தி, மின்னியல் மற்றும் வேதியியல் துறைகளில் பல்வேறு பயன்பாடுகளுக்கும் இது பயன்படுத்தப்பட்டது. கதிரியக்க ஐசோடோப்பான சீசியம்-137 அரை ஆயுட்காலமாக 30 வருடங்களைப் பெற்றுள்ளது.இது மருத்துவத்துறையில் பயன்படுத்தப்படுகிறது. கதிரியக்கமல்லாத சீசியச் சேர்மங்கள் குறைந்த அளவு நச்சுத்தன்மை கொண்டவையாக உள்ளன. ஆனால் தூயநிலையில் இருக்கும் சீசியம் நீருடன் தீவிரமாக வெடித்தலுடன் வினைபுரிவதால் உதை தீங்கு விளைவிக்கும் தனிமமாகக் கருதுகிறார்கள். கதிரியக்க ஐசோடோப்புகள் குறிப்பிடத்தக்க சுகாதார விளைவுகளையும் சுற்றுச்சூழல் தீங்கையும் விளைவிக்கிறது.
இயற்பியல் பண்புகள்
மோவின் கடினத்தன்மை அளவுகோலில் 0.2 மோ மதிப்பைக் கொண்ட சீசியம் ஒரு மென்மையான உலோகமாகக் கருதப்படுகிறது. இதை தகடாகவும் அடிக்கலாம் கம்பியாகவும் நீட்டலாம். வெளிர் நிறத்தில் காணப்படும் ஒரு உலோகம் இதுவாகும். ஆக்சிசனுடன் வினைபுரிந்து கருமையாகிறது[4][5][6]. கனிம எண்ணெய்களில் வைத்து எடுத்துச் செல்லும் போது இது தன்னுடைய பளபளப்பை இழந்து சாம்பல் நிறத்திற்கு மங்கிவிடுகிறது. 28.5° செல்சியசு என்ற குறைந்த உருகுநிலையைக் கொண்டு அறை வெப்பநிலையில் நீர்ம நிலையில் உள்ள சில தனிமங்களின் வரிசையில் ஒன்றாக இதுவும் இடம்பிடிக்கிறது. பாதரசம் மட்டுமே சீசியத்தைக் காட்டிலும் குறைந்த உருகுநிலை கொண்ட தனிமமாக உள்ளது. மேலும் கூடுதலாக சீசியம் மட்டுமே 641° செல்சியசு வெப்பநிலை என்ற குறைந்த கொதிநிலை கொண்ட தனிமமாகும். பாதரசம் மட்டுமே இதைவிட குறைந்த கொதிநிலை கொண்ட தனிமமும் ஆகும். சிசியத்தின் சேர்மங்கள் நீல நிறம் அல்லது ஊதா நிறத்துடன் எரிகின்றன.
மற்ற கார உலோகங்களுடனும், தங்கம், மற்றும் பாதரசம் போன்ற உலோகங்களுடனும் சீசியம் உலோகக் கலவைகளை உருவாக்குகிறது. 650 ° செல்சியசு வெப்பநிலைக்கு கீழான வெப்பநிலையில் இது கோபால்ட், இரும்பு, மாலிப்டினம், நிக்கல், பிளாட்டினம், தங்குதன் ஆகியவற்றுடன் உலோகக் கலவைகளை உருவாக்குவதில்லை. ஆண்டிமனி, காலியம், இண்டியம், தோரியம் போன்ற ஒளி உணர் தனிமங்களுடன் சிசியம் இணைந்து உலோகமிடை சேர்மங்களை உருவாக்குகிறது. இலித்தியம் தவிர மற்ற கார உலோகங்கள் அனைத்துடனும் சீசியம் கலக்கிறது. 41% சீசியம், 47% பொட்டாசியம் மற்றும் 12% சோடியம் கலந்து உருவாக்கப்படும் கலப்புலோகம் மிகக் குறைந்த உருகுநிலை கொண்ட உலோகக் கலவையாக கருதப்படுகிறது. CsHg2 மற்றும் CsHg உள்ளிட்ட சில இரசக் கலவைகளும் அறியப்படுகின்றன.
பயன்பாடுகள்
சீசியத்தின் ஐசோடோப்பான Cs 137,புற்றுநோய்கான கதிர்மருத்துவத்திலும் அண்மை கதிர் மருத்துவத்திலும் தொலைக்கதிர் மருத்துவத்திலும் பயன்படுகிறது. அதன் குறைந்த ஆற்றலால் அதனைக் கையாழுவது எளிமையாக இருக்கிறது.30.5 வருட அரை வாழ்நாளும் சாதகமாக உள்ளன.
அணு உலைகளில் யுரேனியம் பிளவுறும் போது கிடைக்கப்பெறும் பல தனிமங்களில் சீசியம் 137 னும் ஒன்று. இதனுடன் கதிரியக்கம் இல்லாத சீசியம் 133 அணுவும் கதிரியக்கமும் குறைந்த அரை வாழ்நாளும் கொண்ட சீசியம் 134 அணுவும் கிடைக்கின்றன.சீசியம் 137 னின் ஒப்புக் கதிரியக்கம் அதாவது ஒரு கிராம் சீசியம் 137 னுடைய கதிரியக்கம் 25 கியூரி அளவேயாகும். சீசியம் 137 ,கதிர் ஐசோடோப்பிலிருந்து 0.66 மில்லியன் எலக்ட்ரான் வோல்ட் காமா கதிர்கள் வெளிப்படுகின்றன.இது தோல்பரப்பில் காணப்படும் புற்றுநோய்க்கு மருத்துவம் மேற்கொள்ள ஏற்றது.வெளிப்படும் β துகளின் ஆற்றல் 0.51 மி. எ.வோ.அளவே ஆகும்.
மேற்கோள்கள்
புற இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.