காலியம்
From Wikipedia, the free encyclopedia
காலியம் (ஆங்கிலம்: Gallium (அ.ப.அ: /ˈgaliəm/) ஒரு வேதியியல் தனிமம். இதன் வேதியியல் குறியீடு Ga. இதன் அணுவெண் 31 மற்றும் இதன் அணுக்கருவில் 39 நொதுமிகளும் உள்ளன. பார்ப்பதற்கு இது வெண்சாம்பல் அல்லது வெள்ளிய வெண்மை நிறத்தில் உள்ள மாழையிலி வகையைச் சேர்ந்த தனிமம். இது அறைவெப்பநிலையில் திண்மமாக உள்ளது, ஆனால் எளிதில் உடையும் பண்பு (முரியல் பண்பு அல்லது நொறுநொறுப்புத் தன்மை) உடையது. இது அளவில் மிகவும் குறைவாகவே உலகில் கிடக்கும் ஒரு தனிமம். காலியமானது ஆர்சனிக் என்னும் மற்றுமொரு தனிமத்துடன் சேர்ந்து காலியம்-ஆர்சினைடு என்னும் சேர்மம் உண்டாகின்றது. இது சிலிக்கானுக்கு அடுத்த முக்கியமான குறைக்கடத்தியாகும். காலியம்-ஆர்சினைடுதனில் எதிர்மின்னிகள் சிலிக்கானில் உள்ள எதிர்மின்னிகளைக்காட்டில் அதிக நகர்மியம் கொண்டது, ஆகையால் விரைவாக இயங்கும் நுண்மின் கருவிகள் செய்யலாம். காலியம்-ஆர்சினைடுதனைப் பயன்படுத்தி ஒளிவிடும் இருமுனையக் கருவிகள் (LED) செய்யலாம் (சிலிக்கானில் இப்படிச் செய்வது இயலாது இருந்தது, இப்பொழுதும் செய்வது மிகக் கடினம்). காலியம் நைட்ரஜனுடன் சேர்ந்து காலியம்-நைட்ரைடு என்னும் சேர்மம் உண்டாகின்றது. இது நீல நிற ஒளிவிடும் இருமுனையங்களைச் செய்யப் பயன்படுகின்றது. புவியில் இதன் செழுமை ஈயத்தின் செழுமைக்குச் சமமானது. பாதரசத்தின் செழுமையை விட 30 மடங்கு அதிகமானது. இயற்கையில் துத்தநாகம், ஜெர்மானியம், அலுமினியம் போன்றவற்றுடன் சேர்ந்தே காலியம் காணப்படுகின்றது.
| காலியம் | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
31Ga | |||||||||||||||||||
| |||||||||||||||||||
| தோற்றம் | |||||||||||||||||||
வெள்ளிய வெண்மை | |||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||
| பெயர், குறியீடு, எண் | காலியம், Ga, 31 | ||||||||||||||||||
| உச்சரிப்பு | /ˈɡæliəm/ GAL-ee-əm | ||||||||||||||||||
| தனிம வகை | குறை மாழை | ||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 13, 4, p | ||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
69.723(1) | ||||||||||||||||||
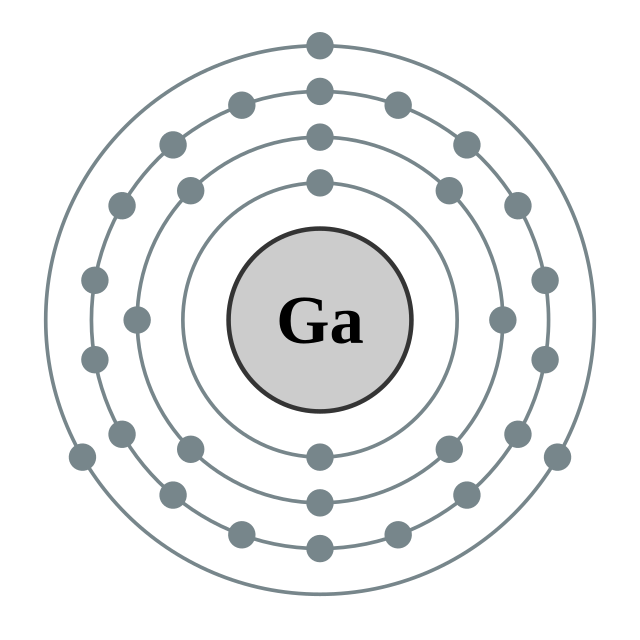
| இலத்திரன் அமைப்பு | [Ar] 4s2 3d10 4p1 2, 8, 18, 3 | ||||||||||||||||||
| வரலாறு | |||||||||||||||||||
| முன்னூகிப்பு | திமீத்ரி மெண்டெலீவ் (1871) | ||||||||||||||||||
| கண்டுபிடிப்பு | Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| முதற்தடவையாகத் தனிமைப்படுத்தியவர் |
Lecoq de Boisbaudran (1875) | ||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||
| நிலை | திண்மம் | ||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 5.91 g·cm−3 | ||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 6.095 g·cm−3 | ||||||||||||||||||
| உருகுநிலை | 302.9146 K, 29.7646 °C, 85.5763 °F | ||||||||||||||||||
| கொதிநிலை | 2477 K, 2204 °C, 3999 °F | ||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 5.59 கி.யூல்·மோல்−1 | ||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 254 கி.யூல்·மோல்−1 | ||||||||||||||||||
| வெப்பக் கொண்மை | 25.86 யூல்.மோல்−1·K−1 | ||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||
| |||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 3, 2, 1 (ஈரியல்பு ஆக்சைட்டு) | ||||||||||||||||||
| மின்னெதிர்த்தன்மை | 1.81 (பாலிங் அளவையில்) | ||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 578.8 kJ·mol−1 | ||||||||||||||||||
| 2வது: 1979.3 kJ·mol−1 | |||||||||||||||||||
| 3வது: 2963 kJ·mol−1 | |||||||||||||||||||
| அணு ஆரம் | 135 பிமீ | ||||||||||||||||||
| பங்கீட்டு ஆரை | 122±3 pm | ||||||||||||||||||
| வான்டர் வாலின் ஆரை | 187 பிமீ | ||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||
| படிக அமைப்பு | orthorhombic | ||||||||||||||||||
| காந்த சீரமைவு | diamagnetic | ||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 270 nΩ·m | ||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 40.6 W·m−1·K−1 | ||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 18 µm·m−1·K−1 | ||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 2740 மீ.செ−1 | ||||||||||||||||||
| யங் தகைமை | 9.8 GPa | ||||||||||||||||||
| பாய்சான் விகிதம் | 0.47 | ||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
1.5 | ||||||||||||||||||
| பிரிநெல் கெட்டிமை | 60 MPa | ||||||||||||||||||
| CAS எண் | 7440-55-3 | ||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||
| முதன்மைக் கட்டுரை: காலியம் இன் ஓரிடத்தான் | |||||||||||||||||||
| |||||||||||||||||||
கண்டுபிடிப்பு
தனிம அட்டவனையை நிறுவிய மென்டலீவ் என்பார் அலுமினியத்திற்கும் (அணுவெண் 13) இன்டியத்திற்கும் (அணுவெண் 49) இடையில் அவற்றின் பண்புகளை ஒத்த ஒரு தனிமம் இருக்க வேண்டும் என்றும் அதை ஏக அலுமினியம் என்று அழைக்கலாம் என்றும் கூறினார். இந்த ஏக அலுமினியமே பாய்ஸ் பௌட்ரனின் கண்டு பிடிப்பிற்குப் பின்னர் காலியம் ஆனது. 1875 ல் பிரான்சு நாட்டின் பால் எமில் பௌத்ரன்(Paul Emile Lecoq de Boisbaudran) என்பாரால் கண்டுபிடிக்கப்பட்டது. தனிம அட்டவணையில் மூன்றாம் வரிசையில் உள்ள போரான், அலுமினியம், இன்டியம் போன்ற தனிமங்களின் நிறமாலைகளுக்கிடையேயுள்ள ஒற்றுமைகளை ஆராய்ந்த போது கிடைத்த வீழ்படிவு ஆக்ஸி -ஹைட்ரஜன் சுவாலையில் ஊதா முனையில் இரு புதிய வரிகளை ஏற்படுத்தியது.[1] பாய்ஸ் பௌத்ரன் காலியத்தைக் கண்டுபிடித்தார்.[2] இந்த வீழ்படிவு புதிய உலோகமாகக் காலியமானது. பிரான்சு நாட்டிற்கு இலத்தீன் மொழியில் காலியா என்று பெயர். தன் நாட்டைக் கௌரவிக்கும் வகையில் இப் புதிய தனிமத்திற்கு காலியம் எனப் பெயரிட்டார்.[3]
பண்புகள்
இதன் வேதிக் குறியீடு Ga, அணுவெண் 31, அணுநிறை 69.72, அடர்த்தி 5950 கிகி /கமீ, உறை நிலையும், கொதி நிலையும் முறையே 29.78 பாகை செல்சியசு, 2403 பாகை செல்சியசு. அறை வெப்ப நிலைக்கு அருகாமையில் நீர்ம நிலையில் இருக்கும் உலோகங்களுள் பாதரசம், சீசியம் மற்றும் ருபீடியம் தவிர்த்து காலியமும் ஒன்றாகும்.[4][5][6] இவ்வியல்பால் காலியம் உயர் வெப்பநிலையை அளவிடும் வெப்பமானிகளில் பயன்படுத்தப்படுகின்றது. எல்லா உலோகங்களிலும் இதுவே நீண்ட வெப்ப நிலை நெடுக்கையில் நீர்மமாக இருக்கின்றது. உயர் வெப்பநிலையிலும் இதன் ஆவி அழுத்தம் மிகவும் குறைவு. நீர்மக் காலியம் திண்மமாக உறையும் போது 3.2 % பருமப் பெருக்கம் அடைகின்றது.[7] இது போன்ற பண்பை ஆண்டிமணி, பிஸ்மத் மற்றும் ஜெர்மானியம் போன்ற தனிமங்கள் மட்டுமே பெற்றிருக்கின்றன.
காலியம் அணித் தளங்களில் மிக எளிதாக ஊடு பரவுவதால் பெரும்பாலான உலோகங்களை அரித்தெடுத்து விடுகின்றது.[8] பல உலோகங்களுடன் சேர்ந்து கலப்பு உலோகங்களைத் தருகின்றது.[9] தாழ்ந்த உருகு நிலை உடைய சில கலப்பு உலோகங்கள், தாழ்ந்த வெப்ப நிலையில் பற்றவைப்புக்குப் பயன்படுகின்றன. காலியம் பிற உலோகங்களின் இயற்பியல் பண்புகளை குறிப்பிடும் படியாக மாற்றி விடுகின்றது. காலியம் தோய்த்த அலுமினியம் மிக எளிதில் உடைந்து நொறுங்கி விடுகின்றது. இதனால் காலியத்தை வானவூர்திகளில் ஏற்றிச் செல்வதில்லை.
வேதியியல் வினையால் காலியம் ஏறக்குறைய துத்தநாகத்தை ஒத்திருக்கிறது. அலுமினியத்தை விடச் சற்று குறைந்த அளவு வேதி வினைகளில் ஈடுபடும் தன்மை கொண்டது. அலுமினியத்தைப் போல காலியமும் ஒரு மெல்லிய ஆக்சைடு படலத்தைப் புறப்பரப்பில் ஏற்படுத்திக் கொள்கிறது. இப் படலம் காலியம் வளி மண்டலத்திலுள்ள ஆக்சிஜனுடன் வினையாற்றுவதைத் தடுக்கின்றது.
பொதுவாக காலியம் மட்டும் செறிந்துள்ள கனிமங்கள் அதிகம் காணப்படுவதில்லை. அலுமினியத்தின் கனிமமான பாக்சைட்டில் காலியம் 0.001 முதல் 0.008 சதவீதம் என்ற என்ற அளவில் காணப்படுகின்றது.[10] இன்றைக்குப் பெருமளவு காலியம் அலுமினியச் சுத்திகரிப்பு வழிமுறையிலிருந்தே பெறப்படுகின்றது.
மேற்கோள்களும் குறிப்புகளும்
வெளி இணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.