Efedryna
związek chemiczny Z Wikipedii, wolnej encyklopedii
Efedryna – organiczny związek chemiczny, alkaloid roślinny, pochodna fenyloetyloaminy. Stosowana jako stymulant, reduktor apetytu, środek zwiększający koncentrację i uwagę, lekarstwo na nieżyt nosa oraz do leczenia niedociśnienia związanego z narkozą. Występuje w roślinach z rodzaju przęśl (Ephedra equisetina, Ephedra sinica, Ephedra distachya) oraz w cisie (Taxus baccata). Jest najczęściej dostępna w formie chlorowodorku i siarczanu.
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny |
C10H15NO | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
165,23 g/mol | ||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały, krystaliczny proszek lub bezbarwne kryształy[1] | ||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS |
299-42-3 (wolna amina) | ||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki |
fenyloetyloamina, adrenalina, amfetamina, metamfetamina, pseudoefedryna | ||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||||
| ATC | |||||||||||||||||||||||||||||
| Legalność w Polsce | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
Struktura chemiczna
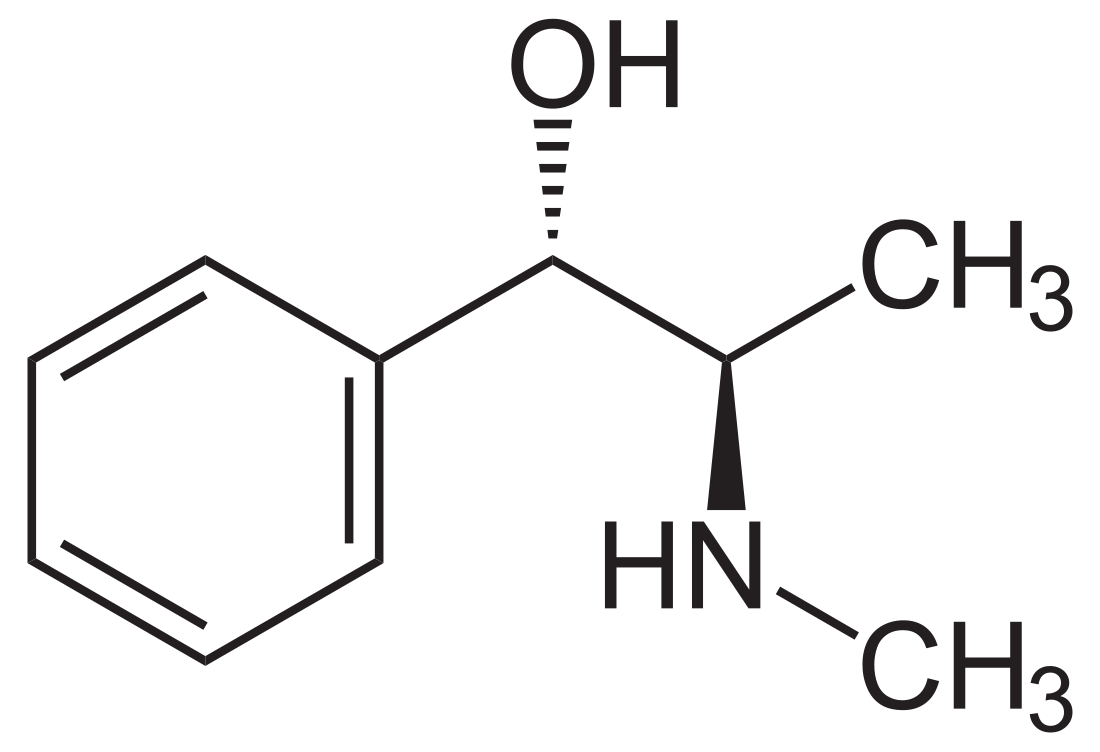
Występuje w postaci dwóch enancjomerów o konfiguracji 1R,2S ((−)-efedryna lewoskrętna)[2] i 1S,2R ((+)-efedryna prawoskrętna)[6], pozostałe dwa diastereoizomery znane są jako pseudoefedryna (o konfiguracji 1R,2R ((−)-pseudoefedryna lewoskrętna)[2] i 1S,2S ((+)-pseudoefedryna prawoskrętna).
Preparaty handlowe zawierają wariant 1R,2S[7].
Historia

Efedryna po raz pierwszy została wyizolowana z przęśli dwukłosowej (Ephedra distachya a. Ephedra vulgaris) przez Nagayoshiego Nagaiego w 1885 roku.
Produkcja
Przęśl chińska (łac. Ephedra sinica, chiń. 麻黃 má huáng), zawierająca efedrynę oraz pseudoefedrynę, stosowana jest w tradycyjnej medycynie chińskiej. Produkcja efedryny w Chinach stała się dochodowym przemysłem eksportowym o wartości 13 mln dolarów rocznie. Z przetworzenia 30 tys. ton surowca roślinnego otrzymuje się 10 razy więcej substancji niż wynosi roczne zapotrzebowanie w tradycyjnej medycynie chińskiej[8].
Syntetyczna efedryna
Podsumowanie
Perspektywa
Oprócz efedryny otrzymywanej ze źródeł naturalnych uzyskuje się ją na drodze syntezy chemicznej. Jedną z pierwszych metod było działanie na mieszaninę 1-fenylopropano-1,2-dionu i metyloaminy wodorem w obecności katalizatora[9]:
Reakcję przeprowadza się w środowisku czystego alkoholu etylowego, katalizatorem redukcji jest tlenek platyny(IV). Po zakończeniu redukcji katalizator jest usuwany przez filtrację, natomiast nieprzereagowana metyloamina jest oddestylowana pod zmniejszonym ciśnieniem. Następnie mieszaninę traktuje się roztworem chlorowodoru w alkoholu etylowym i wytrąca się kryształy przez odparowanie rozpuszczalnika. Tak przygotowany chlorowodorek efedryny przemywa się zimnym acetonem i suszy. Produkt zawiera oba stereoizomery efedryny oraz pewne ilości pseudoefedryny.
Komercyjnie dostępna efedryna syntezowana jest jedną z dwóch poniższych metod[10][11]:
- Metoda wykorzystująca fermentację cukru:
- Cukier lub inne źródło sacharozy (np. melasa) poddawana jest fermentacji za pomocą drożdży w obecności benzaldehydu. Produktem takiej reakcji jest (R)-1-fenylo-1-hydroksypropan-2-on, który reagując z metyloaminą w eterze dibutylowym w obecności katalizatora, którym może być platyna, daje produkt końcowy. Wadami tej metody jest potrzeba użycia dużej ilości eteru, wymagana duża czystość benzaldehydu oraz duże zużycie surowca cukrowego (do produkcji 1 kg efedryny potrzebne jest 9 kg cukru).
- Metoda wykorzystująca jako surowiec propiofenon:
- Propiofenon reaguje z bromem dając α-bromopropiofenon, który następnie traktowany jest metyloaminą. Tak otrzymany produkt jest redukowany wodorem wobec katalizatora, którym jest pallad lub nikiel Raneya. Otrzymuje się racemiczną mieszaninę efedryny i pseudoefedryny, co jest główną wadą tej metody. Produkty rozdziela się, a ponadto pseudoefedrynę poddaje się izomeryzacji, co zwiększa wydajność efedryny.
Ponadto w literaturze naukowej informowano o innych możliwościach syntezy efedryny; koncentrują się one zwykle na otrzymaniu selektywnie jednego z enancjomerów. Poniżej podano wybrane przykłady:
- Metoda oparta na redukcji za pomocą związków silanowych[12]:
- Pierwszym etapem syntezy jest redukcja aminoketonu zabezpieczonego w formie karbaminianu za pomocą dimetylofenylosilanu w środowisku kwasu trifluorooctowego (TFA). Etap ten przebiega praktycznie stereospecyficznie (wydajność 87%, de >98%). W drugim etapie redukuje się otrzymany produkt za pomocą tetrahydroglinianu litu (LAH). Wydajność tego etapu wynosi 80%, a produktem jest (–)-efedryna. Syntezę tę można również przeprowadzić w innych kwasach i przy użyciu innych związków silanowych, jednak uzyskuje się gorsze wyniki.
- Metoda oparta na cyjanohydrynach[13]:
- Pierwszym etapem syntezy jest reakcja cyjanohydryny (z atomem tlenu zabezpieczonym grupą trimetylosililową, TMS) ze związkiem Grignarda. Produkt pośredni jest następnie hydrolizowany, w efekcie czego otrzymuje się 1-fenylo-1-hydroksypropan-2-on (stereoizomer R). Drugim etapem syntezy jest reakcja z metyloaminą, po której następuje redukcja. W zależności od warunków redukcji otrzymuje się efedrynę i pseudoefedrynę w różnych proporcjach. Najlepsze wyniki otrzymano stosując jako reduktor Zn(BH
4)
2 oraz przeprowadzając reakcję w eterze w temperaturze −76 °C. Niezależnie od stosowanych warunków i reduktora otrzymywano wydajności powyżej 75%.
Właściwości spektroskopowe
- Spektroskopia UV-VIS (efedryna w formie chlorowodorku w metanolu): maksima absorpcyjne przy długościach fali: 250, 256 oraz 262 nm. W zależności od środowiska pomiaru wartości te wykazują niewielkie (nie więcej niż 1 nm) odchylenia[14].
- Spektroskopia IR: Główne maksima absorpcyjne występują przy liczbach falowych: 700, 2885 oraz 2974 cm−1[15]
- Spektrometria mas: największy pik rejestruje się dla stosunku m/z = 58[15]
- Spektroskopia NMR (rozpuszczalnik CDCl
3)[16]:

- 1H NMR:
| Rodzaj at. H | 1 | 2 | 3 | 4 | Ph |
|---|---|---|---|---|---|
| Przesunięcie chemiczne, ppm | δ = 0,85 (d, 3H, J = 6,2 Hz) | δ = 2,5 (bs, 3H) | δ = 2,8 | δ = 4,75 (d, 1H, J = 3,1 Hz) | δ = 7,30 (s, 5H) |
- 13C NMR:
| Rodzaj at. C | 1 | 2 | 3 | 4 | Ph |
|---|---|---|---|---|---|
| Przesunięcie chemiczne, ppm | δ = 14,3 | δ = 34 | δ = 60,8 | δ = 73,0 | δ = 126,1, 127,0, 128,1 |
Działanie
Podsumowanie
Perspektywa
Działa pośrednio na układ współczulny poprzez zwiększanie uwalniania noradrenaliny i innych katecholamin na zakończeniach włókien nerwowych, hamuje również ich zwrotne wchłanianie z szczeliny synaptycznej. W mniejszym stopniu wykazuje działanie bezpośrednie, polegające na pobudzeniu receptorów adrenergicznych (α oraz β)[17]. Przy powtarzanym podawaniu występuje zjawisko tachyfilaksji - każda następna dawka podawana w krótkim czasie powoduje mniejszy skutek farmakologiczny[17]. Obecnie coraz rzadziej stosowana w lecznictwie, zostaje zastąpiona środkami o bardziej specyficznym działaniu (np. synefryną).
Efedryna pomaga utrzymać szybkie tempo przemiany materii dzięki stymulowaniu konwersji nieaktywnej formy hormonu tarczycy T4 w postać aktywną T3. Indukowanie metabolizmu tkanki tłuszczowej w procesie termogenezy oraz działanie pobudzające efedryny są wynikiem jej zdolności do pobudzania wydzielania katecholamin: adrenaliny i noradrenaliny. Obie te substancje przyspieszają uwalnianie tłuszczu z komórek tłuszczowych i pobudzają układ nerwowy. Proces termogenezy gwałtownie spada po kilku tygodniach.
Najważniejsze działania efedryny to:
- podwyższenie ciśnienia tętniczego krwi (skurcz naczyń oporowych) – stosowana w leczeniu niedociśnienia;
- zwiększenie siły skurczu mięśnia sercowego;
- przyspieszenie akcji serca;
- rozszerzenie oskrzeli (rozkurcz mięśni gładkich oskrzeli);
- pobudzające ośrodkowy układ nerwowy;
- zwiększenie przepływu krwi przez tętnice wieńcowe, mózgowe i zaopatrujące mięśnie prążkowane;
- zmniejszenie przepływu przez tętnice trzewne oraz zaopatrujące skórę.
Przypomina adrenalinę, ale nie ulega rozkładowi w układzie pokarmowym.
Dawniej była stosowana w leczeniu astmy oskrzelowej. W medycynie chińskiej stosowana od 4 tysięcy lat. Obecnie najczęściej bywa stosowana w preparatach leczniczych takich jak: Tussipect, Proasthmin, Allergoasthmin.
Bywa używana jako środek dopingujący i w postaci ECA jako silny i skuteczny środek odchudzający (patrz wyżej termogeneza). Może powodować uzależnienie psychiczne u niektórych osób (ze względu na początkowy efekt euforii – nie powoduje fizycznego), z powodu rosnącej tolerancji nie można jej długo stosować (tolerancja wynika z tego że receptory są po pewnym czasie zablokowane i niewrażliwe na działanie efedryny).
Efekty niepożądane
Podsumowanie
Perspektywa
Skutki uboczne najczęściej występują przy regularnym stosowaniu (iniekcje, bądź przyjmowanie doustne), rzadziej w przypadku okresowego korzystania z inhalatorów zawierających efedrynę (np. do nosa). Możliwe efekty uboczne stosowania efedryny:
- nieprawidłowości kardiowaskularne: tachykardia, arytmia serca, choroba wieńcowa, wazokonstrykcja, nadciśnienie;
- zmiany dermatologiczne: zaczerwienienie skóry, pocenie się, trądzik (wysypki skórne);
- rozstrój żołądka: nudności, utrata apetytu;
- układ moczowo-płciowy: zmniejszone wydalanie moczu[18] z powodu wazokonstrykcji tętnic nerkowych; nierzadko trudności w oddawaniu moczu, jako że agonisty receptorów α-adrenergicznych powodują skurcz zwieracza wewnętrznego cewki moczowej, naśladując efekty pobudzenia układu współczulnego.
- układ nerwowy: niepokój, chaotyczność (zmieszanie), bezsenność, umiarkowana euforia, manie i halucynacje (rzadko, pod warunkiem wcześniej występujących psychicznych zaburzeń), wrogość (drażliwość), mrowienie (nieudokumentowane), paranoja, pobudzenie psychomotoryczne (zwłaszcza kiedy przyjmowana z kofeiną);
- układ oddechowy: duszności, obrzęk płuc;
- inne: podniesiona średnio o 1 °C temperatura ciała (działanie termogeniczne), zawroty głowy, ból głowy, drżenie (zwłaszcza rąk), hiperglikemia, suchość w ustach.
Przedawkowanie może prowadzić do śmierci (m.in. przez obciążenie serca), aczkolwiek w przypadku zażycia zalecanej dawki (poniżej 60 mg – zależne też od masy ciała) rzadko występują efekty niepożądane.
Przyjmowanie wysokich dawek efedryny może prowadzić do uszkodzenia mózgu z powodu ciągłego oddziaływania na neurotransmitery; może także powodować uszkodzenia naczyń krwionośnych z powodu towarzyszącego nadciśnienia. Efedryna może powodować zmniejszenie napięcia mięśniowego oraz psychozy paranoidalne. Badania na zwierzętach wskazują na możliwość uszkodzeń mózgu, mogących prowadzić do „tików” podobnych do występujących w chorobie Parkinsona[19].
Neurotoksyczność
Ponieważ efedryna jest substancją sympatykomimetyczną, podobną strukturalnie oraz pod względem aktywności do amfetamin, efedryna bywa używana jako prekursor do produkcji narkotyków (metamfetaminy i metkatynonu). Efedryna ze względu na swoje właściwości pobudzające bywa używana jako domieszka do narkotyków np. dostępny w USA narkotyk zwany Cloud Nine, uważany za „całkowicie naturalny” odpowiednik MDMA (Ecstasy) zawiera w swym składzie efedrynę.
Zbadane zostało, czy może powodować ona efekty neurodegeneracyjne. W poszczególnych badaniach porównano poziom takich neurotransmiterów jak serotonina, dopamina, glutaminian – kwas glutaminowy, czy epinefryna przy równoległej administracji efedryny oraz różnych amfetoaminopodobnych substancji. W badanym obszarze efedryna nie wykazała działania neurotoksycznego. Stwierdzono, że efedryna zwiększa poziom uwalniania dopaminy w minimalnym stopniu w porównaniu z identyczną dawką dekstroamfetaminy. Słabsze działanie efedryny na układ nerwowy wynika prawdopodobnie z utrudnionego przenikania bariery krew-mózg[20].
Przypisy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.