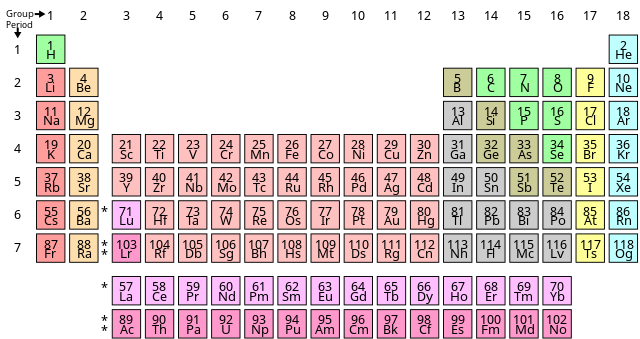
Периоден систем на елементите
From Wikipedia, the free encyclopedia
Remove ads
Периоден систем, познат и како Периоден систем на елементите — подредено распоредување на хемиските елементи во редови („периоди“) и колони („групи“). Системот претставува икона на хемијата и е широко користен во физиката и другите науки. Периодниот систем е приказ на периодичниот закон, кој вели дека кога елементите се подредени според нивниот атомски број, евидентно е приближно повторување на нивните својства. Табелата е поделена на четири приближно правоаголни области наречени блокови. Елементите од истата група имаат тенденција да покажуваат слични хемиски карактеристики.

Вертикалните, хоризонталните и дијагоналните положби го карактеризираат периодниот систем. Металичниот карактер се зголемува одејќи надолу по група и од десно кон лево низ период. Неметалните знаци се зголемуваат од долу лево на периодниот систем кон горе десно.
Првиот периоден систем кој станал општо прифатен бил оној на рускиот хемичар Дмитриј Менделеев во 1869 година; тој го формулирал периодниот закон како зависност на хемиските својства од атомската маса. Бидејќи тогаш не биле познати сите елементи, постоеле празнини во неговиот периодичен систем, а Менделеев успешно го користел периодичниот закон за да предвиди некои својства на некои од елементите кои недостасуваат. Периодниот закон бил признат како основно откритие кон крајот на 19 век. Тој бил објаснет на почетокот на 20 век, со откривањето на атомските броеви и поврзаната пионерска работа во квантната механика, и двете идеи служат за осветлување на внатрешната структура на атомот. Препознатливиот современ облик на табелата бил постигнат во 1945 година со откритието на Глен Т. Сиборг дека актиноидите се всушност елементи од f-блокот, а не d-блокот. Периодниот систем и Периодниот закон денес се централен и незаменлив дел од современата хемија.
Периодниот систем продолжува да се развива со напредокот на науката. Во природата постојат единствено елементи до атомскиот број 94; за да се оди понатаму, било неопходно да се синтетизираат нови елементи во лабораторијата. До 2010 година, првите 118 елементи станале познати, со што биле комплетирани првите седум редови од табелата;[1] сепак, сè уште е потребна хемиска карактеризација за најтешките елементи да потврдат дека нивните својства одговараат на нивните местоположби. Новите откритија ќе ја прошират табелата надвор од овие седум редови, иако сè уште не е познато уште колку елементи се можни; освен тоа, теоретските пресметки сугерираат дека овој непознат регион нема да ги следи моделите на познатиот дел од табелата. Продолжува и одредена научна расправа за тоа дали некои елементи се правилно поставени во денешната табела. Постојат многу алтернативни претстави на периодниот закон, и постои одредена расправа за тоа дали постои оптимална форма на периодниот систем.

Remove ads
Структура

Секој хемиски елемент има единствен атомски број (Z — за „Zahl“, германски за „број“) што го претставува бројот на протони во неговото јадро. Затоа, секој посебен атомски број одговара на класа на атом: овие класи се нарекуваат хемиски елементи. Хемиските елементи се она што периодниот систем го класифицира и организира. Водородот е елемент со атомски број 1; хелиум, атомски број 2; литиум, атомски број 3; и така натаму. Секое од овие имиња може дополнително да се скрати со хемиски симбол со една или две букви; оние за водород, хелиум и литиум се соодветно H, He и Li. Неутроните не влијаат на хемискиот идентитет на атомот, но влијаат на неговата тежина. Атомите со ист број на протони, но различен број на неутрони се нарекуваат изотопи на ист хемиски елемент. Природните елементи обично се јавуваат како смеси на различни изотопи; бидејќи секој изотоп обично се јавува со карактеристична застапеност, природните елементи имаат добро дефинирани атомски тежини, дефинирани како просечна маса на природно настанатиот атом на тој елемент.[2] Сите елементи имаат повеќе изотопи, варијанти со ист број на протони, но различен број на неутрони. На пример, јаглеродот поседува три природни изотопи: сите негови атоми имаат шест протони, а поголемиот број имаат и шест неутрони, но околу еден процент има седум неутрони, а многу мал дел има осум неутрони. Изотопите никогаш не се одвојуваат во периодниот систем; тие секогаш се групирани заедно под еден елемент. Кога е прикажана атомската маса, тоа е обично пондериран просек на природни изотопи; но доколку нема природни изотопи во значителни количини, масата на најстабилниот изотоп обично се појавува, најчесто во загради.
Во стандардниот периоден систем, елементите се наведени по редослед на зголемување на атомскиот број. Нов ред (периода) започнува кога нова електронска обвивка го има својот прв електрон. Колоните (групите) се одредуваат со електронската конфигурација на атомот; елементите со ист број на електрони во одредена подобвивка спаѓаат во истите колони (на пр. кислородот, сулфурот и селенот се во иста колона бидејќи сите имаат четири електрони во најоддалечената p-подобвивка). Елементите со слични хемиски својства генерално спаѓаат во иста група во периодниот систем, иако во f-блокот и до одреден степен во d-блокот, елементите во истиот период имаат тенденција да имаат слични својства. Така, релативно е лесно да се предвидат хемиските својства на елементот доколку се знаат својствата на елементите околу него.
Денес се познати 118 елементи, од кои за првите 94 е познато дека се случуваат природно на Земјата. [б 1] Останатите 24, од америциум до оганесон (95-118), се јавуваат единствено кога се синтетизираат во лаборатории. Од 94 природни елементи, 83 се првобитни, а 11 се јавуваат единствено во ланци на распаѓање на првобитните елементи. Неколку од вторите се толку ретки што не биле откриени во природата, но биле вештачки направени во лабораторија пред да се утврди дека сепак постојат во природата: технициум (елемент 43), прометиум (елемент 61), астатин (елемент 85), нептуниум (елемент 93) и плутониум (елемент 94). Ниту еден елемент потежок од ајнштајниум (елемент 99) досега не бил забележан во макроскопски количини во неговата чиста форма, ниту пак астатин; франциум (елемент 87) е фотографиран единствено во форма на светлина испуштена од микроскопски количини (300.000 атоми).[7] Од 94 природни елементи, осумдесет имаат стабилен изотоп и уште еден (бизмут) има речиси стабилен изотоп (со полураспад од 2,01×1019, над милијарда пати поголема од староста на вселената).[8] [б 2] Уште два, ториум и ураниум, имаат изотопи кои се подложени на радиоактивно распаѓање со полураспад споредлив со староста на Земјата. Стабилните елементи заедно со бизмутот, ториумот и ураниумот ги сочинуваат 83-те првобитни елементи кои преживеале од формирањето на Земјата. [б 3] Останатите единаесет природни елементи се распаѓаат доволно брзо, така што нивното континуирано појавување на траги првенствено зависи од постојаното регенерирање како меѓупроизводи од распаѓањето на ториумот и ураниумот. [б 4] Сите 24 познати вештачки елементи се радиоактивни.
Имиња и броеви на групи
Според меѓународната конвенција за именување, групите се нумерирани од 1 до 18 од најлевата колона (алкалните метали) до најдесната колона (благородните гасови). Групите од f-блокот се игнорираат при ова нумерирање.[15] Групите може да се именуваат и според нивниот прв елемент, на пр. „скандиумска група“ за групата 3. Претходно, групите биле познати со римски бројки. Во Соединетите Американски Држави, по римските бројки следело или „А“ доколку групата била во блокот s или p, или „Б“ доколку групата била во блокот d. Користените римски бројки одговараат на последниот број од денешната конвенција за именување (на пр. елементите од групата 4 биле групата IVB, а елементите од групата 14 биле групата IVA). Во Европа, буквите биле слични, освен што „А“ се користела за групите од 1 до 7, а „Б“ се користела за групите од 11 до 17. Дополнително, групите 8, 9 и 10 порано се третирале како една група со тројна големина, позната колективно во двете ознаки како група VIII. Во 1988 година, бил пуштен во употреба новиот систем за именување МСЧПХ (Меѓународен сојуз за чиста и применета хемија) (1–18), а старите имиња на групите (I–VIII) останале застарени.[16]
Формулари за презентација
Поради простор во табелата,[17] периодниот систем вообичаено се прикажува со отсечени елементи од f-блок и позиционирани како посебен дел под главното тело.[18] Ова го намалува бројот на колони со елементи од 32 на 18.
Двете форми претставуваат ист периоден систем. Формата со f-блок вклучен во главното тело понекогаш се нарекува 32-колона или долга форма;[19] формата со f-блок ја отсекува формата со 18 колони или средно долга форма.[19] Формата со 32 колони има предност што ги прикажува сите елементи во нивната правилна низа, но има недостаток бидејќи повеќе простор. Избраната форма е уреднички избор и не подразбира никаква промена на научното тврдење или изјава. На пример, кога се расправа за составот на групата 3, опциите може да се прикажат подеднакво (без предрасуди) во двете форми.[20]
Периодични табели обично ги прикажуваат симболите на елементите; голем дел од нив, исто така, обезбедуваат дополнителни информации за елементите, или преку кодирање на бои или како податоци во ќелиите. Горната табела ги прикажува имињата и атомските броеви на елементите, како и нивните блокови, природни појави и стандардни атомски тежини. За краткотрајните елементи без стандардни атомски тежини, наместо тоа се користи масениот број на најстабилниот познат изотоп. Други табели може да вклучуваат својства како што се состојба на материјата, точки на топење и вриење, густини, како и да обезбедат различни класификации на елементите. [б 5]
Електронска конфигурација
Периодниот систем претставува графички опис на периодниот закон[21], кој вели дека својствата и атомските структури на хемиските елементи се периодична функција од нивниот атомски број.[22] Елементите се сместени во периодниот систем според нивните електронски конфигурации,[23] чии периодични повторувања ги објаснуваат трендовите во својствата низ периодниот систем.[24]
Електронот може да се смета дека населува атомска орбитала, што ја карактеризира веројатноста дека може да се најде во кој било одреден регион околу атомот. Нивните енергии се квантизирани, што значи дека тие можат да земаат единствено дискретни вредности. Понатаму, електроните го почитуваат Паулиевото начело на исклучување: различни електрони секогаш мора да бидат во различни состојби. Ова овозможува класификација на можните состојби што електронот може да ги преземе во различни енергетски нивоа познати како обвивки или слоеви, поделени на поединечни подобвивки, од кои секоја содржи една или повеќе орбитали. Секоја орбитала може да содржи до два електрони: тие се разликуваат по количината позната како спин, конвенционално означена како „горе“ или „долу“.[25][б 6] Во ладен атом (еден во неговата основна состојба), електроните се распоредуваат на таков начин што вкупната енергија што ја имаат се минимизира со зазимање на достапните орбитали со најниска енергија.[27] Единствено најоддалечените електрони (т.н. валентни електрони) имаат доволно енергија да се ослободат од јадрото и да учествуваат во хемиски реакции со други атоми. Другите се нарекуваат основни електрони.[28]
Познати се елементите со зафатени до првите седум обвивки. Првата обвивка содржи само една орбитала, сферична s-орбитала. Како што е во првата обвивка, таа се нарекува орбитала 1s. Таа може да собере до два електрони. Втората обвивка на сличен начин содржи орбитала 2s, а содржи и три орбитали 2p во форма на гира, и на тој начин може да пополни до осум електрони (2×1 + 2×3 = 8). Третата обвивка содржи една 3s-орбитала, три 3p-орбитали и пет 3d-орбитали и затоа има капацитет од 2×1 + 2×3 + 2×5 = 18. Четвртата обвивка содржи една 4s-орбитала, три 4p-орбитали, пет 4d-орбитали и седум 4f-орбитали, што доведува до капацитет од 2×1 + 2×3 + 2×5 + 2×7 = 32. Повисоките обвивки содржат повеќе видови орбитали кои го продолжуваат моделот, но таквите типови на орбитали не се пополнуваат во основните состојби на познатите елементи.[30] Типовите на подобвивки се карактеризираат со квантни броеви. Четири броеви целосно ја опишуваат орбиталата во атомот: главниот квантен број n, орбиталниот квантен број ℓ (орбиталниот тип), орбиталниот магнетен квантен број m ℓ и спиновиот магнетен квантен број ms.
Редослед на полнење на подобвивката

Редоследот во кој се пополнуваат подобвивките е дадена во повеќето случаи со принципот Ауфбау, познат и како Маделунгово правило или Клечковско правило (по Ервин Маделунг и Всеволод Клечковски соодветно). Ова правило првпат било забележано од Маделунг, а Клечковски и подоцнежните автори му дале теоретско оправдување.[31][32][33][34] Обвивките се преклопуваат во енергии, а Маделунговото правило ја одредува низата на полнење според:
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 4s < 3d < 4p ≪ 5s < 4d < 5p ≪ 6s < 4f < 5d < 6p ≪ 7s < 5f < 6d < 7p ≪ ...
Овде знакот ≪ значи „многу помалку од“ за разлика од < што значи единствено „помалку од“. Различно фразиран, електроните влегуваат во орбиталите по редослед на зголемување n + ℓ, и доколку се достапни две орбитали со иста вредност n + ℓ, најпрвин се зафаќа онаа со помала n..[30][34] Општо земено, орбиталите со иста вредност од n + ℓ се слични по енергија, но во случајот на s-орбиталите (со ℓ = 0), квантните ефекти ја зголемуваат нивната енергија приближувајќи до онаа на следната n + ℓ група. Оттука, периодниот систем обично се црта за да започне секој ред (често се нарекува точка) со пополнување на нова s-орбитала, што одговара на почетокот на нова обвивка.[32][33] Така, со исклучок на првиот ред, секоја должина на период се појавува двапати:
- 2, 8, 8, 18, 18, 32, 32, ...
Преклопувањата се приближуваат до точката каде што d-орбиталите влегуваат во сликата, и редоследот може малку да се помести со атомскиот број и атомскиот полнеж.[35] [б 7]
Почнувајќи од наједноставниот атом, ова овозможува да се изгради периодниот систем еден по еден по редослед на атомски број, со разгледување на случаите на единечни атоми. Во водородот, постои само еден електрон, кој мора да оди во орбиталата 1 со најниска енергија. Оваа електронска конфигурација е напишана 1s1, каде што надредениот знак го означува бројот на електрони во подобвивката. Хелиумот додава втор електрон, кој исто така оди во 1s, целосно пополнувајќи ја првата обвивка и давајќи ја конфигурацијата 1s2.[24][42] [б 8]
Почнувајќи од третиот елемент, литиум, првата обвивка е полна, така што нејзиниот трет електрон зафаќа орбитала 2s, давајќи конфигурација 1s2 2s1. Електронот 2s е единствениот валентен електрон на литиумот, бидејќи подобвивката 1s сега е премногу цврсто врзана за јадрото за да учествува во хемиското поврзување со другите атоми: таквата обвивка се нарекува „јадрена обвивка“. Подобвивката 1s е основна обвивка за сите елементи од литиум наваму. Подобвивката 2s е комплетирана со следниот елемент берилиум (1s2 2s2). Следниве елементи потоа продолжуваат да ја пополнуваат подобвивката 2p. Борот (1s2 2s2 2p1) го става својот нов електрон во 2p орбитала; јаглеродот (1s2 2s2 2p2) исполнува втора 2p орбитала; а со азот (1s2 2s2 2p3) сите три 2p орбитали стануваат поединечно зафатени. Ова е во согласност со Хандовото правило, кое вели дека атомите обично претпочитаат поединечно да ја зафаќаат секоја орбитала од ист тип пред да ги наполнат со вториот електрон. Кислород (1s2 2s2 2p4), флуор (1s2 2s2 2p5) и неон (1s2 2s2 2p6) потоа се комплетираат веќе поединечно исполнетите 2p-орбитали; последниот од нив целосно ја исполнува втората подобвивка.[24][42]
Почнувајќи од елементот 11, натриум, втората обвивка е полна, што ја прави втората обвивка основна обвивка за овој и за сите потешки елементи. Единаесеттиот електрон го започнува полнењето на третата обвивка со зафаќање на орбиталата 3s, давајќи конфигурација од 1s2 2s2 2p6 3s1 за натриум. Оваа конфигурација е скратена [Ne] 3s1, каде што [Ne] ја претставува неонската конфигурација. Магнезиумот ([Ne] 3s2) ја завршува оваа 3s-орбитала, а следните шест елементи алуминиум, силициум, фосфор, сулфур, хлор и аргон ги исполнуваат трите 3p орбитали ([Ne] 3s2 3p1 до [Ne] 3s2 3p6). Ова создава аналогна серија во која структурите на надворешната обвивка на натриум преку аргон се аналогни на оние на литиум преку неон, и е основа за периодичноста на хемиските својства што ги илустрира периодниот систем: во редовни, но променливи интервали на атомски броеви, својствата на хемиските елементи приближно се повторуваат.[21]
Така, првите 18 елементи може да се подредат како почеток на периодниот систем. Елементите во истата колона имаат ист број на валентни електрони и имаат слични конфигурации на валентни електрони: овие колони се нарекуваат групи. Единствен исклучок е хелиумот, кој има два валентни електрони како берилиум и магнезиум, но обично се става во колоната од неон и аргон за да се нагласи дека неговата надворешна обвивка е полна. (Некои современи автори го доведуваат во прашање дури и овој единствен исклучок, претпочитајќи постојано да ги следат валентните конфигурации и да го ставаат хелиумот над берилиумот.) Постојат осум колони во овој дел од периодниот систем, што одговара на најмногу осум електрони од надворешната обвивка.[18] Понатаму започнува период кога почнува да се полни нова обвивка. Бојата ги илустрира блоковите: елементите во s-блокот (обоени црвено) ги исполнуваат s-орбиталите, додека оние во p-блокот (обоени жолти) пополнуваат p-орбитали.
| 1 H |
2 He |
2×1 = 2 елементи 1s | ||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 елементи 2s 2p |
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 елементи 3s 3p |
Почнувајќи од следниот ред, за калиум и калциум, подобвивката 4s е најниска во енергија, и затоа се полни.[24][42] Калиумот додава еден електрон на 4s обвивката ([Ar] 4s2), а калциумот потоа го комплетира ([Ar]4s2). Сепак, почнувајќи од скандиум ([Ar] 3d14s2) 3d подобвивката станува следната највисока енергија. 4s и 3d подобвивките имаат приближно иста енергија и тие се натпреваруваат за полнење на електроните, и затоа занимањето не е сосема доследно пополнување на 3d орбиталите една по една. Прецизното енергетско уредување на 3d и 4s се менува по должината на редот, а исто така се менува во зависност од тоа колку електрони се отстранети од атомот. На пример, поради одбивањето помеѓу 3d електроните и оние 4s, кај хромот нивото на енергија 4s станува малку повисоко од 3d, и затоа станува попрофитабилно за атом на хром да има [Ar] 3d5 4s1 конфигурација отколку [Ar] 3d4 4s2. Слична аномалија се јавува кај бакарот, чиј атом има конфигурација [Ar] 3d10 4s1 наместо очекуваната [Ar] 3d9 4s2. Станува збор за прекршување на Маделунговото правило. Таквите аномалии, сепак, немаат никакво хемиско значење: повеќето хемикалии не се однесуваат на изолирани гасовити атоми, а различните конфигурации се толку блиски по енергија една до друга што присуството на блискиот атом може да ја промени рамнотежата. Затоа, периодниот систем ги игнорира и ги разгледува единствено идеализираните конфигурации.[23]
Кај цинкот ([Ar] 3d10 4s2), 3d орбиталите се целосно исполнети со вкупно десет електрони.[24][42] Следуваат орбиталите 4p, комплетирајќи го редот, кои се пополнуваат прогресивно со галиум ([Ar] 3d10 4s2 4p1) преку криптон ([Ar] 3d10 4s2 4p6), на начин аналоген на претходните p-блок елементи. Од галиумот наваму, 3d орбиталите сочинуваат дел од електронското јадро и повеќе не учествуваат во хемијата.[41] Елементите од s и p-блок, кои ги пополнуваат нивните надворешни обвивки, се нарекуваат елементи од главната група; Елементите од d-блок (обоени сини долу), кои ја исполнуваат внатрешната обвивка, се нарекуваат преодни елементи (или преодни метали, бидејќи сите се метали).[44]
Следните 18 елементи ги исполнуваат 5s-орбиталите (рубидиум и стронциум), потоа 4d (итриум преку кадмиум, повторно со неколку аномалии на патот), а потоа 5p (индиум преку ксенон). Повторно, од индиум па натаму, 4d орбитали се во јадрото.[45] Оттука, петтиот ред ја има истата структура како и четвртиот.
| 1 H |
2 He |
2×1 = 2 елементи 1s | ||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 елементи 2s 2p | ||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 елементи 3s 3p | ||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
2×(1+3+5) = 18 елементи 4s 3d 4p |
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
2×(1+3+5) = 18 елементи 5s 4d 5p |
Шестиот ред од табелата исто така започнува со два s-блок елементи: цезиум и бариум.[42] После тоа, првите елементи од f-блокот (подолу обоени во зеленo) почнуваат да се појавуваат, започнувајќи од лантан. Овие понекогаш се нарекуваат внатрешни преодни елементи.[44] Бидејќи веќе има не само 4f туку и 5d и 6s подобвивки со слични енергии, конкуренцијата се појавува повторно со многу неправилни конфигурации; ова резултирало со одреден спор околу тоа каде точно треба да започне f-блокот, но повеќето кои ја проучуваат материјата се согласуваат дека тој започнува од лантан во согласност со Клечковското правило.[46] Иако самиот лантан не ја исполнува подобвивката 4f како еден атом, поради одбивноста помеѓу електроните, неговите 4f-орбитали се доволно ниски со енергија за да учествуваат во хемијата.[36][47][48] Кај итербиумот, седумте 4f-орбитали се целосно исполнети со четиринаесет електрони; потоа, следи серија од десет преодни елементи (лутетиум преку жива),[49][50][51] и на крајот шест елементи од главната група (талиум преку радон) го комплетираат периодот.[52] Од лутециумот наваму, 4f-орбиталите се во јадрото, и од талиумот наваму, исто така се 5d-орбиталите.[53]
Седмиот ред е аналоген на шестиот ред: 7s (франциум и радиум), потоа 5f (актиниум до нобелиум), потоа 6d (ларенциум до копернициум) и на крајот 7p (нихониум до оганесон). Почнувајќи од лоренциум, 5f-орбиталите се во јадрото, и веројатно 6d-орбиталите се приклучуваат на јадрото почнувајќи од нихониумот.[54] [б 9] Повторно има неколку аномалии на патот: на пример, како поединечни атоми ниту актиниум ниту ториумот всушност не ја пополнуваат подобвивката 5f, а лоренциумот не ја пополнува 6d-обвивката, но сите овие подобвивки сè уште можат да се пополнат во хемиски средини.[56][57][58] Долго време, седмиот ред бил нецелосен бидејќи повеќето од неговите елементи не се појавуваат во природата. Елементите што недостасуваат надвор од ураниумот започнале да се синтетизираат во лабораторија во 1940 година, кога бил направен нептуниум. (Меѓутоа, првиот елемент кој бил откриен со синтеза, а не во природата бил технециумот во 1937 година.) Редот бил завршен со синтеза на тенесинот во 2010 година [59] (последниот елемент оганесон веќе бил направен во 2002 година),[60] и последните елементи во овој седми ред добиле имиња во 2016 година.
| 1 H |
2 He |
2×1 = 2 елементи 1s | ||||||||||||||||||||||||||||||
| 3 Li |
4 Be |
5 B |
6 C |
7 N |
8 O |
9 F |
10 Ne |
2×(1+3) = 8 елементи 2s 2p | ||||||||||||||||||||||||
| 11 Na |
12 Mg |
13 Al |
14 Si |
15 P |
16 S |
17 Cl |
18 Ar |
2×(1+3) = 8 елементи 3s 3p | ||||||||||||||||||||||||
| 19 K |
20 Ca |
21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 Kr |
2×(1+3+5) = 18 елементи 4s 3d 4p | ||||||||||||||
| 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 In |
50 Sn |
51 Sb |
52 Te |
53 I |
54 Xe |
2×(1+3+5) = 18 елементи 5s 4d 5p | ||||||||||||||
| 55 Cs |
56 Ba |
57 La |
58 Ce |
59 Pr |
60 Nd |
61 Pm |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 At |
86 Rn |
2×(1+3+5+7) = 32 елементи 6s 4f 5d 6p |
| 87 Fr |
88 Ra |
89 Ac |
90 Th |
91 Pa |
92 U |
93 Np |
94 Pu |
95 Am |
96 Cm |
97 Bk |
98 Cf |
99 Es |
100 Fm |
101 Md |
102 No |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
2×(1+3+5+7) = 32 елементи 7s 5f 6d 7p |
Ова го комплетира современиот периоден систем, со сите седум реда целосно исполнети до крај.
Remove ads
Варијанти
Периода 1
Иако современиот периодичен систем денес е стандарден, поставувањето на елементите од I периода на периодниот систем за водород и хелиум останува отворено прашање за расправа и може да се најдат некои варијанти.[41][61] Следејќи ги нивните соодветни конфигурации на електрони s1 и s2, водородот би бил сместен во групата 1, а хелиумот би бил сместен во групата 2. Поставувањето на водородот од групата 1 е вообичаено, но хелиумот речиси секогаш се става во групата 18 со другите благородни гасови. Расправата има врска со спротивставените сфаќања за степенот до кој хемиските или електронските својства треба да одлучуваат за поставувањето на периодичната табела.[61]
Како и металите од групата 1, водородот има еден електрон во својата најоддалечена обвивка и обично го губи својот единствен електрон во хемиските реакции.[62] Водородот има некои хемиски својства кои се слични на метал, бидејќи може да помести некои метали од нивните соли. Но, тој формира двоатомски неметален гас во стандардни услови, за разлика од алкалните метали кои се реактивни цврсти метали. Ова и формирањето на хидриди од страна на водородот, во кое тој добива електрон, го приближува до својствата на халогените кои го прават истото (иако е поретко водородот да формира H− отколку H+).[63] Покрај тоа, најлесните два халогена (флуор и хлор) се гасовити како водородот во стандардни услови. Некои својства на водородот не се погодни за ниту една група: водородот не е ниту силно оксидирачки ниту силно редуцирачки и не е реактивен со вода. Така, водородот има својства што одговараат и на оние на алкалните метали и на халогените, но совршено се совпаѓа со ниту една група, и затоа е тешко да се постави според неговата хемија. Затоа, додека електронското сместување на водородот во групата 1 преовладува, некои поретки аранжмани покажуваат или водород во групата 17, дупликат водород во двете групи 1 и 17,[64][65] или го додлуваат одделно од сите групи. Оваа последна опција сепак била критикувана од хемичарот и филозоф на науката Ерик Счери со образложениедека водородот е целосно над периодичниот закон, за разлика од сите други елементи.[66]
Хелиумот е единствениот елемент кој рутински зазема позиција во периодниот систем што не е во согласност со неговата електронска структура. Поседува два електрони во својата најнадворешна обвивка, додека другите благородни гасови имаат осум; и тој е елемент од s-блокот, додека сите други благородни гасови се елементи од p-блокот. Сепак, тој е нереактивен во стандардни услови и поседува целосна надворешна обвивка: овие својства се како благородните гасови во групата 18, но воопшто не се како реактивните земноалкални метали од групата 2. Поради овие причини хелиумот е речиси универзално сместен во групата 18 со која неговите својства најдобро се совпаѓаат; предлогот за преместување на хелиумот во групата 2 бил отфрлен од Меѓународниот сојуз за чиста и применета хемија во 1988 година поради овие причини. Сепак, хелиумот сè уште повремено се става во групата 2 денес,[67] и некои од неговите физички и хемиски својства се поблиску до елементите од групата 2 и го поддржуваат електронското поставување. Цврстиот хелиум се кристализира во хексагонална блиску спакувана структура, која одговара на берилиум и магнезиум во групата 2, но не и на другите благородни гасови од групата 18.[68] Неодамнешните теоретски случувања во хемијата на благородни гасови, во кои се очекува хелиумот да покаже малку помала инертност од неонот и да формира (HeO)(LiF)2 со структура слична на аналогното соединение на берилиум (но без очекуван неонски аналог), резултирале повеќе хемичари кои се залагаат за сместување на хелиум во групата 2. Ова се однесува на електронскиот аргумент, бидејќи причината за поголемата инертност на неонот е одбивноста од неговата наполнета p-обвивка што му недостасува на хелиумот, иако реално е малку веројатно дека молекулите кои содржат хелиум ќе бидат стабилни надвор од екстремни услови на ниска температура (околу 10 К).[69][70][71]
Аномалијата од првиот ред во периодниот систем дополнително е наведена за поддршка на движењето на хелиумот кон групата 2. Настанува затоа што првата орбитала од кој било тип е невообичаено мала, бидејќи за разлика од нејзините повисоки аналози, таа не доживува меѓуелектронско одбивање од помала орбитала од ист тип. Ова го прави првиот ред на елементи во секој блок невообичаено мал, а таквите елементи имаат тенденција да покажуваат карактеристични видови аномалии за нивната група. Некои хемичари кои дебатираат за репозиционирање на хелиумот истакнале дека хелиумот ги покажува овие аномалии доколку е сместен во групата 2, но не и доколку е сместен во групата 18: од друга страна, неонот, кој би бил првиот елемент од групата 18 доколку хелиумот се отстрани од тоа место, ги покажува тие аномалии. Потоа се тврди дека односот помеѓу хелиумот и берилиумот е сличен на односот помеѓу водородот и литиумот, поставеност што е многу поприфатено. На пример, поради овој тренд во големината на орбиталите, голема разлика во атомските радиуси помеѓу првиот и вториот член на секоја главна група се гледа во групите 1 и 13-17: таа постои помеѓу неон и аргон, и помеѓу хелиум и берилиум, но не и помеѓу хелиум и неон. Ова на сличен начин влијае на точките на вриење на благородните гасови и растворливоста во вода, каде што хелиумот е премногу блиску до неонот, а големата разлика карактеристична помеѓу првите два елементи од групата се појавува единствено помеѓу неонот и аргонот. Преместувањето на хелиумот во групата 2 го прави овој тренд доследен и во групите 2 и 18, со тоа што хелиумот е елемент од првата група 2, а неонот елементот од првата група 18: и двата ги покажуваат карактеристичните својства на кајносиметричниот прв елемент од групата. Групата 18 сепак останува речиси универзална поради неговата екстремна инертност.[72] Дополнително, ретко може да се сретнат табели каде водородот и хелиумот се надвор од сите групи.[41][42]
Група 3
Во многу периодни системи, f-блокот е поместен за еден елемент надесно, така што лантан и актиниум стануваат дел од d-блок елементи во групата 3, а Ce-Lu и Th-Lr го формираат f-блокот. Така d-блокот е поделен на два многу нерамни делови. Ова е задржување од раните погрешни мерења на конфигурациите на електрони; современите мерења се поконзистентни со формата со лутетиум и лоренциум во групата 3, и со La–Yb и Ac–No како f-блок.
Обвивката на 4f е целосно исполнета со итербиум, и поради таа причина Лев Ландау и Евгени Лифшиц во 1948 година сметале дека не е точно да се групира лутетиумот како елемент од f-блокот. Тие сè уште не презеле чекор да го отстранат лантанот од d-блокот, но Џун Кондо во 1963 година сфатил дека нискотемпературната суперспроводливост на лантан ја подразбира активноста на неговата 4f-обвивка.[73] Во 1965 година, Дејвид К. Хамилтон го поврзал ова набљудување со неговата местоположба во периодниот систем и тврдел дека f-блокот треба да биде составен од елементите La–Yb и Ac–No. Оттогаш, физички, хемиски и електронски докази ја поддржуваат оваа задача. Прашањето добило пошироко внимание од Вилијам Б. Џенсен во 1982 година, и преназначувањето на лутециумот и лоренциумот во групата 3 било поддржано од извештаите на Меѓународниот сојуз за чиста и применета хемија (МСЧПХ), кои датираат од 1988 година (кога биле препорачани броевите на групата 1-18) и 2021 година.[74] Варијантата сепак сè уште постои бидејќи повеќето писатели на учебници не се свесни за ова прашање.
Понекогаш може да се сретне и трета форма во која местата под итриумот во групата 3 се оставени празни, како што е табелата што се појавува на мрежното место на МСЧПХ, но ова создава неусогласеност со квантната механика со тоа што го прави f-блокот широк 15 елементи (La–Lu и Ac–Lr) иако може да се вклопат само 14 f-електрони. Покрај тоа, постои одредена нејасност во литературата за тоа кои елементи потоа се подразбираат дека се во групата 3.[75][76][77] Додека извештајот на МСЧПХ од 2021 година забележал дека f-блоковите со ширина од 15 елементи се поддржани од некои практичари од специјализирана гранка на релативистичка квантна механика која се фокусира на својствата на супертешките елементи, мислењето на проектот било дека таквите интереси зависни од интерес не треба да имаат никакво влијание врз тоа како периодичната табела е претставена на „општата хемиска заедница“. Други автори кои се фокусираат на супертешките елементи оттогаш појасниле дека „15-тиот запис на f-блокот го претставува првиот отвор од d-блокот кој е оставен празен за да го означи местото на влошките на f-блокот“, што би значело дека оваа форма сè уште има лутециум и лоренциум (15-ти записи за кои станува збор) во групата d-3 [78] Така, кога изданијата на МСЧПХ ја прошируваат табелата на 32 колони, тие го прават тоа јасно и ги ставаат лутециумот и лоренциумот под итриум во групата 3.[79][80]
Во литературата може да се сретнат неколку аргументи во корист на Sc-Y-La-Ac,[81][82] но тие се оспорени како логичко нејасни. На пример, се тврди дека лантанот и актиниумот не можат да бидат во f-блокот на елементи бидејќи како поединечни атоми во гасна фаза, тие не почнале да ги пополнуваат f-подобвивките.[83] Но, истото важи и за ториумот кој никогаш не бил оспорен како елемент од f-блокот, и овој аргумент го занемарува проблемот на другиот крај: дека f-обвивките целосно се пополнуваат кај итербиумот и нобелиумот, што одговараат на формата Sc-Y-Lu-Lr, а не во лутециум и лоренциум, како што е Sc.[84] Не само што се такви исклучителни конфигурации во малцинството, туку тие, исто така, во секој случај никогаш не биле сметани за релевантни за позиционирање на други елементи на периодниот систем: во гасовити атоми, d-обвивките го завршуваат своето полнење со бакар, паладиум и злато, но кај хемичарите универзално прифатено е дека овие конфигурации се навистина во согласност со Маделунговото правило со цинкот, кадмиумот и живата. Релевантниот факт за поставување е дека лантанот и актиниумот (како ториумот) имаат валентни f-орбитали кои можат да станат опфатени во хемиски средини, додека лутециумот и лоренциумот немаат:[85] нивните f-обвивки не можат да се користат, а хемиските обвивки се користат во реакцијата. Така, врската помеѓу итриумот и лантанот е само секундарна врска помеѓу елементите со ист број на валентни електрони, но различни видови валентни орбитали, како што е онаа помеѓу хромот и ураниумот; додека врската помеѓу итриумот и лутетиумот е примарна, споделувајќи го и валентниот електронски број и валентен орбитален тип.
Бидејќи хемиските реакции ги вклучуваат валентните електрони, елементите со слични надворешни електронски конфигурации може да се очекува да реагираат слично и да формираат соединенија со слични пропорции на елементи во нив. Таквите елементи се сместени во иста група, и на тој начин постои тенденција да има јасни сличности и закони во хемиското однесување додека се движиме низ групата.[86] Бидејќи аналогните конфигурации се случуваат во редовни интервали, својствата на елементите на тој начин покажуваат периодични повторувања, па оттука и името на периодниот систем и периодичниот закон. Овие периодични повторувања биле забележани многу пред да се развие основната теорија која ги објаснува.[87][88]
Атомски полупречник
Историски гледано, физичката големина на атомите била непозната до почетокот на 20 век. Првата пресметана проценка на атомскиот полупречник на водород била објавена од страна на физичарот Артур Хас во 1910 година во рамките на редот на големина (фактор 10) од прифатената вредност, Боровиот полупречник (~0,529 Å). Во својот модел, Хас користел конфигурација со еден електрон заснован на класичниот атомски модел предложен од Џозеф Томсон во 1904 година, често наречен Модел на пудинг од слива.
Атомските полупречници (големината на атомите) зависат од големината на нивните најоддалечени орбитали. Тие генерално се намалуваат од лево кон десно по елементите од главната група, бидејќи јадреното полнење се зголемува, но надворешните електрони сè уште се во истата обвивка. Меѓутоа, спуштајќи се по колона, полупречниците генерално се зголемуваат, бидејќи најоддалечените електрони се во повисоките обвивки кои се подалеку од јадрото.[89] Првиот ред од секој блок е многу мал, поради ефектот наречен кајносиметрија или примогена одбивност:[90] подобвивките 1s, 2p, 3d и 4f немаат внатрешни аналози. На пример, орбиталите на 2p не доживуваат силно одбивање од орбиталите 1s и 2s, кои имаат сосема различни аголни распределби на полнеж, па оттука и не се многу големи; но орбиталите на 3p доживуваат силно одбивање од орбиталите 2p, кои имаат слични аголни распределби на полнеж. Така повисоките s-, p-, d- и f-подобвивки доживуваат силно одбивање од нивните внатрешни аналози, кои имаат приближно иста аголна распределба на полнежот и мора да се прошират за да се избегне ова. Ова прави значајни разлики помеѓу малите 2p елементи, кои претпочитаат повеќекратно поврзување, и поголемите 3p и повисоки p-елементи, кои не го прават тоа. Слични аномалии се јавуваат за 1s, 2p, 3d, 4f и хипотетичките 5g елементи:[91] степенот на оваа аномалија од првиот ред е највисок за s-блокот, е умерен за p-блокот и е помалку изразен за d- и f-блоковите.
Во елементите на преминување, внатрешната обвивка се полни, но големината на атомот сè уште е одредена од надворешните електрони. Зголемениот јадрен полнеж низ серијата и зголемениот број на внатрешни електрони за заштита донекаде се компензираат едни со други, па намалувањето на полупречникот е помало. Атомите 4p и 5d, кои доаѓаат веднаш по за прв пат воведувањето на новите типови на преодни серии, се помали отколку што би се очекувало, бидејќи додадените јадра 3d и 4f подобвивки обезбедуваат единствено нецелосна заштита на јадрено полнење за надворешните електрони. Оттука, на пример, атомите на галиум се малку помали од атомите на алуминиум. Заедно со кајносиметријата, ова резултира со пар-непар разлика помеѓу периодите (освен во s-блокот) [б 10] која понекогаш е позната како секундарна периодичност: елементите во парните периоди имаат помали атомски полупречници и претпочитаат да губат помалку електрони, додека елементите во непарните периоди (освен првиот) се разликуваат во спротивна насока. Така, на пример, многу својства во p-блокот покажуваат цик-цак насока наместо мазен тренд по должината на групата. На пример, фосфорот и антимонот во непарните периоди од групата 15 лесно ја достигнуваат оксидационата состојба +5, додека азотот, арсенот и бизмутот во парните периоди претпочитаат да останат на +3.[93] Слична ситуација важи и за d-блокот, при што лутециумот преку атомите на волфрам е малку помал од итриумот преку атомите на молибденот соодветно.[94][95]

Атомите на талиум и олово имаат приближно иста големина како атомите на индиум и калај, соодветно, но од бизмут до радон атомите 6p се поголеми од аналогните 5p атоми. Ова се случува затоа што кога атомските јадра стануваат високо наелектризирани, потребна е специјална релативност за да се измери ефектот на јадрото врз електронскиот облак. Овие релативистички ефекти резултираат со тешки елементи кои се повеќе имаат различни својства во споредба со нивните полесни хомолози во периодниот систем. Взаемното дејство спин-орбита ја дели p-подобвивката: едната р-орбитала е релативистички стабилизирана и намалена (полн талиум и олово), но другите две (полнење на бизмут преку радон) се релативистички дестабилизирани и проширени. Релативистичките ефекти објаснуваат и зошто златото е златно, а живата е течност на собна температура.[97] Тие се очекува да станат многу силни во доцниот седми период, што потенцијално ќе доведе до колапс на периодичноста.[98] Електронските конфигурации се јасно познати единствено до елементот 108 (хасиум), а експерименталната хемија над 108 е направена единствено за елементите 112 (копернициум) до 115 (московиум), така што хемиската карактеристика на најтешките елементи останува тема на тековното истражување.[99][100]
Трендот дека атомските полупречници се намалуваат од лево кон десно е присутен и кај јонските полупречници, иако е потешко да се испита бидејќи најчестите јони на последователните елементи вообичаено се разликуваат по задолженост. Јоните со иста електронска конфигурација се намалуваат во големина како што расте нивниот атомски број, поради зголемената привлечност од попозитивно наелектризираното јадро: на пример, јонските полупречници се намалуваат во серијата Se2−, Br−, Rb+, Sr2+, Y3+ , Zr4+, Nb5+, Tс7. Јоните од истиот елемент стануваат помали како што се отстрануваат повеќе електрони, бидејќи привлечноста од јадрото почнува да ја надминува одбивноста помеѓу електроните што предизвикува ширење на електронските облаци: на пример, јонските полупречници се намалуваат во серијата V2+, V3+, V4+, V 5+.
Енергија на јонизација

Првата енергија на јонизација на атомот е енергијата потребна за отстранување на електрон од него. Ова варира во зависност од атомскиот полупречник: енергијата на јонизација се зголемува лево кон десно и надолу кон горе, бидејќи електроните што се поблиску до јадрото се држат поцврсто и потешко се отстрануваат. Така, енергијата на јонизација се минимизира на првиот елемент од секој период - водородот и алкалните метали - и потоа генерално се зголемува додека не стигне до благородниот гас на десниот раб на периодот. Постојат некои исклучоци од овој тренд, како што е кислородот, каде што електронот што се отстранува е спарен и на тој начин меѓуелектронската одбивност го олеснува отстранувањето од очекуваното.
Во преминска серија, надворешните електрони преференцијално се губат иако внатрешните орбитали се полнат. На пример, во 3d серијата, прво се губат електроните 4s иако 3d орбиталите се пополнуваат. Заштитниот ефект на додавање дополнителен 3d електрон приближно го компензира порастот на јадреното полнење, и затоа енергиите на јонизација остануваат главно исти, иако постои мало зголемување особено на крајот од секоја преодна серија.[101]
Бидејќи металните атоми имаат склоност да губат електрони во хемиските реакции, енергијата на јонизација генерално е во заемен однос со хемиската реактивност, иако има и други фактори кои се вклучени.
Електронски афинитет

Спротивното својство на енергијата на јонизација е електронскиот афинитет, што преттавува енергијата што се ослободува кога се додава електрон во атомот.[102] Електронот што поминува ќе биде полесно привлечен кон атомот доколку посилно го почувствува влечењето на јадрото, а особено доколку има достапна делумно пополнета надворешна орбитала што може да го прими. Поради тоа, електронскиот афинитет има тенденција да се зголемува надолу нагоре и лево кон десно. Исклучок е последната колона, благородните гасови, кои имаат полна обвивка и немаат место за друг електрон. Ова им дава на халогените во следната до последна колона највисоки електронски афинитети.
Некои атоми, како благородните гасови, немаат електронски афинитет: тие не можат да формираат стабилни анјони во гасната фаза.[103] (Тие можат да формираат метастабилни резонанци доколку дојдовниот електрон пристигне со доволно кинетичка енергија, но тие неизбежно и брзо се самојонизираат: на пример, животниот век на најдолготрајното ниво на He- е околу 359 микросекунди [104]. Благородните гасови, кои имаат високи енергии на јонизација и немаат електронски афинитет, имаат мала склоност кон добивање или губење на електрони и генерално се нереактивни.
Се случуваат некои исклучоци: кислородот и флуорот имаат пониски електронски афинитети од нивните потешки хомолози сулфур и хлор, бидејќи тие се мали атоми и оттука новододадениот електрон би доживеал значително одбивање од веќе присутните. За неметалните елементи, електронскиот афинитетисто така донекаде корелира со реактивноста, но не совршено бидејќи се вклучени други фактори. На пример, флуорот има помал афинитет на електрони од хлорот (поради екстремната меѓуелектронска одбивност за многу малиот атом на флуор), но е пореактивен.
Валентни и оксидациони состојби
Валентноста на елементот може да се дефинира или како број на атоми на водород кои можат да се комбинираат со него за да формираат едноставен двоен хидрид, или како двојно поголем број на атоми на кислород што можат да се комбинираат со него за да формираат едноставен двоен оксид (односно, не пероксид или супероксид). Валентноста на елементите од главната група се директно поврзани со бројот на групата: хидридите во главните групи 1–2 и 13–17 ги следат формулите MH, MH2, MH3, MH4, MH3, MH2 и на крајот MH. Наместо тоа, највисоките оксиди се зголемуваат во валентноста, следејќи ги формулите M2O, MO, M2O3, MO2, M2O5, MO3, M2O7. [б 11] Денес поимот за валентност е проширен со онаа на оксидационата состојба, што е формално полнење кое останува на елементот кога сите други елементи во соединението се отстранети како нивни јони.
Електронската конфигурација сугерира подготвено објаснување од бројот на електрони достапни за поврзување; белектрони започнува од 1 во групата 1, а потоа се зголемува кон десната страна на периодниот систем, единствено ресетирање на 3 секогаш кога ќе започне секој нов блок. Така, во периодот 6, Cs–Ba имаат 1–2 валентни електрони; La–Yb имаат 3–16; Lu–Hg имаат 3-12; и Tl–Rn имаат 3–8. Меѓутоа, кон десната страна на d- и f-блоковите, теоретскиот максимум што одговара на користењето на сите валентни електрони воопшто не е остварлив; истата ситуација влијае на кислородот, флуорот и лесните благородни гасови до криптон.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | H 1 |
He 2 | ||||||||||||||||||||||||||||||
| 2 | Li 1 |
Be 2 |
B 3 |
C 4 |
N 5 |
O 6 |
F 7 |
Ne 8 | ||||||||||||||||||||||||
| 3 | Na 1 |
Mg 2 |
Al 3 |
Si 4 |
P 5 |
S 6 |
Cl 7 |
Ar 8 | ||||||||||||||||||||||||
| 4 | K 1 |
Ca 2 |
Sc 3 |
Ti 4 |
V 5 |
Cr 6 |
Mn 7 |
Fe 8 |
Co 9 |
Ni 10 |
Cu 11 |
Zn 12 |
Ga 3 |
Ge 4 |
As 5 |
Se 6 |
Br 7 |
Kr 8 | ||||||||||||||
| 5 | Rb 1 |
Sr 2 |
Y 3 |
Zr 4 |
Nb 5 |
Mo 6 |
Tc 7 |
Ru 8 |
Rh 9 |
Pd 10 |
Ag 11 |
Cd 12 |
In 3 |
Sn 4 |
Sb 5 |
Te 6 |
I 7 |
Xe 8 | ||||||||||||||
| 6 | Cs 1 |
Ba 2 |
La 3 |
Ce 4 |
Pr 5 |
Nd 6 |
Pm 7 |
Sm 8 |
Eu 9 |
Gd 10 |
Tb 11 |
Dy 12 |
Ho 13 |
Er 14 |
Tm 15 |
Yb 16 |
Lu 3 |
Hf 4 |
Ta 5 |
W 6 |
Re 7 |
Os 8 |
Ir 9 |
Pt 10 |
Au 11 |
Hg 12 |
Tl 3 |
Pb 4 |
Bi 5 |
Po 6 |
At 7 |
Rn 8 |
| 7 | Fr 1 |
Ra 2 |
Ac 3 |
Th 4 |
Pa 5 |
U 6 |
Np 7 |
Pu 8 |
Am 9 |
Cm 10 |
Bk 11 |
Cf 12 |
Es 13 |
Fm 14 |
Md 15 |
No 16 |
Lr 3 |
Rf 4 |
Db 5 |
Sg 6 |
Bh 7 |
Hs 8 |
Mt 9 |
Ds 10 |
Rg 11 |
Cn 12 |
Nh 3 |
Fl 4 |
Mc 5 |
Lv 6 |
Ts 7 |
Og 8 |
Целосното објаснување бара да се земе предвид енергијата што би се ослободила при формирање на соединенија со различни валентни наместо едноставно да се земат предвид само електронските конфигурации. На пример, магнезиумот формира катјони Mg2+ наместо Mg+ кога се раствора во вода, бидејќи тие спонтано би се диспропорционираат во катјони Mg0 и Mg2+. Тоа е затоа што енталпијата на хидратација (опкружување на катјон со молекули на вода) се зголемува во големина со полнењето и полупречникот на јонот. Во Mg+, најоддалечената орбитала (која го одредува јонскиот полупречник) е сè уште 3s, така што хидратациската енталпија е мала и недоволна да ја компензира енергијата потребна за отстранување на електронот; но, повторно јонизирајќи до Mg2+ ја открива јадрото 2p подобвивка, правејќи ја хидратациската енталпија доволно голема за да овозможи формирање на соединенијата на магнезиум(II). Од слични причини, вообичаените состојби на оксидација на потешките p-блок елементи (каде што ns електроните стануваат пониски во енергија од np) имаат стремежи да варираат по чекори од 2, бидејќи тоа е неопходно за да се открие внатрешната подобвивка и да се намали јонскиот полупречник (на пр. Tl+ открива 6s, а Tl 3+ открива 6s, а Tl 3+ открива 5 d, а еднаш губи 2 електрони, така што еднаш губи 5d електрони, така што еднаш изгубил 5d електрони). За помалку електронегативните p-блок елементи може да се користат аналогни аргументи засновани на орбитална хибридизација. [б 12]

За преодните метали, вообичаените состојби на оксидација се скоро секогаш најмалку +2 поради слични причини (откривајќи ја следната подобвивка); ова важи дури и за металите со аномални dx+1 s1 или dx+2 s0 конфигурации (освен за среброто), бидејќи одбивноста помеѓу d-електроните значи дека движењето на вториот електрон од s- до d-подобвивката не ја променува значително неговата енергија на јонизација. Бидејќи јонизирањето на преодните метали понатаму не открива нови внатрешни подобвивки, нивните оксидациони состојби имаат стремеж да варираат со чекори од 1. Лантанидите и доцните актиниди генерално покажуваат стабилна состојба на оксидација +3, отстранувајќи ги надворешните s-електрони, а потоа (обично) еден електрон од (n−2) f-орбиталите, кои се слични по енергија на ns.[108] Заедничките и максималните состојби на оксидација на елементите d- и f-блокови имаат стремеж да зависат од енергиите на јонизација. Како што енергетската разлика помеѓу (n−1)d и ns орбиталите расте по секоја преодна серија, станува енергетски помалку поволно да се јонизираат дополнителни електрони. Така, раните групи на метали во премин имаат тенденција да претпочитаат повисоки состојби на оксидација, но состојбата на оксидација +2 станува постабилна за доцните преодни метални групи. Така, највисоката формална оксидациска состојба се зголемува од +3 на почетокот на секој ред од блоковите d, до +7 или +8 во средината (на пр. OsO4), а потоа се намалува на +2 на крајот.[109] Лантанидите и доцните актиниди обично имаат висока четврта енергија на јонизација и оттука ретко ја надминуваат +3 оксидациската состојба, додека раните актиниди имаат ниска четврта енергија на јонизација и така, на пример, нептуниумот и плутониумот можат да достигнат +7. Последните актиниди одат подалеку од лантанидите кон состојби на ниска оксидација: менделевиумот полесно се сведува на +2 состојба отколку тулиумот или дури и европиумот (лантанидот со најстабилна +2 состојба, поради неговата полуполнета f-обвивка), а нобелиумот целосно фаворизира +2 над +3, за разлика од итербиумот.[37]
Бидејќи елементите во истата група ги делат истите валентни конфигурации, тие обично покажуваат слично хемиско однесување. На пример, алкалните метали од првата група имаат сите еден валентен електрон и формираат многу хомогена класа на елементи: сите тие се меки и реактивни метали. Сепак, постојат многу фактори кои се вклучени, а групите честопати можат да бидат прилично хетерогени. На пример, водородот има и еден валентен електрон и е во иста група со алкалните метали, но неговото хемиско однесување е сосема различно. Стабилните елементи од групата 14 опфаќаат неметал (јаглерод), два полупроводници (силициум и германиум) и два метали (калај и олово); тие сепак се обединети со тоа што имаат четири валентни електрони. Ова често води до сличности во максималната и минималната состојба на оксидација (на пр. сулфур и селен во групата 16 имаат максимална оксидациона состојба +6, како во SO3 и SeO3, и минимална состојба на оксидација −2, како кај сулфидите и селенидите); но не секогаш (на пр. не е познато дека кислородот формира оксидациона состојба +6, и покрај тоа што е во иста група со сулфурот и селенот).
Електронегативност

Друга важна особина на елементите е нивната електронегативност. Атомите можат да формираат ковалентни врски едни со други преку споделување на електрони во парови, создавајќи преклопување на валентни орбитали. Степенот до кој секој атом го привлекува заедничкиот електронски пар зависи од електронегативноста на атомот да добива или губи електрони. Колку повеќе електронегативен атом ќе има стремеж да го привлекува електронскиот пар повеќе, а помалку електронегативниот (или повеќе електропозитивен) ќе го привлече помалку. Во екстремни случаи, електронот може да се смета дека е целосно пренесен од поелектропозитивниот атом на поелектронегативниот, иако ова е поедноставување. Врската потоа врзува два јони, еден позитивен (кој се откажал од електронот) и еден негативен (кој го прифатил), и се нарекува јонска врска.
Електронегативноста зависи од тоа колку силно јадрото може да привлече електронски пар, и поради тоа покажува слична варијација на другите веќе дискутирани својства: електронегативноста има тенденција да паѓа горе надолу, а да расте лево кон десно. Алкалните и земноалкалните метали се едни од најелектропозитивните елементи, додека халкогените, халогените и благородните гасови се меѓу најелектронегативните.
Електронегативноста генерално се мери на според Полинговата скала, на која на најелектронегативниот реактивен атом (флуор) му е дадена електронегативност 4,0, а на најмалку електронегативниот атом (цезиум) му е дадена електронегативност 0,79. Всушност, неонот е најелектронегативниот елемент, но Полинговата скала не може да ја измери неговата електронегативност бидејќи не формира ковалентни врски со повеќето елементи.[110]
Електронегативноста на елементот варира во зависност од идентитетот и бројот на атомите со кои е поврзан, како и со тоа колку електрони веќе изгубил: атомот станува поелектронегативен кога изгубил повеќе електрони. Ова понекогаш прави голема разлика: оловото во состојба на оксидација +2 има електронегативност 1,87 на Полинговата скала, додека оловото во +4 оксидациона состојба има електронегативност од 2,33.[111]
Металност
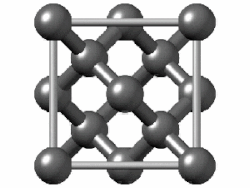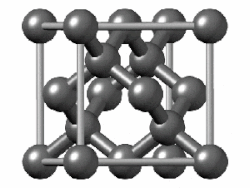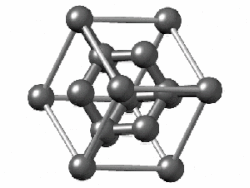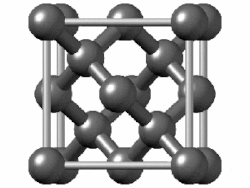
Едноставна супстанција е супстанца која се состои од атоми на еден хемиски елемент. Едноставните супстанции од поелектронегативните атоми имаат склонетост да споделуваат електрони (формираат ковалентни врски) едни со други. Тие формираат или мали молекули (како водород или кислород, чии атоми се поврзуваат во парови) или џиновски структури кои се протегаат неодредено (како јаглерод или силициум). Благородните гасови едноставно остануваат како единечни атоми, бидејќи веќе имаат полна обвивка. Супстанциите составени од дискретни молекули или единечни атоми се држат заедно со послаби привлечни сили помеѓу молекулите, како што е Лондонската дисперзивна сила: додека електроните се движат во молекулите, тие создаваат моментални нерамнотежи на електричното полнење, што предизвикува слична нерамнотежа на блиските молекули и создава синхронизирани движења на електроните низ многу соседни.[113]

Сепак, поелектропозитивните атоми, наместо тоа, имаат стремеж да губат електрони, создавајќи „море“ од електрони што ги зафаќа катјоните. Надворешните орбитали на еден атом се преклопуваат споделувајќи ги електроните со сите негови соседи, создавајќи џиновска структура на молекуларни орбитали кои се протегаат над сите атоми.[114] Ова негативно наелектризирано „море“ ги влече сите јони и ги одржува заедно во метална врска. Елементите што формираат такви врски често се нарекуваат метали; оние кои не се често наречени неметали. Некои елементи можат да формираат повеќе едноставни супстанции со различни структури: тие се нарекуваат алотропи. На пример, дијамантот и графитот се два алотропи на јаглеродот. [б 13]
Металноста на елементот може да се предвиди од електронските својства. Кога атомските орбитали се преклопуваат за време на метално или ковалентно поврзување, тие создаваат и врзувачки и антиврзувачки молекуларни орбитали со еднаков капацитет, со антиврзувачките орбитали со поголема енергија. Нето сврзувачкиот карактер се јавува кога има повеќе електрони во сврзувачките орбитали отколку што има во орбиталите против сврзување. Така, металното поврзување е можно кога бројот на електрони делокализирани од секој атом е помал од двапати од бројот на орбитали кои придонесуваат за преклопување. Ова е ситуацијата за елементите од групите 1 до 13; тие исто така имаат премалку валентни електрони кои формираат големи ковалентни структури каде што сите атоми заземаат еквивалентни местоположби, и така речиси сите се метализираат. Исклучок се водородот и борот, кои имаат превисока енергија на јонизација. Така, водородот формира ковалентна молекула H2, а борот формира џиновска ковалентна структура базирана на икозаедарските кластери B12. Во метал, сврзувачките и антиврзувачките орбитали имаат енергии кои се преклопуваат, создавајќи единствена лента низ која електроните можат слободно да течат, овозможувајќи електрична спроводливост.

Во групата 14, станува возможно и металното и ковалентно поврзување. Во дијамантскиот кристал, ковалентните врски помеѓу јаглеродните атоми се силни, бидејќи тие имаат мал атомски полупречник и на тој начин јадрото има поголемо задржување на електроните. Според тоа, сврзувачките орбитали што произлегуваат се многу пониски во енергија од орбиталите против сврзување и нема преклопување, така што електричната спроводливост станува невозможна: јаглеродот е неметал. Сепак, ковалентната врска станува послаба за поголемите атоми и енергетскиот јаз помеѓу сврзувачките и антиврзувачките орбитали се намалува. Според тоа, силиконот и германиумот имаат помали појасни празнини и се полупроводници при амбиентални услови: електроните можат да го преминат јазот кога се топлинско возбудени. (Борот е исто така полупроводник при амбиентални услови). Како што се зголемува температурата, сите неметали развиваат некои полупроводнички својства, во поголема или помала мера во зависност од големината на јазот на појасот. Така, металите и неметалите може да се разликуваат според температурната зависност на нивната електрична спроводливост: спроводливоста на металот се намалува со зголемувањето на температурата (бидејќи топлинското движење го отежнува слободниот проток на електроните), додека спроводливоста на неметалот се зголемува (бидејќи повеќе електрони може да се возбудат да го преминат јазот).[116]
Елементите во групите од 15 до 17 имаат премногу електрони, формираат гигантски ковалентни молекули кои се протегаат во сите три димензии. За полесните елементи, врските во малите двоатомски молекули се толку силни што кондензираната фаза е оневозможена: на тој начин азот (N2), кислород (O2), бел фосфор и жолт арсен (P4 и As4), сулфур и црвен селен (S8 и стабилните халогени (F2, Cl2, Br2, и I2) лесно формираат ковалентни молекули со малку атоми. Потешките имаат тенденција да формираат долги синџири (на пр. црвен фосфор, сив селен, телур) или слоевити структури (на пр. јаглерод како графит, црн фосфор, сив арсен, антимон, бизмут) кои се протегаат само во една или две, наместо во три димензии. И двата вида структури може да се пронајдат како алотропи на фосфор, арсен и селен, иако алотропите со долги синџири се постабилни во сите три. Бидејќи овие структури не ги користат сите свои орбитали за поврзување, тие завршуваат со сврзувачки, неврзувачки и антиврзувачки појаси со цел да се зголеми енергијата. Слично на групата 14, празнините на појасот се намалуваат за потешките елементи и станува возможно слободното движење на електроните помеѓу синџирите или слоевите. Така, на пример, црн фосфор, црн арсен, сив селен, телур и јод се полупроводници; сивиот арсен, антимонот и бизмутот се полуметали (што покажуваат квазиметална спроводливост, со многу мало преклопување на лентата); а полониумот и веројатно астатинот се вистински метали. Елементите од природната група 18 остануваат како поединечни атоми.[117] [б 14]
Линијата на поделба помеѓу металите и неметалите е приближно дијагонала од горе лево кон доле десно, при што преодните серии се појавуваат лево од оваа дијагонала (бидејќи тие имаат многу достапни орбитали за преклопување). Ова е очекувано, бидејќи металноста има сколонетост да биде во сооднос со електропозитивноста и подготвеноста да се изгубат електрони, што се зголемува од десно кон лево и нагоре надолу. Така, металите значително ги надминуваат неметалите. Елементите во близина на границата тешко се класифицираат: тие имаат стремеж да имаат својства што се средно помеѓу оние на металите и неметалите и може да имаат некои својства карактеристични за двете. Тие често се нарекуваат полуметали или металоиди. Терминот „полуметал“ кој што се користи во оваа смисла не треба да се меша со неговата строга физичка смисла која има врска со структурата на лентата: на пример бизмутот е физички полуметал, но хемичарите генерално го сметаат за метал.[119]
- Железо, метал
- Сулфур, неметал
- Арсен, елемент кој често се нарекува полуметал или металоид
Општо земено, металите се сјајни и густи. Тие обично имаат високи точки на топење и вриење поради јачината на металната врска и често се податливи и еластични (лесно се протегаат и обликуваат), бидејќи атомите можат да се движат релативно едни на други без да се прекине металната врска.[120] Тие спроведуваат струја бидејќи нивните електрони се слободни да се движат во сите три димензии. Слично на тоа, тие спроведуваат топлина, која се пренесува од електроните како дополнителна кинетичка енергија: тие се движат побрзо. Овие својства опстојуваат во течна состојба, бидејќи иако кристалната структура е уништена при топење, атомите сè уште се допираат и металната врска опстојува, иако е ослабена. Металите имаат стремеж да бидат реактивни кон неметали. Може да се најдат некои исклучоци од овие генерализации: на пример, берилиум, хром, манган,[121] антимон,[122] бизмут, и ураниум се кршливи (не е исцрпен списокот); хромот е исклучително тврд;[123] галиумот, рубидиумот, цезиумот и живата се течни на или блиску до собна температура; и благородните метали како златото се хемиски многу инертни.[124][125]
Неметалите покажуваат различни својства. Оние кои формираат џиновски ковалентни кристали покажуваат високи точки на топење и вриење, бидејќи е потребна значителна енергија за да се надминат силните ковалентни врски. Оние кои формираат дискретни молекули се држат заедно главно преку силите на дисперзија, кои полесно се надминуваат; на тој начин тие имаат тенденција да имаат пониски точки на топење и вриење,[126] а многу се течности или гасови на собна температура. Неметалите често имаат тенденција да бидат реактивни кон металите, освен за благородните гасови, кои се инертни кон повеќето супстанции. Тие се кршливи кога се цврсти бидејќи нивните атоми цврсто се држат на место. Тие се помалку густи и слабо спроведуваат електрицитет, бидејќи нема мобилни електрони.[127] Во близина на границата, празнините на појасот се мали и затоа многу елементи во тој регион се полупроводници, како што се силициум, германиум и телур. Селенот има и полупроводен сив алотроп и изолациски црвен алотроп; арсенот има метален сив алотроп, полупроводлив црн алотроп и изолациски жолт алотроп (иако последниот е нестабилен при амбиентални услови). Повторно постојат исклучоци; на пример, дијамантот има најголема топлинска спроводливост од сите познати материјали, поголема од кој било метал.[128]
Вообичаено е да се назначи класа на металоиди кои се протегаат на границата помеѓу металите и неметалите, бидејќи елементите во тој регион се средни и во физички и во хемиски својства. Сепак, не постои консензус во литературата за тоа кои точно елементи треба да бидат назначени така. Кога се користи таква категорија, силициумот, германиумот, арсенот и телурот речиси секогаш се вклучени, а борот и антимонот обично се вклучени; но поолемиот дел од изворите вклучуваат и други елементи, без договор за тоа кои дополнителни елементи треба да се додадат, а некои други наместо тоа одземаат од овој список. [б 15] На пример, за разлика од сите други елементи кои генерално се сметаат за металоиди или неметали, единствената стабилна форма на антимонот има метална спроводливост. Покрај тоа, елементот наликува на бизмут и, поопшто, на другите метали од p-блокот во неговото физичко и хемиско однесување. Врз основа на ова, некои автори сметаат дека тој е подобро класифициран како метал отколку како металоид.[131] Од друга страна, селенот има некои полупроводнички својства во својата најстабилна форма (иако има и изолациски алотропи) и се тврди дека треба да се смета за металоид - иако оваа ситуација важи и за фосфорот, што е многу поретко вклучување меѓу металоидите.
Понатамошни прикажувања на периодичноста
Постојат некои други врски низ периодниот систем помеѓу елементите кои не се во иста група, како што се дијагоналните односи помеѓу елементите кои се дијагонално соседни (на пр. литиум и магнезиум). Може да се најдат некои сличности меѓу главните групи и групите на преодни метали, или помеѓу раните актиниди и раните преодни метали, кога елементите имаат ист број на валентни електрони. Така, ураниумот донекаде наликува на хром и волфрам во групата 6,[132] бидејќи сите три имаат шест валентни електрони.[133] Односите помеѓу елементите со ист број на валентни електрони, но различни типови на валентни орбитали се нарекуваат секундарни или изодонорски односи: тие обично ги имаат истите максимални состојби на оксидација, но не и исти минимални состојби на оксидација. На пример, хлорот и манганот имаат +7 како максимална состојба на оксидација (на пр. Cl2O7 и Mn2O7), но нивните соодветни минимални состојби на оксидација се -1 (на пр. HCl) и -3 (K2[Mn(CO)4]). Елементите со ист број на празни валентни места, но различен број на валентни електрони се поврзани со терциерна или изоакцепторна врска: тие обично имаат слични минимални, но не и максимални состојби на оксидација. На пример, водородот и хлорот имаат −1 како минимална оксидациска состојба (во хидриди и хлориди), но максималната оксидациона состојба на водородот е +1 (на пр. H2O) додека хлорот е +7.
Многу други физички својства на елементите покажуваат периодични варијации во согласност со периодниот закон, како што се точките на топење, точките на вриење, топлина на топење, топлина на испарување, енталпија на атомизација итн. Слични периодични варијации се појавуваат за соединенијата на елементите, кои можат да се забележат со споредување на хидриди, оксиди, сулфиди, халиди итн. Хемиските својства се потешко да се опишат квантитативно, но исто така покажуваат свои периодичности. Примерите вклучуваат варијации во киселинските и базичните својства на елементите и нивните соединенија, стабилноста на соединенијата и методите за изолирање на елементите. Периодичноста е и се користи многу широко за да се предвидат својствата на непознати нови елементи и нови соединенија, и е централна за современата хемија.
Remove ads
Класификација на елементи
Многу термини биле користени во литературата за да се опишат групи на елементи кои се однесуваат слично. Имињата на групата алкален метал, алкален земјен метал, триел, тетрел, пниктоген, халкоген, халоген и благороден гас се признати од Меѓународниот сојуз за чиста и применета хемија; другите групи може да се наведат според нивниот број или според нивниот прв елемент (на пр., групата 6 е групата на хром).[135] Некои ги делат p-блок елементите од групите 13 до 16 по металичност,[129][134] иако не постои ниту дефиниција од МСЧПХ ниту прецизен консензус за тоа кои точно елементи треба да се сметаат за метали, неметали или полуметали (понекогаш се нарекуваат металоиди). Ниту, пак, постои консензус за тоа како треба да се нарекуваат металите кои ги наследуваат преодните метали, при што меѓу можностите се користени постпремински метал и слаб метал. Некои напредни монографии ги исклучуваат елементите од групата 12 од преодните метали врз основа на нивните понекогаш сосема различни хемиски својства, но ова не е универзална практика [136] и МСЧПХ во моментов не го споменува како дозволен во своите Принципи на хемиска номенклатура.[137]
Се смета дека лантанидите се елементите La–Lu, кои сите се многу слични еден на друг: историски тие вклучувале само Ce–Lu, но лантанот станал вклучен со вообичаена употреба. Ретките земјени елементи (или ретките метали) додаваат скандиум и итриум на лантанидите. Аналогно на тоа, актинидите се сметаат за елементите Ac-Lr (историски Th-Lr), иако варијацијата на својствата во оваа група е многу поголема отколку во лантанидите. МСЧПХ ги препорачува имињата лантаноиди и актиноиди за да се избегне двосмисленост, бидејќи суфиксот -ide обично означува негативен јон; сепак лантанидите и актинидите остануваат вообичаени. Со зголеменото препознавање на лутециумот и лоренциумот како d-блок елементи, некои автори почнале да ги дефинираат лантанидите како La-Yb и актинидите како Ac-No, што одговараат на f-блок.[138][139][140] Трансактинидите или супертешките елементи се краткотрајните елементи надвор од актинидите, почнувајќи од лоренциум или рутерфордиум (во зависност од тоа каде завршуваат актинидите).[141][142][143]
Многу повеќе категоризации постојат и се користат според одредени дисциплини. Во астрофизиката, металот е дефиниран како секој елемент со атомски број поголем од 2, односно сè освен водород и хелиум.[144] Терминот „полуметал“ има поинаква дефиниција во физиката отколку во хемијата: бизмутот е полуметал според физичките дефиниции, но хемичарите генерално го сметаат за метал.[145] Неколку термини се широко користени, но без некоја многу формална дефиниција, како што е „тежок метал“, кој добил толку широк опсег на дефиниции што бил критикуван како „ефективно бесмислен“.[146]
Опсегот на термините значително варира помеѓу авторите. На пример, според МСЧПХ, благородните гасови ја опфаќаат целата група, вклучувајќи го и многу радиоактивниот супертежок елемент оганесон.[147] Меѓутоа, меѓу оние кои се специјализирани за супертешки елементи, тоа не се прави често: во овој случај, „благородниот гас“ обично се подразбира за нереактивното однесување на полесните елементи од групата. Бидејќи пресметките генерално предвидуваат дека оганесонот не треба да биде особено инертен поради релативистичките ефекти, а можеби и не е гас на собна температура доколку може да се произведува на големо, неговиот статус како благороден гас често се доведува во прашање во овој контекст.[148] Понатаму, понекогаш се среќаваат национални варијанти: во Јапонија, алкалните земјени метали често не вклучуваат берилиум и магнезиум бидејќи нивното однесување е различно од потешките метали од групата 2.[149]
Remove ads
Историја
Рана историја
Во 1817 година, германскиот физичар Јохан Волфганг Деберајнер започнал да формулира еден од најраните обиди за класификација на елементите.[150] Во 1829 година, тој открил дека може да формира некои од елементите во групи од по три, при што членовите на секоја група имаат сродни својства. Тој ги нарекол овие групи тријади.[151][152] Хлорот, бромот и јод формирале тријада; како и калциумот, стронциумот и бариумот; литиум, натриум и калиум; и сулфур, селен и телур. Денес, сите овие тријади се дел од современите групи: халогени, земноалкални метали, алкални метали и халкогени. Различни хемичари ја продолжиле неговата работа и биле во можност да идентификуваат сè повеќе врски помеѓу мали групи елементи. Сепак, тие не можеле да изградат еден модел кој ќе ги опфати сите.[153]

Џон Њуландс објавил писмо во Chemical News во февруари 1863 година за периодичноста меѓу хемиските елементи. Во 1864 година Њуландс објавил статија во Chemical News во која покажал дека ако елементите се подредени по редослед на нивната атомска тежина, оние кои имаат последователни броеви често или припаѓаат на иста група или заземаат слични позиции во различни групи, и тој истакна дека секој осми елемент почнувајќи од даден е во овој аранжман еден вид повторување на оската на првото право. Октави).[154] Сепак, формулацијата на Њуландс функционираше добро само за елементите од главната група и наиде на сериозни проблеми со другите.[42]
Германскиот хемичар Лотар Мајер забележал низи од слични хемиски и физички својства кои се повторуваат во периодни интервали. Според него, доколку атомските тежини се исцртаат како ординати (т.е. вертикално), а атомските волумени како апсциси (т.е. хоризонтално) - кривата би добила низа максимални и минимуми - најелектропозитивните елементи би се појавиле на врвовите на кривата по редослед на нивните атомски тежини. Во 1864 година била објавена негова книга; содржела рана верзија на периодниот систем кој содржи 28 елементи и тие се класифицирани елементи во шест фамилии според нивната валентност - за прв пат, елементите биле групирани според нивната валентност. Работите за организирање на елементите по атомска тежина дотогаш биле спречени со неточни мерења на атомските тежини.[155] Во 1868 година, тој ја ревидирал својата табела, но оваа ревизија била објавена како нацрт дури по неговата смрт.
Менделеев
Дефинитивниот пробив дошол од рускиот хемичар Дмитриј Менделеев. Иако другите хемичари (вклучувајќи го и Мајер) пронашле некои други варијанти на периодичниот систем приближно во исто време, Менделеев бил најпосветен на развојот и одбраната на неговиот систем, а неговиот систем бил тој што најмногу влијаел на научната заедница. На 17 февруари 1869 година (1 март 1869 година според Грегоријанскиот календар), Менделеев започнал да ги распоредува елементите и да ги споредува според нивната атомска тежина. Тој започнал со неколку елементи и со текот на времето неговиот систем растел додека не ги опфатил повеќето познати елементи. Откако пронашол конзистентен распоред, неговата печатена табела се појавила во мај 1869 година во списанието на Руското хемиско друштво. Кога се сметало дека елементите не се вклопуваат во системот, тој смело предвидел дека или валентностите или атомските тежини биле погрешно измерени или дека допрва треба да се открие елемент што недостасува. Во 1871 година, Менделеев објавил долга статија, вклучувајќи ажурирана форма на неговата табела, која ги направила разбирливи неговите предвидувања за непознатите елементи. Менделеев детално ги предвидел својствата на три од овие непознати елементи: бидејќи ќе им недостасуваат потешки хомолози на бор, алуминиум и силициум, тој ги нарекол ека-бор, ека-алуминиум и ека-силикон („ека“ е санскрит за „еден“).[156][157] Во 1875 година, францускиот хемичар Пол-Емил Лекок де Буабодран, работејќи без знаење за предвидувањата на Менделеев, открил нов елемент во примерок од минералот сфалерит и го нарекол галиум. Тој го изолирал елементот и почнал да ги одредува неговите својства. Менделеев, читајќи ја публикацијата на Буабодран, испратил писмо во кое тврдел дека галиумот е неговиот предвиден ека-алуминиум. Иако Лекок де Буабодран првично бил скептичен и се сомневал дека Менделеев се обидува да ја земе заслугата за неговото откритие, тој подоцна признал дека Менделеев бил во право. Во 1879 година, шведскиот хемичар Ларс Фредрик Нилсон открил нов елемент, кој го нарекол скандиум: се покажало дека е ека-бор. Ека-силициумот бил пронајден во 1886 година од германскиот хемичар Клеменс Винклер, кој го нарекол германиум. Својствата на галиумот, скандиумот и германиумот се совпаѓаат со она што го предвидел Менделеев. Во 1889 година, Менделеев забележал на Фарадејското предавање во Кралската институција во Лондон дека не очекувал да живее доволно долго „за да го спомене нивното откритие на Хемиското друштво на Велика Британија како потврда за точноста и општоста на периодичниот закон“.[158] Дури и откривањето на благородните гасови на крајот на 19 век, кое Менделеев не го предвидел, уредно се вклопило во неговиот модел како осма главна група.
Сепак, Менделеев имал некои проблеми да ги вклопи познатите лантаниди во неговиот модел, бидејќи тие не ја покажувале периодичната промена во валентностите што ја правеле другите елементи. По долго истражување, чешкиот хемичар Бохуслав Браунер во 1902 година сугерирал дека лантанидите можат сите да се стават заедно во една група на периодниот систем. Тој ја нарекол оваа „астероидна хипотеза“ како астрономска аналогија: исто како што постои астероиден појас наместо една планета помеѓу Марс и Јупитер, така се сметало дека местото под итриумот го заземаат сите лантаниди наместо само еден елемент.
Атомски број

Откако била испитана внатрешната структура на атомот, аматерскиот холандски физичар Антониус ван ден Брук во 1913 година предложил дека јадреното полнење го одредува сместувањето на елементите во периодниот систем.[159] Новозеландскиот физичар Ернест Радерфорд го измислил зборот „атомски број“ за ова јадрено полнење. Во објавената статија на Ван Ден Брук, тој ја илустрирал првата електронска периодична табела која ги прикажува елементите подредени според бројот на нивните електрони. Радерфорд во својот труд од 1914 година потврдил дека Бор го прифатил ставот на ван ден Брук.
Истата година, англискиот физичар Хенри Мозли користејќи спектроскопија на Х-зраци експериментално го потврдил предлогот на Ван Ден Брук. Мозели ја одредил вредноста на јадреното полнење на секој елемент од алуминиум до злато и покажал дека Менделеевовиот редослед всушност ги поставува елементите во секвенцијален редослед по јадрено полнење.[160] Јадреното полнење е идентично со бројот на протони и ја одредува вредноста на атомскиот број (Z) на секој елемент. Користењето на атомски број дава дефинитивна, заснована на цел број, низа за елементите. Истражувањето на Мозели веднаш ги решило несогласувањата помеѓу атомската тежина и хемиските својства; тоа биле случаи како што се телур и јод, каде што атомскиот број се зголемува, но атомската тежина се намалува. Иако Мозели набрзо бил убиен во Првата светска војна, шведскиот физичар Мане Зигбан ја продолжил својата работа до ураниумот и утврдил дека тоа е елементот со највисок атомски број тогаш познат (92).[161] Врз основа на истражувањето на Мозели и Зигбан, исто така станало познато кои атомски броеви одговараат на исчезнатите елементи што допрва треба да се најдат: 43, 61, 72, 75, 85 и 87. (Елементот 75 всушност веќе бил пронајден од јапонскиот хемичар Масатака Огава во 1908 година и го нарекол нипониум, но тој по грешка го доделил како елемент 43 наместо 75 и затоа неговото откритие не било општо признато. Современо прифатеното откритие за елементот 75 дошло во 1925 година, кога независно повторно го открил и му го дал денешното име, рениум) [162]
Развојот на атомската физика исто така ја разјаснила ситуацијата со изотопите. Во синџирите на распаѓање на исконските радиоактивни елементи ториум и ураниум, набрзо станало очигледно дека има многу очигледни нови елементи кои имаат различна атомска тежина, но точно исти хемиски својства. Во 1913 година, Фредерик Соди го измислил терминот „изотоп“ за да ја опише оваа ситуација и сметал дека изотопите се единствено различни форми на ист хемиски елемент. Ова дополнително ги разјаснило разликите како што се телурот и јодот: природниот изотопски состав на телурот се мери кон потешки изотопи од јодот, но телурот има помал атомски број.[163]
Електронски обвивки
Данскиот физичар Нилс Бор ја применил идејата на Макс Планк за квантизација на атомот. Тој заклучил дека енергетските нивоа на електроните се квантизирани: дозволено е само дискретно збир на стабилни енергетски состојби. По ова, Бор се обидел да ја разбере периодичноста преку електронски конфигурации, претпоставувајќи во 1913 година дека внатрешните електрони треба да бидат одговорни за хемиските својства на елементот. Во 1913 година, тој го произвел првиот електронски периоден систем заснован на квантен атом.
Бор ги нарекол своите електронски обвивки „прстени“ во 1913 година: атомските орбитали во обвивките не постоеле во времето на неговиот планетарен модел. Бор објаснува во Дел 3 од неговиот познат труд од 1913 година дека максималниот број електрони во обвивката е осум, пишувајќи: „Понатаму, гледаме дека прстен од n електрони не може да ротира во еден прстен околу јадро на полнење ne освен доколку n < 8“. За помалите атоми, електронските обвивки би се пополниле на следниов начин: „прстените од електрони ќе се спојат единствено доколку содржат еднаков број електрони; и дека соодветно на тоа, бројот на електрони на внатрешните прстени ќе биде само 2, 4, 8“. Меѓутоа, кај поголемите атоми највнатрешната обвивка би содржила осум електрони: „од друга страна, периодниот систем на елементите силно сугерира дека веќе во неон N = 10 ќе се појави внатрешен прстен од осум електрони“. Неговите предложени електронски конфигурации за атомите (прикажани десно) главно не се во согласност со оние што се денес познати.[164] Тие биле дополнително подобрени откако работата на Арнолд Зомерфелд и Едмунд Стонер откриле повеќе квантни броеви.
Првиот кој систематски ги проширил и коригирал хемиските потенцијали на атомската теорија на Бор бил Валтер Косел во 1914 година и во 1916 година. Косел објаснил дека во периодниот систем ќе се создадат нови елементи бидејќи електроните се додаваат на надворешната обвивка. Во трудот на Косел, тој пишува:
Ова води до заклучок дека електроните, кои дополнително се додаваат, треба да се стават во концентрични прстени или обвивки, на секој од нив... треба да се подредат само одреден број електрони - имено, осум во нашиот случај. Штом ќе се заврши еден прстен или обвивка, треба да се стартува нов за следниот елемент; бројот на електрони, кои се најлесно достапни и лежат на најоддалечената периферија, повторно се зголемува од елемент до елемент и, според тоа, при формирањето на секоја нова обвивка хемиската периодичност се повторува.
Во еден труд од 1919 година, Ирвинг Лангмјур го постулирал постоењето на „клетки“ кои денес се нарекуваат орбитали, кои секоја може да содржи само по два електрони, и тие биле распоредени во „еднадалечни слоеви“ кои денес се нарекуваат обвивки. Тој направил исклучок за првата обвивка која содржи само два електрони.[165] Хемичарот Чарлс Ругели Бури во 1921 година предложил дека осум и осумнаесет електрони во обвивка формираат стабилни конфигурации. Бури предложил дека електронските конфигурации во преодните елементи зависат од валентните електрони во нивната надворешна обвивка.[166] Тој го вовел зборот преод за да ги опише елементите кои денес се познати како преодни метали.[167] Теоријата на Бор била оправдана со откривањето на елементот 72: Жорж Урбејн тврдел дека го открил како редок земјен елемент келтиум, но Бури и Бор предвидиле дека елементот 72 не може да биде елемент од ретка земја и мора да биде хомолог на циркониум. Дирк Костер и Георг фон Хевеси го барале елементот во рудите на циркониум и го пронашле елементот 72, кој го нарекле хафниум по родниот град на Бор, Копенхаген (Хафнија на латински).[168][169] Урбејновиот келтиум се покажал како едноставно прочистен лутетиум (елемент 71).[170] Така, хафниумот и рениумот станале последните стабилни елементи што биле откриени.
Поттикнат од Бор, Волфганг Паули се зафатил со проблемот со електронските конфигурации во 1923 година. Паули го проширил моделот на Бор да користи четири квантни броеви и го формулирал неговиот принцип на забрана кој вели дека ниту еден електрон не може да има исти четири квантни броеви. Ова ги објаснило должините на периодите во периодниот систем (2, 8, 18 и 32), што одговарало на бројот на електрони што секоја обвивка може да ги зафати. Во 1925 година, Фридрих Хунд стигнал до конфигурации блиски до современите.[171] Како резултат на овие достигнувања, периодичноста се заснова на бројот на хемиски активни или валентни електрони наместо на валентностите на елементите. Принципот на Маделунг кој ги опишува електронските конфигурации на елементите првпат бил емпириски забележан од Ервин Маделунг во 1926 година, иако првиот што го објавил бил Владимир Карапетоф во 1930 година.[172][173] Во 1961 година, Всеволод Клечковски го извел првиот дел од правилото Маделунг (дека орбиталите се пополнуваат по редослед на зголемување n + ℓ) од моделот Томас-Ферми;[174] целосното правило било изведено од сличен потенцијал во 1971 година од страна на Јури Н. Демков и Валентин Н. Островски.[175] [б 16]

Квантната теорија ги разјаснила преодните метали и лантанидите дека формираат свои посебни групи, преодни помеѓу главните групи, иако некои хемичари веќе предложиле табели што ги прикажувале на овој начин пред тоа: англискиот хемичар Хенри Басет го сторил тоа во 1892 година, данскиот хемичар Јулиус Томсен во 1895 година, и шведскиот хемичар Алфред Вернер во 1905 година. Бор ја користел формата на Томсен во неговото Нобелово предавање од 1922 година; Формата на Вернер е многу слична на современата форма од 32 колони. Особено, ова ја заменило астероидната хипотеза на Браунер.
Точната местоположба на лантанидите, а со тоа и составот на групата 3, останала спорна со децении подолго, бидејќи нивните електронски конфигурации првично биле погрешно измерени. На хемиска основа Басет, Вернер и Бури ги групирале скандиумот и итриумот со лутециум наместо со лантан (првите двајца оставиле празен простор под итриумот бидејќи лутециумот сè уште не бил откриен).[166] Хунд претпоставил во 1927 година дека сите атоми на лантанид имаат конфигурација [Xe]4f 0−145d1 6s2, поради нивната преовладувачка тривалентност. Денес е познато дека односот помеѓу хемијата и конфигурацијата на електроните е покомплициран од тоа. [б 17] Раните спектроскопски докази се сметало дека ги потврдуваат овие конфигурации, и на тој начин периодниот систем бил структуриран да ја има групата 3 како скандиум, итриум, лантан и актиниум, со четиринаесет f-елементи кои го разбиваат d-блокот помеѓу лантан и хафниум. Но, подоцна било откриено дека ова е точно единствено за четири од петнаесетте лантаниди (лантан, цериум, гадолиниум и лутетиум), и дека другите атоми на лантанид немаат d-електрон. Особено, итербиумот ја комплетира обвивката 4f и на тој начин советските физичари Лев Ландау и Евгениј Лифшиц забележале во 1948 година дека лутециумот правилно се смета за d-блок наместо како елемент од f-блок; дека најголемиот дел од лантанот е f-метал првпат било предложено од Јун Кондо во 1963 година, врз основа на неговата суперспроводливост на ниска температура. Ова ја разјаснило важноста на гледањето на ниско поставените возбудени состојби на атомите кои можат да играат улога во хемиските средини кога се класифицираат елементите по блок и се позиционираат на таелата. Многу автори последователно ја откриле оваа корекција врз основа на физички, хемиски и електронски проблеми и ја примениле на сите релевантни елементи, со што групата 3 содржи скандиум, итриум, лутециум и лоренциум има лантан преку итербиум и актиниум до нобел: оваа поправена верзија постигнува конзистентност со правилото на Маделунг и ја оправдува почетната хемиска поставеност на Басет, Вернер и Бури.
Во 1988 година, МСЧПХ објавила извештај кој го поддржува овој состав на групата 3, одлука која била реафирмирана во 2021 година. Сè уште може да се најдат варијации во учебниците за составот на групата 3, и некои аргументи против овој формат сè уште се објавуваат денес, но хемичарите и физичарите кои ја разгледале оваа материја во голема мера се согласуваат за групата 3 што содржи скандиум, итриум, лутециум и лоренциум и ги оспоруваат контрааргументите како неконзистентни.
Синтетички елементи
До 1936 година, базенот на исчезнати елементи од водород до ураниум се намалил на четири: елементите 43, 61, 85 и 87 останале исчезнати. Елементот 43 на крајот станал првиот елемент што се синтетизирал вештачки преку јадрени реакции наместо да биде откриен во природата. Бил откриен во 1937 година од италијанските хемичари Емилио Сегре и Карло Периеро, кои своето откритие го нарекле технициум, според грчкиот збор за „вештачко“. Елементите 61 (прометиум) и 85 (астатин) биле исто така произведени вештачки во 1945 и 1940 година, соодветно; елементот 87 (франциум) станал последниот елемент откриен во природата, од француската хемичарка Маргерит Пери во 1939 година. [б 18] Елементите надвор од ураниумот биле исто така откриени вештачки, започнувајќи со откривањето на нептуниум од 1940 година на Едвин Мекмилан и Филип Абелсон (преку бомбардирање на ураниум со неутрони). Глен Т. Сибор и неговиот тим во Националната лабораторија Лоренс Беркли (НБЛБ) продолжиле со откривање на задураниумски елементи, почнувајќи со плутониум во 1941 година, и откриле дека спротивно на претходното размислување, елементите од актиниумот наваму се сродни на лантанидите, а не на преодните метали.[176] Басет (1892), Вернер (1905) и францускиот инженер ШарлЖанет (1928) претходно го предложиле ова, но нивните идеи тогаш не биле општо прифатени. Така, Сиборг ги нарекол актиниди. Елементите до 101 (наречен менделевиум во чест на Менделеев) биле синтетизирани до 1955 година, или преку зрачење со неутрони или алфа-честички, или во јадрени експлозии во случаите на 99 (ајнштајниум) и 100 (фермиум).[177]
Значаен спор се појавил со елементите 102 до 106 во 1960-тите и 1970-тите, бидејќи се појавила конкуренција помеѓу тимот на НБЛБ (веќе предводен од Алберт Гиорсо) и тимот советски научници од Заедничкиот институт за јадрени истражувања (ЗИЈИ) предводен од Георги Флоров. Секој тим тврдел дека е откриен, а во некои случаи секој предложил свое име за елементот, создавајќи спорови за името на елементот што траело со децении. Овие елементи биле направени со бомбардирање на актиниди со светлосни јони. Меѓународниот сојуз за чиста и применета хемија најпрвин го усвоил пристапот на „hands off“, претпочитајќи да почека и да види дали ќе дојде до консензус. Но, бидејќи тоа било и врвот на Студената војна, станало јасно дека тоа нема да се случи. Како такви, МСЧПХ и Меѓународнниот сојуз за чиста и применета физика (МСЧПФ) создале Трансфериумска работна група (ТРГ, фермиумот е елемент 100) во 1985 година за да ги утврдат критериумите за откривање,[178] кои биле објавени во 1991 година [179] По некои натамошни спорови, овие елементи ги добиле своите последни имиња во 1997 година, вклучувајќи го и сиборгиум (106) во чест на Сиборг.[180]

Критериумите на ТРГ биле искористени за арбитража на подоцнежните тврдења за откривање елементи од НБЛБ и ЗИЈИ, како и од истражувачките институти во Германија (ГИИ) и Јапонија (Рикен).[181] Во моментов, разгледувањето на тврдењата за откритие го врши заедничка работна група МСЧПХ /МСЧПФ. Откако бил доделен приоритет, елементите биле официјално додадени во периодниот систем, а откривачите биле поканети да ги предложат нивните имиња. До 2016 година, ова се случило за сите елементи до 118, со што се комплетирале првите седум редови на периодниот систем.[182] Откритијата на елементите надвор од 106 биле овозможени со техниките што ги смислил Јури Оганесјан во ЗИЈИ: ладното спојување (бомбардирање на олово и бизмут со тешки јони) ги овозможило откритијата на елементите 107 до 112 во ГИИ и 113 во Рикен од 1981-2004 година, а тој го предводел тимот на ЗИЈИ (во соработка со американските научници) да ги открие елементите 114 до 118 користејќи топло соединување (бомбардирање на актиниди од јони на калциум) во 1998-2010 година.[183] Најтешкиот познат елемент, оганесон (118), е именуван во чест на Оганесјан. Елементот 114 е наречен флеровиум во чест на неговиот претходник и ментор Флоров.
На прославата на 150-годишнината од периодниот систем, Обединетите нации ја прогласиле 2019 година за Меѓународна година на периодниот систем, прославувајќи го „едно од најзначајните достигнувања во науката“.[184] Критериумите за откривање поставени од ТРГ биле ажурирани во 2020 година како одговор на експерименталниот и теоретскиот напредок што не бил предвиден во 1991 година.[185] Денес, периодниот систем е меѓу најпрепознатливите икони на хемијата. МСЧПХ денес е вклучен во многу процеси поврзани со периодниот систем: препознавање и именување на нови елементи, препорачување на броеви на групи и колективни имиња и ажурирање на атомските тежини.
Remove ads
Идно продолжување по седмиот период

Неодамна именуваните елементи - нихониум (113), московиум (115), тенесин (117) и оганесон (118) - го комплетирале седмиот ред од периодниот систем. Идните елементи ќе треба да започнат осми ред. Овие елементи може да се наведат или со нивните атомски броеви (на пр. „ елемент 164“), или со систематските имиња на елементите на МСЧПХ усвоени во 1978 година, кои директно се однесуваат на атомските броеви (на пр. „унбиквадиум“ за елементот 164, изведен од латински unus „еден“, грчки хекса „шест“, латински quadra „метална“ и традиционалните quadra метални елементи „четири“). Сите обиди да се синтетизираат такви елементи досега не успеале. Обидот да се направи елементот 119 е во тек од 2018 година во истражувачкиот институт Рикен во Јапонија. НБЛБ во Соединетите Американски Држави, ЗИЈИ во Русија и Истражувачкиот објект за тешки јони во Ланжу (HIRFL) во Кина, исто така, планираат да направат свои обиди за синтетизирање на првите неколку периоди 8 елементи.[188][189][190][191][192]
Доколку осмиот период го следи моделот поставен од претходните периоди, тогаш ќе содржи педесет елементи, пополнувајќи ги подобвивките 8s, 5g, 6f, 7d и на крајот 8p по тој редослед. Но, до овој момент, релативистичките ефекти треба да резултираат со значителни отстапувања од Маделунговото правило. Различни модели биле предложени за конфигурации на елементи од осмата периода и како да се прикажат резултатите во периодична табела. Сите се согласуваат дека осмата периода треба да започне како и претходните со два елементи од 8-р, 119 и 120. Меѓутоа, после тоа масивните енергетски преклопувања помеѓу подобвивките 5g, 6f, 7d и 8p значи дека сите тие почнуваат да се полнат заедно и не е познато како да се издвојат специфичните серии 5g и 6f.[43][193][194][195][196] Според тоа, елементите од 121 до 156 не се вклопуваат добро како хемиски аналози на која било претходна група во претходните делови од табелата, иако понекогаш се ставаат како 5g, 6f и други серии за формално да ги рефлектираат нивните електронски конфигурации. Ерик Скери го поставил прашањето дали продолжениот периоден систем треба да го земе предвид неуспехот на Маделунгото правило во овој регион или доколку таквите исклучоци треба да се игнорираат. Структурата на обвивката, исто така, може да биде прилично формална во овој момент: веќе распространувањето на електрони во атом на оганесон се очекува да биде прилично униформирано, без забележлива структура на обвивка.[197]
Ситуацијата од елементите 157 до 172 треба да се врати во нормала и повеќе да потсетува на претходните редови. Тешките p-обвивки се поделени со заемното дејство спин-орбита: едната p-орбитала (p1/2) е постабилизирана, а другите две (p3/2) се дестабилизирани. (Таквите поместувања во квантните броеви се случуваат за сите типови обвивки, но тоа прави најголема разлика во редоследот на p-обвивките.) Веројатно е дека според елементот 157, пополнетите 8s и 8p1/2 обвивки со вкупно четири електрони потонале во јадрото. Надвор од јадрото, следните орбитали се 7d и 9s со слични енергии, проследени со 9p1/2 и 8p3/2 при слични енергии. Така, орбиталите 9s и 9p1/2 во суштина ги заменуваат оние 8s и 8p1/2, правејќи ги елементите 157-172 веројатно хемиски аналогни на групите 3-18: на пример, елементот 164 би се појавил две места под олово во групата 14 под вообичаениот модел, но се пресметува дека е многу аналоген на паладиумот во групата 10 наместо тоа. Така, потребни се педесет и четири елементи наместо педесет за да се достигне следниот благороден елемент по 118.[198] Меѓутоа, иако овие заклучоци за елементите 157 до 172-та хемија се генерално договорени, постои несогласување околу тоа дали периодниот систем треба да се нацрта за да ги одразува хемиските аналогии или дали треба да ги одразува веројатните формални конфигурации на електрони, кои треба да бидат сосема различни од претходните периоди и не се договорени помеѓу изворите. Така, расправата за форматот на осмиот ред продолжува.
Надвор од елементот 172, пресметката е комплицирана со тоа што нивото на енергија на електронот 1 станува имагинарно. Таквата ситуација има физичко толкување и сама по себе не претставува електронска граница за периодниот систем, но правилниот начин да се вклучат такви состојби во пресметките со повеќе електрони е сè уште отворено прашање што треба да се реши за да се пресмета структурата на периодниот систем надвор од оваа точка.[199]
Јадрената стабилност најверојатно ќе се покаже како одлучувачки фактор кој го ограничува бројот на можни елементи. Тоа зависи од рамнотежата помеѓу електричната одбивност помеѓу протоните и големата сила што ги поврзува протоните и неутроните заедно.[200] Протоните и неутроните се распоредени во обвивки, исто како и електроните, и затоа затворената обвивка може значително да ја зголеми стабилноста: познатите супертешки јадра постојат поради таквото затворање на обвивката, веројатно на околу 114-126 протони и 184 неутрони. Тие веројатно се блиску до предвидениот остров на стабилност, каде што супертешките нуклиди би требало да бидат подолготрајни од очекуваното: предвидувањата за најдолговечните нуклиди на островот се движат од микросекунди до милиони години.[201][202] Сепак, треба да се забележи дека ова се во суштина екстраполации во непознат дел од графиконот на нуклиди, и систематските несигурности на моделот треба да се земат предвид.
Како што се поминуваат затворените обвивки, стабилизирачкиот ефект треба да исчезне.[203] Така, супертешките нуклиди со повеќе од 184 неутрони се очекува да имаат многу пократок животен век, спонтано расцепувајќи во рок од 10 −15 секунди. Доколку е така, тогаш нема смисла да се сметаат за хемиски елементи: [МСЧПХ /МСЧПФ теоретизираат и препорачуваат] елементот да постои единствено доколку јадрото живее подолго од 10−14 секунди, времето потребно за да собере електронски облак. Сепак, теоретските проценки на полураспад се многу зависни од моделот, кои се движат во многу редови на големина. Се предвидува дека екстремното одбивање помеѓу протоните ќе резултира со егзотични јадрени топологии, со меурчиња, прстени и тори кои се очекуваат: ова дополнително ја комплицира екстраполацијата. Не е познато дали постојат понатамошни затворања на обвивки, поради очекуваното размачкување на различни јадрени обвивки (како што веќе се очекува за електронските обвивки во оганесон).[203] Понатаму, дури и ако постојат подоцнежни затворања на обвивки, не е јасно дали тие би дозволиле да постојат такви тешки елементи.[129][204] Како таков, периодниот систем практично завршува околу елементот 120, бидејќи елементите стануваат премногу краткотрајни за набљудување, а потоа премногу краткотрајни за да имаат хемија; периодот на откривање нови елементи на тој начин би била блиску до својот крај.[205] Ако постои друго затворање на протонска обвивка над 126, тогаш тоа веројатно се случува околу 164; на тој начин регионот каде што периодичноста не успева повеќе или помалку се совпаѓа со регионот на нестабилност помеѓу затворачите на обвивката.
Алтернативно, кварковната материја може да стане стабилна при високи масни броеви, во кои јадрото се состои од кваркови кои слободно течат нагоре и надолу наместо да ги врзуваат за протони и неутрони; ова би создало континент на стабилност наместо остров.[206] Може да се појават и други ефекти: на пример, во многу тешки елементи електроните 1s веројатно поминуваат значително време толку блиску до јадрото што всушност се наоѓаат во него, што би ги направило ранливи на заробување на електрони.[207]
Дури и доколку би можело да постојат елементи од осмиот ред, нивното производство е веројатно тешко, а би требало да станува уште потешко како што се зголемува атомскиот број.[208] Иако елементите 8s 119 и 120 се очекува да бидат достапни со денешните средства, елементите надвор од тоа се очекува да бараат нова технологија,[209] доколку воопшто можат да се произведат.[210] Експерименталното хемиско карактеризирање на овие елементи исто така би претставувало голем предизвик.
Remove ads
Алтернативни периодни системи

Периодниот закон може да биде претставен на повеќе начини, од кои стандардниот периоден систем е само еден. Во рок од 100 години од појавувањето на системот на Менделеев во 1869 година, Едвард Г. Мазурс собрал околу 700 различни објавени варијанти на периодниот систем.[211] Многу форми ја задржуваат правоаголната структура, вклучително и периодната табела на Чарлс Џенет (на сликата подолу) и современата форма на оригиналниот распоред со 8 колони на Менделеев што сè уште е вообичаен во Русија. Други формати на периодниот систем се обликувани многу поегзотично, како што се спиралите (десно на сликата на Ото Теодор Бенфи), кругови и триаголници.[212]
Алтернативните периодни системи често се развиваат за да се истакнат или потенцираат хемиските или физичките својства на елементите кои не се толку очигледни во традиционалните периодни системи, при што различните се повеќе наклонети кон нагласување на хемијата или физиката на двата краја. Стандардната форма, која останува далеку најчеста, е некаде на средината.[213]
Многуте различни форми на периодниот систем ги поттикнало прашањата дали постои оптимална или дефинитивна форма на периодниот систем, и доколку е така, каква би можела да биде таа. Не постојат моментални консензусни одговори на ниту едното прашање.[214] Табелата од левиот чекор на Џенет се повеќе се дискутира како кандидат за оптимална или најфундаментална форма; Счери напишал во прилог на тоа, бидејќи ја појаснува природата на хелиумот како елемент од s-блок, ја зголемува регуларноста со повторување на сите должини на периодите, верно го следи Маделунговото правило правејќи секој период да одговара на една вредност од n + ℓ, [б 19] и ги регулира тријадите на атомските броеви и трендот на аномалија од првиот ред. Иако забележува дека неговото поставување на хелиум врз металите на алкалните земји може да се види како недостаток од хемиска перспектива, тој го спротивставува ова со привлекување на аномалија од првиот ред, посочувајќи дека периодниот систем „фундаментално се сведува на квантна механика“ и дека се занимава со „апстрактни елементи“ и оттука со макроатомски својства отколку со макроатомски својства.[220]
Remove ads
Белешки
- Прашањето за тоа колку природни елементи има е доста комплицирано и не е целосно решено. Најтешкиот елемент што се јавува во големи количини на Земјата е елементот 92, ураниум. Сепак, ураниумот може да претрпи спонтано цепење во природата, а добиените неутрони можат да удрат други атоми на ураниум. Доколку дојде до заробување на неутрони, елементите 93 и 94, нептуниум и плутониум се формираат преку бета-распад;[3] тие се всушност почести од некои од најретките елементи во првите 92, како што се прометиум, астатин и франциум (види Застапеност на хемиските елементи во Земјината кора). Теоретски, зафаќањето на неутроните на добиениот плутониум може да произведе уште повисоко нумерирани елементи, но количините би биле премали за да се набљудуваат[3] Во раниот Сончев Систем, елементите со пократко траење сè уште не се распаднале, и следствено, имало повеќе од 94 природни елементи. Кириумот (елемент 96) е најдолговечниот елемент надвор од првите 94, и веројатно сè уште се пренесува на Земјата преку космички зрак, но не е пронајден.[3] Елементи до 99 (ајнштајниум) се забележани во Ѕвездата на Пржибилски.[4] Елементи до 100 (фермиум) веројатно се случиле во природниот јадрен реактор во Рудник Окло, Габон, но тие одамна се распаднале.[5] Дури и потешки елементи може да се произведат преку r-процесот преку супернова или спојување на неутронски ѕвезди, но тоа не е потврдено. Не е јасно до каде би се протегале елементите над 100 и колку долго би траеле: пресметките сугерираат дека нуклиди со маса од околу 280 до 290 се формираат во r-процесот, но брзото бета-распаѓање до нуклиди кои трпат спонтано цепење, така што 99,9% од произведениот елемент на еден месец.[6] Наместо тоа, доколку би биле доволно долготрајни, би можеле на сличен начин да бидат донесени на Земјата преку космичките зраци, но повторно не се пронајдени.[3]
- Некои изотопи кои моментално се сметаат за стабилни, теоретски се очекува да бидат радиоактивни со екстремно долг полураспад: на пример, сите стабилни изотопи на елементите 62 (самариум), 63 (европиум) и сите елементи од 67 (холмиум) па наваму се очекува да подлежат на алфадекај. Сепак, предвидените полураспади се екстремно долги (на пр. алфа распаѓањето на 208Pb до основната состојба од 204Hg се очекува да има полураспад поголем од 10120 години), а распаѓањата никогаш не биле забележани.[9][10]
- Полураспадот на најстабилниот изотоп на плутониум е доволно долг што треба да биде и исконски елемент. Студија од 1971 година тврдела дека открила исконски плутониум,[11] но едно поново иследување од 2012 година не можело да го открие.[12] Врз основа на неговата веројатна првична застапеност во Сончевиот Систем, денешните експерименти од 2022 година се веројатно околу ред на големина подалеку од откривање на жив првобитен 244Pu.[13]
- Како пример видете постер од периодичната табела што го продава Сигма-Олдрич.
- Откако ќе се отстранат два до четири електрони, орбиталите d и f обично стануваат пониски во енергија од оние s:[35]
- 1s ≪ 2s < 2p ≪ 3s < 3p ≪ 3d < 4s < 4p ≪ 4d < 5s < 5p ≪ 4f < 5d < 6s < 6p ≪ 5f < 6d < 7s < 7p ≪ ...
- Cs0: 6s < 6p < 5d < 7s < 4f
- Ba+: 6s < 5d < 6p < 7s < 4f
- La2+: 5d < 4f < 6s < 6p < 7s
- Ce3+: 4f < 5d < 6s < 6p < 7s
- Всушност, електронските конфигурации претставуваат приближување од прв ред: атом навистина постои во суперпозиција на повеќе конфигурации, а електроните во атомот не се разликуваат. Елементите во блоковите d и f имаат повеќекратни конфигурации разделени со мали енергии и можат да ја променат конфигурацијата во зависност од хемиската средина.[35] Во некои од неоткриените елементи на g-блок, мешањето на конфигурациите може да стане толку важно што резултатот повеќе не може добро да се опише со една конфигурација.[43]
- Својствата на елементите на p-блокот сепак влијаат на следните елементи на s-блокот. Обвивката на 3s во натриум е над кајносиметричното 2p јадро, но обвивката на 4s во калиум е над многу поголемото 3p јадро. Оттука, иако веќе би се очекувало атомите на калиум да бидат поголеми од атомите на натриум, разликата во големината е поголема од вообичаеното.[92]
- Нормално „забранетите“ средни оксидациски состојби може да се стабилизираат со формирање димери, како во [Cl3Ga–GaCl3]2− (галиум во +2 оксидациона состојба) или S2F10 (сулфур во +5 оксидациона состојба).[106] Некои соединенија кои се чини дека се во такви средни оксидациски состојби се всушност мешани валентни соединенија, како што е Sb2O4, кој ги содржи и двете Sb(III) and Sb(V).[107]
- Сето ова ја опишува ситуацијата при стандарден притисок. Под доволно висок притисок, јазот на појасот на секој цврст пад на нула и доаѓа до метализација. Така на пример на околу 170 kbar јодот станува метал,[117] и метален водород треба да се формира при притисок од околу четири милиони атмосфери.[118].Видете притисок на метализација за вредностите за сите неметали
- Погледнете список на металоиди. На пример, периодична табела што ја користи Американското хемиско друштво вклучува полониум како металоид, и она што е вклучено во Encyclopædia Britannica воопшто не се однесува на металоиди или полуметали.[129] Класификацијата може да се промени дури и во рамките на едно дело. На пример, „Хемијата на неметалните елементи“ на Шервин и Вестон (1966) има периодичен систем на стр. 7 класифицирајќи го антимонот како неметал, но на стр. 115 се нарекува метал.[130]
- Демков и Островски го разгледуваат потенцијалот каде и се постојани параметри; ова се приближува до Кулонов потенцијал за мали. Кога ја задоволува состојбата, каде, нулта-енергетските решенија на Шредингеровата равенка за овој потенцијал може да се опишат аналитички со Гегенбауеровите полиноми. Кога поминува низ секоја од овие вредности, колектор што ги содржи сите состојби со таа вредност на настанува со нулта енергија, а потоа се врзува, враќајќи го редот на Маделунг. Разгледувањата на теоријата на пертурбации покажуваат дека состојбите со помали имаат помала енергија и дека s-орбиталите (со) нивните енергии се приближуваат до следната група.[67][175]
- На пример, раните актиниди продолжуваат да се однесуваат повеќе како преодните метали од d-блок во нивната склоност кон високи оксидациски состојби сè до ураниум, иако всушност само актиниум и ториум имаат конфигурации слични на d-блок во гасната фаза; f-електроните се појавуваат веќе кај протактиниумот.[84] Вистинската конфигурација на ураниумот на [Rn]5f36d17s2 всушност е аналогно на она што Хунд го претпоставува за лантанидите, но ураниумот не ја фаворизира тривалентна состојба, претпочитајќи да биде четиривалентен или шествалентен.[37] Од друга страна, конфигурациите слични на лантанид за актинидите започнуваат со плутониум, но промената кон однесувањето слично на лантанид е јасно само кај куриумот: елементите помеѓу ураниумот и куриумот формираат премин од однесување слично на преодниот метал кон однесување слично на лантанид..[84] Така, хемиското однесување и конфигурацијата на електроните не се совпаѓаат точно една со друга.[84]
- Технециум, прометиум, астатин, нептуниум и плутониум на крајот биле откриени дека се појавуваат и во природата, иако во мали траги.
- Авторите се разликуваат околу тоа дали n + ℓ правилото сè уште е изведено од квантната механика. Счери тврди дека не е така,[215][216] и покрај неколкуте обиди за тоа[217] Од друга страна, Островски, кој тврдел такво оправдување од 1971 година, напишал: „Некои автори инсистираат на тоа дека „сè уште никој не го заклучил правилото n+l од принципите на квантната механика“, додека други претставуваат квантно оправдување на правилото кое никогаш не било спорно“.[218] Други автори тврдат дека таквото изведување не е неопходно, бидејќи признава исклучоци.[219]
Remove ads
Наводи
Библиографија
Понатамошно читање
Надворешни врски
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads















