Loading AI tools
malattia oncologica Da Wikipedia, l'enciclopedia libera
Il carcinoma del polmone è una categoria diagnostica che comprende l'insieme delle neoplasie maligne che originano dai tessuti epiteliali (carcinomi) che compongono i bronchi e il parenchima polmonare.[1]
| Carcinoma del polmone | |
|---|---|
 La zona a valle del bronco colpito ha limiti sfrangiati e irregolari, con aspetto cotonoso; quest'ultimo reperto identifica un'area di consolidamento pneumonico post-ostruttivo. | |
| Tipo | Maligno |
| Cellula di origine | Epitelio bronchiale Cellule APUD |
| Fattori di rischio | |
| Incidenza | 60-90/100 000 |
| Età media alla diagnosi | 60-80 anni |
| Rapporto M:F | 4-5:1 |
| Classificazione e risorse esterne | |
| ICD-9-CM | (EN) 162 |
| ICD-10 | (EN) C33-C34 |
 | |
Per questo, i sarcomi e i linfomi che originano nel contesto delle strutture polmonari devono essere distinti da questa categoria.
La maggior parte (oltre il 95%) delle neoplasie polmonari maligne è rappresentato dal carcinoma del polmone, mentre i sarcomi e linfomi costituiscono meno dello 0,5% di questa casistica.[2] Meno del 5% delle neoplasie polmonari è invece rappresentato da tumori benigni (amartoma) o a basso grado di malignità (carcinoidi).[3]
Un'ulteriore distinzione deve essere operata tra neoplasie primitive e neoplasie secondarie; infatti, mentre le prime originano dalle strutture polmonari, le seconde sono rappresentate da metastasi di neoplasie che si originano in altri organi come, ad esempio, il rene, il fegato, la mammella e la prostata.
Il carcinoma del polmone era poco comune prima della diffusione del tabagismo e fino al 1791 non era considerato un'entità patologica con dignità propria.[4] I differenti aspetti del carcinoma del polmone vennero descritti nel 1819.[5] Nel 1878 i tumori maligni del polmone costituivano solo l'1% delle neoplasie osservate in corso di autopsia, ma la percentuale salì fino al 10-15% nella prima parte del 1900.[6] I dati riportati nella letteratura medica riferiscono solo 374 casi in tutto il mondo nel 1912,[7] ma lo studio dei dati derivati dai referti autoptici ha dimostrato che l'incidenza aumentò dallo 0,3% nel 1852 al 5,66% nel 1952.[8]
In Germania, nel 1929, il medico Fritz Lickint riconobbe la connessione tra il fumo di sigaretta e il carcinoma del polmone,[6] evento che portò a un'imponente campagna anti-fumo nella Germania nazista.[9] Nel 1939 Franz Müller pubblicò su JAMA il primo metastudio statistico ed epidemiologico sulla correlazione fra tabagismo ed incremento dei tumori al polmone.[10]
Il British Doctors Study, uno studio iniziatosi negli anni cinquanta, costituì la prima solida evidenza epidemiologica della connessione tra il fumo e il carcinoma del polmone.[11] Come risultato, nel 1964, il chirurgo generale degli Stati Uniti raccomandò a tutti i fumatori di interrompere l'abitudine al fumo.[12]
La connessione col radon venne riconosciuta per prima tra i minatori delle riserve metallifere intorno a Schneeberg, nella zona di confine tra la Baviera e la Boemia. Questa regione è molto ricca in fluorite, ferro, rame, cobalto e argento, quest'ultimo raccolto fin dal 1470. La presenza di notevoli quantità di uranio e radio si tradusse in un'intensa e continuativa esposizione al radon, gas radioattivo ritenuto responsabile della carcinogenesi (vedi eziologia).
I minatori svilupparono una quantità sproporzionata di affezioni polmonari, ricondotte nel 1870 ai poliedrici quadri clinici sostenuti dalle neoplasie polmonari. È stato stimato che circa il 75% di questi minatori morirono per carcinoma del polmone.[13] Nonostante questa scoperta l'estrazione di uranio continuò anche durante gli anni cinquanta, a causa della continua richiesta da parte dell'Unione Sovietica.[14]
Il primo intervento riuscito di pneumectomia per carcinoma del polmone è stato effettuato nel 1933.[15] La radioterapia palliativa è stata usata sin dagli anni quaranta,[16] mentre la radioterapia radicale (ad alti dosaggi) cominciò a essere presa in considerazione dagli anni cinquanta in poi come presidio terapeutico nei soggetti con carcinoma del polmone limitato, ma inadatti all'intervento chirurgico.[17] Nel 1997 la radioterapia continua accelerata iperfrazionata (CHART) soppiantò la convenzionale radioterapia radicale per la cura delle neoplasie polmonari.[18]
Per quanto riguarda il carcinoma polmonare a piccole cellule, gli iniziali approcci chirurgici nel 1960[19] e la radioterapia radicale[20] furono infruttuosi. Regimi chemioterapici soddisfacenti vennero sviluppati solo a partire dagli anni settanta.[21]

Il carcinoma del polmone è la neoplasia col maggior tasso di incidenza e di mortalità nel mondo (1,35 milioni di nuovi casi all'anno e 1,18 milioni di morti), con la massima frequenza negli Stati Uniti d'America e in Europa.[22] Negli Stati Uniti, nel 2006, il carcinoma del polmone è stato diagnosticato in circa 60 persone ogni 100 000 abitanti; nello stesso periodo sono morte per questa neoplasia circa 52 persone ogni 100 000 abitanti.[2]
Vengono colpiti prevalentemente soggetti di età superiore a 50 anni che abbiano fatto uso di tabacco. Le misure di prevenzione per il fumo di sigaretta, prese dal 1960 in poi, hanno portato a una lenta ma costante diminuzione del tasso di mortalità negli individui di sesso maschile nella prima parte di questo secolo, benché non si sia ancora osservata una diminuzione significativa nelle donne.[23] In particolare è stato rilevato che, mentre nell'Europa orientale il tasso di mortalità è maggiore negli uomini, nell'Europa settentrionale (vedi epidemiologia in Europa) e negli Stati Uniti il tasso di mortalità è maggiore nelle donne.[24]
Altri studi epidemiologici si sono concentrati nella valutazione di altri fattori di rischio per lo sviluppo di tumori polmonari, rivelando un maggiore tasso d'incidenza nelle popolazioni esposte all'inquinamento proveniente dalle emissioni di automobili, industrie e centrali termoelettriche, come nel Texas,[25] a Taiwan[26] e nelle zone limitrofe a Dublino.[27] Dai dati provenienti da questi studi è risultato evidente il ruolo delle misure preventive focalizzate sulla riduzione dell'esposizione soprattutto ai fumi provenienti dalla combustione dei carburanti derivati dal petrolio.[28]
Il carcinoma del polmone è meno comune nei paesi in via di sviluppo, benché sia stato rilevato un notevole aumento di incidenza e di mortalità nei paesi in cui è subentrata l'abitudine al fumo di sigaretta, in particolare in Cina[29] e in India.[30]
L'incidenza (per ogni paese) di neoplasie polmonari ha una relazione inversa con l'esposizione alla luce solare e ai raggi ultravioletti: una possibile spiegazione del fenomeno può essere connessa al ruolo anti-tumorale svolto dalla vitamina D, che si origina nella pelle in seguito all'esposizione solare.[31]
Un dato degno di nota è un aumento dell'incidenza, dal 1950 in poi, della variante adenocarcinoma,[32] tumore che interessa soprattutto le regioni periferiche del polmone. Il fenomeno è essenzialmente dovuto all'introduzione del filtro nelle sigarette, in grado di intrappolare le particelle più grandi (che si depositerebbero nei bronchi prossimali) e di lasciar passare invece le particelle più piccole, che si depositano nei bronchi distali. La presenza del filtro, inoltre, induce il fumatore a fare inspirazioni più profonde per ricevere la stessa quota di nicotina, con maggiore deposizione delle sostanze tossiche nelle regioni polmonari più periferiche.[33] Negli Stati Uniti d'America, tuttavia, l'incidenza di adenocarcinoma sta diminuendo dal 1999: questo dato sembra essere dovuto alla diminuzione dell'inquinamento ambientale.[32]
In Europa (2006) il carcinoma del polmone costituisce la più comune causa di morte per cancro.[34]
Nella tabella e nelle carte tematiche sono riportati i relativi dati di incidenza e mortalità in Europa nello stesso periodo.[34] L'incidenza nelle femmine, in assoluto, è minore di quella nei maschi, in accordo con la tendenza mondiale. In particolare, l'incidenza nei maschi risulta essere particolarmente elevata negli Stati dell'Europa orientale (Ungheria, Polonia, Russia e Bielorussia), mentre negli Stati dell'Europa settentrionale (Svezia, Finlandia, Norvegia, Gran Bretagna, Islanda e Irlanda) l'incidenza è molto minore. Per le femmine la situazione è quasi opposta: negli Stati dell'Europa settentrionale l'incidenza è massima, con un sorpasso sul sesso maschile in Islanda, mentre è minima nell'Europa orientale.
Elaborando queste informazioni si ricava che l'assetto della distribuzione dell'incidenza prevede una discrepanza minima tra il sesso maschile e quello femminile negli Stati del nord e massima negli Stati dell'est. Allo stesso modo si può constatare che, in linea generale, a mano a mano che per ogni paese scende l'incidenza per i maschi quella per le femmine aumenta fino a equipararsi. La mortalità segue strettamente la tendenza mostrata dall'incidenza, con picchi nei paesi dell'est per i maschi e nei paesi del nord per le femmine.
| Nazione | Incidenza nei maschi | Incidenza nelle femmine | Mortalità nei maschi | Mortalità nelle femmine |
|---|---|---|---|---|
| 95 | 26 | 85 | 23 | |
| 54 | 22 | 51 | 18 | |
| 93 | 23 | 94 | 21 | |
| 87 | 7 | 75 | 5 | |
| 76 | 18 | 70 | 16 | |
| 67 | 12 | 58 | 9 | |
| 66 | 10 | 60 | 9 | |
| 69 | 14 | 81 | 16 | |
| 65 | 49 | 58 | 42 | |
| 80 | 13 | 88 | 11 | |
| 46 | 15 | 44 | 13 | |
| 76 | 15 | 60 | 14 | |
| 61 | 21 | 54 | 18 | |
| 57 | 35 | 51 | 30 | |
| 89 | 13 | 69 | 11 | |
| 60 | 34 | 49 | 26 | |
| 41 | 46 | 40 | 35 | |
| 85 | 16 | 63 | 14 | |
| 83 | 10 | 79 | 9 | |
| 92 | 10 | 74 | 8 | |
| 70 | 16 | 63 | 17 | |
| 72 | 9 | 62 | 8 | |
| 64 | 13 | 50 | 9 | |
| 54 | 34 | 48 | 26 | |
| 63 | 33 | 67 | 31 | |
| 103 | 29 | 92 | 22 | |
| 45 | 12 | 43 | 8 | |
| 79 | 23 | 77 | 19 | |
| 93 | 11 | 75 | 8 | |
| 72 | 12 | 65 | 12 | |
| 62 | 17 | 63 | 18 | |
| 76 | 23 | 69 | 20 | |
| 68 | 14 | 67 | 9 | |
| 29 | 24 | 30 | 24 | |
| 53 | 26 | 43 | 18 | |
| 75 | 10 | 59 | 7 | |
| 119 | 42 | 110 | 35 |

In Italia nel 2004 sono morte 32 840 persone per carcinoma del polmone.[35] Nel periodo compreso tra l'anno 1998 e il 2002, nell'area AIRT (località italiane analizzate nei grafici a sinistra) il carcinoma del polmone ha rappresentato per frequenza la 3ª neoplasia diagnosticata nel sesso maschile e la 4ª nel sesso femminile.[36] Per quanto riguarda la mortalità, il carcinoma del polmone rappresenta la prima causa di mortalità per cancro nell'uomo e la seconda nella donna (dopo il cancro della mammella).
I tassi relativi sono stati elaborati e inseriti nel grafico a sinistra, dalla cui osservazione è possibile ricavare una serie di informazioni. In primo luogo, come in Europa, l'incidenza di carcinoma del polmone in Italia è caratterizzata da un rapporto maschi: femmine di circa 5-4:1, benché queste differenze si stiano completamente annullando per quanto riguarda l'incidenza in soggetti di età compresa tra i 20 e i 44 anni.[37]
L'incidenza per il sesso maschile è massima a Genova, in Veneto, a Ferrara e a Napoli, mentre è minima nell'Alto Adige; nelle femmine l'incidenza è massima nel Veneto e a Parma mentre è minima in alcune città del Sud come Salerno e Ragusa. La mortalità per i maschi è massima in Veneto, Napoli e a Varese mentre è minima in Umbria, a Macerata e a Ragusa. Nelle femmine la mortalità è massima a Ferrara e in Veneto mentre è minima a Ragusa, Salerno e Macerata.
Un'ulteriore osservazione può essere fatta confrontando i dati di incidenza con quelli di mortalità per uno stesso luogo, ricavando che, comunque sia, il carcinoma del polmone ha un bassissimo indice di sopravvivenza sia nei maschi sia nelle femmine. Inoltre, per entrambi i sessi, in luoghi come Ferrara e Genova dove è massimo il tasso di incidenza vi è un indice di sopravvivenza maggiore rispetto a luoghi come l'Alto Adige in cui l'incidenza è minima. Questo significa che ad esempio a Genova, benché il tasso di mortalità sia in assoluto maggiore rispetto a quello dell'Alto Adige, vi è una maggiore possibilità di sopravvivenza nei soggetti cui viene diagnosticato il carcinoma del polmone.
Nello stesso periodo gli istotipi (vedi classificazione istologica) più frequenti nel sesso maschile sono il carcinoma polmonare a cellule squamose (32%) e l'adenocarcinoma polmonare (23%), mentre il carcinoma polmonare a piccole cellule rappresenta circa l'8% di questa casistica.[36] Nelle femmine l'adenocarcinoma polmonare rappresenta l'istotipo più frequente (33%), seguito dal carcinoma polmonare a cellule squamose (16%). Come nei maschi, il carcinoma polmonare a piccole cellule è meno frequente a questi due istotipi (9%). In entrambi i sessi l'età media di incidenza in Italia è tra i 70 e gli 80 anni. La mortalità nei maschi è massima tra i 75 e i 79 anni, mentre nelle femmine è massima tra gli 80 e 84 anni. Deve inoltre essere sottolineato che a partire dalla fine degli anni ottanta fino al 2002 l'incidenza e la mortalità di carcinoma del polmone sono diminuite nel sesso maschile. Nel sesso femminile i dati indicano un aumento dell'incidenza e della mortalità. Tuttavia, per il sesso femminile, la mortalità cresce meno di quanto cresca l'incidenza; il motivo di questo fenomeno è da ricercare nella maggiore speranza di sopravvivenza offerta dai nuovi schemi di chirurgia associati a radioterapia e chemioterapia adiuvante (vedi terapia).

Il fumo di sigaretta è considerato il principale agente eziologico per lo sviluppo di carcinoma del polmone.[38] Secondo uno studio elaborato servendosi di proiezioni statistiche, è responsabile di circa il 90% dei tumori polmonari mortali nei paesi sviluppati.[39] In particolare, sempre secondo uno studio, negli USA il fumo di sigaretta è responsabile dello sviluppo dell'87% dei casi di neoplasia polmonare (90% negli individui di sesso maschile e 85% nelle donne),[40] con un'incidenza che aumenta considerevolmente se le prime esposizioni avvengono entro i 25 anni di età.[41] Il fumo di sigaretta contiene circa 60 cancerogeni certi,[42] inclusi i radioisotopi provenienti dal decadimento del radon, il benzopirene e alcune nitrosamine. Inoltre, la nicotina presente è in grado di deprimere la risposta immunitaria, diminuendo la capacità di sorveglianza e di uccisione delle cellule neoplastiche da parte dei linfociti T e dei linfociti NK.[43] Il rischio percentuale di sviluppo di cancro mortale aumenta con l'aumentare del tempo di esposizione e del numero di sigarette fumate, con graduale diminuzione temporale del rischio in seguito a cessazione totale dell'esposizione.[44] Il fumo di sigaretta non rappresenta solo un fattore di rischio, ma anche un importante elemento in grado di influenzare la prognosi, dimostrato dal fatto che soggetti non fumatori ma con carcinoma del polmone hanno una maggiore percentuale di sopravvivenza a 5 anni rispetto ai fumatori.[45] Inoltre è stato ampiamente documentato che la cessazione del fumo in seguito alla diagnosi di tumore migliora notevolmente il profilo prognostico.[46]
Del fumo di sigaretta si deve considerare una componente mainstream e una sidestream; la prima, ad alte temperature, è quella generata da processi di inspirazione attiva. La seconda, a basse temperature, è il risultato della combustione spontanea tra le dita o nel posacenere. Ultimamente questa distinzione ha assunto un notevole peso epidemiologico, poiché recenti studi[47] hanno dimostrato come la componente sidestream, che rappresenta per larga parte il fumo passivo (85%), sia potenzialmente più nociva rispetto alla componente mainstream (fumo attivo). Naturalmente all'atto pratico, data la notevole diluizione nell'aria che il fumo passivo subisce prima di essere eventualmente inalato, l'aumento percentuale di rischio di contrarre patologie a cui è esposto chi lo assume resta notevolmente inferiore rispetto a quello del fumatore attivo. La connessione tra esposizione passiva e aumento del rischio è stata ulteriormente dimostrata da studi condotti negli USA,[23][48] in Europa,[49] in Gran Bretagna[50] e in Australia[51] che hanno documentato un aumento del rischio relativo nei soggetti esposti al fumo passivo (soggetti che vivono o che lavorano con un fumatore attivo).
Il radon è un gas inodore e incolore, generato dai processi di decadimento del radio, esso stesso prodotto del decadimento dell'uranio, presente diffusamente nella crosta terrestre (granito e minerali usati per la costruzione delle abitazioni). Il radon rappresenta un elemento volatile e radioattivo, in grado di indurre mutazioni a carico del DNA e di rappresentare quindi un rischio concreto di neoplasia: ricerche recenti hanno promosso il radon come secondo fattore di rischio per lo sviluppo di cancro mortale al polmone.[52][53][54] I livelli di radon variano in base alla località e in base alla composizione relativa della crosta terrestre; per esempio in Cornovaglia l'elevata presenza di granito e altri minerali aumenta a tal punto i livelli di radon da rendere consigliato l'uso di ventilatori ed estrusori per diminuire la concentrazione del gas all'interno degli edifici.[55] La United States Environmental Protection Agency (EPA) ha stimato che negli USA almeno in una casa su 15 sono presenti livelli di radon che superano di almeno 4 picocurie per litro (pCi/L, o 148 Bq/m³) i limiti di sicurezza stabiliti.[56] L'Iowa è lo Stato degli USA con la più elevata concentrazione di radon nell'aria (superiore di quattro pCi/L rispetto al controllo), con un aumento del rischio di sviluppo di cancro mortale del polmone superiore del 50% rispetto alla popolazione non esposta.[57] L'esposizione media italiana al radon all'interno degli edifici è mediamente di 77 Bq/m³; in relazione alla mortalità assoluta per cancro al polmone è stato stimato che dal 5 al 20% di insorgenza di tumore mortale è dovuta a tale esposizione.[58] In base a questi dati e a successivi esperimenti, una buona ventilazione degli edifici si è dimostrata essere un provvedimento in grado di diminuire considerevolmente l'esposizione al radon.[59] I decreti legislativi n. 230/1995 e n. 241/2000 impongono inoltre la misurazione dei livelli di radiazione assunta da radon negli individui che lavorano nel sottosuolo.[60]

L'amianto, oltre a essere implicato nella patogenesi della asbestosi e del mesotelioma pleurico, mostra un ruolo sinergico con il fumo di tabacco per lo sviluppo di carcinoma del polmone.[61] In Gran Bretagna è stato stimato che il 2-3% dei casi di cancro mortale è causato dall'amianto.[62] In Italia, l'amianto è stato messo al bando a partire dal 1992, con la legge n. 257. Uno stesso studio ha dimostrato che mentre la sola esposizione all'amianto è in grado di aumentare il rischio di 5 volte, l'esposizione combinata di amianto e fumo di tabacco è in grado di aumentare il rischio di 50 volte.[63]
Benché non siano presenti ancora dati definitivi, l'esposizione allo smog e all'inquinamento atmosferico (prodotti della combustione dei derivati del petrolio e prodotti delle lavorazioni che comportano l'uso di metalli particolari come nichel e cromo) è chiamata in causa nella patogenesi di cancro mortale del polmone.[64][65]
La capacità oncogena dei virus è stata ampiamente dimostrata nel modello animale,[66][67] benché recenti evidenze suggeriscano il ruolo potenziale del papillomavirus,[68] del poliomavirus JC,[69] del simian virus 40 (SV40), del virus BK e del citomegalovirus[70] nella patogenesi del carcinoma del polmone nell'uomo. Questi virus possono alterare il ciclo cellulare e bloccare i processi di apoptosi, promuovendo un anomalo controllo della replicazione cellulare e il successivo sviluppo di neoplasia.
La presenza di anomalie ereditarie a carico di p53 (come la sindrome di Li-Fraumeni) e di Rb predispongono al carcinoma del polmone.[71] Un ulteriore gene coinvolto sembra essere il gene che codifica per il citocromo CYP1A1, della famiglia del sistema enzimatico P450,[72] responsabile del metabolismo di alcuni farmaci, di composti aromatici e del benzopirene.[73] Polimorfismi a carico di questo gene comportano un alterato metabolismo dei composti cancerogeni presenti nel fumo di sigaretta, con maggiore suscettibilità al cancro per i soggetti che hanno ereditato la variante enzimatica del CYP1A1.[3]
La presenza di enfisema o di bronchite cronica testimonia l'esposizione massiccia al fumo di sigaretta;[74] conseguentemente, questi soggetti hanno una probabilità maggiore di sviluppo di cancro mortale del polmone.[38] Una pregressa tubercolosi rappresenta un rischio a sé stante per lo sviluppo di cancro mortale del polmone; tale evento prende il nome di carcinoma su cicatrice,[75] che descrive l'innesco del processo neoplasico nel sito polmonare nel quale è avvenuto (e in seguito risolto con cicatrizzazione) il processo tubercolare.
Gli elementi eziologici analizzati portano a mutazioni del DNA che innescano un insieme di modificazioni che hanno come risultato finale un'intensa proliferazione dell'epitelio, con aberrazioni dell'architettura del tessuto polmonare. Con il tempo e con il prolungarsi dell'esposizione, l'insieme di queste modificazioni costituisce il terreno sul quale origina e si muove la neoplasia. Da queste considerazioni si deduce che al disordine neoplastico si associano alterazioni microscopiche, macroscopiche e molecolari, che evolvono in coerenza nel tempo e nello spazio.
Mentre queste ultime verranno discusse nella sezione Eventi biologico-molecolari, le prime due corrispondono ad alterazioni visibili che sostengono il quadro clinico-patologico. Occorre quindi considerare sempre che, simultaneamente al disordine neoplastico visibile, si muove un substrato molecolare sincrono ed evolutivo in grado di condizionare la storia clinica e la prognosi del tumore, conferendo proprietà di invasività, metastatizzazione o resistenza alla chemio-radioterapia.
| Alterazioni istologiche nel carcinoma del polmone[3] | |
| Tappe anatomo-patogenetiche | |
| Stimolo oncogeno ↓ | Stimolo oncogeno I I I ↓ Iperplasia adenomatosa atipica I I I I ↓ |
| Alterazioni reversibili | |
| Iperplasia epiteliale ↓ Epitelio metaplastico ↓ | |
| Alterazioni irreversibili | |
| Displasia ↓ Carcinoma in situ ↓ | |
| Carcinoma polmonare a cellule squamose | Adenocarcinoma polmonare Carcinoma bronchioloalveolare |
Come illustra lo schema, un tumore non insorge in un epitelio sano: occorrono infatti molti anni affinché lo stimolo cancerogeno, rappresentato dal contatto con uno dei fattori di rischio, possa promuovere alterazioni tali da innescare lo sviluppo di tumore. Nell'epitelio bronchiale, l'esposizione ripetitiva al fumo porta a un'intensa proliferazione (iperplasia), che tuttavia non possiede le alterazioni genetiche tipiche del tumore. Con il tempo e il perdurare dello stimolo, le cellule che costituiscono il tessuto iperplastico possono andare incontro a un processo definito metaplasia, un particolare evento caratterizzato dalla trasformazione di un tipo cellulare in un altro. Nel caso del polmone, le cellule che compongono l'epitelio si trasformano da cilindriche a fusate, assumendo un aspetto pavimentoso stratificato (metaplasia squamosa).[3] Il passo successivo è rappresentato dalla displasia, una situazione nella quale viene a essere alterata la normale architettura tissutale. Questo significa che le cellule vanno incontro a una proliferazione non più ordinata in base alla fisiologica anatomia del tessuto, ma verranno a svilupparsi, ad esempio, in contesti di pertinenza di altri tessuti. Nel polmone questo è visibile, poiché le cellule pavimentose non si disporranno più verso il lume del bronco, ma tenderanno ad accumularsi negli strati medi e inferiori della mucosa, testimoniando che le cellule alterate sono svincolate dalla polarizzazione imposta dall'epitelio stesso. Differentemente dalla metaplasia, che può essere risolta eliminando lo stimolo nocivo, la displasia è un processo irreversibile e rappresenta il seme dal quale si genera il carcinoma in situ, definito come una lesione neoplastica che non ha ancora oltrepassato il limite imposto dalla membrana basale. Questi eventi descrivono le tappe patogenetiche che caratterizzano la genesi del carcinoma polmonare a cellule squamose; tuttavia è stato messo in evidenza che,[76] a differenza di questo tipo, l'adenocarcinoma polmonare e il carcinoma bronchioloalveolare originano da un'alterazione pre-neoplastica denominata iperplasia adenomatosa atipica, caratterizzata da un'intensa proliferazione di strutture ghiandolari nel contesto del tessuto polmonare.
Il terreno attraverso il quale si snoda il disordine neoplastico è caratterizzato da alterazioni molecolari che possono essere riassunte in sei grandi gruppi patogenetici.[77]

Una cellula privata di fattori di crescita va rapidamente incontro ad apoptosi. Per questo, acquisire autosufficienza per i fattori di crescita rappresenta un meccanismo fondamentale per innescare e sostenere la carcinogenesi. Diverse alterazioni, su diverse componenti, possono realizzare e promuovere l'autosufficienza: per il carcinoma del polmone assumono particolarmente importanza le vie di segnalazione cellulare che riguardano tre sistemi proteici: EGFR, Ras e Myc.
Nel tessuto polmonare uno dei recettori per i fattori di crescita è rappresentato dal recettore del fattore di crescita dell'epidermide o EGFR (anche detto ErbB-1), proteina posta sulla membrana cellulare di molte cellule bronchiali.[78]
Essenzialmente, sono 3 i meccanismi attraverso i quali alterazioni di EGFR possono contribuire allo sviluppo e al mantenimento del carcinoma del polmone.[78]
La proteina Ras rappresenta un punto di snodo cruciale nella segnalazione di proliferazione e differenziazione cellulare, anche per quanto riguarda la via trasduzionale di EGFR.[82] Mutazioni di Ras, in particolare dell'isoforma K-Ras, sono presenti soprattutto nell'adenocarcinoma polmonare,[83] benché, comunque sia, rappresentino un'alterazione tipica (15-20%) di tutte le forme di NSCLC.[84] Mutazioni attivanti di K-Ras si associano molto strettamente all'abitudine al fumo di sigaretta e alla resistenza insorta durante il trattamento chemioterapico.[85]
Myc è un oncogene codificante per una proteina che rappresenta il traguardo finale del segnale di proliferazione convogliato da Ras;[86] ciò significa che una mutazione attivante di Myc, o una sua iperespressione, mima fisiologicamente una mutazione attivante di Ras. Le alterazioni di Myc sono associate a moltissime forme di cancro[87] e nel carcinoma del polmone assumono una valenza particolare le forme cMYC, MYCN e MYCL. Mentre si ha mutazione di cMyc in circa l'8-20% delle forme di NSCLS, la mutazione delle ultime due forme rappresenta un meccanismo patogenetico fondamentale nello sviluppo di carcinoma polmonare a piccole cellule.[88]
L'apoptosi, o morte cellulare programmata, rappresenta un processo fisiologico di notevolissima importanza. La sua regolazione permette il corretto sviluppo di diversi nuovi tessuti, a scapito di popolazioni cellulari senescenti o rudimentali. Benché questi processi siano particolarmente evidenti durante l'embriogenesi, l'apoptosi riveste un ruolo fondamentale anche nell'individuo adulto, soprattutto nell'eliminazione dei linfociti autoreattivi e delle cellule cancerose.[89] Giocoforza, la compromissione di tali meccanismi o l'acquisizione da parte del tumore della capacità di evadere l'apoptosi, rappresenta uno dei momenti cruciali per la progressione della neoplasia.[79]
Nel processo di evoluzione di una neoplasia le cellule acquisiscono gradualmente nuove capacità proliferative svincolandosi dal blocco imposto da alcuni geni denominati per questo oncosoppressori.[79] In generale, meccanismi che portano alla perdita di un solo allele oncosoppressore non sono sufficienti a promuovere lo sviluppo di un tumore; tuttavia, la perdita di entrambi gli alleli (two hits hypothesis) è strettamente associata a instabilità genetica, ad alterato ciclo cellulare e, infine, alla proliferazione incontrollata.[100]
La proteina p53 rappresenta un tipico esempio di gene oncosoppressore; un ulteriore classico esempio è rappresentato dalla Rb, in grado di controllare le diverse tappe del ciclo cellulare.[101] Ogniqualvolta uno di questi geni viene perso o inattivato da mutazione in entrambi gli alleli si parla di loss-of-heterozygosity (LOH).[102] Molti studi,[103] focalizzati soprattutto sul carcinoma polmonare a cellule squamose, hanno messo in evidenza le seguenti loss-of-heterozygosity:
|
Studi pubblicati nel marzo 2008[104] hanno messo in luce un ulteriore processo responsabile dell'evasione dal blocco alla crescita cellulare, rappresentato dalla metilazione dei promotori che modulano l'espressione di geni oncosoppressori. La metilazione è un processo fisiologico che porta al silenziamento di geni non necessari per la cellula nel dato periodo preso in considerazione;[105] tuttavia, la metilazione patologica che avviene in queste cellule tumorali può portare al silenziamento di oncosoppressori, con un profilo funzionale conseguente praticamente identico alla loss-of-function. Questi studi hanno inoltre messo in evidenza che tali alterazioni si verificano nelle fasi iniziali del processo di carcinogenesi, quando ancora non sono avvenute alterazioni mutazionali stabili. Ciò implica che le modificazioni a carico delle lesioni neoplastiche precoci possiedono ancora un certo grado di reversibilità.
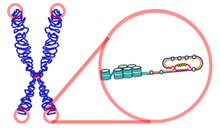
Fisiologicamente, con il ripetersi dei cicli cellulari e, dunque, delle mitosi, i telomeri si accorciano, testimoniando la fisiologica senescenza cellulare.[105] L'enzima telomerasi[106] utilizza continuamente nuovi nucleotidi per cercare di mantenere costante la lunghezza dei telomeri. Da ciò si può dedurre che cellule con una spiccata attività telomerasica, quindi con telomeri costantemente lunghi, possono essere in grado di sfuggire ai normali processi di invecchiamento procedendo verso uno stato di immortalità. Nel carcinoma del polmone è stata ampiamente documentata[107] un'iperattività telomerasica soprattutto nelle fasi precoci del processo neoplastico. Presa visione di questa evidenza, numerosi studi[108][109] si sono focalizzati nel ricercare evidenze che possano suggerire il ruolo dell'esame dell'attività telomerasica sul liquido di lavaggio bronchiolo-alveolare (BAL) prelevato in corso di broncoscopia come misura di screening e prevenzione. Ulteriori studi[110] hanno analizzato la capacità predittiva dell'analisi dell'attività telomerasica associata alla normale citologia dell'espettorato o del BAL. Da queste ricerche risulta che, benché sia ancora una metodica in fase di sperimentazione e con costi elevati, l'analisi dell'attività telomerasica aggiunge sensibilità e accuratezza diagnostica al più specifico esame citologico, con ulteriore migliore capacità discriminativa sul grado di malignità del disordine neoplastico esaminato.

Numerosi studi sono stati condotti sul ruolo dei fattori di crescita per i vasi sanguigni nel carcinoma del polmone, dimostrando che il fattore cardine è rappresentato dal VEGF;[111] da ciò è stato reso evidente che un'elevata concentrazione di VEGF del sangue dei pazienti con carcinoma del polmone rappresenta un fattore prognostico negativo indipendente dalla loro classificazione.[112] È stato inoltre dimostrato che il processo di angiogenesi sostenuto dal VEGF avviene nelle fasi precoci della carcinogenesi del carcinoma del polmone,[113] con pesanti implicazioni nella storia naturale di queste neoplasie.

Alcuni studi hanno dimostrato che cellule epiteliali bronchiali possono mostrare una perdita dell'inibizione da contatto in seguito a esposizione alla nicotina.[114] Il passo successivo alla perdita dell'inibizione da contatto è rappresentato dall'acquisizione della capacità di invasione tissutale attiva, grazie all'espressione di proteine, come le metallo proteasi, in grado di demolire la matrice extracellulare, permettendo alle cellule neoplastiche di farsi strada tra i tessuti. Molte di queste proteine sono chiamate in causa nella capacità invasiva del carcinoma del polmone; di seguito vengono discussi alcuni degli elementi ritenuti più importanti nell'infiltrazione di questa neoplasia.


L'esposizione ai fattori di rischio si traduce in modificazioni delle cellule dell'epitelio dei bronchi, soprattutto di quelli di primo, secondo e terzo ordine, da dove origina la maggior parte dei tumori polmonari.[3] Di questi, la maggioranza (90-95%) è rappresentata da tumori maligni di origine epiteliale (carcinomi) mentre solo il 5% dai carcinoidi bronchiali e il 2-5% da tumori mesenchimali[129]. Come discusso in seguito, le forme epiteliali si distinguono in "tumori a piccole cellule" (SCLC) e "tumori non a piccole cellule" (NSCLC). Nelle fasi avanzate anche l'intero polmone può essere invaso dalla massa tumorale e spesso si hanno metastasi ai linfonodi mediastinici che drenano il parenchima polmonare, con aspetto di ilo globoso o comunque aumentato di volume nei radiogrammi del torace. Talvolta i linfonodi aumentati di volume possono comprimere la vena cava superiore determinando una stasi venosa con edema a mantellina (sindrome della vena cava superiore). Sedi frequenti di lesioni metastatiche da carcinoma polmonare sono le ghiandole surrenali, le ossa, il cervello ed eventualmente anche il polmone controlaterale rendendo difficile l'individuazione della sede d'origine.[130] Un tumore polmonare periferico, inoltre, può invadere la pleura per contiguità, causando versamento, le costole o, nel caso di tumori apicali (tumore di Pancoast), i rami del plesso brachiale, causando dolore all'arto superiore corrispondente e particolari sindromi connesse all'interessamento dei plessi nervosi che regolano il sistema nervoso autonomo.[130]
I nomi delle neoplasie benigne derivano dal nome della cellula di origine al quale si aggiunge il suffisso -oma. Ad esempio, una neoplasia benigna che origina dal tessuto adiposo, è chiamata lipoma (dal greco lypos, grasso). Analogamente, la neoplasia benigna del tessuto cartilagineo è chiamata condroma (dal greco khondrós, cartilagine). Ancora; una neoplasia benigna che origina dai fibroblasti è chiamata fibroma, uno che origina dall'osso si chiama invece osteoma. Adenoma è invece il termine utilizzato per indicare una neoplasia benigna che origina da un epitelio e che riproduce un aspetto ghiandolare. Per le neoplasie maligne la regola è diversa; si deve aggiungere il suffisso -sarcoma se la neoplasia origina da cellule mesenchimali, mentre si usa il suffisso -carcinoma se la neoplasia origina dalle cellule epiteliali. Per cui, una neoplasia maligna dei tessuti precedentemente citati avrà come nome: liposarcoma, condrosarcoma, fibrosarcoma, osteosarcoma e adenocarcinoma. Il 95% delle neoplasie polmonari è maligno e origina dalle cellule dell'epitelio bronchiale. I carcinomi polmonari possono essere ulteriormente divisi in base alle caratteristiche. Ad esempio:
Infine, nel polmone possono insorgere particolari neoplasie a basso grado di malignità (ma non benigne) che originano dalle cellule neuroendocrine e che vengono definiti carcinoidi. Queste neoplasie (rare) devono essere distinte dal carcinoma polmonare a piccole cellule che, pur originando dalle cellule neuroendocrine, è caratterizzato da notevolissima malignità.
| Classificazione istologica | Frequenza (%) |
|---|---|
| Carcinoma polmonare non a piccole cellule (NSCLC) | 80.4 |
| Carcinoma polmonare a piccole cellule (SCLC) | 16.8 |
| Carcinoide[132] | 0.8 |
| Sarcoma[133] | 0.1 |
| Altri istotipi | 1.9 |
| Sottotipi istologici di NSCLC |
Frequenza di NSCLC (%) | ||
|---|---|---|---|
| Fumatori | Non fumatori | ||
| Carcinoma a cellule squamose (carcinoma epidermoide) |
42 | 33 | |
| Adenocarcinoma | Adenocarcinoma (non altrimenti specificato) |
39 | 35 |
| Carcinoma bronchioloalveolare | 4 | 10 | |
| Carcinoide | 7 | 16 | |
| Altri | 8 | 6 | |
L'Organizzazione mondiale della sanità prevede la divisione in quattro principali tipi istologici; tuttavia, ai fini terapeutici e prognostici è opportuno dividere le neoplasie polmonari in due grandi gruppi,[1] definiti come carcinomi polmonari non a piccole cellule (NSCLC) e carcinoma polmonare a piccole cellule (SCLC). All'interno degli NSCLC si possono distinguere diversi sottotipi istologici, tra i quali:
Il carcinoma epidermoide è un tumore maligno prevalentemente centrale che origina della cellule basali dell'epitelio dei bronchi, con lenta crescita e che predilige i lobi polmonari superiori; è la forma più strettamente associata al fumo di sigaretta.[135] L'adenocarcinoma del polmone è una forma tumorale estremamente variabile con linfotropismo estremamente marcato e in grado di formare metastasi linfonodali senza ingrandimento TC visibile (micrometastasi).[136] Il carcinoma bronchioloalveolare nasce dagli alveoli e diffonde tappezzando la parete alveolare, risultando non strettamente invasivo; ha un decorso clinico indolente e una frequenza molto bassa, con un quadro radiologico simile alla polmonite.
Il carcinoma polmonare a piccole cellule deve essere distinto da queste forme; è un tumore estremamente maligno, con elevatissima mortalità e che si sviluppa in un contesto patogenetico molecolare differente rispetto ai NSCLC; può essere definito come l'estremo maligno della linea dei tumori che originano dalle cellule neuroendocrine (carcinoidi tipici e atipici, carcinoma polmonare a grandi cellule). La malignità tipica di questi tumori viene giustificata dal decorso clinico estremamente rapido, dalla precocissima capacità di metastatizzare e all'associazione con sindromi paraneoplastiche.[130]
L'epitelio bronchiale normale è formato da un monostrato di cellule cilindriche ciliate frammiste a cellule mucipare caliciformi. Mentre queste ultime, insieme con le ghiandole della sottomucosa, sono deputate alla produzione di muco, le prime devono sostenere un'intensa attività di pulizia (clearance) dell'epitelio stesso, trasportando il muco prodotto verso l'alto attraverso il movimento ritmato delle ciglia. Tra queste cellule si interpongono le cellule neuroendocrine, in grado di secernere un insieme di sostanze con proprietà vasoattive e con attività sulla muscolatura liscia bronchiale[137]. Sono inoltre presenti cellule indifferenziate che forniscono popolazioni cellulari sempre nuove all'epitelio bronchiale. Mentre si ritiene che i NSCLC originino dalle cellule ciliate o dalle cellule indifferenziate, la presenza di marcatori neuroendocrini nelle cellule degli SCLC fa ritenere che questa linea di tumori originino dalle cellule del sistema APUD.[138]
Come tutti i carcinomi a cellule squamose (o spinocellulari), questi tumori sono caratterizzati dalla presenza di cheratinizzazione, ben visibile per la presenza di elementi cellulari fusiformi intensamente eosinofili e totalmente o quasi totalmente privi di nucleo.[138] La combinazione e l'intensa proliferazione di questi elementi intorno a un punto porta alla formazione di perle cornee, identificabili come zone concentriche con elevatissima cheratinizzazione (rappresentazione A, in basso a destra). Nell'immagine istologica A (e nella rappresentazione connessa) è inoltre possibile osservare la presenza di "spine" che protrudono dalla membrana cellulare e che formano ponti tra cellula e cellula. I ponti intercellulari altro non sono che desmosomi e testimoniano, unitamente alla cheratinizzazione, la conversione dell'epitelio cilindrico bronchiale in un epitelio molto più simile a quello della cute. La presenza di spine intercellulari è un reperto così caratteristico da poter render necessaria la sua ricerca in ogni lesione bronchiale sospetta. La presenza di perle, di elementi squamosi e di spine delineano una forma di neoplasia ben differenziata; viceversa, l'assenza di perle cornee, la presenza di figure mitotiche atipiche e di elementi cellulari giganti e immaturi possono far propendere più verso un reperto di neoplasia scarsamente differenziata, con un grado maggiore di invasività.[3]
Con il termine adenocarcinoma si fa riferimento a una neoplasia di origine epiteliale in cui è possibile osservare un certo grado di differenziazione verso l'epitelio ghiandolare, caratterizzato dalla presenza di strutture acinose o papillari e dalla produzione di mucina.[3] Come mostra l'immagine istologica B, le cellule che si radunano a formare una struttura ghiandolare possono assumere una colorazione molto chiara per l'elevata presenza di mucina nel citosol. In questo caso si può parlare di adenocarcinoma a cellule chiare.[138] Invece, nella rappresentazione B si focalizza l'attenzione sulla formazione di strutture ghiandolari acinose che testimoniano il buon grado si differenziano del tumore; viceversa, ma mano che il tumore diventa più indifferenziato, le strutture acinari possono lasciare il posto a strutture papillari, che danno un aspetto più compatto al tessuto osservato. Con la progressiva perdita della differenziazione il tumore può assumere un aspetto solido, con elementi cellulari atipici e pleomorfi, di difficile caratterizzazione e inquadramento.
Questa variante istologica è sovente considerata una variante dell'adenocarcinoma, benché mostri una caratterizzazione anatomo-patologica, diagnostica e prognostica differente. Come è possibile vedere nelle immagini istologiche C1 e C2 e dalla rappresentazione C, le cellule tumorali proliferano rispettando la struttura microscopica polmonare, non invadendo la sottomucosa ma tappezzando come farfalle su di uno steccato (crescita lepidica, dal gr. λεπίς, -ίδος, «involucro», essendo la crescita di questo tumore contenuta all'interno delle vie aeree che appunto lo rivestono) i setti alveolari. Le due varianti, muciparo e non muciparo, si differenziano per forma cellulare ed evoluzione: mentre la prima è costituita da cellule cilindriche e tende a diffondersi per via aerogena, la seconda è caratterizzata da cellule cuboidi o leggermente fusate, in grado di formare noduli spesso confinati.[3]
Con questo termine si definisce una neoplasia polmonare altrimenti non identificabile nell'ambito di carcinoma squamocellulare o adenocarcinoma. Come suggeriscono sia la rappresentazione sia l'immagine istologica D, questo tipo di tumore è formato da elementi cellulari pleomorfi, con nuclei prominenti e di dimensioni variabili dove è possibile apprezzare nucleoli intensamente cromofili. Questi tumori possono mostrare un certo grado di differenziazione neuroendocrina, confermata dall'aspetto di crescita organoide, con formazione di trabecole e rosette molto simili a quelle osservate nel microcitoma.[139]
Questo tumore rappresenta l'estremo maligno di una serie di neoplasie che originano dalle cellule neuroendocrine, proprietà confermata dalla presenza di marcatori come la cromogranina o la sinaptofisina. Le cellule sono rotondeggianti, con scarso citoplasma e membrana cellulare ben definita; si organizzano formando strutture a palizzata (immagine istologica e rappresentazione E) con zone di necrosi e con elevatissima conta mitotica, fattore che testimonia il basso grado di differenziazione e l'elevata malignità.[3]
In generale il carcinoma del polmone appare come una massa compatta, di colore spesso grigio-biancastro e con contorni sfrangiati e invasivi delle zone circostanti ancora sane del polmone, benché possano essere evidenziate caratteristiche individuali per ogni tipo istologico. Dal luogo d'origine, le cellule tumorali possono migrare per la via linfatica ed ematica in altri organi dove attecchiscono e colonizzano in forma di aggregati detti "metastasi". Frequenti sono le metastasi alle linfoghiandole dell'ilo polmonare, del mediastino, del collo, oppure degli organi, come il surrene, il cervello, le ossa, il fegato o il rene. Le cellule tumorali possono raramente migrare anche nei bronchi e da qui diffondersi in altre regioni polmonari (metastasi polmonari). Le neoplasie possono estendersi localmente e interessare la pleura, producendo un liquido siero-ematico, e la parete toracica o il mediastino.
Sono molto spesso tumori centrali[138] (immagine A1). Il carcinoma a cellule squamose si origina dall'epitelio bronchiale come un'escrescenza verrucosa (immagine A2) che può crescere fino a occupare l'intero lume, provocando fenomeni di atelectasia o polmonite post-ostruttive, ben visibile nella figura A3. Il tumore può infiltrare la sottomucosa ed espandersi seguendo il tessuto peribronchiale in direzione mediastinica, dove appare radiograficamente come un'estesa opacità in sede para-ilare (vicino all'ilo polmonare).[140] Si presenta caratteristicamente come una massa "a cavolfiore", lobulata, di colore bianco-grigiastro e di consistenza dura; intorno alla massa possono presentarsi fenomeni necrotici (zone soffici e giallastre) ed emorragici (zone di polmone collassato infarcito di sangue).[3] Talora l'elevato tasso di crescita produce delle zone ischemico-necrotiche nella zona centrale, che può escavarsi raccogliendo materiale purulento; in questi casi si parla di cancro-ascesso.
Sono spesso tumori che originano dai bronchi di piccolo calibro, benché possano anche presentarsi in sede parailare.[139] Assumono un aspetto lobulato e traslucido, in virtù della intensa produzione di mucina, come mostra l'immagine B.
La confluenza di più noduli (ben visibili nell'immagine C) porta alla formazione di un addensamento talmente esteso da poter essere confuso con una polmonite lobare. Qualora sia presente un'intensa secrezione mucosa, la superficie di taglio può mostrarsi lucida, con aree più o meno grandi di raccolta.[138] L'addensamento del parenchima, senza coinvolgimento bronchiale, porta allo sviluppo di broncogramma nei reperti radiografici, caratterizzato dalla visibilità delle strutture bronchiali contenenti aria nel contesto del mezzo solido rappresentato dal tumore.[136]
Questo tumore si sviluppa soprattutto nelle zone polmonari periferiche, benché, allo stesso modo dell'adenocarcinoma, possa estendersi in sede parailare.[139] Hanno un aspetto solido e lobulato (immagine D), possono assumere grandi dimensioni e avere aree di raccolta ascessuale al loro interno.
Si sviluppano in sede ilare, coinvolgendo precocemente le strutture tracheali e mediastiniche.[141] Come mostra l'immagine E, il tumore tende a infiltrare nel tessuto peribronchiale, coinvolgendo anche vasi sanguigni e linfonodi, benché possano presentarsi fenomeni di desquamazione necrotica intrabronchiale nel corso della malattia.[138]
I segni e sintomi che si manifestano nei soggetti con carcinoma del polmone sono direttamente correlati a:
Come discusso nel profilo anatomo-patologico, i tumori del polmoni possono manifestarsi come forme centrali o come forme periferiche, benché le prime siano le più frequenti. In seguito all'espansione della massa nel lume del bronco viene a crearsi una situazione ostruttiva che si manifesta con sibili e stridori respiratori che possono essere valutati in corso di esame obiettivo, dispnea (spiacevole consapevolezza di respirazione difficoltosa), tosse stizzosa per irritazione della superficie bronchiale ed emoftoe (espettorato striato di sangue) per rottura dei numerosi esili capillari che percorrono la superficie del tumore.[142] Il paziente può lamentare inoltre dolore al torace. L'ostruzione del lume bronchiale porta a un ristagno delle secrezioni a valle dell'ostruzione, che può esitare verso la polmonite ostruttiva, spesso manifesta con febbre e radiografia compatibile.[143] L'ostruzione completa del lume può portare allo sviluppo di atelectasia (collasso) del parenchima polmonare a valle. Con la crescita, il tumore può andare incontro a escavazione con formazione di cavità ascessuali nel contesto della neoplasia stessa. Tale entità prende il nome di cancro ascesso. Il carcinoma bronchioloalveolare, ricoprendo la superficie degli alveoli, può ostacolare la diffusione dell'ossigeno, causando ipossia e insufficienza respiratoria.[144]

I tumori periferici possono provocare dolore in virtù del possibile coinvolgimento pleurico. Per lo stesso motivo, si può sviluppare un versamento pleurico (e relativa grave dispnea) spesso di carattere essudativo e francamente emorragico.[1] Il coinvolgimento della parete toracica può dar luogo a dispnea in seguito a insufficienza respiratoria di tipo restrittivo. Tumori che originano dalle porzioni superiori del polmone (tumore di Pancoast), possono dar origine a un quadro sindromico definito sindrome di Pancoast o sindrome del tumore del solco superiore, caratterizzato dal coinvolgimento compressivo o infiltrativo dell'ottavo nervo cervicale e del primo-secondo nervo toracico. La sindrome si manifesta con dolore alla spalla che si irradia lungo il lato ulnare dell'arto superiore corrispondente.[145] Il quadro può essere confermato da una radiografia che dimostri l'opacità apicale e l'infiltrazione della prima o seconda costa.[143] Riconosce invece la compressione delle strutture del sistema nervoso simpatico il quadro clinico denominato sindrome di Bernard-Horner, caratterizzato dalla triade miosi (pupilla ristretta), blefaroptosi (palpebra abbassata) ed enoftalmo (occhio infossato) nel lato colpito.[146]

I polmoni sono drenati da una serie di vasi linfatici che fanno capo a numerosi linfonodi del mediastino. Questi vengono divisi in 14 gruppi e sono in contatto con molti organi e strutture mediastiniche. Dunque, la presenza di metastasi linfonodali da carcinoma del polmone, possono presentarsi con segni e sintomi (dovuti alla compressione o all'infiltrazione degli organi confinanti) che nell'insieme vengono considerati con il nome complessivo di sindrome mediastinica. L'infiltrazione dell'esofago da parte dei linfonodi peritracheali può provocare disfagia, con rigurgito e possibile scialorrea, segno che correla con malattia avanzata e prognosi infausta.[147] L'interessamento della trachea o dei bronchi principali può esitare in un quadro dispnoico con tosse irritativa ed emoftoe; analogamente al quadro esofageo, questi segni e sintomi non si manifestano se non in fase tardiva. L'invasione della vena cava superiore è invece molto più frequente, a causa della debolezza tipica di tale struttura:[148] in questo caso la sintomatologia è caratterizzata da edema al volto e agli arti superiori, da obnubilamento, da cefalea e da cianosi dei distretti superiori, in un quadro che viene definito sindrome della vena cava superiore. Un po' meno frequente, ma molto rilevante ai fini prognostici, è il quadro clinico derivante dalla compromissione delle strutture nervose che risiedono nel mediastino. Un incoercibile singhiozzo o una paralisi diaframmatica sono reperti associabili alla compromissione del nervo frenico, mentre una tosse stizzosa e una marcata bradicardia possono associarsi a una lesione del nervo vago. La presenza di metastasi che coinvolgono i linfonodi della finestra aorto-polmonare (compartimento anatomico della porzione sinistra del mediastino compreso tra aorta e arterie polmonari) possono comprimere la prima porzione del nervo ricorrente laringeo di sinistra, con presenza di disfonia per impossibilità dei movimenti di adduzione delle corde vocali (voce rauca).
Il carcinoma del polmone metastatizza al cervello, ai surreni, alle ossa e al fegato. Meno frequentemente, le metastasi possono presentarsi anche nello stesso polmone, nei reni e al pericardio.[149] Le metastasi al cervello possono esordire con sintomi focali, parestesie, scosse cloniche, epilessia o altri disturbi del movimento. Il surrene rappresenta un sito di metastasi specifico per il carcinoma del polmone e per altre poche forme neoplastiche, con effetti metabolici che si contestualizzano in una sindrome di Addison e possono rappresentare un'importante causa di comorbidità. Le metastasi ossee sono associate a un'intensa sintomatologia dolorosa per distensione e infiltrazione del periostio.
Una sindrome paraneoplastica può essere definita come l'insieme dei segni, dei sintomi e delle alterazioni morfologico-funzionali che un tumore è in grado di dare a distanza dalla sede di sviluppo primitivo o di sviluppo delle metastasi.[77] In questo senso, un carcinoma del polmone viene spesso scoperto in seguito all'evidenza clinica di questi quadri patologici.[150] Nel carcinoma del polmone, le sindromi paraneoplastiche di maggiore rilevanza sono la sindrome di Lambert-Eaton (disordine autoimmune caratterizzato da affaticabilità muscolare dovuta alla presenza di autoanticorpi diretti verso i canali per il calcio voltaggio dipendenti[151]), l'ipercalcemia (dovuta alla produzione da parte del tumore di PTHrP)[152] e la sindrome da inappropriata secrezione di ADH (secrezione da parte del tumore di ormone anti-diuretico).[153] Altri sintomi sistemici che correlano con prognosi infausta sono: artralgie, febbre, anoressia, astenia e insonnia.[147][154]
In un contesto anamnestico in cui si presenta uno o più di questi reperti:[155]
il primo esame da eseguire è rappresentato dalla radiografia del torace,[136] in grado di dare informazioni sulla presenza di una massa, sul coinvolgimento dei linfonodi mediastinici, sulla presenza di una polmonite ostruttiva o di atelectasia e sulla presenza di versamento pleurico. Qualora le informazioni provenienti dalla radiografia del torace non risultassero esaustive per un soggetto fumatore con emoftoe e tosse, si deve procedere con esami di secondo livello come la tomografia computerizzata o la broncoscopia.[143] Un quadro radiografico compatibile con un tumore polmonare deve essere comunque indagato con la TC,[1] al fine di stabilire un corretto algoritmo diagnostico. Il successivo step è rappresentato dalla biopsia; il prelievo bioptico di una lesione neoplastica confinata nel mantello polmonare (tumore periferico) si svolge attraverso una biopsia percutanea TC guidata. Viceversa, una lesione neoplastica centrale (per definizione raggiungibile con il broncoscopio), deve essere indagata con una biopsia svolta in corso di broncoscopia.[143] Un ruolo importante è quello dall'analisi citologica dell'espettorato, soprattutto per le forme di tumore centrale; questa analisi, unitamente ad altre procedure come la radiografia del torace in soggetti a rischio (forti fumatori sopra i 50 anni), può avere un ruolo nella diagnosi precoce di carcinoma del polmone.[156]
La diagnosi differenziale si snoda tra i quadri infettivi e i disordini infiammatori cronici in grado di dare una linfoadenopatia mediastinica. Tra i primi è sempre buona regola escludere la tubercolosi come possibile causa di opacità mediastinica; tra i secondi, si deve cercare di escludere la presenza di sarcoidosi.[154] Tuttavia, moltissimi altri quadri infettivi sono in grado di realizzare e sostenere una linfoadenopatia mediastinica. Non si deve inoltre escludere la presenza di disordini linfoproliferativi primitivi del mediastino che solitamente possono provocare opacità ilare senza coinvolgimento polmonare.[157] Il carcinoma del polmone può essere riscontrato anche in qualità di incidentaloma, ovvero, può essere scoperto grazie a una radiografia del torace svolta per altri motivi. Il riscontro di tumore primitivo polmonare in seguito a indagini svolte per sospetto di malattia neoplastica estesa (riscontro di metastasi ossee, cerebrali o surrenali), corrisponde a una diagnosi di tumore inoperabile e in fase terminale (grado IV, vedi classificazione) in grado di portare rapidamente verso l'exitus.[130]
Le forme di carcinoma polmonare a piccole cellule vengono classificate in malattia localmente delimitata (limited disease) o in stadio avanzato (extended disease)[158] in base alla possibilità o meno di colpire in fase radioterapica la massa tumorale mediante un'unica irradiazione.[1] Le forme di tumore non a piccole cellule vengono classificate in base all'estensione del tumore (parametro T), alla localizzazione di linfonodi coinvolti (N) e alla presenza di metastasi (M). Con tali reperti è possibile procedere alla classificazione mediante la seguente tabella:[130]
|
Come è possibile notare, la presenza di metastasi a distanza, qualunque sia l'estensione e la presenza di metastasi linfonodali, promuove il tumore in categoria IV, caratterizzata da inoperabilità e sopravvivenza bassissima a un anno.[1] Un'ulteriore particolarità è rappresentata dal fatto che carcinomi privi di metastasi caratterizzati da parametri T4 o N3 sono sempre assegnati al grado IIIb. Sono considerati operabili gli stadi Ia, Ib, IIa, IIb e alcuni IIIa (pazienti in buone condizioni di salute e senza esteso coinvolgimento linfonodale).[157] Gli stadi IIIb e IV sono da considerare sempre inoperabili; il trattamento di elezione è rappresentato dalla chemioterapia e dalla radioterapia.[77]
Il grado T può essere indagato mediante metodiche tomografiche, di risonanza magnetica (poco utilizzata nel polmone) e di videotoracoscopia; quest'ultima trova particolare impiego nell'analisi del coinvolgimento mediastinico e delle strutture vascolari.[157]
Con N si fa riferimento ai linfonodi coinvolti dal processo tumorale. Tale indagine può essere svolta mediante tomografia computerizzata o a emissione di positroni. Il limite più spiccato di queste metodiche è l'incapacità di visualizzare coinvolgimenti senza tumefazione (nel caso della TC) e l'incapacità di dare informazioni su piccole formazioni (PET). Per questo, i linfonodi prelevati in corso di procedure di chirurgia toracica come la lobectomia o la pneumectomia, devono essere sempre analizzati in ambito anatomo-patologico per la ricerca di processi infiltrativi non espansivi e quindi non visualizzabili mediante procedure radiografiche.[157]
Il grado M può essere indagato con la tomografia computerizzata al torace e all'addome (surreni), la risonanza magnetica (soprattutto i distretti encefalici) e la scintigrafia ossea.[130]
La terapia del carcinoma del polmone dipende dal tipo cellulare, dall'estensione della malattia e dalle condizioni di salute del paziente (valutabili con l'indice di Karnofsky). I trattamenti comuni includono chirurgia, chemioterapia e radioterapia.[159]


Una volta confermata la presenza di neoplasia, la tomografia computerizzata e a emissione di positroni sono strumenti necessari per la valutazione di resecabilità del tumore (eliminazione della maggior quantità possibile di tumore), condizionata dall'estensione, dall'infiltrazione degli organi vicini e dalla presenza di metastasi. Elementi che invece influenzano l'operabilità (sopravvivenza e qualità di vita del paziente in seguito all'operazione) possono essere gli esami del sangue e la spirometria: mentre i primi possono indicare la presenza di comorbidità come il diabete, l'insufficienza respiratoria o l'insufficienza renale, la spirometria è in grado di valutare in maniera semplice e rapida la presenza di gravi BPCO, condizione che rappresenta una notevole limitazione alla chirurgia. Analogamente, deve essere effettuato un profilo elettrocardiografico al fine di valutare la presenza di aritmie o altre patologie cardiache.
La chirurgia toracica (con accesso toracotomico, vedi immagine) per il carcinoma del polmone ha un tasso di mortalità totale del 4,4%, strettamente correlato alla funzione polmonare e alla presenza di altri fattori di rischio.[160] La chirurgia rappresenta il primo presidio terapeutico nei NSCLC confinati a un polmone e fino allo stadio IIIa[161] (la stadiazione si assegna pre-operatoriamente attraverso la tomografia computerizzata e a emissione di positroni). Inoltre, deve essere valutata la capacità respiratoria in modo da poter predire la funzionalità residua in seguito all'intervento chirurgico.
Le procedure chirurgiche comprendono la resezione atipica[162](wedge resection rimozione del tessuto neoplastico e di piccola parte del parenchima polmonare che lo circonda), la segmentectomia (rimozione di una sezione di parenchima ventilato da un bronco segmentale), la lobectomia (rimozione di un lobo intero), la bilobectomia (rimozione di due lobi) e la pneumonectomia (rimozione dell'intero polmone). Nei pazienti con riserva funzionale adeguata, la lobectomia costituisce l'opzione di scelta, in quanto minimizza la possibilità locale di recidiva. Nei pazienti che non hanno un'adeguata riserva funzionale, la wedge resection costituisce una valida alternativa.[163] La brachiterapia con frammenti di iodio applicata ai margini dell'escissione wedge può ridurre il tasso di recidiva con risultati comparabili alla lobectomia.[164]
La chirurgia toracica video assistita (VATS = Video-Assisted Thoracic Surgery) (approccio mini-invasivo) e le procedure di lobectomia condotte con questo metodo possono presentare vantaggi nel più rapido recupero post-operatorio, nella più breve degenza e nei diminuiti costi da parte dell'ospedale.[165]
La presenza di tumore polmonare confinato e associato a nodulo surrenale solitario metastatico può in alcuni casi essere trattato con associazione di interventi chirurgici finalizzati sia alla rimozione del tumore primitivo sia della metastasi, con buoni tassi di sopravvivenza.[166] È stato inoltre dimostrato[167] che nei soggetti con metastasi surrenali sincrone o metacrone, la surrenectomia costituisce un intervento che può aumentare la sopravvivenza a 5 anni nei soggetti con tumore polmonare avanzato.


Il carcinoma polmonare a piccole cellule viene trattato primariamente con la chemioterapia e la radioterapia, poiché la chirurgia non ha dimostrato influenzare la sopravvivenza, benché alcune ricerche abbiano dimostrato che pazienti con SCLC confinato e senza coinvolgimento linfonodale risultino trarre giovamento in termini di sopravvivenza con l'associazione di chirurgia e chemioterapia.[168][169][170]
La chemioterapia rappresenta anche il primario approccio terapeutico in caso di NSCLC metastatico.
La combinazione di regime dipende dal tipo di tumore. Spesso i carcinomi non a piccole cellule vengono trattati con cisplatino o carboplatino in combinazione con gemcitabina, paclitaxel, docetaxel, etoposide o vinorelbina.[171] Nel carcinoma a piccole cellule sono comunemente usati il cisplatino e l'etoposide.[172] Possono essere anche usate le combinazioni con carboplatino, gemcitabina, paclitaxel, vinorelbina, topotecano ed irinotecano.[173][174] In caso di malattia diffusa, il celecoxib può essere associato in maniera sicura con l'etoposide, migliorando i risultati in termini di sopravvivenza rispetto alle precedenti combinazioni.[175]
Questo termine indica l'uso di chemioterapia in associazione contemporanea con altre terapie, come la chirurgia e la radioterapia. Durante le procedure chirurgiche devono essere prelevati i linfonodi; se in seguito all'esame istologico risultassero positivi per presenza di cellule neoplastiche, il tumore viene classificato in stadio II o III (in base al gruppo colpito). In questa situazione, la chemioterapia adiuvante può incrementare il tasso di sopravvivenza del 15%,[176][177] soprattutto se vengono usati farmaci contenenti platino, come il cisplatino e il carboplatino.[178]
L'uso di questo schema chemioterapico nei pazienti in stadio Ib è invece controverso, poiché le prove cliniche non hanno ancora dimostrato un beneficio in termini di sopravvivenza.[179][180] I test di valutazione in termini di sopravvivenza per la chemioterapia pre-operatoria (chemioterapia neoadiuvante) nei tumori completamente resecabili non sono stati finora conclusivi.[181]
La radioterapia è spesso associata alla chemioterapia nei pazienti con carcinoma polmonare non a piccole cellule che non possono essere sottoposti all'intervento chirurgico. Questa forma di radioterapia è chiamata radioterapia radicale.[182] Un perfezionamento di questa tecnica è la radioterapia continua accelerata iperfrazionata (CHART), nella quale un'elevata dose è somministrata in un breve periodo di tempo.[18] Nei casi di carcinoma polmonare a piccole cellule potenzialmente curabili, l'irradiazione del torace è raccomandata in associazione alla chemioterapia.[183] L'uso della radioterapia adiuvante per i NSCLC è ancora controverso, benché diversi benefici siano stati documentati nei tumori con coinvolgimento dei linfonodi mediastinici.[184][185]
Sia per i NSCLC sia per i SCLC, i pazienti possono trarre giovamento per il controllo del dolore e dei sintomi attraverso piccole dosi di radioterapia (radioterapia palliativa).
La brachiterapia (radioterapia localizzata) può avere un effetto diretto nei tumori confinanti a una piccola sezione di bronco.[186] Può essere inoltre usata quando un tumore inoperabile causa l'ostruzione di una via aerea di grandi dimensioni.[187]
La somministrazione di terapia radiativa craniale profilattica (PCI) ai pazienti con SCLC in stadio limitato è spesso usata per ridurre il rischio di metastasi in tal sede.[188] Più recentemente, la PCI ha dimostrato analoghi benefici nei soggetti con malattia avanzata.[189] Nei pazienti di cui il cancro è migliorato dopo un ciclo di chemioterapia, la PCI è indicata per ridurre il rischio cumulativo di metastasi al cervello a un anno dal 40,4% al 14,6%.[190]
I recenti miglioramenti nell'ottimizzazione e nella formazione dell'immagine radiografica hanno condotto allo sviluppo di tecniche di radioterapia stereotassica per il trattamento di carcinoma del polmone in fase iniziale. Questa metodica viene primariamente utilizzata in quei soggetti che, presentando co-morbidità, non possono essere candidati all'exeresi chirurgica.[191]
L'ablazione con radiofrequenza è una tecnica che rappresenta un'alternativa per il trattamento di neoplasie polmonari primitive e secondarie, nei pazienti che, per le scarse condizioni cliniche generali, non possono essere sottoposte a intervento chirurgico. La procedura consiste nell'inserimento sotto guida TC o ecografica di un agoelettrodo all'interno della lesione. Questo agoelettrodo è costituito da uncini che si dispiegano così all'interno della lesione stessa determinando un'area di necrosi coagulativa.[192] [193]

Sono stati sviluppati vari farmaci mirati (targeted therapy) per il trattamento del carcinoma del polmone. Il gefitinib ha come bersaglio i domini tirosin chinasici del recettore del fattore di crescita dell'epidermide (EGFR), iperespresso o mutato in modo da essere costitutivamente attivo nelle diverse forme di carcinoma polmonare non a piccole cellule. Benché diverse prove abbiano dimostrato che il farmaco non sia in grado di migliorare i profili di sopravvivenza a 5 anni, il gefitinib dimostra una buona efficacia nel trattamento del carcinoma bronchioloalveolare in donne non fumatrici di origine asiatica.[194][195] Successivamente è stato scoperto che i principali fattori predittivi di risposta a questi inibitori sono gli stati mutazionali dei geni EGFR e Ras. Bisogna quindi verificare che il primo possegga mutazioni attivanti (in quanto il gene mutato si è visto essere più sensibile ai farmaci) e il secondo no (in quanto il segnale inibitorio verso il nucleo non verrebbe trasmesso)
L'erlotinib, un altro inibitore dei domini tirosin chinasici, si è dimostrato efficace in termine di aumento del tasso di sopravvivenza nei pazienti con NSCLC[196] ed è attualmente considerato dalla Food and Drug Administration come trattamento di seconda linea nelle neoplasie avanzate. Analogamente al gefitinib, ha dimostrato una maggiore efficacia nel trattamento del carcinoma bronchioloalveolare in donne non fumatrici di origine asiatica.[195]
L'associazione di paclitaxel e carboplatino con bevacizumab, un inibitore dell'angiogenesi, migliora il tasso di sopravvivenza nei pazienti con NSCLC in stadio avanzato,[197] benché il suo uso sia connesso a un aumento del rischio di sanguinamento polmonare soprattutto nei soggetti con carcinoma polmonare a cellule squamose.
Ricerche e studi in future terapie focalizzano l'attenzione su nuovi farmaci citotossici,[198] sulla farmacogenetica[199] e sulla ingegneria farmaceutica in grado di "disegnare" nuove molecole specifiche.[200] Alcune terapie mirate, come quelle a base di inibitori della COX-2,[201] di exisulind (uno stimolatore dell'apoptosi),[202] di inibitori della proteasi,[203] di bexarotene[204] e di alcuni vaccini,[205] sono ancora oggetto di studi preliminari. Le future aree di ricerca includono lo studio degli inibitori del protoncogene Ras, degli inibitori della PI3K, degli inibitori della deacetilasi degli istoni e dei farmaci in grado di sostituire gli oncosoppressori.[206]

La prognosi viene basata sul tipo istologico e sulla stadio del tumore. Il carcinoma polmonare a piccole cellule ha una prognosi infausta, benché interventi di radioterapia e chemioterapia mirata nella forma localmente delimitata siano in grado di aumentare la sopravvivenza a 5 anni fino al 5%.[208] Nelle forme di carcinoma polmonare non a piccole cellule la sopravvivenza dipende soprattutto dalla classificazione, benché deve essere sempre considerata la presenza di patologie concomitanti e l'indice di Karnofsky calcolato per il paziente in osservazione. Nell'immagine a fianco sono messe a confronto le curve di sopravvivenza per la classificazione (o stadiazione) clinica (cTNM), ovvero basata sui reperti strumentali pre-operatori come la tomografia computerizzata, la tomografia ad emissione di positroni e la videotoracoscopia, e quella per la stadiazione patologica (pTNM), basata sull'analisi anatomo-patologica e microscopica delle stazioni linfonodali e dei frammenti prelevati in seguito all'intervento di chirurgia toracica. Come è possibile notare, è presente una notevole discrepanza tra i due metodi di classificazione: questo significa che la stadiazione operata su valutazione clinica (cTNM, pre-operatoria) sottovaluta la reale estensione della neoplasia[207], ad esempio un IIb clinico ha lo stesso indice di sopravvivenza di una IIIa anatomo-patologico. Ulteriori elementi prognosticamente sfavorevoli sono la presenza di sindromi paraneoplastiche come la sindrome di Cushing, la sindrome da inappropriata secrezione di ADH e l'ipercalcemia. Quest'ultima, unitamente alla presenza di iperkaliemia da lisi neoplastica e all'insufficienza renale, può aggravare il quadro patologico per lo sviluppo di gravi quadri aritmici.[135] La comparsa di sindromi mediastiniche come disfonia, disfagia, grave dispnea e sindrome della vena cava superiore testimoniano la presenza di una malattia estesa, con rapida evoluzione verso l'exitus.[209] La presenza di polmonite da ostruzione, atelectasia e versamento pleurico sono condizioni che, oltre a condizionare la stadiazione e quindi la prognosi, rappresentano ulteriori condizioni di comorbidità che devono essere trattate con terapie specifiche e mirate.[157]
|
Per definizione, le misure preventive hanno come scopo l'eliminazione dei fattori eziologici e dei fattori di rischio. In questa ottica, la misura preventiva più efficace per ridurre l'incidenza di carcinoma del polmone è ridurre al minimo l'esposizione al fumo di sigaretta, sia esso attivo o passivo.[210] In seguito alle evidenze mostrate dagli studi citati in precedenza, risulta essere molto importante prevenire l'esposizione al fumo soprattutto nei soggetti giovani.[41] Negli Stati Uniti d'America, il Centers for Disease Control, un ente che si occupa del controllo e della prevenzione delle malattie, ha proposto diversi programmi di prevenzione.[211]
A partire dal 1998, negli stati occidentali degli USA come la California sono state prese numerose misure per diminuire l'esposizione al fumo passivo nei luoghi pubblici. In seguito, analoghe misure sono state prese in Europa, con l'Irlanda nel 2004, l'Italia e la Norvegia nel 2005, la Scozia nel 2006, l'Inghilterra nel 2007 e la Francia nel 2008. La Nuova Zelanda ha cominciato ad applicare misure contro il fumo nei luoghi pubblici nel 2004. Nello Stato del Bhutan, dal 2005, è in vigore una legge che impone il completo divieto di fumo.[212] In molti paesi, gruppi attivi nella lotta contro il fumo stanno facendo una campagna per simili divieti. Nel 2007, Chandigarh è diventato la prima città indiana a diventare "senza fumo". L'India ha introdotto un divieto totale di fumo ai luoghi pubblici il 2 ottobre 2008.
Tuttavia, una politica eccessivamente tesa al proibizionismo nei confronti del fumo di tabacco si è dimostrata essere positivamente correlata allo sviluppo di attività criminali di contrabbando, il che ha portato a porre un limite allo sviluppo di decreti legislativi troppo restrittivi.[213]
Nel 2008, uno studio condotto su oltre 77000 soggetti adulti ed anziani ha dimostrato che l'utilizzo protratto di integratori multivitaminici contenenti folati, vitamina C e vitamina E non è in grado di prevenire l'incidenza di carcinoma del polmone. Inoltre, è stato osservato che un uso intenso di vitamina E, soprattutto se condotto per lunghi periodi, è associato ad un aumento del rischio per lo sviluppo di carcinoma del polmone.[214]
L'Organizzazione mondiale della sanità ha richiesto ai governi di eliminare completamente la pubblicità riguardanti il tabacco per prevenire che i giovani inizino a fumare, sostenendo che, nei paesi in cui queste misure sono già state prese, il consumo di tabacco si è già ridotto del 16%.[215]
Per limitare l'esposizione al radon è possibile effettuare un controllo della quantità di questo gas nella propria abitazione tramite la sede ARPA più vicina.
Lo scopo dello screening è quello di identificare le malattie presenti in una comunità in una fase precoce, permettendo così di giungere ad interventi terapeutici tempestivi ed alla gestione standardizzata della terapia al fine di ridurre in maniera significativa la mortalità. In questo senso, in Italia gli screening oncologici sono rivolti all'identificazione precoce del cancro della mammella, del cancro del colon-retto e del cancro della cervice uterina.[216] Per il carcinoma del polmone il discorso è invece più complesso[217]: lo screening in soggetti a rischio asintomatici svolto mediante l'esame citologico dell'espettorato, la radiografia del torace e la tomografia computerizzata non è sufficiente a garantire una riduzione della mortalità per carcinoma del polmone.[218] Nel 2004, sulla base di queste evidenze la US Preventive Services Task Force ha affermato che i risultati a lungo termine dello screening sulla mortalità per carcinoma del polmone non sono sufficienti per istituire un programma nazionale basato sulle metodiche di indagine prese in considerazione.[219] Nel 2007 anche l'American College of Chest Physicians ha raccomandato di non eseguire esami di screening per il carcinoma del polmone a causa della mancanza di efficacia sulla riduzione del tasso di mortalità.[220]
Nel 2006, la International Early Lung Cancer Action Project (I-ELCAP) ha pubblicato i risultati di uno screening fondato sulla metodica TC spirale a basse dosi applicato su 31.000 soggetti ad alto rischio.[221] Furono diagnosticate 484 neoplasie polmonari; tra queste, circa l'85% era in stadio I (neoplasie di piccolo diametro completamente resecabili con una sopravvivenza a 10 anni dell'88%). Sono state mosse diverse critiche allo studio I-ELCAP:
In Giappone, lo screening basato sulla metodica TC a basse dosi è stato comparato allo screening basato sulla radiografia del torace.[222][223][224] Da questi studi è risultato che:
Uno studio di 5 anni pubblicato nel 2005 ha ulteriormente dimostrato la validità della TC spirale a basse dosi, pur evidenziando l'elevato numero di falsi positivi (96% per tutte le formazioni nodulari, 92% per i noduli superiori a 4 mm).[225]
In contrasto, nel marzo 2007, uno studio pubblicato nel Journal of the American Medical Association ha dimostrato l'assenza di benefici sulla mortalità dello screening basato sulla metodica TC a bassi dosi.[226][227]
Mediante un dispositivo simile a quello utilizzato nel breath test per la ricerca di Helicobacter pylori è possibile "intrappolare" ed analizzare le proteine emesse dal soggetto durante l'espirazione: successive analisi fondate sulle moderne tecniche di proteomica consentono di ricavare un profilo qualitativo e quantitativo di queste proteine. Questa metodica è volta a ricercare modificazioni nella tipologia o nella quantità di proteine che possano essere correlate con la presenza di alterazioni neoplastiche delle strutture polmonari, anche qualora siano ancora in uno stato iniziale. Benché siano necessarie altre prove di efficacia, alcuni studi hanno dimostrato come la metodica non-invasiva dell'analisi dell'esalato possa garantire un'elevata sensibilità con costi esigui e rapidità di indagine.[228]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.