Timeline
Chat
Prospettiva
Acido ascorbico
vitamina Da Wikipedia, l'enciclopedia libera
Remove ads
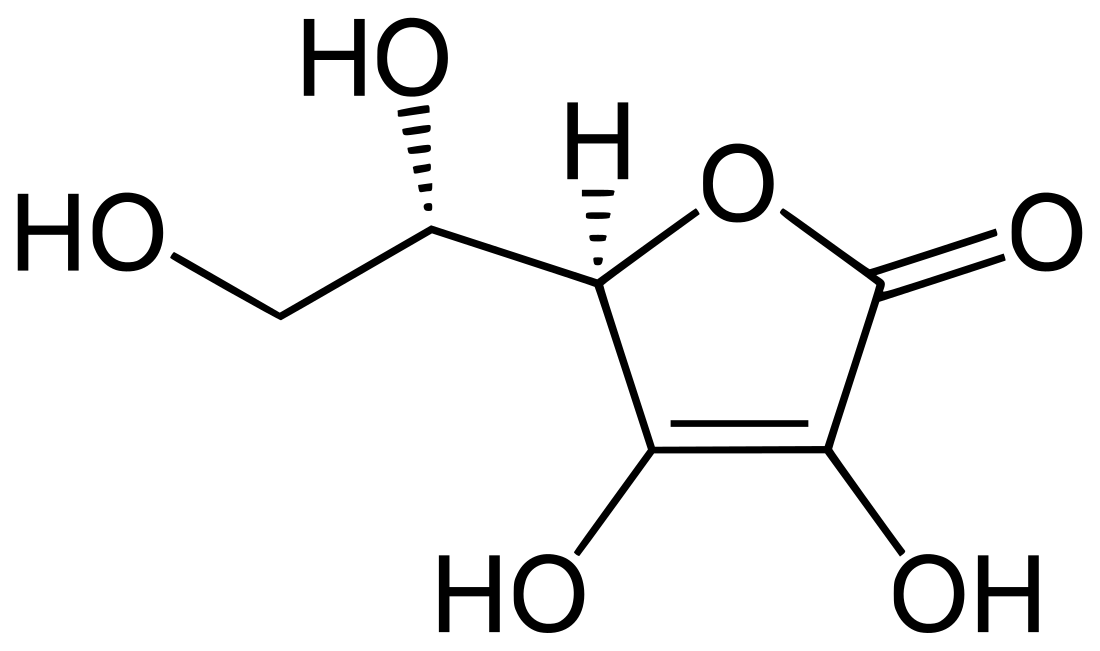
L'acido L-ascorbico (L-AA), acido ascorbico, principio antiscorbutico o semplicemente vitamina C, è un composto chimico di formula C6H8O6 che in condizioni normali si presenta come una polvere cristallina di colore tra il bianco e il giallo pallido dal gradevole gusto acido e quasi completamente inodore.[3]
Remove ads



Remove ads
Storia
Riepilogo
Prospettiva
La sua storia si riallaccia a quella dello scorbuto, una patologia legata a una carenza di questo composto nella dieta. Questa malattia era già descritta nella medicina greca attorno al V secolo a.C. Nel XVI secolo, soprattutto tra le popolazioni marinare, era noto come lo scorbuto potesse essere curato e prevenuto dall'assunzione di verdure e frutta fresca, o dall'estratto di aghi di pino.[4]
Tuttavia la prima prova di ciò venne nel maggio del 1747 da parte di James Lind, un chirurgo della marina reale inglese. Lind sottopose a un esperimento 12 membri dell'equipaggio affetti da scorbuto, dividendoli in sei gruppi da due persone ciascuno. A ogni gruppo fece assumere, oltre alle normali razioni alimentari, un composto particolare: sidro, acido solforico, aceto, spezie ed erbe, acqua di mare, arance e limoni. I risultati ottenuti permisero di dimostrare che effettivamente quest'ultima aggiunta permetteva di prevenire l'insorgere dello scorbuto. Lind pubblicò i risultati di questo studio nel 1753. Nel 1795 la marina inglese stabilì di aggiungere succo di limone o di lime alla dieta dei marinai.[5]
Nel XVIII e XIX secolo venne usato il termine di antiscorbutico per tutti quei cibi che erano in grado di prevenire la comparsa dello scorbuto. Tra essi, oltre ai limoni, alle arance e ai lime, vi sono: i crauti, il cavolo salato, il malto e il brodo portatile. Pare che James Cook per il suo primo famoso viaggio d'esplorazione nel Pacifico abbia utilizzato i crauti.[6][7]
Nel 1912 Casimir Funk, da studi su malattie carenziali, ipotizzò la presenza di composti che denominò vitamine. Sebbene avesse studiato soprattutto il beri-beri, ipotizzò che anche altre malattie, tra cui lo scorbuto, dipendessero da mancanza di specifiche vitamine.[8]
Nel 1921 il composto antiscorbutico venne denominato vitamina C e tra il 1928 e 1933 fu isolato e cristallizzato da Joseph Svirbely e dall'ungherese Albert Szent-Gyorgyi Von Nagyrapolt e, in modo indipendente, da Charles Glen King.[9] Nel 1934 Sir Walter Norman Haworth e Tadeusz Reichstein, in maniera indipendente, riuscirono a sintetizzare la vitamina C. Nel 1937 Szent-Gyorgyi ricevette il Premio Nobel per la medicina per le sue scoperte sui processi biologici di combustione, con particolare riguardo alla vitamina C, e alla catalisi dell'acido fumarico. Lo stesso anno Haworth venne insignito del Premio Nobel per la chimica.[10]
Nel 1955 J.J. Burns scoprì che il motivo per cui alcuni mammiferi, compresa la specie umana, non riescono a produrre autonomamente la vitamina C risiede nella mancanza dell'ultimo enzima della catena metabolica responsabile della sintesi di tale molecola: la L-gulonolattone ossidasi.[11]
Remove ads
Caratteristiche strutturali e fisiche
Dal punto di vista strutturale l'acido l-ascorbico ricade nella classe dei lattoni,[3] si tratta dell'enantiomero L dell'acido ascorbico e l'acido coniugato dell'L-ascorbato.[12] In particolare si tratta di un composto a sei atomi di carbonio correlato al glucosio.[13] Il composto risulta solubile in acqua,[3] insolubile in etere, cloroformio, benzene, etere di petrolio, oli, grassi, solventi grassi,[14] etanolo, glicerolo e propanolo.[15]
| N. donatori di legami a idrogeno | 4 | |
| N. accettori di legami a idrogeno | 6 | |
| N. atomi pesanti | 12 | |
| N. elementi stereogenici | 2 | |
| N. legami ruotabili | 2 | |
| Superficie polare | 107 Ų | |
| Sezione d'urto[17][18] | [M+Na]+ | 141,6 Ų |
| [M-H]- | 127,7 Ų | |
| [M+H]+ | 138,6 Ų | |
| Massa monoisotopica | 176,03208797 u | |
| Densità[16] | 1,65 g/cm³ a 25 °C |
| Gravità specifica[3] | 1,65 |
| Tensione superficiale[19] | 4,039 x 10-2 N/m |
| Potere rotatorio[20] | [α]D/20 tra + 20,5° e + 21,5° (10 % w/v soluzione acquosa) |
| Punto di fusione[16] | 191°C |
| Entalpia di vaporizzazione[19] | 1,487x10+8 J/kmol a 465,.15 K |
| pH[21] | 2,4 - 2,8 |
Remove ads
Abbondanza e disponibilità
Riepilogo
Prospettiva
L'acido ascorbico viene sintetizzato dagli eucarioti, con l'eccezione nota dei primati (incluso l'uomo) e di alcuni altri gruppi animali che hanno perso la funzionalità dell'enzima gulonolattone ossidasi.[22] L'incapacità di sintetizzare la vitamina C è dovuta a mutazioni casuali nel gene GULO, che codifica l'enzima omonimo responsabile della catalizzazione dell'ultimo passaggio della biosintesi della vitamina C.[23][24] I procarioti non sintetizzano ascorbato e non necessitano di un apporto di questo composto che viene sostituito da altri.[22]
Il percorso dell'acido uronico consente alla maggior parte delle piante e degli animali di sintetizzare l'ascorbato a partire da glucosio o galattosio attraverso l'azione della gluconolattone ossidasi.[25] Il corpo umano ha sviluppato un efficace sistema di adattamento che mantiene le riserve organiche di vitamina C e ne previene la carenza a causa di un basso apporto dietetico. Questi adattamenti includono una maggiore capacità di assorbimento e riciclo della vitamina C rispetto ad altre specie animali (es. capra e rettili), che sono normalmente in grado di produrla.[26][27]
L'acido ascorbico e l'acido deidroascorbico sono presenti in tutte le piante, ma il loro contenuto varia notevolmente tra le diverse piante e specie.[28] La stabilità della vitamina C negli alimenti dipende da numerosi fattori, come la composizione del prodotto, il contenuto di ossigeno, il valore del pH e i metodi di lavorazione.[29] Nei prodotti ortofrutticoli freschi, la quantità di DHAA è inferiore al 10%, ma tende ad aumentare durante la conservazione.[30]
La degradazione della vitamina C può avvenire attraverso percorsi anaerobici e aerobici. La degradazione aerobica può verificarsi durante la lavorazione degli alimenti, mentre la degradazione anaerobica potrebbe verificarsi durante la conservazione.[30] La cottura può comportarne perdita, in alcuni casi fino al 75%, che può essere ridotta adottando una cottura il più rapida possibile.[31]
Sintesi del composto
Riepilogo
Prospettiva
La sintesi dell'acido ascobico inizia dalla sintesi classica di Reichstein - Grüssner inizia con la riduzione del D-glucosio a D-sorbitolo mediante idrogenazione su un catalizzatore di nichel. Segue l'ossidazione microbiologica del D-sorbitolo a L-sorbosio effettuata con A. xylinum. Il trattamento del L-sorbosio con acetone a bassa temperatura in presenza di acido solforico porta alla formazione di 2,3:4,6-di-O-isopropilidene-alfa-L-sorbofuranosio.[32]
La protezione del di-O-isopropilidenile dei gruppi ossidrilici in C-2, C-3 e C-4, C-6 consente un'ossidazione ad alta resa in acido di-O-isopropilidene-2-cheto-gulonico, evitando sovra-ossidazioni o altre reazioni indesiderate. L'ossidazione viene eseguita con permanganato di potassio in soluzione alcalina.[32]
Segue il trattamento dell'acido di-O-isopropilidene-2-cheto-gulonico con acqua calda che produce acido 2-cheto-L-gulonico, il quale viene convertito in acido L-ascorbico mediante riscaldamento in acqua a 100 °C (resa del 20%) oppure per esterificazione e successivo trattamento con metossido di sodio in metanolo seguito da acidificazione con acido cloridrico, ottenendo circa il 70% di acido L-ascorbico. La resa complessiva di acido ascorbico a partire da D-glucosio è pari al 15-18%.[32]
Remove ads
Reattività e caratteristiche chimiche
Riepilogo
Prospettiva
Esistono due tipi di acido ascorbico suddivisi in forme ossidate e ridotte: l'ascorbato è la forma ridotta, mentre l'acido deidroascorbico (DHAA) è la forma ossidata.[25]
Questa vitamina in condizioni fisiologiche e a pH 7 si trova in forma dissociata, cioè di riducente monoelettrico, questo perché il gruppo - OH enolico legato al C2 dell'anello lattonico, possiede una pKa di 4,2 che lo rende debolmente acido.[33] La capacità dell'ascorbato di donare elettroni gli permette di agire come un agente di eliminazione dei radicali liberi e di ridurre stati di ossidazione più elevati del ferro a Fe²⁺. Queste reazioni costituiscono la base della sua attività biologica, insieme alla relativa stabilità del radicale monodeidroascorbato stabilizzato per risonanza.[22]
L'acido ascorbico è facilmente ossidato da ossigeno, alcali e alte temperature.[25] Reagisce come un agente riducente relativamente forte e decolora molti coloranti. Forma sali metallici stabili. Incompatibile con ossidanti, coloranti, alcali, ferro e rame. Incompatibile anche con sali ferrici e sali di metalli pesanti, in particolare rame, zinco e manganese.[3]
Spettri analitici
Ne sono disponibili i seguenti spettri analitici:
Determinazione analitica
Titolazione con diclorofenolindofenolo (DCPIP)
Questo metodo sfrutta il potere riducente della vitamina C e utilizza il 2,6-diclorofenolindofenolo (DCIP) come indicatore redox per la determinazione dell'acido ascorbico. Il principio di questo metodo consiste in una titolazione dell'acido ascorbico con diclorofenolindofenolo. L'acido ascorbico reagisce con il DCPIP, cambiando colore da blu a incolore. I campioni alimentari vengono estratti utilizzando acido metafosforico (MPA) e il pH viene regolato a 1,2. L'estratto viene quindi titolato con 2,6-diclorofenolindofenolo.[42]
Il punto finale di questa titolazione si raggiunge quando la soluzione assume una colorazione rosa dovuto all'eccesso di colorante non ridotto in soluzione acida. Nel caso di estratti intensamente colorati, si effettua un'estrazione ripetuta con etere per facilitare la rilevazione del punto finale.[43]
Metodo iodometrico
È possibile determinare la quantità di vitamina C in diverse sostanze attraverso l'utilizzo del reattivo di Lugol. la reazione che avviene tra i due composti è:[44]
Lo iodio ossida con facilità l'acido ascorbico convertendolo in acido deidroascorbico. Nelle analisi quantitative il campione di acido ascorbico viene trattato con una quantità nota di iodio superiore a quella necessaria a ossidare l'intero campione; l'eccesso di iodio non reagito viene quindi retrotitolato con una soluzione a concentrazione nota di tiosolfato di sodio. Questa tecnica può essere applicata a compresse di vitamina C, succhi di frutta freschi o confezionati, frutti solidi e verdure.[44]
Spettrofotometria UV
La spettrofotometria UV è il metodo prevalentemente utilizzato per determinare al concentrazione dell'acido ascorbico, poiché il composto è in grado di assorbire i raggi UV ed è un metodo semplice. Questa tecnica può essere applicata a compresse di vitamina C, succhi di frutta freschi o confezionati, frutti solidi e verdure.[45]
Possono essere utilizzate tre metodiche:
- il metodo della 2,4-dinitrofenilidrazina (2,4-DNPH)[46]
- la valutazione della riduzione dell'assorbanza di una soluzione di permanganato di potassio quando reagisce con una soluzione di vitamina C in ambiente acido:[47]
- il metodo enzimatico: l'ascorbato ossidasi catalizza l'ossidazione dell'acido ascorbico in acido deidroascorbico. Il DHAA formato reagisce con o-fenilendiammina per produrre 2,2-anidrochinoxalina di cui si osserva l'assorbimento rispetto a un bianco appositamente preparato viene osservato a 358 nm. L'aumento dell'assorbanza della chinoxalina è un indicatore della quantità di acido ascorbico presente che ha reagito con l'ossigeno in presenza di ascorbato ossidasi.[30]
HPLC
La preparazione e l'estrazione del campione sono passaggi importanti per minimizzare la degradazione dell'AA. L'MPA è il reagente più comunemente utilizzato, poiché può funzionare sia come agente estrattivo che stabilizzante. Inibisce l'ascorbato ossidasi, la catalisi dei metalli e precipita le proteine. L'MPA può essere usato con altri acidi organici e modificatori come acido acetico, metanolo, ecc., oltre a stabilizzanti come l'EDTA e il glutammato monosodico (MSG). L'AA ha una stabilità maggiore nell'MPA rispetto all'acido ossalico e all'acido tricloroacetico. L'analisi dei campioni liquidi viene effettuata iniettando direttamente il campione nell'HPLC dopo la diluizione con la fase mobile iniziale.[30]
Metodo microfluorimetrico
Questo metodo prevede che i campioni alimentari vengono prima estratti in soluzioni di MPA.[42] L'acido ascorbico negli estratti viene ossidato a DHAA con carbone attivo. Gli aliquoti vengono quindi fatti reagire con o-fenilendiammina per ottenere un derivato fluorescente della chinoxalina attivato a 350 nm, fluoresce a 430 nm. Per ogni campione alimentare analizzato, viene analizzato un campione in bianco specifico mediante l'aggiunta di acido borico.[43]
Voltammetria
Tra gli elettrodi comunemente utilizzati per la determinazione elettrochimica dell'acido ascorbico nelle formulazioni farmaceutiche e nei succhi di frutta troviamo:
- elettrodi di platino[48]
- elettrodi di platino ricoperti di iodio[46]
- elettrodi in carbonio vetroso ricoperto con un film di cellulosa modificata[49]
- elettrodi di carbonio vetroso modificato con nanotubi di carbonio multi parete[50]
- elettrodi di carbonio vetroso modificato con nanotubi di carbonio multi-strato/tetradeciltrimetilammonio bromuro[45]
- elettrodi di carbonio vetroso modificato con nanoparticelle di argento/PVP[51]
Composti
- Acido deidroascorbico (DHAA)
- Palmitato di ascorbile
- 6-deossi-L-AA
- 2-fosfato-L-AA[52]
- Idrossimetilfurfurale[30]
Remove ads
Biochimica
Riepilogo
Prospettiva
Gli studi sugli animali hanno dimostrato che la vitamina C viene preferenzialmente immagazzinata nel cervello, nelle ghiandole surrenali, nel fegato e nei polmoni,[53][54] ma i suoi livelli in questi organi si esauriscono rapidamente dopo circa una settimana di insufficienza dietetica.[55] Negli esseri umani, i muscoli scheletrici rappresentano la principale riserva di vitamina C.[56] Le fibre muscolari perdono anch'esse il contenuto di vitamina C molto rapidamente in caso di apporto dietetico insufficiente. Tuttavia, il consumo di metà di un kiwi al giorno sembra essere sufficiente per saturare le concentrazioni di vitamina C nei tessuti muscolari negli uomini non fumatori.[57]
È un potente agente riducente e antiossidante che agisce nella lotta contro le infezioni batteriche, nelle reazioni disintossicanti e nella formazione di collagene nel tessuto fibroso, nei denti, nelle ossa, nel tessuto connettivo, nella pelle e nei capillari.[58] Funziona come coenzima in diverse vie metaboliche.[13]
L'acido ascorbico è essenziale per la sintesi e il metabolismo della vitamina B9 e della tirosina. La prolina e la glicina vengono anch'esse idrossilate con il suo aiuto. Facilita il metabolismo delle catecolamine, della carnitina e della lisina. Inoltre, l'acido ascorbico favorisce la conversione del colesterolo in acidi biliari, riducendo i livelli di colesterolo nel sangue. Come antiossidante, l'acido ascorbico aiuta a difendere il corpo dagli effetti negativi delle tossine, degli inquinanti e dei radicali liberi.[25]
Inoltre sembra che la vitamina C possa diminuire la formazione di nitrosammine intestinali e ridurre vari composti ossidanti tra cui il radicale superossido, l'acido ipocloroso e i radicali idrossilici. Recenti studi sull'acido ascorbico indicano che può ridurre il tempo di ventilazione nei pazienti in condizioni critiche.[59]
La carenza di vitamina C determina la comparsa dello scorbuto, patologia che riguarda particolarmente l'insufficiente produzione di collagene e di sostanza cementante intercellulare. Ciò determina alterazioni a livello dei vasi sanguigni con comparsa di emorragie, rallentamento della cicatrizzazione delle ferite, gengiviti con alterazioni della dentina, gengivorragie e osteoporosi. Nei bambini si ha anche un arresto della crescita. Le varie emorragie sviluppantesi possono portare a un quadro di anemia sideropenica.[60]
Bassi livelli di acido ascorbico sufficienti alla sopravvivenza, ma al di sotto di quelli necessari, sembrano favorire l'aterosclerosi, sia per l'ipotesi ossidativa sia per l'ipotesi risposta alla lesione. Per la scarsità di vitamina C nell'organismo si instaurano situazioni come la progressiva crescita dell'azione devastante dello stress ossidativo e dei radicali liberi sulle pareti cellulari vascolari e/o il progressivo impoverimento e cedimento di collagene nelle pareti cellulari vascolari che venendo tamponato da derivati delle α-lipoproteine produce, col progressivo accumulo, l'aterosclerosi e, di conseguenza, tutte le altre pericolosissime sue patologie derivate a cascata.[60]
Remove ads
Farmacologia e tossicologia
Riepilogo
Prospettiva
Le indicazioni sulla quantità giornaliera consigliata di vitamina C sono:
- 30 mg/die per il Codex Alimentarius
- 40 mg/die in Regno Unito (Food Standards Agency)[61]
- 45 mg/die per l'OMS-WHO[62]
- 60 mg/die in Canada[63]
- 75–120 mg/die per gli adulti, 2 g/die come limite di tolleranza: Food and Nutrition Board, Institute of Medicine, National Academy of Sciences, Ministero della Salute, USA.[64]
Farmacocinetica
L'omeostasi della vitamina C è finemente regolata da almeno quattro meccanismi: assorbimento intestinale, trasporto nei tessuti, riassorbimento renale ed escrezione urinaria, regolati principalmente da una famiglia di proteine chiamate trasportatori della vitamina C dipendenti dal sodio (SVCT).[65] Considerando la variabilità individuale nei soggetti sani, gli studi suggeriscono che un'assunzione giornaliera di vitamina C da 100 a 400 mg garantisce il 100% della biodisponibilità e della saturazione sanguigna con uno stato stabile della concentrazione plasmatica che raggiunge un livello massimo di circa 70–80 µmol/L.[66][67]
In generale, se l'assunzione di vitamina C supera i 500 mg/giorno, un ulteriore aumento della concentrazione plasmatica viene inibito e la biodisponibilità può diminuire fino al 30% quando vengono somministrati più di 1.000 mg di vitamina C in una singola dose.[68] Questo accade perché, quando vengono somministrati per via orale 500–1.000 mg di vitamina C, il trasportatore intestinale (SVCT1) raggiunge rapidamente la sua saturazione massima, mentre l'escrezione urinaria aumenta progressivamente.[67][68]
La misurazione della concentrazione plasmatica di vitamina C può essere considerata, anche se i valori circolanti non possono essere utilizzati come un indicatore affidabile delle riserve corporee (circa 5 g).[69] Un valore di concentrazione plasmatica di vitamina C inferiore a 23 μmol/L riflette un esaurimento delle riserve di vitamina C (stato di ipovitaminosi), mentre i sintomi clinici dello scorbuto si verificano quando i valori plasmatici sono inferiori a 11 μmol/L.[70]
A pH 7, vicino al pH del plasma, la forma predominante della vitamina C è il monoanione ascorbato, seguita dall'acido ascorbico e, in concentrazioni molto basse, dal dianione ascorbato (0,005%). In un pH acido, la forma predominante è l'acido ascorbico.[71] I leucociti sono in grado di mantenere concentrazioni di vitamina C diverse volte superiori rispetto a quella plasmatica e possono riflettere meglio l'assunzione dietetica di vitamina C nel lungo termine.[72]
Effetti del composto e usi clinici
Viene usato per trattare la carenza di vitamina C, lo scorbuto, la guarigione ritardata delle ferite e delle ossa, l'acidificazione delle urine, nella prevenzione e nel trattamento dell'anemia sideropenica e in generale come antiossidante. È stato anche suggerito che sia un efficace agente antivirale.[13]
Sebbene alcune medicine alternative, come per esempio la medicina ortomolecolare, propongano megadosi di vitamina C come pratica terapeutica, non esistono prove scientifiche in merito e in taluni casi sono anzi controindicate.[73][74][75][76] Poiché la vitamina C diminuisce i livelli di acido urico, il consumo di elevate quantità di questa vitamina potrebbe avere un effetto preventivo verso l'iperuricemia (concentrazione sierica di acido urico > 6 mg/dL) e la gotta.[77]
Tossicologia
I sintomi dell'esposizione a questo composto possono includere irritazione della pelle, degli occhi e delle vie respiratorie. L'ingestione di grandi quantità può causare disturbi gastrointestinali e diarrea. L'esposizione può anche causare la formazione di calcoli renali di ossalato di calcio. Ci sono stati casi di reazione allergica con eczema, orticaria e asma. L'effetto mucolitico di questo composto potrebbe rendere il muco cervicale meno permeabile agli spermatozoi.[3]
Pericoli
Può essere sensibile all'esposizione prolungata alla luce e all'aria. Sensibile all'umidità. È soggetto a degradazione in condizioni anaerobiche. Quando riscaldato fino alla decomposizione emette fumo acre e fumi irritanti.[3]
Controindicazioni ed effetti collaterali
La vitamina C ha un eccellente profilo di sicurezza, principalmente grazie alla sua elevata solubilità in acqua e al rapido smaltimento dei livelli in eccesso da parte dei reni.[78][79] Sebbene non sia possibile stabilire un livello di assunzione tollerabile (UL) per la vitamina C, alcuni paesi hanno suggerito valori di 1.000–2.000 mg/giorno come limiti prudenti, basandosi su un potenziale rischio di diarrea osmotica e disturbi gastrointestinali correlati in alcuni individui a dosi più elevate.[78][80]
La vitamina C può provocare emolisi nei pazienti con carenza eritrocitaria di G6PD o favismo.[81] La somministrazione di vitamina C per via orale come forma farmaceutica solida (compresse) è stata associata a danni esofagei dovuti all'acidificazione del pH o della soluzione acquosa in cui è disciolta la compressa o della saliva. Il danno esofageo in genere è risultato transitorio e autolimitante ed è consistito nella formazione di ulcere localizzate che regrediscono dopo la sospensione del farmaco e non causano stenosi.[82][83]
Non esiste una dose letale accertata per l'uomo, esiste invece una LD50 per i ratti che corrisponde a 11,9 grammi per chilogrammo di peso corporeo in una sola dose per via orale. Un uomo medio di 70 kg dovrebbe dunque ingerirne circa 850 g in un'unica soluzione.[84]
Dosi superiori ai 1 g/die di vitamina C, assunte sotto forma di acido ascorbico, possono portare alla presenza di alcuni disturbi come nausea e mal di testa.[85][86] Inoltre secondo alcuni studi sembra che venga aumentata l'eliminazione tramite le urine di ossalati, che potrebbero facilitare la formazione di calcoli renali in un numero limitato di soggetti.[87][88]
Remove ads
Applicazioni
L'acido ascorbico viene utilizzato oltre che in medicina anche come:
- additivo alimentare (E300, E301, E302, E303, E304)[89]
- agente di trattamento delle farine[90]
- pesticida[91]
- nei cosmetici[92]
- in analisi di laboratorio (es. determinazione colorimetrica dell'uranio)[93]
- rivelatore per la fotografia analogica in bianco e nero[94]
- agente per il trattamento delle superfici[95]
Note
Bibliografia
Altri progetti
Collegamenti esterni
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads