composto químico From Wikipedia, the free encyclopedia
Os lipopolisacáridos (LPS), tamén chamados endotoxinas polos seus efectos tóxicos, son grandes moléculas que constan dun lípido e un polisacárido composto por tres porcións: o antíxeno O, o núcleo interno e o núcleo externo, unidos por enlace covalente. Encóntranse na membrana externa de bacterias gramnegativas.
Suxeriuse que "Endotoxina" sexa fusionado con este artigo ou apartado (conversa). Para realizar a fusión dos artigos sigue estes pasos. |

O termo lipooligosacárido (LOS) utilízase para referirse a unha forma de baixo peso molecular de lipopolisacáridos bacterianos.
A actividade tóxica do LPS descubriuna Richard Friedrich Johannes Pfeiffer e denominouna "endotoxina" para distinguila das exotoxinas, que el clasificou como toxinas liberadas pola bacteria no ambiente que a rodea, mentres que el cosideraba que as endotoxinas se mantiñan "dentro" da célula bacteriana e só se liberaban despois da destrución da parede celular bacteriana.[1]:84 Traballos posteriores demostraron que a liberación de LPS dos microbios gramnegativos non require necesariamente a destrución da parece bacteriana, senón que o LPS se segrega como parte da actividade fisiolóxica normal do tráfico de vesículas de membrana en forma de vesículas da membrana externa bacteriana, que poden conter tamén outros facores de virulencia e proteínas.[2]
Hoxe, o termo "endotoxina" utilízase principalmente como sinónimo de LPS,[3] aínda que hai unhas poucas endotoxinas que non están relacionadas co LPS, como as denominadas proteínas delta endotoxinas segregadas polo Bacillus thuringiensis (que é grampositivo). Outras bacterias grampositivas, como Listeria monocytogenes teñen na membrana ácidos lipoteicoicos con funcións e estrutura similares ás das endotoxinas lipopolisacáridas.[4][5]
O LPS é o principal compoñente da membrana externa das bacterias gramnegativas, contribuíndo grandemente á integridade estrutural das bacterias e protexendo a membrana de certos tipos de ataques químicos. O LPS tamén incrementa a carga negativa da membrana celular e axuda a estabilizar toda a estrutura da membrana. É de vital importancia para moitas bacterias gramnegativas, que morren se este muta ou é eliminado; malia todo, parece que o LPS non é esencial en polo menos algunhas bacterias gramnegativas, como Neisseria meningitidis, Moraxella catarrhalis e Acinetobacter baumannii.[6] O LPS induce unha forte resposta dos sistemas inmunitarios animais en estado normal. Tamén foi implicado en aspectos non patoxénicos da ecoloxía bacteriana, como a adhesión a superficies, sensibilidade a bacteriófagos e interaccións con predadores como as amebas.
O LPS é necesario para a correcta conformación da actividade omptina; porén, o LPS liso interfire estericamene coas omptinas.

Comprende tres partes:
Un polímero repetitivo de glicano contido no LPS da bacteria denomínase antíxeno O, polisacárido O ou cadea lateral O. O antíxeno O está unido ao oligosacárido que forma o núcleo da molécula e comprende o dominio máis externo da molécula de LPS. A composición da cadea O varía de cepa a cepa. Por exemplo, hai unhas 160 estruturas diferentes de antíxeno O producidas por distintas cepas de E. coli.[7] A presenza ou ausencia de cadeas O determina se o LPS se considera rugoso ou liso. As cadeas O de lonxitude completa orixinan LPS lisos, mentres que a ausencia ou redución das cadeas O dan lugar ao LPS rugoso.[8] As bacterias con LPS rugoso xeralmente teñen membranas celulares máis penetrables por antibióticos hidrófobos, xa que un LPS rugoso é máis hidrófobo.[9] O antíxeno O está exposto na superficie externa da célula bacteriana e, en consecuencia, é unha diana para o recoñecemento polos anticorpos do hóspede.
O dominio do núcleo (core) sempre contén un compoñente oligosacárido (oligosacárido do núcleo) que se une directamente ao lípido A e normalmente contén azucres como a heptosa e a ácido 3-desoxi-D-mano-oct-2-ulosónico (tamén chamado KDO, ceto-desoxioctulosonato).[10] Os núcleos do LPS de moitas bacterias tamén conteñen compoñentes non carbohidratos, como substituíntes fosfato, aminoácidos e etanolamina.
O lípido A é, en circunstancias normais, un disacárido de glicosamina fosforilado decorado con múltiples ácidos graxos. Estas cadeas de ácidos graxos hidrófobos ancoran o LPS na membrana bacteriana e o resto do LPS proxéctase desde a superficie da célula. O dominio do lípido A é responsable de gran parte da toxicidade das bacterias gramnegativas. Cando as células bacterianas son lisadas polo sistema inmunitario, fragmentos da membrana que conteñen o lípido A son liberados á circulación, causando febre, diarrea e un posible choque endotóxico letal (chamado choque séptico). O residuo de lípido A é un compoñente moi conservado do LPS.[11] Porén, a estrutura do lípido A varía entre especies bacterianas e dita estrutura define a activación global do sistema inmnitario do hóspede.[12]
Os lipoologosacáridos (LOS) son glicolípidos que se encontran na membrana externa dalgúns tipos de bacterias gramnegativas, como Neisseria spp. e Haemophilus spp. O termo é sinónimo de forma de baixo peso molecular do LPS bacteriano.[13] Os LOS teñen un papel central no mantemento da integridade e funcionalidade da membrana externa da envoltura gramnegativa. Os lipooligosacáridos xogan un importante papel na patoxénese de certas infeccións bacterianas porque poden actuar como inmunoestimuladores e inmunomoduladores.[13] Ademais, as moléculas de LOS son responsables da capacidade que teñen algunhas cepas de bacterias de presentar mimetismo molecular e diversidade antixénica, que axuda á evasión das defensas inmunitarias do hóspede e así contribúe á virulencia destas cepas de bacterias.
Quimicamente, os lipooligosacáridos carecen de antíxenos O e só posúen un residuo para a ancoraxe na membrana externa baseado no lípido A e un núcleo oligosacárido.[14] No caso de Neisseria meningitidis, a porción de lípido A da molécula ten unha estrutura simétrica e o núcleo interno está composto por ácido 3-desoxi-D-mano-2-octulosónico (KDO) e restos de heptosa (Hep). A cadea oligosacárida do núcleo externo varía dependendo da cepa bacteriana.[13][14] O lipopolisacárido bacteriano pode clasificarse en dúas formas: a forma de alto peso molecular (Mr, ou lisa) posúe unha cadea repetitiva de polisacárido O (antíxeno O) de alto peso molecular, e a forma de baixo peso molecular (baixo Mr ou rugosa ou oligosacárido, LOS), carece de cadea O, pero posúe un curto oligosacárido no seu lugar.[13]
A produción do LPS na bacteria pode ser modificada para que este teña unha estrutura de azucres específica. Estas estruturas poden ser recoñecidas por outros LPS (o cal permite inhibir toxinas LPSs) ou por glicosiltransferases que utilizan esas estruturas de azucres para engadir máis azucres específicos. Un encima lipase do hóspede moi conservado pode detoxificar o LPS cando este entra ou é producido nos tecidos animais. Pode tamén converter o LPS no intestino nun inhibidor de LPS. Os neutrófilos, macrófagos e células dendríticas producen esta lipase, a aciloxiacil hidrolase (AOAH), que inactiva o LPS ao eliminar as dúas cadeas acilo secundarias do lípido A para producir tetraacil LPS. Nos ratos se se administra LPS por vía parenteral, aqueles ratos que carecen de AOAH desenvolven altos títulos de anticorpos non específicos, desenvolvendo unha prolongada hepatomegalia, e experimentando unha prolongada tolerancia á endotoxina. Para que os animais recuperen a homeostase despois dunha exposición parenteral ao LPS pode ser necesaria a inactivación do LPS.[15] Aínda que os ratos teñen moitos outros mecanismos para inhibir a sinalización por LPS, ningún pode impedir estes cambios en animais que carecen de AOAH.


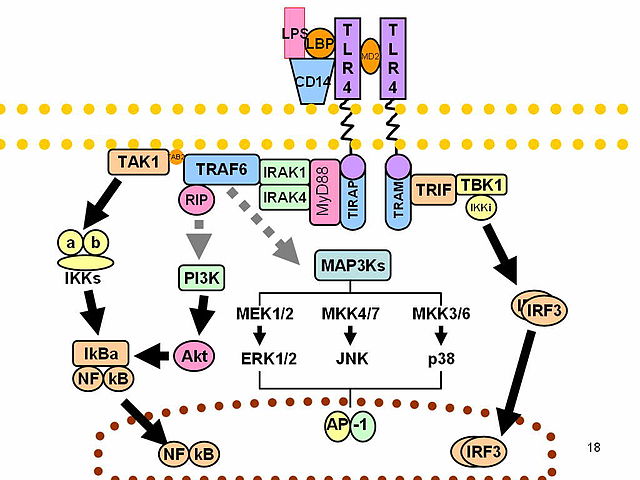
O LPS actúa como a endotoxina prototípica porque se une ao complexo receptor CD14/TLR4/MD2 en moitos tipos celulares, pero especialmente en monocitos, células dendríticas, macrófagos e células B, o cal promove a secreción de citocinas proinflamatorias, óxido nítrico e eicosanoides.[18]
Como parte da resposta ao estrés celular, o superóxido é unha das principais especies reactivas do oxíxeno inducida polo LPS en varios tipos celulares que expresan o TLR (receptor de tipo Toll).
O LPS é tamén un piróxeno exóxeno (substancia que induce a febre).
Como esta molécula é de crucial importancia para as bacterias gramnegativas, estas moléculas son dianas candidatas para novos axentes antimicrobianos.
Algúns investigadores dubidan dos informes de efectos tóxicos xeneralizados atribuídos a todos os lipopolisacáridos, en especial para o caso das cianobacterias.[19]
A función do LPS estivo en investigación experimental durante varios anos debido ao seu papel na activación de moitos factores de transcrición. O LPS tamén produce smoitos tipos de mediadores implicados no choque séptico. Os humanos son máis sensibles ao LPS que outros animais (por exemplo, os ratos). Unha dose de 1 µg/kg induce un shock en humanos, pero os ratos toleran unha dose ata mil veces máis alta.[20] Isto pode estar relacionado con diferenzas no nivel de anticorpos naturais circulantes entre as dúas especies.[21][22] Said et al. demostraron que o LPS causa unha inhibición dependente da IL-10 da expansión e función de células T CD4 ao regular á alza os niveis de PD-1 en monocitos, o que orixina a produción de IL-10 polos monocitos despois de unirse o PD-1 ao PD-L1.[23]
As endotoxinas son en gran parte responsables das intensas manifestacións clínicas das infeccións por bacterias patóxenas gramnegativas, como Neisseria meningitidis, o patóxeno que causa a enfermidade meningocócica, incluíndo a meningococcemia, a síndrome de Waterhouse–Friderichsen e a meninxite. A fosfatase alcalina impide a inflamación intestinal (e a elevada permeabilidade intestinal) causada polas bacterias ao desfosforilaren a porción do lípido A do LPS.[24][25][26]
Bruce Beutler compartiu o Premio Nobel de Medicina ou Fisioloxía de 2011 polo seu traballo que demostraba que o TLR4 é o receptor do LPS.[27][28]
Demostrouse que porcións do LPS de varias cepas bacterianas son quimicamente similares ás moléculas da superficie de células hóspede humanas; a capacidade dalgunhas bacterias de presentar moléculas na súa superficie que son quimicamene idénticas ou similares ás moléculas da superficie dalgúns tipos de células do hóspede denomínase mimetismo molecular.[29] Por exemplo, en Neisseria meningitidis L2,3,5,7,9, a porción terminal tetrasacárida do oligosacárido (lacto-N-neotetraosa) é o mesmo tetrasacárido que se encontra no paraglobósido, un precursor dos antíxenos glicolipídicos ABH que se encontran nos eritrocitos humanos.[13] Outro exemplo é a porción terminal trisacárida (lactotriaosa) do oligosacárido de Neisseria spp patóxena. O LOS tamén se encontra en glicoesfingolípidos lactoneoseries de células humanas.[13] A maioría dos meningococos dos grupos B e C, e tamén os gonococos teñen este trisacárido formando parte da estrutura dos LOS.[13] A presenza deste 'imitadores' da superficie celular humana pode, ademais de actuar como unha 'camuflaxe' ante o sistema inmunitario, ter un papel na supresión da tolerancia inmunitaria cando se infecta o hóspede con certas xenotipos de antíxeno leucocitario humano (HLA), como HLA-B35.[13]
Recentemente, un novo estudo publicado descubriu que o LPS pode ser detectado directamente polas células nais hematopoéticas por medio da súa unión ao TLR4, causando que proliferen en reacción á infección sistémica. Esta resposta activa a sinalización de TLR4-TRIF-ROS-p38 dentro da célula nai e por medio dunha activación sostida de TLR4 pode causar un estrés proliferativo, que conduce a alterar a súa capacidade de repoboación competitiva.[30] A infección en ratos por Salmonella typhimurium mostrou resultados similares, validando o modelo experimental in vivo.
Os antíxenos O (os carbohidratos externos) son a porción máis variable da molécula de LPS, e danlle a especificidade antixénica. En contraste, o lípido A é a parte máis conservada. Porén, a composición do lípido A tamén pode variar (por exemplo, no número e natureza das cadeas acilo tanto entre distintos xéneros coma dentro do mesmo xénero). Algunhas destas variacións poden darlle propiedades antagonistas a estes LPS. Por exemplo, o lípido A difosforilo de Rhodobacter sphaeroides (RsDPLA) é un potente antagonista do LPS en células humanas, pero é un agonista en células de hámster e de equinos.[31]
Especulouse que os lípidos A cónicos (por exemplo o de E. coli) son moi agonistas, e os lípidos A menos cónicos, como os de Porphyromonas gingivalis, poden activar un sinal diferente (o TLR2 en troques do TLR4), e os lípidos A completamente cilíndricos, como o de Rhodobacter sphaeroides, son antagonistas dos TLRs.[32][33]
Os clústers de xenes para a prodción de LPS son moi variables entre diferentes cepas, subespecies e especies de patóxenos bacterianos de plantas e animais.[34][35]
O soro sanguíneo humano normal contén anticorpos anti-LOS que son bactericidas e os pacientes que teñen infeccións causadas por cepas serotipicamente distintas posúen anticorpos anti-LOS que difiren na súa especificidade comparados co soro normal.[36] Estas diferenzas na resposta inmune humoral a diferentes tipos de LOS poden atribuírse á estrutura da molécula do LOS, principalmente dentro da estrutura da porción oligosacárida do LOS.[36] En Neisseria gonorrhoeae demostrouse que a antixenidade das moléculas de LOS pode cambiar durante unha infección debido á capacidade destas bacterias de sintetizar máis dun tipo de LOS,[36] unha característica coñecida como variación de fase. Adicionalmente, Neisseria gonorrhoeae, así como Neisseria meningitidis e Haemophilus influenzae,[13] poden modificar máis os seus LOS in vitro, por exemplo por sialilación (modificación con residuos de ácido siálico) e como resultado poden incrementar a súa resistencia á morte mediada polo complemento [36] ou mesmo regulan á baixa a activación do complemento[13] ou evádense dos efectos de anticorpos bactericidas.[13] A sialilación pode tamén contribuír a dificultar a adhesión e fagocitose de neutrófilos polas células do sistema inmunitario e tamén a reducir a explosión oxidativa.[13] Haemophilus somnus, un patóxeno do gando vacún, tamén presenta variación de fase de LOS, unha característica que pode axudar a evasdirse das defensas inmunitarias do hóspede bovino.[37] En conxunto, estas observacións suxiren que as variacións nas moléculas da superficie de bacterias como os LOS poden axudar a que o patóxeno se evada tanto das defensas inmunes do hóspede humorais (mediadas polos anticorpos e complemento) coma das celulares (matanza realizada polos neutrófilos, por exemplo).
Recentemente, demostrouse que ademais das vías mediadas por TLR4, certos membros da familia das canles iónicas de potencial receptor transitorio (TRP) recoñecen o LPS.[38] A activación mediada por LPS de TRPA1 demostouse en ratos[39] e moscas Drosophila melanogaster.[40] A altas concentracións, o LPS activa tamén outros membros da familia da canle TRP, como TRPV1, TRPM3 e en certa medida TRPM8.[41] O LPS é recoñecido polo TRPV4 en células epiteliais. A activación de TRPV4 polo LPS era necesaria e suficiente para inducir a produción de óxido nítrico con efectos bactericidas.[42]
A presenza de endotoxinas no sangue denomínase endotoxemia. Pode orixinar un choque séptico se a resposta inmune é excesivamente pronunciada.[43]
Porén, a endotoxemia de orixe intestinal, especialmente na interface hóspede-patóxeno, considérase un importante factor no desenvolvemento da hapatite alcohólica,[44] que probablemente se desenvolve sobre a base do síndrome de sobrecrecemento bacteriano no intestino delgado e un incremento na permeabilidade intestinal.[45]
O lípido A pode causar unha activación incontrolada dos sistemas inmunitarios de mamíferos con produción de mediadores inflamatorios que pode causar un choque séptico.[14] Esta reacción inflamatoria é mediada polo TLR 4, que é responsable da activación de células do sistema inmunitario.[14] Os danos na capa endotelial de vasos sanguíneos causados por estes mediadores inflamatorios pode orixinar unha síndrome de permeabilidade capilar, dilatación de vasos sanguíneos e un decrecemento da función cardíaca e pode conducir a un choque séptico.[46] Unha activación do complemento demasiado pronunciada pode observarse tamén posteriormente no curso da infección a medida que as bacterias se multiplican no sangue.[46] Unha elevada proliferación de bacterias que desencadea un dano endotelial destrutivo pode igualmete levar a unha coagulación intravascular diseminada con perda da función de certos órganos internos como os riles, glándulas adrenais e pulmóns debido a que o rego sanguíneo se ve comprometido. A pel pode mostrar os efectos do dano vascular a miúdo acoplados con diminución dos factores de coagulación en forma de petequias, púrpura e equimoses. As extremidades poden tamén ser afectadas, ás veces con consecuencias devastadoras como o desenvolvemento de gangrena, que pode requirir amputación.[46] A perda de función das glándulas adrenais pode causar insuficiencia adrenal e hemorraxias adicionais nas adrenais causan a síndrome de Waterhouse-Friderichsen, ambas as cales poden ser mortais. Tamén se informou que os LOS de gonococos poden causar danos nas trompas de Falopio das mulleres.[36]
O mimetismo molecular dalgunhas moléculas de LOS pénsase que causa respostas do hóspede baseadas na autoinmunidade, como gromos de esclerose múltiple.[13][29] Outros exemplos de mimetismo bacteriano de estruturas do hóspede por medio do LOS poden encontrarse nas bacterias Helicobacter pylori e Campylobacter jejuni, organismos que causan enfermidade gastrointestinal en humanos, e en Haemophilus ducreyi, que causa o chancroide. Certos serotipos de LPS de C. jejuni (atribuídos a certos residuos de tetra- e pentasacárido do núcleo oligosacarídico) foron tamén implicados na síndrome de Guillain–Barré e unha variante da Guillain–Barré chamada síndrome de Miller-Fisher.[13]
Demostrouse en estudos epidemiolóxicos que un incremento da carga de endotoxinas, que pode ser o resultado do incremento de poboacións de bacterias produtoras de endotoxinas no tracto intestinal, está asociado con certos grupos de pacientes relacionados coa obesidade.[47][48][49] Outros estudos mostraron que a endotoxina purificada de Escherichia coli pode inducir obesidade e resistencia á insulina cando se inxecta en modelos de ratos libres de xermes.[50] Un estudo máis recente descubriu unha posible contribución en Enterobacter cloacae B29 á obesidade e á resistencia á insulina nun paciente humano.[51] O mecanismo que se supón para a asociación da endotoxina coa obesidade é que a endotoxina induce unha vía mediada pola inflamación que explica a obesidade e resistencia á insulina observadas.[50] Entre os xéneros bacterianos asociados cos efectos sobre a obesidade relacionados coa endotoxina están Escherichia e Enterobacter.
Os lipopolisacáridos son frecuentes contaminantes do ADN de plásmidos preparados a partir de bacterias ou proteínas expresadas por bacterias, e deben ser eliminados deses ADN e proteínas para evitar contaminar os experimentos e evitar a toxicidade dos produtos fabricados usando a fermentación industrial.[52]
Ademais, a ovoalbumina está frecuentemente contaminada con endotoxinas. A ovoalbumina é unha das proteínas máis estudadas en modelos animais e tamén un modelo establecido de alérxeno para a hipersensibilidade das vías aéreas. A ovoalbúmina dispoñible comercialmente que está contaminada con LPS pode activar completamente as células endoteliais nun ensaio in vitro da primeira etapa da inflamación e falsea os resultados das investigacións, xa que non reflicte con exactitude o efecto dos antíxenos proteicos na fisioloxía animal.[53]
Na produción farmacéutica cómpre eliminar todas as trazas de endotoxina dos recipientes dos medicamentos, xa que mesmo pequenas cantidades de endotoxina causan enfermidade en humanos. Para este propósito utilízase un forno de despiroxenación. Necesítanse temperaturas por riba de 300 °C para destruír esta substancia. Unha taxa de redución de endotoxina definida é unha correlación entre o tempo e a temperatura. Baseándose no material de empaquetado primario, como viais ou xiringas, para conseguir unha redución de niveis de endotoxina á milésima parte o típico é chegar unha temperatura do vidro de 250 °C e mantela durante un tempo de 30 minutos.[54]
O ensaio estándar para detectar a presenza de endotoxina é o ensaio Lisado de Amebocito de Limulus (LAL), no que se utiliza sangue do artrópodo mariño Limulus polyphemus (cangrexo de ferradura).[55] Niveis moi baixos de LPS poden causar coagulación do lisado de Limulus debido a unha potente amplificación por medio dunha fervenza encimática. Porén, debido á minguante poboación destes animais, e ao feito de que hai factores que interfiren co ensaio LAL, estanse facendo intentos de desenvolver ensaios alternativos, e os máis prometedores son os tests ELISA que usan unha versión recombinante dunha proteína do ensaio LAL, o factor C.[56]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.