element químic amb nombre atòmic 73 From Wikipedia, the free encyclopedia
El tàntal és l'element químic de símbol Ta i nombre atòmic 73. Se situa en el grup 5 de la taula periòdica dels elements i al 6è període. El seu símbol és Ta. És un metall de transició molt semblant al niobi, situat just damunt a la taula periòdica, amb el qual es presenta en la majoria dels minerals que els contenen. Els minerals més important d'on se'ls extreu són els del grup de la columbita-tantalita o coltan. Fou descobert el 1802 pel químic Anders Ekeberg. Se'n produeixen anualment unes 1 800 tones, majoritàriament a la República Democràtica del Congo i a Ruanda. És un metall de gran importància degut a que amb ell s'han pogut miniaturitzar els condensadors de tots els dispositius electrònics que hom té a l'abast. Per la seva biocompatibilitat s'empra en diversos tipus d'implants. També s'empra en aliatges que han de resistir altes temperatures i en lents d'objectius fotogràfics.
| Per a altres significats, vegeu «Tàntal (desambiguació)». |
| Tàntal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
73Ta | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Blau grisós Cristalls de tàntal i un cub d'1 cm³  Línies espectrals del tàntal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Tàntal, Ta, 73 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 5, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 180,94788 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d3 6s2 2, 8, 18, 32, 11, 2  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
16,69 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
15 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 3.290 K, 3.017 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 5.731 K, 5.458 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 36,57 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 732,8 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,36 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 5, 4, 3, 2, -1 (òxid àcid feble) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,5 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 761 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.500 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 170±8 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara[1]  (α-Ta) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tetragonal[1]  (β-Ta) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 131 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 57,5 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 6,3 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.400 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 186 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 69 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 200 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 873 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 800 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-25-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del tàntal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Anders Gustaf Ekeberg (1767-1813), químic de la Universitat d'Uppsala, Suècia, comunicà el descobriment del tàntal com a nou element químic el 1802. Tot i això, quan el 1809 el químic britànic William Hyde Wollaston (1776-1828) analitzà els minerals dels quals s'havia extret, conclogué que era idèntic al niobi, que havia sigut descobert pel químic anglès Charles Hatchet el 1801 i que havia anomenat columbi.[3] Com a resultat de la similitud d'ambdós elements es produí confusió quant a la seva identificació. Aquests dos elements sovint es donen junts i, essent químicament molt similars, eren difícils de separar pels mètodes disponibles en el moment del descobriment.

No fou fins al 1846 que el químic alemany Heinrich Rose (1795-1864) separà el tàntal i el niobi i demostrà de manera concloent que eren elements diferents, i tanmateix la seva mostra de tàntal encara era una mica impura, i no fou fins al 1903 que el tàntal pur pogué ser obtingut pel químic alemany Werner von Bolton (1868-1912).[4]
El nom tàntal prové del llatí científic tantalum, i aquest del llatí Tantălus 'Tàntal', personatge mitològic, fill de Zeus i de la nimfa Pluto, castigat a patir fam i set eternament, per al·lusió a la nul·la capacitat d'absorció del tàntal quan se submergeix en àcids.[5] Tántal és el pare de la deessa Níobe, que dona nom al niobi.[6]

El tàntal és un element poc abundant a l'escorça de la Terra, només té una concentració mitjana de 2 ppm, ocupant la 51a posició en quan a abundància dels elements químics. Se'l pot trobar com a mineral natiu en placers de rius i formant molts minerals en els quals hi és present en elevades proporcions. Els minerals que en contenen més d'un 75 % són: tantalcarbur 93,78 %; tantita 81,90 %; litiowodginita 80,09 %; natrotantita 76,53 %; i tantalowodginita76,24 %.[7]

El tàntal natiu amb una mica de niobi i traces de manganès i or se'l troba amb escassetat a Rússia a placers de les muntanyes Urals i possiblement al massís de l'Altai a l'Àsia central.[8] S'obté de forma industrial dels minerals del grup de la columbita-tantalita , que també es coneixen per l'acrònim coltan. Una part del tàntal també és un subproducte de l'extracció d'estany.[9] Els principals jaciments actuals es troben a Austràlia, Brasil, Ruanda, Zimbàbue, Congo-Kinshasa, Nigèria i el Canadà.[6] El principals extractors són Congo-Kinshasa i Ruanda (740 tones i 370 tones respectivament el 2019).[10]
El tàntal se separa dels compostos de niobi per extracció de dissolvents en un procés líquid-líquid i després es redueix a pols de tàntal metàl·lic. El metall massiu es produeix mitjançant tècniques de metal·lúrgia en pols. També es pot obtenir mitjançant electròlisi de sals fusionades o reducció de complexos fluorats amb un metall molt reactiu com el sodi.[8]
El tàntal és un metall gris, brillant, pesant, dúctil, d'alta densitat 16,4 g/cm³, molt alts punt de fusió i d'ebullició, 3 017 °C i 5 458 °C respectivament. És bon conductor de l'electricitat i la calor, i molt dur.[6] Cristal·litza en una estructura cúbica centrada en el cos.[11]
El tàntal no reacciona amb l'aire en condicions normals degut a que la superfície del tàntal metall queda protegida per una fina capa d'òxid que evita l'oxidació de la resta del tàntal. Tampoc reacciona amb l'aigua en condicions normals.[11]
Amb els halògens el tàntal reacciona en escalfar-se per formar halurs de tàntal(5+).
Sembla que el tàntal no és atacat per molts àcids a temperatura ambient, però es dissol en àcid fluorhídric o en òleum (una dissolució de triòxid de sofre en àcid sulfúric , també conegut com a àcid sulfúric fumant). També és atacat per àlcalis fusos.[11]

Hom pot trobar composts de tàntal on el tàntal actua amb nombres d'oxidació +1, +2, +3, +4 i +5. A més dels halogenurs ja indicats hi ha descrits els següents composts: aluminur de tàntal , monoborur de tàntal , diborur de tàntal , bromur de tàntal(III) , bromur de tàntal(IV) , carbur de tàntal , clorur de tàntal(III) , clorur de tàntal(IV) , hidrur de tàntal , iodur de tàntal(IV) , nitrur de tàntal , òxid de tàntal(IV) , òxid de tàntal(V) , selenur de tàntal(IV) , silicur de tàntal , sulfur de tàntal(IV) , tel·lurur de tàntal(IV) .[6]
Es coneixen trenta-quatre isòtops i isòmers del tàntal, que val del nombre màssic 155 al 194, però només dos se'ls troba a la natura, el tàntal 181 que representa la pràctica totalitat (99,99 %) i el tàntal 180 metaestable, que té un període de semidesintegració de 7,15 × 1015 anys.[12]

La principal aplicació del tàntal és la producció de condensadors. La capacitat d'emmagatzemar electricitat en petita quantitat de metall ha permès la miniaturització de tots els dispositius electrònics, com telèfons mòbils, videoconsoles, microprocessadors, aparells de ràdio, armes «intel·ligents», míssils, etc., mitjançant la substitució dels clàssics condensadors d'alumini (més grossos) pels de tàntal (molt més petits).[13]

L'òxid de tàntal s'afegeix al vidre per a augmentar-ne la transparència i l'índex de refracció alhora que el fa més lleuger. Aquests vidres s'empren en la fabricació d'objectius per a les càmeres fotogràfiques.[13]
El carbur de tàntal es considera més resistent que el carbur de tungstè, i s'empra en eines de tall i en la fabricació de motors que han de treballar a altes temperatures i en un ambient corrosiu. També es fabrica instrumental quirúrgic i aparells químics amb aquest metall.[13]

Els condensadors d'alumini o de ceràmica no són una opció còmoda pels límits del cos humà. Tanmateix els condensadors de tàntal són excepcionalment fiables, altament duradors i molt petits, la qual cosa permet implantar dispositius petits i potents que els contenguin en pacients. Així els audiòfons implantables, el neurostimuladors i les bombes d'insulina són possibles gràcies a aquests condensadors. L'aplicació més destacada és pels desfibril·ladors cardioversors implantables (ICDs). L'alternativa tradicional a un ICD és un desfibril·lador extern que s'ha de portar a tot arreu pel pacient. Un ICD pot lliurar 750 volts, suficients per ser eficaç fins i tot en el cos humà més gran.[14]
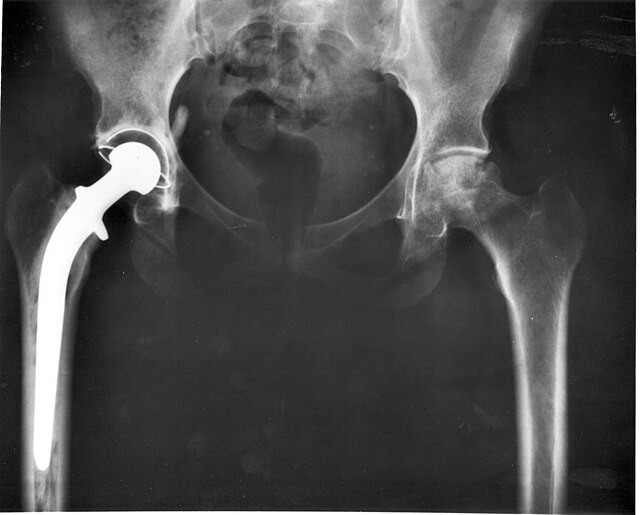
El recobriment natural molt prim d'òxid de tàntal(V) de les superfícies del metall és totalment inert als líquids corporals, característica que converteix el tàntal en un material idoni per a implants quirúrgics. S'han utilitzat implants de tàntal en cirurgia general i en neurocirurgia durant més de mig segle i mai s'han descrit problemes de biocompatibilitat. Les aplicacions quirúrgiques del tàntal inclouen: accessoris de substitució de maluc i genoll; monofilaments i cables de sutura trenada pel tancament de la pell, tendons i reparació de nervis; làmines per a anastomosis nervioses; pinces pel lligament de vasos; grapes per a cirurgia abdominal; làmines i plaques flexibles per a la cranioplàstia i altres cirurgies reconstructives.[14]
Com el tàntal és tant radiopàtic com biològicament inert també es pot utilitzar com un marcador ortopèdic en forma de bolles o perles. S'utilitzen per rastrejar objectes a l'interior d'un cos, com ara per fer un seguiment dels implants fixats en el cos. El tàntal també es pot utilitzar per revestir escuma de carboni per crear un recanvi biocompatible per a implants òssies, per exemple en implants dentals o per a vèrtebres. Aquesta estructura és de 70 a 80 % porosa i un cop implantada el nou teixit biològic creix a través seu, ajudant a fixar-lo al seu lloc.[14]
El tàntal ha rebut molta poca atenció per part dels estudis ambientals. Si coneixem les concentracions a l'escorça terrestre i la raó Nb/Ta i en minerals és perquè aquestes mesures són útils com a eines geoquímiques.[15] Els valors més recents d'amdues són són 0,92 ppm i 12,7 en massa, respectivament.[16]
Hi ha poca informació disponible sobre les concentracions de tàntal en els diferents compartiments ambientals, especialment en aigües naturals, on ni tan sols hi ha càlculs fiables de concentracions de tàntal dissolt en aigües salades i dolces.[17] S'han publicat alguns valors sobre concentracions dissoltes en oceans, però són contradictoris. Els valors per aigües dolces no són molt millors, però, en tots els casos, probablement són inferiors a 1 ng L–1, ja que les concentracions «dissoltes» en aigües naturals estan molt per sota de les capacitats analítiques actuals.[18] L'anàlisi requereix procediments de preconcentració que, de moment, no donen resultats coherents. I, en tot cas, el tàntal sembla estar present a les aigües naturals principalment com a partícules i no en forma dissolta.[17]
Els valors per a concentracions en sòls, sediments fluvials i aerosols atmosfèrics són més fàcils d'aconseguir.[17] Els valors en sòls són propera a 1 ppm i, per tant, als valors UCC, el que indica un origen detrític. Per als aerosols atmosfèrics, els valors existents són dispersos i limitats. Quan s'observa un augment en la concentració de tàntal, probablement es degui a la pèrdua d'elements més solubles en aerosols en els núvols.[19]
No s'ha detectat contaminació relacionada amb l'ús humà de l'element.[20] El tàntal sembla un element molt conservador en termes biogeoquímics, però el seu cicle i la seva reactivitat encara no s'entenen completament.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.