Urani
element químic amb nombre atòmic 92 From Wikipedia, the free encyclopedia
Remove ads
L'urani és un element químic metàl·lic de símbol U i nombre atòmic 92. És de color blanc argentat i pertany a la sèrie dels actínids de la taula periòdica. Un àtom d'urani té 92 protons i 92 electrons, dels quals 6 són electrons de valència. L'urani és feblement radioactiu perquè tots els seus isòtops són inestables. Els seus isòtops més comuns són l'urani 238 (que té 146 neutrons) i l'urani 235 (que té 143 neutrons). Té la segona massa atòmica més elevada dels elements primordials; només és més lleuger que el plutoni.[3] La densitat de l'urani és un 70% major que la del plom, però no és tan dens com l'or o el tungstè. Ocorre de manera natural en concentracions baixes de poques parts per milió al sòl, en roca i en aigua, i s'extreu comercialment a partir de minerals que contenen urani, com la uraninita.
| Per a altres significats, vegeu «Urani (desambiguació)». |
A la natura, l'urani es troba en forma d'urani 238 (99,2739-99,2752%), urani 235 (0,7198-0,7202%), i una quantitat ínfima d'urani 234 (0,0050-0,0059%).[4] L'urani es desintegra lentament i emet una partícula alfa. La semivida de l'urani-238 és d'uns 4.470 milions d'anys i la de l'urani-235 d'uns 704 milions d'anys,[5] la qual cosa fa que aquests isòtops siguin útils per datar l'edat de la Terra.
Molts usos contemporanis de l'urani exploten les propietats úniques del seu nucli. L'urani 235 té la particularitat de ser l'únic isòtop físsil que ocorre de manera natural. L'urani 238 és fissionable per neutrons ràpids, i és fèrtil, la qual cosa significa que pot ser transmutat a plutoni 239 físsil en un reactor nuclear. Un altre isòtop físsil, l'urani 233, pot ser produït a partir de tori natural i també és important en tecnologia nuclear. L'urani 238 té una baixa probabilitat d'entrar en fissió espontània o, fins i tot, en fissió induïda per neutrons ràpids, mentre que l'urani 235 i, en menor mesura, l'urani 233 tenen una secció eficaç de fissió molt més gran per neutrons lents. En una concentració suficient, aquests isòtops mantenen una reacció nuclear en cadena sostinguda que genera calor en reactors de centrals nuclears i produeix el material físsil per armes nuclears. L'urani empobrit (238U) s'utilitza en penetradors d'energia cinètica i blindatge de vehicles.[6]
L'urani s'utilitza com a colorant en vidre d'urani, el qual té unes tonalitats que van del vermell i taronja al groc llimona, i antigament, en els principis de la fotografia, també s'utilitzava per tintar i ombrejar. La descoberta de l'urani en la uraninita (1789) es reconeix a Martin Heinrich Klaproth, qui anomenà el nou element en honor del planeta Urà; posteriorment, Eugène-Melchior Péligot fou la primera persona a aïllar el metall, i les seves propietats radioactives foren descobertes l'any 1896 per Henri Becquerel. La recerca duta a terme per Enrico Fermi i altres científics a partir del 1934 facilità la utilització de l'urani com a combustible de la indústria de l'energia nuclear i també com de la Little Boy, la primera arma nuclear utilitzada en una guerra. La posterior cursa armamentista durant la Guerra Freda entre els Estats Units i la Unió Soviètica produí desenes de milers d'armes nuclears que utilitzaven l'urani metàl·lic i el plutoni 239, derivat de l'urani. La seguretat d'aquestes armes i del seu material físsil després del trencament de l'URSS l'any 1991 encara és una preocupació per la seguretat i salut pública.[7]
Remove ads
Característiques
Quan es refina, l'urani és un metall de color blanc platejat, feblement radioactiu, que és més dur que la majoria d'elements. És mal·leable, dúctil, lleugerament paramagnètic, fortament electropositiu i un pobre conductor elèctric.[8][9] L'urani metàl·lic té una elevada densitat: és aproximadament un 70% més dens que el plom, però lleugerament menys dens que l'or.

L'urani metàl·lic reacciona amb gairebé tots els elements no metàl·lics i els seus compostos; la seva reactivitat augmenta amb la temperatura.[10] Els àcids clorhídric i nítric dissolen l'urani, però els àcids no oxidants diferents que el clorhídric ataquen l'element molt lentament.[8] L'urani dividit finament pot reaccionar amb aigua freda; en aire, l'urani metàl·lic es revesteix amb una capa fosca d'òxid d'urani.[9] L'urani de menes s'extreu químicament i es converteix en diòxid d'urani o altres formes químiques útils per la indústria.
L'urani 235 fou el primer isòtop que es descobrí que era físsil. Altres isòtops presents a la natura també són fissionables, però no físsils. Quan se'l bombardeja amb neutrons lents, l'isòtop urani 235 gairebé sempre es divideix en dos nuclis més petits i allibera energia d'enllaç nuclear i més neutrons. Si molts d'aquests neutrons són absorbits per altres nuclis d'urani-235 llavors té lloc una reacció nuclear en cadena que resulta en un alliberament de calor o bé (en circumstàncies especials) en una explosió. En un reactor nuclear, aquesta reacció en cadena ocorre lentament i és controlada mitjançant un verí de neutrons, el qual absorbeix alguns dels neutrons lliures. Aquests materials que absorbeixen neutrons solen formar part de les barres de control del reactor.
Es necessiten uns 7 kg d'urani 235 per construir una bomba atòmica.[11] La primera bomba nuclear utilitzada en una guerra, la Little Boy, era d'urani, mentre que el primer explosiu nuclear, The gadget, i la bomba que destruí Nagasaki, Fat Man, eren bombes de plutoni.
L'urani metàl·lic té tres formes al·lotròpiques:[12]
- α (estructura ortoròmbica): estable fins a 660 °C
- β (estructura tetragonal): estable de 660 °C a 760 °C
- γ (estructura cúbica centrada en la cara): 760 °C fins al punt de fusió; aquest és l'estat de l'urani en el que és més mal·leable i dúctil.
Remove ads
Aplicacions
Àmbit militar
L'aplicació principal de l'urani en el sector militar és en els penetradors d'alta densitat. Aquesta munició consisteix en urani empobrit (UE) aliat amb un 1-2% d'altres elements. En un impacte a alta velocitat, la densitat, la duresa i la piroforicitat del projectil permeten la destrucció d'objectius blindats. Els tancs i altres vehicles blindats també es protegeixen amb cobertes d'urani empobrit. L'ús de l'urani empobrit esdevingué polèmic políticament i ambiental després que la seva utilització en municions dels Estats Units, del Regne Unit i d'altres països durant les guerres del Pèrsic i dels Balcans plantegés qüestions sobre els compostos d'urani abandonats al sòl (vegeu Síndrome de la guerra del Golf).[11]

Durant les darreries de la Segona Guerra Mundial, la Guerra Freda i, encara que en menys mesura, durant les dècades posteriors, l'urani 235 fou utilitzat com el material físsil explosiu per produir armes nuclears. Inicialment es construïren dos tipus principals de bombes de fissió: un mecanisme relativament simple que utilitza l'urani 235 i un de més complicat que utilitza el plutoni 239, derivat de l'urani 238. Més tard es construí una bomba de fissió/fusió molt més complicada i, de llarg, molt més potent (una arma termonuclear); aquesta arma utilitza un mecanisme basat en el plutoni per aconseguir la fusió nuclear d'una barreja de triti i deuteri. Aquest tipus de bombes estan encapsulades en una caixa no físsil (no enriquida) d'urani, i obtenen més de la meitat de la seva potència a partir de la fissió d'aquest material per neutrons ràpids provinents del procés de fusió nuclear.[13]
Àmbit civil
L'ús principal de l'urani en el sector civil és com a combustible de les centrals nuclears. Un quilogram d'urani 235 teòricament pot produir uns 20 terajoules d'energia (8×1013 joules) si s'assumeix una fissió completa; això equival a l'energia produïda per 1.500 tones de carbó.[6] Les centrals d'energia nuclear comercials utilitzen combustible que sol estar enriquit fins aproximadament un 3% d'urani 235.[6] Els dissenys CANDU i Magnox són els únics reactors comercials capaços d'utilitzar combustible d'urani no enriquit. El combustible utilitzat pels reactors de la marina dels Estats Units sol estar molt enriquit en urani 235 (els valors exactes són informació classificada). En un reactor generador també es pot convertir l'urani-238 en plutoni mitjançant la següent reacció:[9] 238U (n, gamma) → 239U -(beta) → 239Np -(beta) → 239Pu.

L'urani empobrit és utilitzat com a material de protecció en alguns contenidors utilitzats per emmagatzemar i transportar materials radioactius. Encara que el mateix urani és radioactiu, la seva alta densitat el converteix en un material més efectiu que el plom per aturar la radiació de fonts intenses com el radi.[8] Altres usos de l'urani empobrit són com a contrapès de superfícies de control d'aeronaus, com a llast per a vehicles de reentrada i com a material protector.[9] A causa de la seva elevada densitat, aquest material es troba en sistemes de navegació inercials i en compassos giroscòpics.[9] Se sol preferir l'urani empobrit en comptes de metalls de densitat similar per la seva facilitat de mecanització i fosa, així com pel seu baix cost.[14] El risc principal de l'exposició a l'urani empobrit és l'enverinament químic per òxid d'urani i no pas la radioactivitat (l'urani és tan sols un emissor alfa feble).
La descoberta i aïllament del radi en la mena d'urani (pechblenda) per part de Marie Curie comportà el desenvolupament de la mineria d'extracció del radi, el qual s'utilitzava per fer pintures que brillaven en la foscor.[15] Aquest fet provocà que s'obtinguessin grans quantitats d'urani com a producte residual, ja que calen tres tones d'urani per extreure un gram de radi. Aquest producte residual fou derivat a la indústria del vidre, la qual cosa convertí els vidres d'urani en molt abundants i barats. Així doncs, els vidres d'urani conjuntament amb els esmalts ceràmics varen representar l'ús més important de l'urani.

L'urani també fou utilitzat en substàncies químiques per la fotografia (especialment el nitrat d'urani com a tòner),[9] en filaments de làmpades, per millorar l'aparença de pròtesis dentals i en les indústries del cuir i de la fusta per fer tincions i tintats. Les sals d'urani són mordents de la seda i de la llana. L'acetat d'uranil i el formiat d'uranil s'utilitzen com a «taques» de gran densitat d'electrons per la microscòpia electrònica de transmissió, per augmentar el contrast d'espècimens biològics en seccions ultraprimes i en la tinció negativa de virus, orgànuls cel·lulars aïllats i macromolècules.
La descoberta de la radioactivitat de l'urani anà acompanyada de l'estudi de possibles usos científics i pràctics de l'element. La llarga semivida de l'isòtop urani-238 (4,51×109 anys) el col·loca en una bona posició per ser utilitzat per estimar l'edat de les primeres roques ígnies i per altres tipus de datació radiomètrica, entre els quals la datació per urani-tori, la datació per urani-plom i la datació per urani-urani. L'urani metàl·lic s'utilitza per objectius de raigs X en la creació de raigs X d'alta energia.[9]
Remove ads
Història
Fissió prehistòrica d'ocurrència natural
El 1972, el físic francès Francis Perrin descobrí quinze reactors de fissió nuclear naturals antics i ja inactius en tres dipòsits de menes separats a la mina d'Oklo, al Gabon, a l'oest de l'Àfrica, que es coneixen col·lectivament com a «Reactors fòssils d'Oklo». El dipòsit de menes té una antiguitat de 1.700 milions d'anys; en aquella època, l'urani 235 constituïa aproximadament el 3% del total d'urani terrestre.[16] Aquest percentatge és prou elevat per permetre l'ocurrència d'una reacció nuclear de fissió en cadena sostinguda, sempre que existeixin altres condicions necessàries. La capacitat dels sediments de l'entorn per contenir els productes nuclears residuals ha estat citada pel govern federal dels Estats Units com una evidència que dona suport a la tesi sobre la viabilitat d'emmagatzemar combustible nuclear usat a Yucca Mountain.[16]
Ús anterior a la descoberta
L'ús de l'urani en la seva forma natural d'òxid data com a mínim de l'any 79 aC, quan s'utilitzava per donar un color groguenc a vidres ceràmics.[9] L'any 1912, R. T. Gunther, de la Universitat d'Oxford, trobà vidre groc amb un 1% d'òxid d'urani en una vil·la romana del cap Posillipo, al golf de Nàpols (Itàlia).[17] A partir de l'edat mitjana tardana s'extragué pechblenda de les mines de plata dels Habsburg situades a Joachimsthal, Bohèmia (actual Jáchymov, República Txeca), la qual era utilitzada com un agent colorant en la indústria local de producció de vidre.[18] Als inicis del segle xix, aquestes mines eren les úniques fonts de menes d'urani conegudes del món.
Descoberta

L'urani és un element pesant que es va formar a través de la nucleosíntesi d'estrelles massives en la fase de supernova. La descoberta de l'urani es reconeix al químic alemany Martin Heinrich Klaproth. Mentre treballava al seu laboratori experimental de Berlín l'any 1789, Klaproth fou capaç de precipitar un compost groguenc (probablement diuranat de sodi) dissolent pechblenda en àcid nítric i neutralitzant la solució amb hidròxid de sodi.[18] Klaproth assumí que la substància groguenca era l'òxid d'un element no descobert, i l'escalfà amb carbó vegetal per obtenir una pólvora negra, la qual cregué que ja era el nou metall que pretenia descobrir (de fet, la pólvora era un òxid d'urani).[18][19] Anomenà l'element acabat de descobrir en honor del planeta Urà (anomenat al seu torn en honor del déu grec Urà), descobert vuit anys enrere per l'astrònom William Herschel.[20]
El 1841, Eugène-Melchior Péligot, professor de Química analítica del Conservatoire National des Arts et Métiers (Conservatori Nacional d'Arts i Oficis) de París, aïllà la primera mostra d'urani metàl·lic escalfant tetraclorur d'urani amb potassi.[18][21] Durant la major part del segle xix, l'urani no fou pas vist com una substància especialment perillosa, la qual cosa menà al desenvolupament de diversos usos per l'element.
Henri Becquerel descobrí la radioactivitat mitjançant urani el 1896.[10] Becquerel feu la descoberta a París deixant una mostra d'una sal d'urani, K₂UO₂(SO₄)₂ (sulfat de potassi i uranil), a sobre d'una placa fotogràfica sense exposar, i notà que la placa es tornà borrosa.[22] Becquerel determinà llavors que una forma de llum invisible o raigs emesos per l'urani havien causat l'exposició de la placa.
Recerca de la fissió

El 1934, un equip liderat per Enrico Fermi observà que el bombardeig d'urani amb neutrons produeix una emissió de raigs beta (electrons o positrons dels elements produïts; vegeu Partícula beta).[23] Al principi, els productes de fissió es confongueren amb nous elements de nombres atòmics 93 i 94, els quals el rector de la Facultat de Roma, Orso Mario Corbino, batejà com ausoni i hesperi, respectivament.[24][25][26][27] Els experiments que conduïren a la descoberta de la capacitat de l'urani per dividir-se en elements més lleugers (fissió) i alliberar energia d'enllaç foren duts a terme per Otto Hahn i Fritz Strassmann[23] al laboratori de Hahn, situat a Berlín. Lise Meitner i el seu nebot, el físic Otto Robert Frisch, publicaren l'explicació física el febrer de 1939 i anomenaren el procés com a «fissió nuclear».[28] Poc després, Fermi feu la hipòtesi que la fissió de l'urani podria alliberar prou neutrons per mantenir una reacció de fissió. La confirmació d'aquesta hipòtesi arribà l'any 1939, i treballs posteriors descobriren que s'alliberen una mitjana de 2,5 neutrons per cada fissió de l'isòtop rar urani 235.[23] Més tard, investigacions trobaren que l'urani-23, un isòtop molt més comú, pot ser transmutat en plutoni que, igual que l'urani 235, també és fissionable per neutrons tèrmics. Aquestes descobertes feren que molts països comencessin a treballar en el desenvolupament d'armes nuclears i de l'energia nuclear.
El 2 de desembre de 1942, com a part del Projecte Manhattan, un altre equip liderat per Enrico Fermi fou capaç d'iniciar la primera reacció nuclear en cadena artificial automantinguda (Chicago Pile-1). Treballant en un laboratori sota les graderies de l'Stagg Field de la Universitat de Chicago, l'equip creà les condicions necessàries per dur a terme tal reacció apilant 360 tones de grafit, 53 tones d'òxid d'urani i 5,5 tones d'urani metàl·lic, la majoria del qual fou aportat per la fàbrica de làmpades Westinghouse en un procés de producció improvisat.[23][29]
Bombes

Els Estats Units desenvoluparen dos tipus principals de bombes atòmiques durant la Segona Guerra Mundial: una basada en urani (de nom en clau Little Boy), el material físsil de la qual era urani altament enriquit, i una basada en plutoni (vegeu Trinity i Fat Man), el plutoni de la qual era derivat de l'urani 238. La Little Boy esdevingué la primera arma nuclear utilitzada en una guerra quan fou detonada sobre la ciutat japonesa d'Hiroshima el 6 d'agost de 1945. L'explosió i l'ona calorífica, equivalents a 12.500 tones de TNT, destruïren prop de 50.000 edificis i mataren aproximadament 75.000 persones (vegeu Bombardejos atòmics d'Hiroshima i Nagasaki).[22] Inicialment es cregué que l'urani era relativament rar i que la proliferació nuclear es podria evitar simplement comprant tots els estocs coneguts d'urani, però durant la següent dècada se'n descobriren grans dipòsits en molts llocs arreu del món.[30]
Reactors

El reactor de grafit X-10 (X-10 Graphite Reactor) del Laboratori Nacional d'Oak Ridge (ORNL) d'Oak Ridge (Tennessee, Estats Units), originàriament conegut com a Clinton Pile i X-10 Pile, fou el segon reactor nuclear artificial del món (després de la Chicago Pile d'Enrico Fermi) i fou el primer reactor dissenyat i construït per ser operat de manera contínua. El 20 de desembre de 1951, el reactor generador experimental I (Experimental Breeder Reactor I) de l'Argonne National Laboratory, ubicat a l'Atomic Energy Commission's National Reactor Testing Station prop d'Arco (Idaho, Estats Units), esdevingué el primer reactor nuclear que creà energia.[31] Inicialment, el reactor encengué quatre bombetes de 150 watts, però les millores dutes a terme permeteren més endavant donar potència a tota la instal·lació; més tard, la població d'Arco es convertí en la primera del món que tota la seva electricitat provenia de l'energia nuclear, en aquest cas generada pel reactor BORAX-III.[32] La primera central nuclear comercial del món, la central nuclear d'Óbninsk, a la Unió Soviètica, començà a generar energia amb el reactor AM-1 el 27 de juny de 1954. Altres centrals nuclears pioneres foren Calder Hall (Anglaterra), que començà a operar el 17 d'octubre de 1956,[33] i la Shippingport (Pennsilvània, EUA), que començà a operar el 26 de maig de 1958. L'energia nuclear s'utilitzà per primer cop per propulsar un submarí (l'USS Nautilus) l'any 1954.[23][32]
Contaminació i el llegat de la Guerra Freda

Les proves nuclears de la Unió Soviètica i dels Estats Units durant la dècada de 1950 i a principis de la dècada de 1960, juntament amb les de França durant els anys 1970 i 1980[14] deixaren una quantitat significativa de pluja radioactiva arreu del món.[34] També hi hagué pluja radioactiva i pol·lució causades per accidents nuclears.[35][36]
Els miners d'urani presenten una freqüència més elevada de càncer. S'ha documentat i relacionat amb la seva professió, per exemple, un risc superior de càncer de pulmó entre els miners d'urani Navajos.[37] La Radiation Exposure Compensation Act, una llei estatunidenca del 1990, determinà que la compensació econòmica pels miners d'urani que se'ls diagnostiqués càncer o altres complicacions respiratòries seria de 100.000 dòlars.[38]
Durant la Guerra Freda entre la Unió Soviètica i els Estats Units s'amassaren grans quantitats de reserves d'urani i es crearen desenes de milers d'armes nuclears fent servir urani enriquit i plutoni obtingut a partir de l'urani. A partir del desmembrament de la Unió Soviètica l'any 1991, s'estima que unes 540 tones d'armes d'urani altament enriquides (suficients per crear 40.000 caps nuclears) s'han emmagatzemat en instal·lacions mal vigilades de la Federació Russa i en molts altres antics estats de l'URSS.[11] La policia de l'Àsia, d'Europa i de l'Amèrica del Sud interceptà carregaments nuclears d'urani o de plutoni de contraban com a mínim en 16 ocasions durant el període 1993-2005, la majoria dels quals provenien de fonts exsoviètiques.[11] De 1993 a 2005, el Programa de protecció, control i responsabilitat de material (Material Protection, Control, and Accounting Program) dels Estats Units, dut a terme pel govern federal dels Estats Units, destinà aproximadament 550 milions de dòlars per intentar salvaguardar les reserves d'urani i de plutoni de Rússia.[11] El pressupost fou utilitzat per fer millores a les instal·lacions d'emmagatzematge i de recerca.[39]
Remove ads
Abundància natural
Biòtic i abiòtic

L'urani és un element que abunda a la naturalesa: es pot trobar en baixos nivells en totes les roques, sòl i aigua. L'urani és el 51è element pel que fa a abundància a l'escorça terrestre. També és l'element de nombre atòmic més elevat que es pot trobar de manera natural en quantitats significatives a la Terra; gairebé sempre es troba combinat amb altres elements.[9] Juntament amb tots els elements que tenen una massa atòmica superior a la del ferro, l'urani només es forma de manera natural en supernoves.[40] Es creu que la desintegració d'urani, tori i potassi-40 en el mantell terrestre és la font principal de calor[41][42] que manté líquid el nucli extern i causa la convecció mantèl·lica la qual, al seu torn, és la causa de la tectònica de plaques.
La concentració d'urani mitjana a l'escorça terrestre és (segons la referència) de 2 a 4 parts per milió[8][14] o aproximadament 40 vegades més abundant que la plata.[10] Es calcula que l'interval d'escorça terrestre que va de la superfície a 25 km de profunditat conté 1017 kg d'urani, mentre que els oceans en poden contenir 1013 kg.[8] La concentració d'urani en el sòl va des de 0,7 a 11 parts per milió (i fins a 15 parts per milió en sòl agrícola a causa de l'ús de fertilitzants amb fosfat), i la seva concentració en aigua marina és de 3 parts per mil milions.[14]
L'urani és més abundant que l'antimoni, l'estany, el cadmi, el mercuri o la plata, i és més o menys tan abundant com l'arsènic o el molibdè.[9][14] Es troba en centenars de minerals entre els quals la uraninita (la mena d'urani més comuna), la carnotita, l'autunita, l'uranofana, la torbernita i la coffinita.[9] Algunes substàncies contenen concentracions significatives d'urani, tals com els dipòsits de roques fosfòriques, així com minerals com la lignita i sorres de monazita en menes riques en urani[9] (s'obté comercialment a partir de fonts que tenen concentracions tan baixes com del 0,1% d'urani[10]).

S'ha demostrat que alguns bacteris, com Shewanella putrefaciens i Geobacter metallireducens redueixen U(VI) a U(IV).[43] Alguns organismes com el liquen Trapelia involuta o microorganismes com els citrobacteris poden absorbir concentracions d'urani que són fins a 300 vegades superiors a les de l'ambient.[44] Els citrobacteris absorbeixen ions uranil quan se'ls dona glicerol-3-fosfat (o altres fosfats orgànics similars). Un cop passat un dia, un gram de bacteris es pot incrustar amb nou grams de cristalls de fosfat d'uranil, la qual cosa crea la possibilitat que aquests organismes puguin ser usats en un futur en bioremediació per descontaminar aigua contaminada amb urani.[18][45] També s'ha descobert que el proteobacteri Geobacter bioremedia l'urani d'aigües subterrànies.[46]
A la naturalesa, l'urani (VI) forma complexos carbonats altament solubles en pH alcalí. Això n'augmenta la mobilitat i la presència al sòl i les aigües subterrànies provinents de residus nuclears, cosa que representa un perill per la salut. Tanmateix, resulta difícil precipitar urani en forma de fosfat en presència d'un excés de carbonat en pH alcalí. S'ha descobert que una soca de Sphingomonas sp. BSAR-1 expressa una fosfatasa alcalina (PhoK) de gran activitat, que ha estat utilitzada per bioprecipitar l'urani de solucions alcalines en forma d'espècies de fosfat d'uranil. Aquesta capacitat de precipitació s'ha potenciat mitjançant la sobreexpressió de PhoK en E. coli.[47]
Les plantes absorbeixen una mica d'urani del sòl. Les concentracions de pes en sec d'urani a les plantes es troben en el rang de 5 a 60 parts per mil milions, i la cendra de fusta cremada pot tenir concentracions de fins a 4 parts per milió.[18] Quantificada en pes en sec, la concentració d'urani a les plantes alimentàries és més baixa, en general. La gent n'ingereix un o dos micrograms al dia amb el menjar.[18]
Producció i explotació minera


La producció mundial d'urani el 2010 fou de 53.663 tones, de les quals 17.803 (el 33,2%) foren extretes de mines del Kazakhstan. Altres països importants pel que fa a la mineria de l'urani són el Canadà (9.783 t), Austràlia (5.900 t), Namíbia (4.496 t), el Níger (4.198 t) i Rússia (3.562 t).[48]
La mena d'urani s'extreu de les mines de diverses maneres: a cel obert, en mines subterrànies, per lixiviació in situ i per mineria de perforació (vegeu Mineria de l'urani).[6] Un mineral d'urani pobre sol contenir entre un 0,01% i un 0,25% d'òxids d'urani.[49] Els minerals rics que es troben als dipòsits d'Athabasca Basin de la regió de Saskatchewan, al Canadà, poden contenir fins a un 23% d'òxids d'urani de mitjana.[50] La mena d'urani es tritura, es converteix en una pols fina i, a continuació, es lixivia amb un àcid o un àlcali. El lixiviat resultant se sotmet llavors a una seqüència de precipitació, extracció de solvent i intercanvi de ions. La barreja resultant, anomenada yellowcake (concentrat d'urani en pols obtingut a partir de solucions lixiviades de mineral d'urani), conté com a mínim un 75% d'òxids d'urani U₃O₈. En aquest punt, el yellowcake es calcina per eliminar les impureses abans de la refinació i la conversió.[51]
L'urani de qualitat comercial es pot produir mitjançant la reducció d'halurs d'urani amb metalls alcalins o alcalinoterris, o bé mitjançant l'electròlisi de KUF₅ o UF₄ dissolts en una solució de clorur de calci (CaCl
2) i clorur de sodi (NaCl) fosos.[9] L'urani molt pur es produeix mitjançant la descomposició tèrmica d'halurs d'urani en un filament calent.[9]
Extracció d'urani per països
El que segueix és una llista de països segons l'extracció d'urani (en tones) en els anys 2005, 2009 i 2012.[52]
Producció d'urani per empreses
El que segueix és una llista d'empreses segons la producció d'urani (en tones) en els anys 2006, 2009 i 2011.[52]
L'empresa canadenca Uranium One esdevingué empresa subsidiària de la russa ARMZ el 2010.
Recursos i reserves

S'estima que existeixen 5,5 milions de tones d'urani en reserves de menes que són econòmicament viables a 59 dòlars per lliura d'urani,[53] mentre que 35 milions de tones estan classificades com a recursos minerals (prospectes raonables de cara a una futura extracció econòmica).[54] Els preus variaren de 10$/lliura el maig de 2003 fins a 138$/lliura el juliol de 2007, cosa que ha causat un gran increment en la despesa d'exploració:[52] el 2006 es destinaren mundialment 200 milions de dòlars a aquest concepte, la qual cosa representà un 54% d'increment respecte de l'any anterior.[54] La tendència continuà l'any següent, en el qual la despesa en exploració es disparà fins als 774 milions de dòlars, un increment de més del 250% respecte al 2004.[52]
Austràlia posseeix el 31% de les reserves de menes d'urani mundials conegudes[55] així com el dipòsit més gran d'urani del món, ubicat a la mina d'Olympic Dam, a Austràlia Meridional.[56] Hi ha una important reserva d'urani a Bakouma, una subprefectura de la prefectura de Mbomou a la República Centreafricana.
Part del combustible nuclear prové de les armes nuclears que s'estan desmantellant[57] com, per exemple, del Megatons to Megawatts Program.
S'estima que uns 4.600 milions de tones d'urani addicionals es troben a l'aigua de mar; científics japonesos demostraren durant la dècada de 1980 que l'extracció d'urani de l'aigua marina utilitzant intercanviadors de ions és factible.[58][59] S'han dut a terme experiments per extraure urani de l'aigua de mar,[60] però el retorn fou baix a causa de la presència de carbonats en l'aigua. El 2012, investigadors de l'ORNL anunciaren el desenvolupament d'un nou material absorbent anomenat HiCap que és capaç d'eliminar amb èxit metalls tòxics de l'aigua.[61][62]
Subministrament

El 2005, disset països produïen òxids d'urani concentrats, dels quals el Canadà (27,9% de la producció mundial) i Austràlia (22,8%) n'eren els principals productors; el Kazakhstan (10,5%), Rússia (8,0%), Namíbia (7,5%), el Níger (7,4%), l'Uzbekistan (5,5%), els Estats Units (2,5%), Argentina (2,1%), Ucraïna (1,9%) i la Xina (1,7%) també en produïren quantitats significatives,[64] i en 2014 els quatre principals productors eren Kazakhstan, Canadà, Austràlia i Níger.[65]
L'urani disponible es creu que serà suficient com a mínim fins a l'any 2090, encara que el desenvolupament de la tecnologia del reactor ràpid podria fer canviar la previsió a una disponibilitat fins d'aquí a 2.500 anys.[54] Alguns estudis indiquen, però, que la infrainversió de les darreries del segle xx pot causar problemes d'abastament durant el segle xxi.[66] Sembla que els dipòsits d'urani segueixen una distribució lognormal. La quantitat d'urani recuperable augmenta un 30.000% per cada reducció d'un 90% en la riquesa del mineral.[67] En altres paraules, hi ha disponible poc mineral ric i proporcionalment molt més mineral pobre.
Remove ads
Compostos
Òxids i estats d'oxidació
Òxids
 |
 | |
L'octaòxid de triurani (a l'esquerra) i el diòxid d'urani (a la dreta) són els dos òxids més comuns de l'urani. | ||
El yellowcake calcinat produït en la majoria de grans indústries conté una distribució d'espècies d'urani en diverses formes que van des de la menys oxidada a la més oxidada. Les partícules que tenen temps de residència baixos al calcinador són, en general, menys oxidades que les que tenen temps llargs de retenció o que les partícules recuperades a la torre de depuració. El contingut de l'urani se sol denotar per U
3O
8, fórmula que data de l'època del Projecte Manhattan, quan el U
3O
8 era utilitzat com un estàndard en química analítica.
Les relacions de fase en el sistema urani-oxigen són complexes. Els estats d'oxidació més importants de l'urani són l'urani(IV) i l'urani(VI); els seus dos òxids corresponents són, respectivament, el diòxid d'urani (UO
2) i el triòxid d'urani (UO
3).[68] També existeixen altres òxids d'urani com el monòxid d'urani (UO), el pentaòxid de diurani (U
2O
5) i el peròxid d'urani (UO
4·2H
2O).
Les formes més comunes de l'òxid d'urani són l'octaòxid de triurani (U
3O
8) i el UO
2.[69] Ambdues formes són sòlids de baixa solubilitat en aigua i relativament estables en un ventall ampli de condicions ambientals. L'octaòxid de triurani és (segons les condicions) el compost d'urani més estable i la forma que es troba més sovint a la naturalesa. El diòxid d'urani és la forma de l'urani que més s'utilitza com a combustible de reactors nuclears.[69] A temperatura ambient, el UO
2 es converteix de manera gradual a U
3O
8. A causa de la seva estabilitat, els òxids d'urani se solen considerar la forma química preferida per l'emmagatzematge i disponibilitat de l'element.[69]
Química aquosa

Les sals de molts estats d'oxidació de l'urani són solubles en aigua i poden ser estudiades en solucions aquoses. Les formes iòniques més comunes són U3+
(marró-vermella), U4+
(verda), UO+
2 (inestable) i UO2+
2 (groga), pels estats d'oxidació +3, +4, +5 i +6, respectivament.[70] Existeixen alguns compostos sòlids i semimetàl·lics tals com el UO i el US per l'estat d'oxidació formal U(II), però no es coneixen ions simples que existeixin en solució per aquest estat. Els ions del U3+
alliberen hidrogen de l'aigua i, per tant, es consideren altament inestables. L'ió dioxidourani(2+), UO2+
2, representa l'estat de l'urani (VI) i se sap que forma compostos com el carbonat de dioxidourani(2+), el clorur de dioxidourani(2+) i el sulfat de dioxidourani(2+). El UO2+
2 també forma complexos amb diversos agents orgànics quelats, dels quals el que es troba d'una manera més comuna és l'acetat de dioxidourani(2+).[70]
A diferència de les sals d'uranil de l'urani i de les formes d'ió poliatòmic catiòniques urani-òxid, els uranats –les sals que contenen un anió poliatòmic urani-òxid– generalment no són solubles en aigua.
Carbonats
Les interaccions d'anions carbonat amb urani (VI) causen que el diagrama de Pourbaix canviï molt quan el medi canvia d'aigua a una solució amb contingut de carbonat. Mentre que la gran majoria de carbonats són insolubles en aigua, els carbonats d'urani solen ser-hi solubles: això passa perquè un catió de U(VI) és capaç d'enllaçar dos oxígens terminals i tres o més carbonats per formar complexos aniònics.
 |
 |
| Urani en un medi aquós no complexant (per exemple, àcid perclòric/hidròxid de sodi)[71] | Urani en una solució carbonatada |
 |
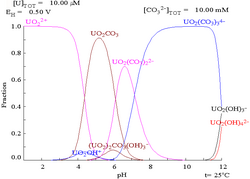 |
| Concentracions relatives de les diferents formes químiques de l'urani en un medi aquós no complexant (per exemple, àcid perclòric/hidròxid de sodi)[71] | Concentracions relatives de les diferents formes químiques de l'urani en una solució aquosa carbonatada[71] |
Efectes del pH
Els diagrames de fracció molar d'urani en presència de carbonats il·lustren el següent: quan el pH de la solució d'urani (VI) augmenta, l'urani es converteix en un òxid hidròxid d'urani hidratat i, en pH elevats, esdevé un complex d'hidròxid aniònic.
Quan s'hi afegeix un carbonat, l'urani es converteix en una sèrie de complexos de carbonats si s'incrementa el pH. Un efecte d'aquestes reaccions és l'augment de la solubilitat de l'urani en el rang de pH de 6 a 8, un fet que té una influència directa en l'estabilitat a llarg termini dels combustibles nuclears de diòxid d'urani consumits.
Hidrurs, carburs i nitrurs
El metall d'urani escalfat fins a 250-300 °C reacciona amb l'hidrogen per formar hidrur d'urani; l'assoliment de temperatures més elevades fa que s'elimini l'hidrogen de manera reversible. Aquesta propietat converteix els hidrurs d'urani en materials inicials convenients per crear pols d'urani reactiu juntament amb diversos compostos de carburs, nitrurs i halurs d'urani.[72] Existeixen dues modificacions cristal·lines de l'hidrur d'urani: la forma α, que s'obté a baixes temperatures, i la forma β, que es crea quan la temperatura de formació és superior als 250 °C.[72]
Els carburs d'urani i els nitrurs d'urani són tots dos compostos semimetàl·lics relativament inerts que són mínimament solubles en àcids, reaccionen amb l'aigua i es poden encendre en aire per formar U
3O
8.[72] Els carburs d'urani inclouen el monocarbur d'urani (UC), el dicarbur d'urani (UC
2) i el tricarbur de diurani (U
2C
3). Tant el UC com el UC
2 són formats mitjançant l'addició de carboni a l'urani fos o bé exposant el metall a monòxid de carboni a altes temperatures. El U
2C
3, d'altra banda, és estable per sota dels 1.800 °C i es prepara sotmetent una barreja escalfada de UC i de UC
2 a tensions mecàniques.[73] Els nitrurs d'urani obtinguts mitjançant exposició directa del metall al nitrogen inclouen el mononitrur d'urani (UN), el dinitrur d'urani (UN
2) i el trinitrur de duirani (U
2N
3).[73]
Halurs

Tots els fluorurs d'urani són creats utilitzant el tetrafluorur d'urani (UF
4); el propi UF
4 es prepara mitjançant la hidrofluorinació del diòxid d'urani.[72] La reducció del UF
4 amb hidrogen a 1000 °C produeix trifluorur d'urani (UF
3). Sota les condicions adients de temperatura i pressió, la reacció de UF
4 sòlid amb hexafluorur d'urani gasós (UF
6) pot formar els fluorurs intermediaris U
2F
9, U
4F
17 i UF
5.[72]
A temperatura ambient, el UF
6 té una elevada pressió de vapor, la qual cosa fa que sigui útil en el procés de difusió gasosa per separar el rar urani-235 de l'isòtop més comú urani-238. Aquest compost es pot preparar a partir de diòxid d'urani (i també d'hidrur d'urani) mitjançant el procés descrit a continuació:[72]
- UO
2 + 4 HF → UF
4 + 2 H
2O (500 °C, endotèrmic) - UF
4 + F
2 → UF
6 (350 °C, endotèrmic)
El UF
6 resultant, un sòlid blanc, és altament reactiu (per fluorinació), sublima fàcilment (emetent un vapor que es comporta gairebé com un gas ideal) i és el compost més volàtil d'urani que es coneix.[72]
Un mètode de preparació del tetraclorur d'urani (UCl
4) consisteix a combinar directament clor amb urani metàl·lic o bé amb hidrur d'urani. La reducció del UCl
4 amb hidrogen produeix triclorur d'urani (UCl
3) mentre que els clorurs d'urani més alts es preparen per reacció amb clor addicional.[72] Tots els clorurs d'urani reaccionen amb l'aigua i l'aire.
Els bromurs i iodurs d'urani es formen mitjançant la reacció directa de brom i iode amb urani, respectivament, o bé afegint UH
3 als àcids d'aquests elements.[72] Alguns exemples coneguts són el UBr
3, el UBr
4, el UI
3 i el UI
4. Els oxohalurs d'urani són solubles en aigua i inclouen els següents compostos: UO
2F
2, UOCl
2, UO
2Cl
2 i UO
2Br
2. L'estabilitat dels oxohalurs decreix amb l'augment del pes atòmic de l'halur.[72]
Remove ads
Isòtops
Concentracions naturals
L'urani natural està format per tres isòtops principals: l'urani 238 (amb una abundància natural del 99,28%), l'urani 235 (0,71%) i l'urani 234 (0,0054%). Tots tres isòtops són radioactius –emeten partícules alfa–, i també tots tres tenen poques probabilitats de patir fissió espontània en comptes d'emissió alfa.
L'urani 238 és l'isòtop més estable de l'urani: té un període de semidesintegració d'uns 4,468×109 anys, la qual equival aproximadament a l'edat de la Terra. L'urani 235 té una semivida d'uns 7,13×108 anys, i l'urani 234 de 2,48×105 anys.[74] Pel que respecta a l'urani natural, tan sols al voltant d'un 49% dels seus raigs alfa són emesos per cada àtom de 238U; també al voltant d'un 49% pel 234U (ja que aquest darrer es forma a partir del primer); i aproximadament un 2% són emesos pel 235U. Quan la Terra era jove, probablement un cinquè del seu urani era urani-235 i el percentatge d'urani 234 era molt més baix que aquest.
Normalment l'urani 238 és un emissor α (ocasionalment pateix fissió espontània) i es desintegra mitjançant la «sèrie de l'urani» de desintegració nuclear, la qual té 18 membres que, al final, es desintegren en plom-206 per mitjà de diferents camins de desintegració.[10] A més, l'urani-238 no és físsil, però és un isòtop fèrtil, perquè després de l'activació de neutrons pot produir plutoni 239, un altre isòtop físsil. De fet, el nucli del 238U pot absorbir un neutró per a produir un isòtop radioactiu urani 239. El 239U es desintegra mitjançant emissió beta en neptuni-239, també un emissor beta, que al seu torn es desintegra en pocs dies en plutoni 239. El 239Pu s'utilitzà com a material físsil en la primera bomba atòmica detonada durant l'assaig nuclear Trinity el 15 de juliol de 1945 a Nou Mèxic, als Estats Units.[23]
La cadena de desintegració del 235U té 15 membres dels quals tots acaben per desintegrar-se en plom-207.[10] Les taxes constants de desintegració d'aquesta cadena fa que la comparació de proporcions d'elements pare i fill sigui útil per la datació radiomètrica. A més a més, l'urani 235 és important tant pels reactors nuclears com per les armes nuclears, ja que es tracta de l'únic isòtop d'urani que existeix a la naturalesa en una quantitat significativa que és físsil, la qual cosa significa que pot ser dividit en dos o tres fragments (productes de fissió) mitjançant neutrons tèrmics.[10]
L'urani 234 és membre de la «sèrie de l'urani» i es desintegra en plom-206 mitjançant una sèrie d'isòtops de semivida relativament curta. D'altra banda, l'urani 233 s'obté a partir del tori 232 amb bombardeig de neutrons –normalment en un reactor nuclear– i, a més, és físsil.[9] La seva cadena de desintegració acaba amb el tal·li-205.
Enriquiment

A la naturalesa, l'urani es troba en forma d'urani 238 (99,2742 %) i d'urani 235 (0,7204 %). La separació isotòpica concentra (enriqueix) l'urani-235 fissionable per armes nuclears i la majoria de centrals nuclears, excepte per reactors de gas i reactors d'aigua pesant pressuritzada. La majoria dels neutrons alliberats per un àtom d'urani 235 que fissiona han d'impactar altres àtoms d'urani 235 per tal de sostenir la reacció nuclear en cadena. La concentració i quantitat d'urani 235 necessàries per aconseguir-ho s'anomenen massa crítica.
Per ser considerat com a enriquit, la fracció d'urani 235 ha d'estar entre el 3% i el 5%.[75] Aquest procés produeix grans quantitats d'urani empobrit d'urani 235 i enriquit (és a dir, amb una fracció incrementada) d'urani 238 anomenat urani empobrit. Per ser considerat com a empobrit, la concentració isotòpica d'urani-235 no ha de ser superior al 0,3%.[76] El preu de l'urani ha augmentat des del 2001, de manera que ara es valora la possibilitat d'enriquir els residus d'enriquiment que contenen més d'un 0,35% d'urani 235. Això ha fet pujar el preu de l'hexafluorur d'urani empobrit des de 5 $/kg el 2001 fins a 130 $/kg al juliol del 2007.[76]
El procés de centrifugació de gas, en el qual se separa l'hexafluorur d'urani (UF
6) gràcies a la diferència de pes molecular entre el 235UF₆ i el 238UF₆ mitjançant centrifugadores d'alta velocitat, és el procés d'enriquiment més barat i més utilitzat.[22] D'altra banda, el procés de difusió gasosa havia estat anteriorment el mètode principal d'enriquiment; de fet, fou utilitzat en el Projecte Manhattan. En aquest procés, l'hexafluorur d'urani és difós repetidament a través d'una membrana de plata-zinc, i els diferents isòtops de l'urani són separats gràcies als diferents coeficients de difusió (com que l'urani 238 és més pesant, la seva difusió és una mica més lenta que la de l'urani 235).[22] El mètode de separació isotòpica mitjançant làser molecular fa servir un raig làser d'energia precisa per trencar l'enllaç entre l'urani 235 i el fluor, la qual cosa deixa l'urani 238 enllaçat amb el fluor i permet la precipitació química del metall urani 235.[6] Un mètode alternatiu d'enriquiment amb làser es coneix com a separació d'isòtops mitjançant làser de vapor atòmic, i fa servir làsers regulables tals com els làsers de colorant.[77] Un altre mètode utilitzat és la difusió tèrmica líquida.[8]
Remove ads
Exposició humana
Una persona pot estar exposada a l'urani (o als seus descendents radioactius com el radó) inhalant pols de l'aire o ingerint aigua o menjar contaminats. La quantitat d'urani en l'aire sol ser molt petita; tanmateix, les persones que treballen en fàbriques que processen fertilitzants fosfatats, que viuen prop d'instal·lacions governamentals on es crearen o provaren armes nuclears, que viuen o treballen prop d'un camp de batalla modern on s'han utilitzat armes d'urani empobrit, o que viuen o treballen prop d'una central energètica de carbó, d'instal·lacions on s'extreu o es processa mena d'urani o d'instal·lacions on s'enriqueix urani, poden patir una exposició més intensa a l'urani.[78][79] Les cases o estructures que es troben a sobre de dipòsits d'urani (ja siguin dipòsits naturals o creats per l'home) poden tenir una incidència més alta d'exposició al gas radó.
La majoria de l'urani ingerit s'excreta durant la digestió. Tan sols s'absorbeix un 0,5% d'urani quan s'ingereixen formes insolubles de l'element (tals com el seu òxid), mentre que l'absorció d'una substància més soluble com l'ió uranil pot arribar a ser del 5%.[18] Tot i això, els compostos solubles d'urani tendeixen a passar ràpidament a través del cos, mentre que els compostos insolubles d'urani –especialment quan s'inhalen en forma de pols cap als pulmons– representen un perill més elevat. Un cop a dins del flux sanguini, l'urani absorbit tendeix a bioacumular-se i a romandre durant molts anys en el teixit ossi a causa de l'afinitat de l'urani cap als fosfats.[18] L'urani no és absorbit a través de la pell i les partícules alfa alliberades per l'urani tampoc la poden penetrar.
L'urani dins del cos esdevé ions d'uranil, els quals s'acumulen en teixits ossis, del fetge, dels ronyons i reproductius. L'urani es pot descontaminar de superfícies d'acer[80] i d'aqüífers.[81]
Efectes i precaucions
El funcionament normal dels ronyons, cervell, fetge, cor i altres sistemes pot resultar afectat per l'exposició a l'urani perquè, a part de ser feblement radioactiu, es tracta d'un metall tòxic.[18][82][83] L'urani també és tòxic per a la reproducció.[84][85] Els efectes radiològics generalment són locals a causa del fet que la radiació alfa, la forma primària de la desintegració del 238U, té un abast molt curt i no és capaç de penetrar la pell. S'ha demostrat que els ions uranil (UO2+
2), provinents del triòxid d'urani, del nitrat d'uranil o d'altres compostos d'urani hexavalents, causen defectes de naixement i danys al sistema immunitari en animals de laboratori.[86] Encara que l'agència estatunidenca CDC ha publicat un estudi segons el qual cap càncer humà s'ha determinat que sigui resultat d'una exposició a l'urani natural o empobrit,[87] l'exposició a l'urani i els seus productes de desintegració (especialment el radó) són coneguts a bastament com a amenaces importants per la salut.[14] L'exposició a l'estronci-90, al iode-131 i a altres productes de fissió no està relacionada amb l'exposició a l'urani, però pot ser resultat de procediments mèdics o a l'exposició a combustible de reactor gastat o als residus d'armes nuclears.[88] Encara que la inhalació accidental d'altes concentracions d'hexafluorur d'urani ha causat morts humanes, aquestes morts foren associades amb la generació d'àcid fluorhídric altament tòxic i de fluorur d'uranil i no pas amb el mateix urani.[89] El metall d'urani finament dividit presenta un perill ignífug perquè l'urani és pirofòric; petits grans poden encendre's espontàniament en aire a temperatura ambient.[9]
El metall d'urani se sol manejar amb guants; es tracta d'una protecció suficient.[90] El concentrat d'urani es maneja i s'emmagatzema de tal manera que cap persona el pugui inhalar o ingerir.[90]
Remove ads
Referències
Bibliografia
Vegeu també
Enllaços externs
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




