element químic amb nombre atòmic 60 From Wikipedia, the free encyclopedia
El neodimi és l'element químic de símbol Nd i nombre atòmic 60. Pertany a la sèrie dels lantanoides. A la temperatura ambient, es troba en estat sòlid. Fou descobert el 1885 pel químic austríac Carl Auer von Welsbach. S'empra en la fabricació d'imants.
| Neodimi | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
60Nd | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||
Blanc platejat  Línies espectrals del neodimi | |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Neodimi, Nd, 60 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Lantànids | ||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 6, f | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 144,242 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f4 6s2 2, 8, 18, 22, 8, 2 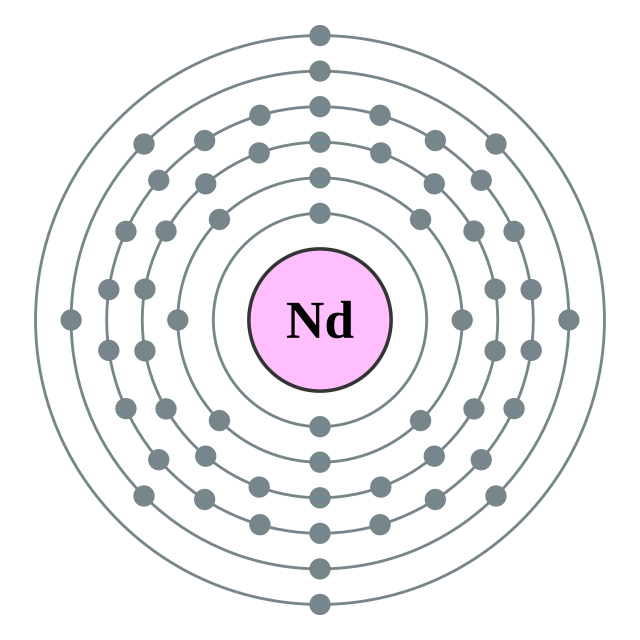 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
7,01 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
6,89 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.297 K, 1.024 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 3.347 K, 3.074 °C | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 7,14 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 289 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 27,45 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 3, 2, 1 (òxid bàsic feble) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 1,14 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 533,1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.040 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.130 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 181 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 201±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic, antiferromagnètic per sota de 20 K[1] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (t. a.) (α, poli) 643 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 16,5 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (t. a.) (α, poli) 9,6 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 2.330 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | (forma α) 41,4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | (forma α) 16,3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | (forma α) 31,8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | (forma α) 0,281 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 343 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 265 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-00-8 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del neodimi | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||

Entre les moltes afirmacions per al descobriment de nous elements n'hi havia una l'any 1839 del químic suec Carl Gustav Mosander (1797–1858) sobre un suposat element que havia anomenat en llatí didymium (en català didimi),[2] a partir del mot grec δίδυμος dídymos 'bessó', fent referència a la seva estreta relació amb el lantani; i del llatí científic –íum.[3]
El químic alemany Robert Bunsen (1811–1899), que, a la dècada de 1870, era la principal autoritat mundial en l'espectroscòpia de les terres rares, posà aquest element com un problema per a un dels seus estudiants, Carl Auer von Welsbach (1858–1929). Aquest reealitzà centenars de cristal·litzacions fraccionades necessàries per aconseguir-lo pur. El 1885 estava clar que el didimi de Mosander no era un sinó dos elements. Un tenia compostos de color lila blavós que anomenà en llatí neodymium, ‘neodimi’, de neo- ‘neo–’ “nou” i de didymium 'didimi'; per tant, amb el significat ‘el nou bessó’. L'altre, amb compostos més verdosos, l'anomenà praseodymium, ‘praseodimi’, del grec πράσιος prásios ‘verd pàl·lid’, i també de. didymium ‘didimi’, en conseqüència ‘el bessó verd’. No obstant això, el neodimi no fou aïllat fins al 1925.[4]

El neodimi mai es troba en la naturalesa com a element lliure, però forma part de cent vint-i-vuit minerals, a alguns d'ells en proporcions importants. A les roques ígnies de l'escorça de la Terra, és més de dues vegades més abundant que el plom i la meitat que el coure.[5] Els minerals que en contenen més d'un 30 % en massa són: hidroxilbastnäsita-(Nd) 65,19 %, wakefieldita-(Nd) 55,65 %, churchita-(Nd) 52,40 %, sinquisita-(Nd) 44,61 %, calcioancylita-(Nd) 42,50 %, lantanita-(Nd) 35,47 %, tundrita-(Nd) 34,89 %, rabdofana-(Nd) 33,91 % i kozoïta-(Nd) 31,63 %. També se'l troba en minerals com la sorra de monazita i en els del grup de la bastnäsita, que presenten en la seva composició petites quantitats de tots els lantanoides.[6]

El neodimi actualment és obtingut per un procés de intercanvi iònic de l'arena de monazita, un material ric en terres rares, i per electròlisi dels seus halurs. Els principals productors són la Xina, seguida de lluny pels Estats Units, Myanmar i Austràlia.[7]
El neodimi és un metall de densitat 7,008 g/cm³ a 25 °C, un punt de fusió de 1.016 °C i un punt d'ebullició de 3.074 °C. Posseeix una lluentor metàl·lica-argentada i brillant. Enfosqueix ràpidament en contacte amb l'aire formant un òxid.[8] La forma cristal·lina estable a temperatura ambient és la fase α, un empaquetatge hexagonal. A alta temperatura, superior a 883 °C, hom troba la fase β d'estructura cristal·lina cúbica centrada en el cos.[5]

El neodimi s'oxida lentament exposat a l'aire i es crema fàcilment per formar òxid de neodimi(III), blau, l'únic òxid de neodimi conegut:[9]
És força electropositiu i actua com a divalent i, majoritàriament, com a trivalent. Reacciona lentament amb aigua freda i força ràpidament amb aigua calenta per formar hidròxid de neodimi(III):[9]
Reacciona amb tots els halògens donant els corresponents halogenurs de neodimi(3+):[9]

Es dissol fàcilment en àcid sulfúric diluït per formar solucions que contenen els ions neodimi(3+), que existeixen com a complexos .[9]
Altres composts de neodimi(3+) són: el nitrat de neodimi(III) , el nitrat de neodimi(III)—aigua(1/6) , el bromat de neodimi(III)—aigua(1/9) , el sulfur de neodimi(III) , el tel·lurur de neodimi(III) , l'hexaborur de neodimi , o el silicur de neodimi .[8]
La majoria de composts del neodimi són compostos de neodimi(3+), però també n'hi ha uns pocs de neodimi(2+) com l'acetat de neodimi(II) i el clorur de neodimi(II) .[8]
El neodimi natural està compost per 5 isòtops estables: 142Nd, 143Nd, 145Nd, 146Nd i 148Nd, sent el més abundant (amb un 27,2 %) el 142Nd, i dos radioisòtops, 144Nd i 150Nd. S'han caracteritzat en total trenta-un radioisòtops del neodimi, sent el més estable el 150Nd amb un període de semidesintegració (T½ ) de més de 1,1 × 1019 anys, el 144Nd amb un 2,29 × 1015 anys, i el 147Nd amb un de 10,98 dies. Els altres isòtops radioactius tenen períodes de semidesintegració per sota dels 3,38 dies, i la majoria són inferiors als 71 segons. Aquest element també presenta 4 estats metaestables, sent els més estables: el 139Ndm (T½ = 5,5 hores), el 135Ndm (T½ = 5,5 minuts) i el 141Ndm (T½ = 62 segons).[10]


Els imants de neodimi, de composició , són els imants permanents més potents i de menys volum que existeixen des del 1984. Tot i que són més fràgils, també resulten més barats, més lleugers i més potents que els imants de samari-cobalt. S'utilitzen en els motors elèctrics dels vehicles híbrids i en els aerogeneradors, on permeten obtenir un millor rendiment de generació d'energia a partir del vent. També es fan servir en equips d'aire condicionat, en ascensors, en discos durs d'ordinador, en aparells electrònics de poc volum però amb imants de fort magnetisme, com ara auriculars petits, altaveus, micròfons, i també en vehicles i avions militars.[11]
Els imants de neodimi són aliatges de neodimi-ferro-bor i altres elements en proporcions inferiors. Essent les proporcions: neodimi 29-32 %, ferro 64,2-68,5 %, bor 1,0-1,2 %, alumini 0,2-0,4 %, niobi 0,5-1,0 % i disprosi 0,8-1,2 %.[12] Es classifiquen segons les proporcions d'aquests elements (N35, N38, N42, N38SH…). Com a regla general, com més alt és el grau (el nombre que segueix la ena, inicial de neodimi), més fort és l'imant. El grau més alt d'aquest imant, actualment, és el N52. Les lletres que segueixen aquest grau, pertanyen al grau de temperatura de l'imant que indica la temperatura màxima a la qual poden estar sotmesos. Si no segueix cap lletra, vol dir que la temperatura de l'imant és l'estàndard.[13] Els graus de temperatura poden ser: M (212 °C), H (248 °C), SH (302 °C), UH (356 °C), EH (392 °C) i AH (428 °C).[14]
El granat sintètic format per itri i alumini (YAG), dopat amb neodimi, és el component bàsic dels potents làsers Nd:YAG usats per a soldar i per a tallar materials.[11]

El neodimi, el bor i el ferro són els components dels grans imants permanents que formen part dels equips de ressonància magnètica oberta. Els làser de NdYVO₄-YAG (neodimi-itri-vanadat/itri-alumini-granat) són de gran utilitat en oftalmologia, dermatologia i otorrinolaringologia.[11]
Existeix, des d'anys, al mercat lliure per correspondència, internet i altres presentacions semipúbliques, mantes, matalassos i altres artefactes que publiciten que el neodimi emprat en aquests productes, arran del seu potent efecte magnètic, tenen propietats miraculoses davant una infinitat de malalties. La magnetoteràpia en general, i la basada en el neodimi en particular, no té la mínima base científica i, en cap cas excepte molt comptades patologies tòpiques, hauria de ser utilitzada sense consulta i prescripció facultativa. Fins i tot, en molts casos seria totalment contraproduent.[15][16][17]
El ferroceri, un material de ferro, ceri, lantani, neodimi, praseodimi i magnesi, s'usa per a fabricar pedres d'encenedor. El neodimi intervé com a catalitzador en el procés de vulcanització del cautxú per als pneumàtics de cotxes de fórmula 1; la seva intervenció fa que el pneumàtic s'agafi a l'asfalt i duri més.[11]
Probablement, a causa de la semblança amb el Ca2+, el Nd3+ fou divulgat com a element per promoure el creixement vegetal. Els compostos d'elements de les terres rares s'empren amb freqüència a la Xina com fertilitzants.
L'ampli ús del neodimi a la indústria, l'agricultura i la medicina l'ha convertit en un contaminant emergent en el medi ambient. L'augment de la contaminació per neodimi comporta perills potencials per a plantes, animals i microorganismes. Mitjançant el cribratge a escala del genoma, s'han identificat setanta mutacions de supressió del monogen de llevat sensibles als ions de neodimi. Aquests gens estan implicats principalment en el metabolisme, la transcripció genètica, la síntesi de proteica, el cicle cel·lular, el processament de l'ADN, el plegament de proteic, la modificació i els processos de transport cel·lular.[18][19]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.