element químic amb nombre atòmic 34 From Wikipedia, the free encyclopedia
El seleni és l'element químic de símbol Se i nombre atòmic 34. Es tracta d'un no-metall (rarament considerat un metal·loide) amb propietats intermèdies entre les del sofre i les del tel·luri, els seus veïns en el grup 16 de la taula periòdica. Així mateix, presenta semblances amb l'arsènic. Gairebé mai no es troba en estat elemental o natiu a l'escorça de la Terra. Fou descobert el 1817 per Jöns Jacob Berzelius, que en reconegué la semblança amb el tel·luri (anomenat en referència a la Terra) i n'encunyà el nom, derivat de σελήνη (selene), que significa ‘Lluna’ en grec antic.
| Per a altres significats, vegeu «Se (kana)». |
| Aquest article tracta sobre l'element químic. Si cerqueu el mineral natiu, vegeu «Seleni natiu». |
| Seleni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
34Se | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Al·lòtrops negres i vermells  Línies espectrals del seleni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Seleni, Se, 34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | No metalls | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 16, 4, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 78,96 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Ar] 3d10 4s2 4p4 2, 8, 18, 6 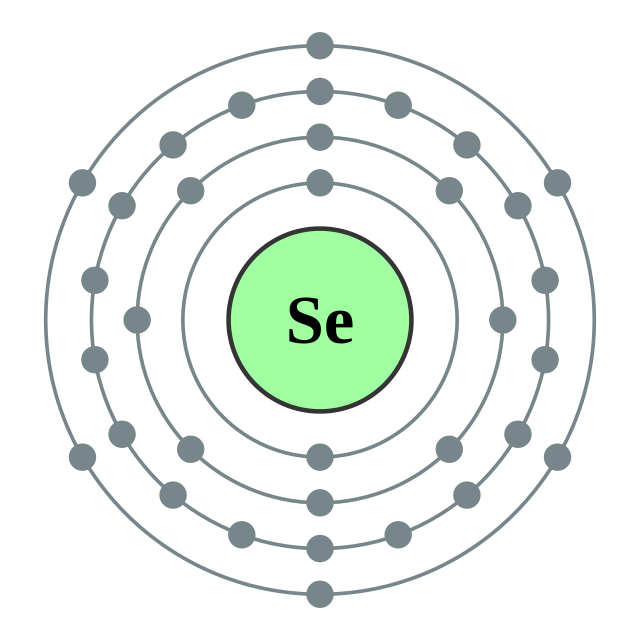 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(gris) 4,81 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(alfa) 4,39 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
(vidriós) 4,28 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
3,99 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 494 K, 221 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 958 K, 685 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt crític | 1.766 K, 27,2 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | (gris) 6,69 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 95,48 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,363 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 4, 2, 1,[1] -2 (òxid àcid fort) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,55 (escala de Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 941,0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 2.045 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.973,7 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 120±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 190 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Diamagnètic[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | (amorf) 0,519 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) (amorf) 37 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (20 °C) 3.350 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 10 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 3,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 8,3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 2,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7782-49-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del seleni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


El seleni fou descobert el 1817 pels químics suecs Jöns Jakob Berzelius (1779-1848) i Johan Gottlieb Gahn (1745-1818). Tots dos químics posseïen una planta química prop de Gripsholm, Suècia, que produïa àcid sulfúric pel procés de les cambres de plom a partir de diòxid de sofre . La pirita de la mina de Falun, emprada per obtenir el diòxid de sofre, produïa un precipitat vermell dins les cambres de plom que es pensava que era un compost d'arsènic, de manera que es paralitzà l'ús de la pirita per fer àcid sulfúric. Berzelius i Gahn analitzaren la pirita i detectaren que el precipitat vermell produïa una olor de rave picant quan es cremava. Aquesta olor no era característica de l'arsènic, però es coneixia una olor comparable dels composts de tel·luri. Berzelius escriví una carta a Alexander John Gaspard Marcet (1770-1822), un metge nascut a Ginebra i convertit en ciutadà britànic el 1800, on deia que es tractava d'un compost de tel·luri. No obstant això, l'absència de composts de tel·luri als minerals de la mina Falun portà finalment a Berzelius a reanalitzar el precipitat vermell, i el 1818 envià una segona carta a Marcet descrivint un element recentment trobat similar al sofre i al tel·luri. A causa de la similitud amb el tel·luri, anomenat així per la Terra, Berzelius anomenà el nou element selenium, seleni, del grec σελήνη selḗnē ‘Lluna’ i el llatí científic. -ium ‘-i’.[3]


El seleni es troba àmpliament distribuït en l'escorça terrestre en la majoria de les roques i sòls es troba en concentracions d'entre 0,1 i 2,0 ppm. Rarament es troba en estat natiu. S'han descrit 127 minerals que contenen seleni. Els que el contenen amb més d'un 70 %, a part del seleni nadiu, són: dzharkenita (73,87 %), ferroselita (73,87 %), kullerudita (72,91 %), trogtalita (72,82 %), penroseïta (72,72 %), krut'aïta (71,31 %) i downeyita (71,16 %).[4]
El 2022 es produïren 3 200 t de seleni al món, essent els principals producvtors la Xina amb 1 300 t, seguida del Japó amb 730 t, Rússia amb 350 t, Alemanya amb 300 t i Bèlgica amb 200 t. Les reserves calculades són de 81 t.[5]
S'obté principalment com a subproducte en el refinament del coure, car apareix en els fangs d'electròlisi junt amb el tel·luri (5-25 % Se, 2-10 % Te). La producció comercial es duu a terme per torrada amb cendres de sosa o àcid sulfúric dels fangs.[6]
Primerament, s'afegeix un aglomerant de cendres de sosa i aigua als fangs per a formar una pasta dura que s'extrusiona o talla en pastilles per a procedir al seu assecatge. La pasta es torra a 530-650 °C i se submergeix en aigua resultant seleni hexavalent que es dissol com selenat de sodi . Aquest es redueix a selenur de sodi escalfant-lo de forma controlada obtenint una solució d'un viu color roig. Injectant aire en la solució el selenur s'oxida ràpidament obtenint-se el seleni. La reducció del seleni hexavalent també pot fer-se emprant àcid clorhídric concentrat, o sals ferroses i ions clorur com a catalitzadors.[6]
El segon mètode consisteix a mesclar els fangs de coure amb àcid sulfúric torrant la pasta resultant a 500-600 °C per a obtenir diòxid de seleni que ràpidament es volatilitza a la temperatura del procés. Aquest es redueix a seleni elemental durant el procés de rentat amb diòxid de sofre i aigua, podent refinar-se posteriorment fins a aconseguir pureses de 99,5-99,7% de seleni.[6]
El seleni es pot trobar en diverses formes al·lotròpiques. El seleni amorf existeix en dues formes, la vítria, negra, obtinguda en refredar ràpidament el seleni líquid, es fon a 180 °C i té una densitat de 4,28 g/cm³; la roja, col·loidal, s'obté en reaccions de reducció; el seleni gris cristal·lí d'estructura hexagonal, la forma més comuna, es fon a 220,5 °C i té una densitat de 4,81 g/cm³; i la forma roja, d'estructura monoclínica, es fon a 221 °C i té una densitat de 4,39 g/cm³.[7]
És insoluble en aigua i alcohol, lleugerament soluble en disulfur de carboni i soluble en èter.[7]
Exhibeix l'efecte fotoelèctric, és a dir, converteix la llum en electricitat, i, a més, la seva conductivitat elèctrica augmenta en exposar-lo a la llum. Per davall del seu punt de fusió és un material semiconductor de tipus p.[7]

El seleni no reacciona amb l'aigua i crema a l'aire per formar el diòxid de seleni, que és sòlid, segons l'equació:[8]
El seleni reacciona amb el fluor per formar l'hexafluorur de seleni, un líquid de color taronja:[8]

El seleni (preferiblement suspès en disulfur de carboni) reacciona amb el clor i el brom per formar diclorur de diseleni i dibromur de diseleni, ambdós líquids i de color taronja:[8]
Fet amb cura, el seleni reacciona amb el fluor a 0 °C per formar el tetrafluorur de seleni, i també, sota condicions controlades, ho fan els altres halògens. Les reaccions són:[8]
El seleni no reacciona amb àcids no oxidants diluïts.[8]
Del seleni s'han identificat trenta-dos isòtops que van del nombre màssic 64 al 95, i tres isòmers nuclears. A la natura hom en troba sis, tots estables, que tenen nombres màssics i abundàncies: 74 (0,89 %), 76 (9,37 %), 77 (7,63 %), 78 (23,77 %), 80 (49,61 %) i 82 (8,73 %). Del 80 al 91 apareixen com a productes de la reacció de fissió nuclear de l'urani 235. Fins al seleni 75 els modes de desintegració majoritaris són l'emissió β+ o la captura electrònica. A partir del seleni 79 es desintegren per emissió d'una partícula β–. El radioisòtop amb un període de semidesintegració més llarg (t½ = 3,26 × 10⁵ anys) és el seleni 79.[9]

Les aplicacions més importants del seleni són en electrònica, per a la fabricació de cel·les fotoelèctriques i rectificadors de corrent; en la indústria del vidre, per a donar color de robí; i en metal·lúrgia, com a additiu de l'acer per a millorar les seves propietats mecàniques.[10]
El seleni és usat en la producció de vidre, perquè decolora el color verd produït per les impureses de ferro que aquest conté. Afegit al vidre que s'empra en construcció, redueix la transmissió de la calor solar. També proporciona un color vermellós al vidre i a la ceràmica.[11]
En revestiments de materials, el seleni millora l'aspecte i la durabilitat. També s'utilitza en la producció electrolítica de manganès perquè en millora la producció i el rendiment.[11]

El diselenur de coure, gal·li i indi (CIGS) és un semiconductor utilitzat en la fabricació de la capa fina conductora de les cèl·lules solars de pel·lícula prima, que són flexibles i, per tant, resulten una alternativa eficaç a les de silici cristal·lí.[11]
El seleni s'usa com a suplement dietètic per a les persones i els animals, ja que és un element essencial, tot i que en excés és tòxic.[12]
S'utilitza com a additiu al cautxú perquè en millora la resistència a l'abrasió. El sulfur de seleni és un ingredient bàsic en els xampús anticaspa, així ajuda al despreniment de la pell seca. Les fotocopiadores i impressores làser tenen un cilindre cobert de seleni que és un element clau en el procés d'impressió.[11] En fotografia s'empra per a intensificar i incrementar el rang de tons de les fotografies en blanc i negre i la durabilitat de les imatges.

El selenat de sodi és un insecticida que s'utilitza en horticultura per al control d'àcars, pugons i pseudocòccids. També s'utilitza com a fungicida.[13] En medicina es fa servir per al control de malalties animals.[14] També s'empra com a additiu per a sòls pobres en seleni.[12]
El diòxid de seleni és un catalitzador adequat per a l'oxidació, hidrogenació i deshidrogenació de compostos orgànics.[15] El seleni 75 s'empra en radiodiagnosi com a traçador en la visualització de tumors malignes.[16]
El seleni és un micronutrient que es troba en el pa, els cereals, el peix, la carn i els ous. És antioxidant, ajuda a neutralitzar els radicals lliures, indueix l'apoptosi, estimula el sistema immunitari i intervé en el funcionament de la glàndula tiroide. Està present en l'aminoàcid selenocisteïna. Les investigacions han mostrat l'existència d'una correlació entre el consum de suplements de seleni i la prevenció del càncer en humans (a causa del seu caràcter antioxidant i protector del DNA).[17]
La deficiència de seleni és relativament rara, però pot donar-se en pacients amb disfuncions intestinals severes o amb nutrició exclusivament parenteral, així com en poblacions que depenguen d'aliments cultivats en sòls pobres en seleni. La ingesta diària recomanada per a adults és de 55-70 µg; més de 400 µg pot provocar efectes tòxics (selenosi: pèrdua dels cabells, alteracions unguials, sabor metàl·lic, sudoració, trastorns gastrointestinals i depressió del sistema nerviós central).[17][18]
El seleni és considerat un element perillós per al medi ambient, per la qual cosa els seus compostos han d'emmagatzemar-se en àrees seques evitant filtracions que contaminen les aigües. Els residus de seleni es tracten en solució àcida amb sulfit de sodi, escalfant-lo després per a obtenir el seleni elemental, que presenta una menor biodisponibilitat.[19]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.