element químic amb nombre atòmic 78 From Wikipedia, the free encyclopedia
El platí és l'element químic de símbol Pt i nombre atòmic 78. Forma part del grup 10 de la taula periòdica dels elements i el període 6è. Es tracta d'un metall de transició i quan és pur és blanc grisenc, preciós, pesat, mal·leable i dúctil. És resistent a la corrosió i es troba en diferents minerals, sovint juntament amb níquel i coure; també es pot trobar com a metall. S'empra en joieria, equipament de laboratori, contactes elèctrics, empastats, i en catalitzadors de cotxes.[1] Dona nom al grup del platí de la taula periòdica o platinoides, que és un grup format per sis elements metàl·lics, ruteni, rodi, pal·ladi, osmi, iridi i platí, amb propietats físiques i químiques similars que ocupen una àrea rectangular a la taula periòdica, i que tendeixen a aparèixer junts en els mateixos jaciments minerals.
| Platí | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
78Pt | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | ||||||||||||||||||||||||||||||||||||||||||||||||||||
Blanc grisós Cristalls de platí  Línies espectrals del platí | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Platí, Pt, 78 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Metalls de transició | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | 10, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | 195,084 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Xe] 4f14 5d9 6s1 2, 8, 18, 32, 17, 1  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat (prop de la t. a.) |
21,45 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitat del líquid en el p. f. |
19,77 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 2.041,4 K, 1.768,3 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt d'ebullició | 4.098 K, 3.825 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de fusió | 22,17 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpia de vaporització | 469 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacitat calorífica molar | 25,86 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Pressió de vapor | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 6, 5, 4, 3, 2, 1, −1, −2, −3 (òxid bàsic feble) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativitat | 2,28 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 870 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.791 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi atòmic | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi covalent | 136±5 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Radi de Van der Waals | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Cúbica centrada en la cara  | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ordenació magnètica | Paramagnètic | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistivitat elèctrica | (20 °C) 105 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivitat tèrmica | 71,6 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Dilatació tèrmica | (25 °C) 8,8 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocitat del so (barra prima) | (t. a.) 2.800 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Resistència a tracció | 125−240 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul d'elasticitat | 168 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de cisallament | 61 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Mòdul de compressibilitat | 230 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Coeficient de Poisson | 0,38 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Mohs | 4–4,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Vickers | 549 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Duresa de Brinell | 392 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 7440-06-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del platí | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||
La mostra més antiga de platí treballat que es coneix és la d'un antic cofre egipci del segle vii aC, descobert a Tebes i dedicat a la reina Shapenapit. Tanmateix, aquest metall fou desconegut a Europa i Àsia durant els propers dos mil·lennis, tot i que a la costa del Pacífic de l'Amèrica del Sud, hi havia persones capaces de treballar platí, tal com demostren els objectes d'enterrament de fa 2000 anys.[2]
Els conquistadors espanyols, al segle xvi, observaren un metall blanc obtingut mentre s'obtenia l'or i que era difícil separar-lo de l'or. Li donaren el nom de platina, diminutiu del castellà plata. Creien que la platina era or que no havia madurat i se la llançava als rius amb l'esperança que completaria la seva maduració transformant-se en or. Hi ha proves anecdòtiques d'abandonament de mines d'or per contaminació per platí.[2]

El 1557, un erudit italià, Julius Scaliger, escriví sobre un metall de l'Amèrica Central que no es podia fondre i, sens dubte, havia de ser el platí. Del 1726 hi ha un manuscrit de José Sánchez de la Torre y Armas on es descriu la separació del platí de l'or. Els espanyols l'anomenaven platina del Pinto per la seva semblança amb l'argent i trobar-se en les sorres fluvials del riu Pinto, a la regió de Popayán (actual Colòmbia).[2] També es coneixia com a or blanc. Antonio de Ulloa (1716-1795) ho descriu en el seu pas pel Partit del Chocó, en la seva Relación Histórica del Viaje a la América Meridional, que publicà amb Jordi Juan (1713-1773) el 1748. Tots dos havien participat en la Missió Geodèsica Francesa (1735-1744) amb matemàtics francesos en terres del Virregnat del Perú (actuals Colòmbia, Perú i Equador), a fi de mesurar la longitud d'un arc de meridià per a dilucidar sobre el tipus d'aplatament de la Terra. En aquesta expedició Ulloa constatà que la platina no era una impuresa que perjudicava el preu de l'or, sinó un metall diferent. Quan tornava cap a Europa en un vaixell francès, aquest fou apressat per corsaris de la Royal Navy i conduït a Londres, on Ulloa i romangué dos anys la qual cosa li permeté contactar amb membres de la Royal Society,[3] essent-ne elegit membre.[2]
El 1741 l'enginyer metal·lúrgic anglès Charles Wood (1702-1774) trobà a Jamaica unes mostres de contraban de platina d'on aïllà el nou metall amb aigua règia, i l'envià al metge anglès William Brownrigg (1711-1800), qui considerà que es tractava d'un nou element químic. A la Royal Society William Watson (1715-1787) recordà el treball d'Ulloa sobre aquest metall.[3]

El platí és un element rar, ocupa la posició 75a en quan a abundància dels elements químics a l'escorça terrestre.[2] Malgrat ser molt rar se'l troba en 50 minerals. Els que el contenen amb un percentatge superior al 75%, excepte el platí natiu, són: yixunita , 83,60 %; tetraferroplatí , 77,74 %; ferroniquelplatí , 77,31 %; tulameenita , 76,57 %; isoferroplatí , 76,13 %; luberoïta , 75,54 %; i hongshiïta 75,43 %.[4]
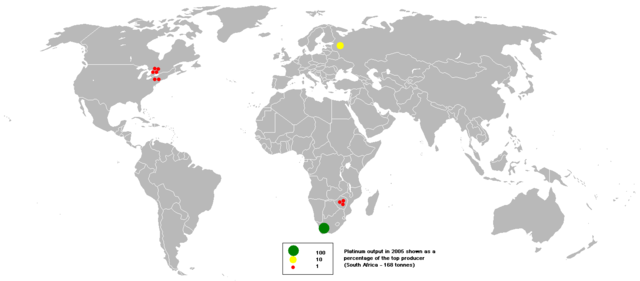
La producció mundial de platí el 2019 fou de 180 tones, essent els principals productors: Sud-àfrica amb 130 t; Rússia amb 22 t; Zimbàbue amb 15 t; el Canadà amb 7,4 t i els Estats Units amb 3,6 t.[5]
A 20 °C el platí té una densitat de 21,45 g/cm³, el seu punt de fusió és elevat, 1 768,2 °C, i el seu punt d'ebullició val 3 825 °C. És un metall de color blanc argentat, és dúctil i mal·leable. El seu coeficient de dilatació és pràcticament igual al del vidre, per la qual cosa es pot emprar per soldar elèctrodes en vidres.[6] La seva estructura cristal·lina és cúbica centrada a la cara.[7]
Els estats d'oxidació més comuns del platí són +2 i +4. És resistent a la corrosió i no es dissol en la majoria dels àcids, però sí en aigua règia i també és atacat lentament per l'àcid clorhídric, , en presència d'aire.
Un control minuciós de la reacció entre el platí i el fluor , dona lloc al fluorur de platí(VI) , un compost volàtil de color roig fosc, o al fluorur del platí(V), , de color roig intens. Aquest darrer es desproporciona en fluorur de platí(VI) i fluorur de platí(IV) . Les reaccions són:[7]
Els altres halurs de platí(4+) es formen per reacció directa del platí amb el clor, brom i iode, són de color marró vermellós, marró fosc i marró fosc:[7]

El clorur de platí(II) , també es forma en la reacció controlada del platí i clor. Depenent de les condicions de reacció, es forma una de les dues formes diferents de de colors roig fosc o verd oliva.[7]
A més d'aquests composts binaris amb halògens se'n coneixen d'altres, el més importants són: òxid de platí(II) , òxid de platí(IV) , òxid de platí(VI) , sulfur de platí(II) , sulfur de platí(IV) , selenur de platí(IV) , tel·lur de platí(II) i tel·lurur de platí(IV) . S'han sintetitzat un gran nombre de complexos de coordinació. Alguns exemples són: formes cis i trans, , , , , , , , , , , , , , i .[7]
A la natura hom pot trobar fins a sis isòtops del platí (, , , , i ), essent la seva abundància en el mateix ordre: 0,014 %; 0,782 %; 32,967 %; 33,382 %; 25,242 % i 7,163 %. El malgrat és inestable, té un període de semidesintegració de 6,5 × 1011 anys i se'l pot considerar estable a efectes pràctics. La resta són totalment estables. També s'han observat 31 altres isòtops sintetitzats artificialment o com a productes de la descomposició radioactiva d'altres núclids artificials. Aquests van des del al . El més estable és el , que té un període de semidesintegració de 50,74 anys, desintegrant-se en per captura electrònica.[8]

La principal aplicació del platí és la fabricació de catalitzadors per als tubs d'escapament dels vehicles (convertidors catalítics), on es transformen els hidrocarburs que no s'han cremat i els gasos tòxics produïts en gasos inocus. Quan els hidrocarburs, el monòxid de carboni i els òxids de nitrogen s'escalfen a uns 500 °C en presència d'oxigen, no es produeix cap reacció. Però si la mescla gasosa està en contacte amb un catalitzador de platí, o d'altres metalls com l'iridi o el rodi, aquest rebaixa l'energia d'activació de la reacció i els gasos tòxics es transformen en diòxid de carboni, aigua i nitrogen, que són inocus. Les reaccions són:[9]

El platí és un component necessari dels elèctrodes de les piles de combustible que empren els motors dels vehicles que funcionen cremant hidrogen amb l'oxigen de l'aire. El platí es diposita sobre elèctrodes porosos generalment de níquel, on serveix d'electrocatalitzador per accelerar la velocitat de les reaccions electroquímiques.[10] Aquests vehicles no emeten cap gas amb efecte hivernacle, com ara el diòxid de carboni , durant la conducció, però ofereixen encara la comoditat familiar dels vehicles convencionals. Per aquesta raó, s'espera que juguin un paper important en la lluita contra el canvi climàtic en la cerca de reduir les emissions de gasos amb efecte hivernacle.[11]
També s'utilitza per a la fabricació de bugies de llarga durada.[12]
El cisplatí, el carboplatí i l'oxaliplatí són fàrmacs antineoplàstics que s'utilitzen en el tractament de diversos càncers (quimioteràpia).[12] El cisplatí és emprat en el tractament de tumors testiculars i ovàrics, carcinomes de bufeta i limfomes, entre d'altres. El carboplatí és emprat en el tractament del carcinoma d'ovari avançat, del neuroblastoma, de la leucèmia refractària i dels càncers de bufeta, testicle, cap, coll i mama. L'oxaliplatí s'utilitza en el tractament del càncer colorectal.[13] Aquests complexos basats en el platí reaccionen in vivo, unint-se a l'ADN cel·lular i causant l'apoptosi de la cèl·lula (mort cel·lular programada). S'administren per via intravenosa.
El platí aliat amb cobalt s'utilitza en la producció de discos durs d'ordinador, ja que en millora les propietats magnètiques, i permet obtenir més capacitat d'emmagatzematge de dades.[12]
El platí és molt apreciat en la fabricació de joies per la seva gran lluïssor[12] i perquè proporciona un encastament pels diamants i altres pedres precioses. En joieria s'empra el platí del 95 % de puresa, cosa que contrasta amb l'or que només té una puresa entre el 35 i el 75 %.[14]
El platí s'usa en laboratoris de química en forma de fils, gresols, filtres, elèctrodes. També s'utilitza en la fabricació de silicones per a motlles que han d'anar al forn (fins a 500 °C).[12]
Els catalitzadors de platí són molt utilitzats en el procés d'obtenció de benzina del petroli i en la fabricació de combustibles d'alt octanatge.[12]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.