Densitat
magnitud escalar que fa referència a la quantitat de massa continguda en un determinat volum d'una substància From Wikipedia, the free encyclopedia
En física i química, la densitat (símbol d, la lletra grega ro) és una magnitud escalar que indica la massa per unitat de volum d'una substància.[1] La densitat és directament proporcional al valor de la massa i inversament proporcional al volum del cos. Matemàticament s'expressa com la massa dividida pel volum:
| Per a altres significats, vegeu «Densitat (desambiguació)». |
 El fenomen de la flotabilitat s'explica per la diferència de densitats entre l'objecte i el líquid en el qual aquest està submergit. | |
| Tipus | propietat mecànica dels materials i quantitat mesurada |
|---|---|
| Símbol | d |
| Anàlisi dimensional | M·L3 |
| Unitats | kg/m3 |
| Intensiva | Sí |
| Fórmula | |
La unitat de mesura en el Sistema Internacional és el quilogram dividit per metre cúbic (kg/m³), encara que per motius històrics i pràctics, de vegades es mesura en gram dividit per centímetre cúbic (g/cm³).[1]
Per una substància pura, la densitat té el mateix valor numèric que la seva concentració màssica. Diferents materials normalment tenen diferents densitats, les quals poden ser importants pel que fa a la seva flotabilitat, puresa i embalatge. L'osmi i l'iridi són els elements químics més densos coneguts en condicions estàndard de pressió i temperatura.
Per simplificar la comparació de densitats entre diferents sistemes d'unitats, de vegades la densitat se substitueix per la quantitat adimensional anomenada densitat relativa, la qual és la proporció entre la densitat d'un material respecte la d'un material pres com a referència (normalment l'aigua).[2] En el cas de l'aigua, per exemple, una densitat relativa inferior a la unitat significa que la substància en qüestió flota en aigua. Matemàticament la densitat relativa s'expressa així:
La densitat d'un material varia amb la temperatura i la pressió. Aquesta variació normalment és petita per a sòlids i líquids però molt més important per gasos. L'increment de pressió sobre un objecte fa decréixer el seu volum i, per tant, incrementar la seva densitat. L'increment de temperatura d'una substància (amb algunes excepcions) redueix la seva densitat, ja que n'incrementa el volum. En la majoria de materials, l'escalfament de la part inferior d'un fluid causa el fenomen de la convecció de la calor de baix cap amunt a causa de la disminució de la densitat del fluid escalfat.
La magnitud recíproca de la densitat d'una substància s'anomena volum específic, el qual és molt utilitzat en termodinàmica. La densitat és una propietat intensiva, ja que no depèn de la quantitat de substància.
Densitat d'un punt D d'un medi continu
La densitat en un medi continu és una magnitud escalar no fonamental definida en cada punt material. Sigui D un punt material d'un medi continu. Sigui una successió de volums materials de volum Vi (decreixents) i de massa mi, tals que tots continguin el punt D en el seu interior. S'anomena densitat del punt D al límit de la successió dels quocients quan Vi tendeix a 0:
Canvis de densitat
En general, la densitat es pot canviar variant o bé la pressió o bé la temperatura. Un augment de la pressió sempre augmenta la densitat d'un material. L'increment de la temperatura generalment fa disminuir la densitat, encara que existeixen excepcions notables a aquesta generalització: per exemple, la densitat de l'aigua augmenta entre el seu punt de fusió a 0 °C i els 4 °C, i es pot observar un comportament similar en la silicia a temperatures baixes.
L'efecte de la pressió i la temperatura sobre les densitats de líquids i sòlids és petit. La compressibilitat d'un líquid o sòlid sol estar al voltant dels 10−6 bar−1 (1 bar = 0,1 MDa) i la dilatació tèrmica al voltant dels 10−5 K−1. Això significa que, més o menys, es necessita deu mil vegades la pressió atmosfèrica per disminuir el volum d'una substància en un u per cent. Una expansió de volum d'un u per cent sol requerir un increment de temperatura de l'ordre de milers de graus Celsius.
En canvi, la densitat dels gasos es veu fortament afectada per la pressió. La densitat d'un gas ideal és:
On M és la massa molar, P és la pressió, R és la constant dels gasos i T és la temperatura absoluta. Això significa que la densitat d'un gas ideal pot ser doblada doblant la pressió o reduint la temperatura absoluta a la meitat.
En el cas de la dilatació tèrmica volúmica a pressió constant i per a petits intervals de temperatura, la densitat varia de la següent manera:
On és la densitat a una temperatura de referència i és el coeficient de dilatació tèrmica del material a temperatures properes a .
Densitat d'una solució
La densitat d'una solució química és la suma de les concentracions màssiques dels components de la solució:
Si l'equació anterior s'expressa com una funció de les densitats dels components purs de la mescla i la seva fracció volumètrica, queda de la següent manera (sempre que no hi hagi interacció entre els components):
Llista de densitats
Aigua
| Temp (°C)[nota 1] | Densitat (kg/m³) |
|---|---|
| 100 | 958,4 |
| 80 | 971,8 |
| 60 | 983,2 |
| 40 | 992,2 |
| 30 | 995,6502 |
| 25 | 997,0479 |
| 22 | 997,7735 |
| 20 | 998,2071 |
| 15 | 999,1026 |
| 10 | 999,7026 |
| 4 | 999,9720 |
| 0 | 999,8395 |
| −10 | 998,117 |
| −20 | 993,547 |
| −30 | 983,854 |
Notes:
| |
Aire

| T (°C) | d(kg/m³) |
|---|---|
| −25 | 1,423 |
| −20 | 1,395 |
| −15 | 1,368 |
| −10 | 1,342 |
| −5 | 1,316 |
| 0 | 1,293 |
| 5 | 1,269 |
| 10 | 1,247 |
| 15 | 1,225 |
| 20 | 1,204 |
| 25 | 1,184 |
| 30 | 1,164 |
| 35 | 1,146 |
Diversos materials
| Material | ρ (kg/m³)[nota 1] | Notes |
|---|---|---|
| Heli | 0,179 | |
| Aerografit | 0,2 | [nota 2][3][4] |
| Microretícula metàl·lica | 0,9 | [nota 2] |
| Aerogel | 1,0 | [nota 2] |
| Aire | 1,2 | A nivell del mar |
| Hexafluorur de tungstè | 12,4 | Un dels gasos coneguts més pesats en condicions estàndard |
| Hidrogen líquid | 70 | A aprox. –255 °C |
| Poliestirè extrudit | 75 | Aprox.[5] |
| Suro | 240 | Aprox.[5] |
| Liti | 535 | |
| Fusta | 700 | Estacionada, típica[6][7] |
| Potassi | 860 | [8] |
| Sodi | 970 | |
| Gel | 916,7 | A temperatura < 0 °C |
| Aigua | 1.000 | A 4 °C, la temperatura de la seva densitat màxima |
| Aigua (salada) | 1.030 | |
| Plàstic | 1.175 | Aprox.; per polipropilè i PETE/PVC |
| Tetracloroetè | 1.622 | |
| Magnesi | 1.740 | |
| Beril·li | 1.850 | |
| Glicerol | 1.261 | [9] |
| Silici | 2.330 | |
| Alumini | 2.700 | |
| Diiodometà | 3.325 | Líquid a temperatura ambient |
| Diamant | 3.500 | |
| Titani | 4.540 | |
| Seleni | 4.800 | |
| Vanadi | 6.100 | |
| Antimoni | 6.690 | |
| Zinc | 7.000 | |
| Crom | 7.200 | |
| Estany | 7.310 | |
| Manganès | 7.325 | Aprox. |
| Ferro | 7.870 | |
| Niobi | 8.570 | |
| Cadmi | 8.650 | |
| Cobalt | 8.900 | |
| Níquel | 8.900 | |
| Coure | 8.940 | |
| Bismut | 9.750 | |
| Molibdè | 10.220 | |
| Argent | 10.500 | |
| Plom | 11.340 | |
| Tori | 11.700 | |
| Rodi | 12.410 | |
| Mercuri | 13.546 | |
| Tàntal | 16.600 | |
| Urani | 18.800 | |
| Tungstè | 19.300 | |
| Or | 19.320 | |
| Plutoni | 19.840 | |
| Platí | 21.450 | |
| Iridi | 22.420 | |
| Osmi | 22.570 | |
Notes:
| ||
Altres
| Entitat | ρ (kg/m³) | Notes |
|---|---|---|
| Medi interestel·lar | 1×10−19 | Assumint 90% H, 10% He; T variable |
| La Terra | 5.515 | Densitat mitjana.[10] |
| Nucli intern de la Terra | 13.000 | Aprox.[11] |
| Nucli del Sol | 33.000–160.000 | Aprox.[12] |
| Forat negre supermassiu | 9×105 | Densitat d'un forat negre de 4,5 milions vegades la massa solar. El radi d'horitzó d'esdeveniments és de 13,5 milions de km. |
| Nana blanca | 2,1×109 | Aprox.[13] |
| Nucli atòmic | 2,3×1017 | No depèn gaire de la mida del nucli.[14] |
| Estrella neutrònica | 1×1018 | |
| Forat negre de massa estel·lar | 1×1018 | Densitat d'un forat negre de quatre masses solars El radi d'horitzó d'esdeveniments és de 12 km. |
La corona d'or d'Arquimedes
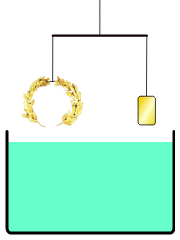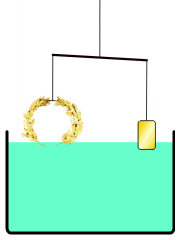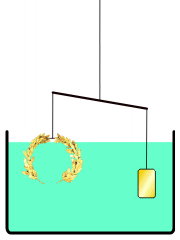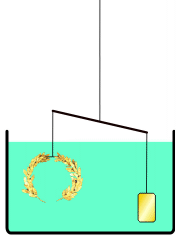
L'anècdota més coneguda sobre Arquimedes explica com va inventar un mètode per determinar el volum d'un objecte amb una forma irregular. D'acord amb Vitruvi, una nova corona amb forma de corona triomfal havia estat fabricada amb metall pintat del color d'or per Hieró II (rei de Siracusa) el qual li va demanar a Arquimedes determinar si la corona estava feta només d'or o si li havia agregat plata un orfebre deshonest.[15] Arquimedes havia de resoldre el problema sense malmetre la corona, de manera que no la podia fondre i convertir-la en un cos regular per calcular-ne la densitat.
Mentre prenia un bany, va notar que el nivell d'aigua pujava a la tina quan entrava, i així es va adonar que aquest efecte podria ser utilitzat per a determinar el volum de la corona. A causa del fet que l'aigua no es pot comprimir,[16] la corona, en ser submergida, desplaçaria una quantitat d'aigua igual al seu volum. En dividir el pes de la corona pel volum d'aigua desplaçada es podria obtenir la densitat de la corona. La densitat de la corona seria menor si altres metalls menys densos li haguessin estat afegits. Llavors, Arquimedes va sortir corrent nu pels carrers, tan emocionat pel seu descobriment que no va recordar vestir-se, cridant «Eureka!» (en grec antic: «εὕρηκα!», que significa 'Ho he trobat!').[17]
La història de la corona daurada no apareix en els treballs coneguts d'Arquimedes. A més, s'ha dubtat que el mètode que descriu sigui factible, a causa del nivell d'exactitud prohibitiu que s'hauria requerit per mesurar el volum d'aigua desplaçada.[18]
En comptes d'això, Arquimedes podria haver buscat una solució a la que aplicava el principi de la hidroestàtica conegut com el principi d'Arquimedes, descrit en el seu tractat Sobre els cossos flotants. Aquest principi planteja que tot cos submergit en un fluid experimenta una empenta vertical i cap amunt igual al pes de fluid que desallotja.[19] Utilitzant aquest principi, hauria estat possible comparar la densitat de la corona daurada amb la d'or pur en usar una balança. Situant en un costat de la balança la corona a investigar i en l'altre una mostra d'or pur del mateix pes, es procediria a submergir la balança en l'aigua; si la corona tingués menys densitat que l'or, desplaçaria més aigua a causa del seu major volum i experimentaria una major empenta que la mostra d'or. Aquesta diferència de flotabilitat decantaria la balança com correspon. Galileu creia que aquest mètode era «el mateix que va usar Arquimedes, a causa del fet que, a més de ser molt exacte, depèn encara de demostracions retrobades pel mateix Arquimedes».[20]
Vegeu també
Referències
Wikiwand - on
Seamless Wikipedia browsing. On steroids.












