Loading AI tools
刺蝟信號通路(英語:Hedgehog signaling pathway)是一個可將信息傳遞給胚胎細胞,使其正常分化的信號通路。胚胎的不同部位具有不同濃度的刺蝟信號蛋白。該通路不僅作用於胚胎,對成人也有作用。
此條目翻譯品質不佳。 (2022年12月16日) |
刺蝟因子是動物發育的關鍵調節因子之一,存在於所有兩側對稱動物中。[1]刺蝟信號通路的名稱來源於其多肽配體,一種在果蠅中發現並稱為刺蝟(Hh)的細胞內信號分子。刺蝟因子是果蠅體節極性基因產物之一,參與建立果蠅形體構型的基礎。沒有刺蝟基因的幼蟲會長得短而多刺,樣子看起來類似於刺蝟,因此得名「刺蝟」。刺蝟信號通路在胚胎發生和變態的後期階段仍然很重要。
哺乳動物有三種刺蝟同系物,即沙漠刺蝟因子(DHH)、印度刺蝟因子(IHH)和音蝟因子(SHH),其中音蝟因子研究得最充分。刺蝟信號通路在脊椎動物得胚胎發育過程中同樣重要,因此該通路在演化發育生物學中備受關注。在缺乏通路組件的基因剔除老鼠中,它的大腦、骨骼、肌肉組織、胃腸道和肺部都無法正常發育。有研究指出了刺蝟信號在調節參與成體組織維持和再生的成體幹細胞中發揮作用。
與刺蝟信號通路功能障礙相關的疾病包括癌症。[2][3][自述來源]刺蝟信號通路與某些癌症的發展有關,如基底細胞癌。[2]因此許多製藥公司正在積極開發專門針對刺蝟信號的藥物來對抗癌症。

1970年代,發育生物學的一個基本問題是了解一個相對簡單的雞蛋是如何產生複雜的分割形體構型。1970年代後期,克里斯汀·紐斯林-沃爾哈德(Christiane Nüsslein-Volhard)和艾瑞克·威斯喬斯(Eric Wieschaus)分離出了控制果蠅分割前後體軸發育的突變基因。[4]飽和突變技術讓他們發現了一組參與身體分割發育的基因,這幫助他們建立了進化發育生物學領域。[5]1995年,他們與愛德華·巴茨·路易斯(Edward B. Lewis)因研究果蠅胚胎發生中的基因突變而共同獲得諾貝爾獎。[6]
果蠅刺蝟(hh)基因於1992年由Jym Mohler、Philip Beachy、Thomas B. Kornberg和Saigo Kaoru的實驗室獨立克隆出來。它被確定為對創造身體前後部分的差異很重要的幾個基因之一。[7]
一些刺蝟突變體會導致胚胎的形狀異常,與野生型胚胎相比,它們顯得異常粗短。已經根據刺蝟體節性基因對幼蟲角質層細齒的正常極化分布的影響以及成蟲得腿和觸角等附屬物的特徵進了行研究以了解其功能。[8]不同於正常的細齒模式,刺蝟突變體幼蟲具有密集的細齒。(圖1)
粗短和毛茸茸的幼蟲的出現啟發了「刺蝟」這個名字。


昆蟲細胞表達Ci蛋白(Cubitus interruptus),一種全尺寸的鋅指轉錄因子。Ci蛋白與驅動蛋白樣蛋白Costal-2(Cos2)形成複合物,並定位於與細胞微管結合的細胞質中(圖2)。SCF複合物靶向全長的Ci蛋白(155kDa)進行蛋白酶體依賴性裂解,從而產生一個75kDa的片段,即CiR。CiR在細胞中積累並擴散到細胞核中。在那裡它將作為刺蝟靶基因的共阻遏物發揮作用。[9]
Ci蛋白通過幾種蛋白激酶,如PKA、糖原合成酶激酶-3和酪蛋白激酶1等的磷酸化作用而水解(圖2)。[10]果蠅Slimb蛋白是SCF複合物的一部分。Slimb靶向蛋白質進行泛素化並和磷酸化後的Ci蛋白結合。
在沒有刺蝟信號蛋白的情況下(圖3),一種稱為PTCH(Patched)的細胞表面跨膜蛋白會阻止稱為SMO(Smoothened)的G蛋白偶聯受體[11]的高表達和活性。PTCH與已知的膜轉運蛋白具有序列相似性。當刺蝟信號蛋白存在於細胞質外時,刺蝟信號蛋白會與PTCH結合併抑制其活性,從而使SMO積累並抑制Ci蛋白的水解。這個過程很可能會涉及SMO和Costal-2的直接相互作用,並且可能將含有Ci蛋白的複合物封存到一個微域中,導致Ci蛋白水解過程被破壞。[9]目前尚不清楚刺蝟信號蛋白與PTCH的結合為什麼會導致SMO的水平升高(圖3中的相互作用1)。在刺蝟信號蛋白與PTCH結合後,SMO的水平大大高於PTCH未與刺蝟信號蛋白結合時SMO在細胞中保持的水平。[12]有人認為,有可能SMO的磷酸化在SMO水平的刺蝟依賴性調節中起作用。[13]
在具有刺蝟信號蛋白激活的PTCH的細胞中,完整的Ci蛋白會在細胞質中積累,並且CiR水平會降低,從而允許某些基因的轉錄,例如Decapentaplegic(Dpp,骨塑型蛋白生長因子家族的成員)。對於其他刺蝟蛋白調節基因,表達不僅需要CiR的缺失,還需要未切割的Ci蛋白作為轉錄激活因子來積極的調控。[10]Costal-2通常是將Ci蛋白保留在細胞質中的關鍵蛋白,但SMO與Costal-2的相互作用會允許一些完整的Ci蛋白進入細胞核。
果蠅Fu蛋白(Fused)是一種與Costal-2結合的蛋白激酶。Fu可以抑制SUFU(Fu抑制因子),後者又與Ci蛋白相互作用以調節某些細胞類型中的基因轉錄。[14]

刺蝟信號通路在幼蟲體節發育和成蟲附肢形成中發揮作用。在發育中的果蠅胚胎的體節形成期間,合成轉錄因子Engrailed基因的細胞條帶也可以表達細胞間的刺蝟信號蛋白(圖4中的綠色)。刺蝟信號蛋白不能自由地遠離製造它的細胞,因此它只會激活與表達engrailed的細胞相鄰的一條細條的細胞。當以這種局部方式發揮作用時,刺蝟信號蛋白會以旁分泌因子的形式發揮作用。在刺蝟蛋白與受體蛋白PTCH產生相互作用後,只有位於表達engrailed的細胞的一側的細胞才能對刺蝟信號蛋白做出反應(圖4中的藍色)。
具有刺蝟激活的PTCH受體的細胞合成Wingless蛋白(圖4中的紅色)。如果改變果蠅胚胎,使其在所有細胞中產生刺蝟蛋白,所有感受態細胞都會做出反應,並在每個區段中形成更寬的Wingless表達細胞帶。Wingless基因有一個上游轉錄調節區,以刺蝟依賴性的方式與Ci轉錄因子結合,導致鄰近刺蝟蛋白產生細胞條帶的細胞中的Wingless轉錄增加(圖3中的相互作用2)。[15]
Wingless蛋白作為一種細胞外信號,通過激活其細胞表面的捲曲受體來排列相鄰的細胞行。Wingless蛋白作用於表達engrailed的細胞以穩定engrailed表達的條帶。Wingless蛋白是細胞間信號蛋白Wnt家族的成員。刺蝟蛋白和Wingless蛋白的相互信號傳遞穩定了副體節之間的邊界(圖4頂部)。Wingless蛋白和刺蝟信號蛋白對每個節段中其他細胞條帶的影響建立了一個位置代碼,該代碼說明了節段前後軸上不同的解剖特徵。[16]
Wingless蛋白之所以被稱為「Wingless」,是因為一些無翼果蠅突變體的表型。Wingless蛋白和刺蝟蛋白在變態過程中共同發揮作用,協調翅膀的形成。刺蝟蛋白在發育中的果蠅四肢的後部表達。刺蝟蛋白還參與眼睛、大腦、性腺、腸道和氣管發育的協調。刺蝟蛋白的下調被認為與片腳類動物鉤蝦的眼睛發育減少有關。[17]
刺蝟信號通路也參與環節動物的分節,因為平行進化似乎不太可能,這表明兩個門之間的分節有共同的起源。[18]雖然刺蝟因子不會誘導分節的形成,但它似乎在分節出現後起到穩定分節區域的作用。[18]
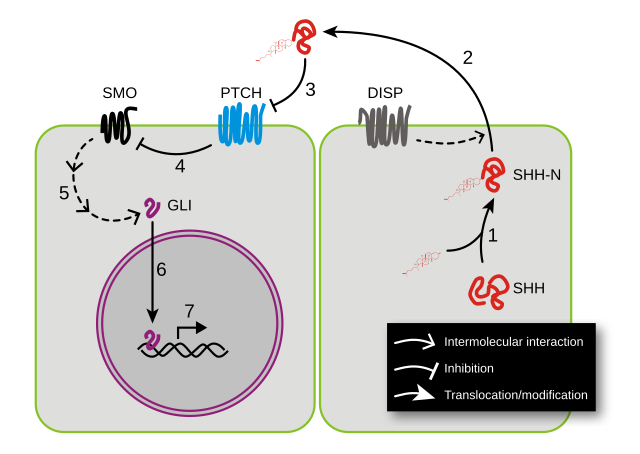
音蝟因子(SHH)是脊椎動物通路中研究最充分的配體。大多數關於刺蝟信號的已知信息都是通過研究SHH建立的。它被翻譯為~45kDa前體並經歷自催化處理(圖5中的過程1),產生~20kDa N端信號結構域(稱為SHH-N)和一個~25kDa C端結構域,沒有已知的信號作用。在裂解過程中,膽固醇分子被添加到N端結構域的羧基端,[19]參與配體的運輸、分泌和受體相互作用。SHH能以自分泌的方式發出信號,並影響產生它的細胞。分泌和隨之而來的旁分泌刺蝟信號需要DISP(Dispatched)蛋白的參與(圖5中的過程2)。
當SHH到達其靶細胞時,它會與PTCH1(Patched-1)受體結合(圖5中的過程3,藍色分子)。在沒有配體的情況下,PTCH1會抑制SMO,這是該通路中的下游蛋白(圖5中的過程4)。有人認為SMO是由一種小分子調節的,其細胞定位則由PTCH控制。[20]PTCH1與尼曼匹克症C1型(NPC1)具有同源性,已知後者可以跨膜運輸親脂性分子。[21]PTCH1有一個甾醇感應結構域(SSD),已被證明對抑制SMO的活性至關重要。[22]目前的一個理論認為,PTCH通過從SMO中去除氧化膽固醇來調節SMO。PTCH的作用類似於膽固醇泵,可去除由7-脫氫膽固醇還原酶產生的氧化膽固醇。[23]當刺蝟蛋白結合或PTCH的SSD發生突變時,泵被關閉,並允許氧化膽固醇積聚在SMO周圍。

這種膽固醇的積累使SMO變得活躍或在膜上停留更長的時間。這一假設得到了作用於SMO的通路的許多小分子激動劑和拮抗劑的支持。SHH的結合解除了SMO的抑制,導致GLI轉錄因子的激活(圖6中的過程5):激活因子Gli1和Gli2以及抑制因子Gli3。將SMO連接到GLI的分子事件的序列知之甚少。被激活的GLI在細胞核中積累(圖6中的過程6)並控制刺蝟靶基因的轉錄(圖6中的過程7)。最近有報告稱PTCH1通過獨立於SMO受體的機制抑制刺蝟靶基因的轉錄。[24]
除了PTCH1,哺乳動物還有另一個刺蝟受體,PTCH2,其序列對比與PTCH1的一致性為54%。[25]那三種哺乳動物刺蝟因子都以相似的親和性結合這兩種受體,因此PTCH1和PTCH2不能區分配體。然而,它們的表達模式確實不同。PTCH2在睪丸中的表達水平更高,並在那裡調節沙漠刺蝟信號。[25]PTCH2似乎有一個與PTCH1不同的下游信號作用。在沒有配體結合的情況下,PTCH2抑制SMO活性的能力下降。[26]此外,在基底細胞癌中,PTCH2的過度表達並不能取代突變的PTCH1。[27]
在無脊椎動物中,就像在果蠅中一樣,刺蝟信號蛋白與PTCH的結合會導致配體的內化和封存。[28]因此,刺蝟信號蛋白在體內通過表達受體的感受野會導致信號衰減,這種效應稱為配體依賴性拮抗(LDA)。與果蠅相反,脊椎動物通過刺蝟相互作用蛋白1(HHIP1)介導的LDA具有另一種水平的刺蝟調節。HHIP1也能封存刺蝟配體,但與PTCH不同,它對SMO的活性沒有影響。[29]

刺蝟家族的成員在各種發育過程中發揮著關鍵作用。[16]研究得最充分的例子之一是音蝟因子在脊椎動物肢體發育過程中的作用。1968年,[30]Saunders和Gasseling對小雞肢芽的發育所做的經典實驗[31]形成了形態發生素概念的基礎。他們表明,小雞肢體中的Digit的特性是由極化活動區(ZPA)產生的被動運輸因子決定的,ZPA是位於肢體後緣的一個小區域的組織。哺乳動物的發育似乎遵循同樣的模式。這種被動運輸的因子後來被證明是音蝟因子。然而,直到現在,音蝟因子究竟如何確定Digit的特性仍然是個謎。目前由Harfe等人提出的模型指出,[32]接觸音蝟因子的濃度和時間都決定了小鼠胚胎組織的發育走向。(圖6)
Digit V、IV和部分的III是直接來自在胚胎發生過程中表達音蝟因子的細胞。在這些細胞中,音蝟因子以自分泌的方式發出信號,這些Digit在沒有DISP的情況下正常發育,而DISP是配體的細胞外擴散所必需的。這些Digit在音蝟因子持續表達的時間長度上有所不同。最靠後的是Digit V,由表達配體時間最長的細胞發育而來。而Digit IV細胞表達音蝟因子的時間較短,Digit III細胞表達時間則更短。Digit II由暴露在中等濃度的細胞外音蝟因子中的細胞發展而來。Digit I的發育不需要音蝟因子。從某種意義上說,它是肢芽細胞的默認程序。
刺蝟信號在成人中仍然很重要。音蝟因子已被證明可以促進來自各種組織的成體幹細胞的增殖,包括原始造血細胞、[33]乳腺[34]和神經幹細胞。[35]毛囊從靜止期過渡到生長期需要刺蝟信號通路的激活。[36]由於在動物模型中發現的毒性,這一點失敗了。[37]
在胚胎發育過程中,通過有害突變或妊娠的母親服用致畸劑等,刺蝟信號的中斷可導致嚴重的發育異常。全前腦畸形是指胚胎前腦不能分裂形成大腦半球,發生概率約為每8,000名活產嬰兒中有1人患有,每200名自然流產嬰兒中有1人患有,通常與參與刺蝟通路的基因突變有關,包括音蝟因子和PTCH。[38]如果妊娠期的哺乳動物食用了通路抑制劑環杷明,就會導致全前腦畸形中最嚴重的缺陷之一,獨眼畸形。[39]
刺蝟信號通路的激活與各種器官的癌症發展有關聯,包括腦、肺、乳腺、前列腺和皮膚。基底細胞癌是最常見的癌症惡性腫瘤,與刺蝟信號通路的關係最為密切。在患有這種疾病的患者中發現PTCH的功能喪失性突變和SMO的激活性突變。[40]刺蝟信號通路的異常激活可能通過將成體幹細胞轉化為癌症幹細胞而導致疾病的發展,從而產生腫瘤。癌症研究人員希望,刺蝟信號的特異性抑制劑能夠為各種惡性腫瘤提供有效的治療。[41]刺蝟信號通路和癌症發展之間的聯繫是非常複雜的。然而,很明顯刺蝟信號的異常激活會導致腫瘤細胞的生長、增殖和侵襲。[42]除了參與癌症的發展外,刺蝟信號通路還可能導致主要的呼吸系統疾病,如肺纖維化,[43]和慢性阻塞性肺病等。[44][45][46]
靶向此通路的最常見方法是調節SMO。SMO的拮抗劑和激動劑已被證明會影響下游的通路調節。目前有幾種刺蝟信號通路抑制劑可用於癌症治療,如維斯莫吉布(vismodegib)和索尼吉布(sonidegib)。這些藥物被認為是有前途的癌症治療藥物,特別是對於難治性或晚期癌症患者。SMO抑制劑代表了對某些類型癌症的潛在治療方法。然而,由於SMO抑制劑的有害和潛在的毒副作用,在兒童中的安全性尚未確定,以及有證據表明一些病人對SMO抑制劑產生抗性,因此需要新的藥物類別。[42]臨床上最先進的SMO靶向劑是競爭性環杷明。伊曲康唑(藥品名為斯皮仁諾)也被證明可以通過不同於環巴胺和維斯莫吉布的機制靶向SMO。[47]伊曲康唑在賦予維斯莫吉布和其他競爭性環杷明拮抗劑(如沙利吉布和索尼吉布[48])抗性的突變存在時抑制SMO。PTCH[49]和Gli3(5E1)[50]抗體也是調節刺蝟信號通路的一種方式。下游效應器和強轉錄激活劑SiRNA Gli1已被用於抑制細胞生長和促進細胞凋亡。[51]砒霜(三氧化二砷)也被證明可以通過干擾Gli的功能和轉錄來抑制刺蝟信號。[52][53]
刺蝟信號傳導的幾個環境修飾物已被確認,它們是潛在的健康或發育危害。在番茄(番茄鹼)、[54]馬鈴薯(茄啶)、[54]茄屬植物如辣椒和茄子(茄解定)[54]及薑黃(薑黃素)[55]中發現的膳食生物鹼已被證明可以對抗SMO並擾亂刺蝟信號。此外,某些環境毒物可以阻斷刺蝟信號傳導。胡椒基丁醚(PBO)是1940年代開發的一種半合成農藥添加劑,可以在上千戶家庭和農產品中找到。[56]儘管PBO被廣泛使用,但直到最近才認識到它能夠抑制刺蝟信號傳導並作為一種強有力的發育致畸劑。[57][58]
刺蝟信號通路的激活導致血管生成因子(血管生成素1和血管生成素2)、[60]周期蛋白(周期蛋白D1和周期蛋白B1)[61]和抗凋亡基因的增加以及凋亡基因(Fas)的減少。[62]

作為原始脊索動物的文昌魚,只擁有一個果蠅刺蝟的同源物(圖7)。另一方面,脊椎動物有幾個刺蝟配體,它們屬於三個亞群,即沙漠刺蝟亞群、印度刺蝟亞群和音蝟亞群,每個亞群由一個哺乳動物基因代表。這是脊椎動物進化史早期發生的兩輪全基因組複製的結果。[65]兩個這樣的事件會產生四個同源基因,可以肯定的是其中一個已經丟失了。沙漠刺蝟是與果蠅刺蝟關係最密切的。在一些物種中發生了額外的基因重複,[16]例如斑馬魚,它在音蝟組中有一個額外的Tiggywinkle刺蝟(TwHH)基因。各種脊椎動物譜系使刺蝟適應了獨特的發育過程。例如,X.laevis帶狀刺蝟的同源物參與了蠑螈肢體的再生。[66]
音蝟因子在導致人類的靈長類譜系中經歷了加速進化。[67]Dorus等人假設,這允許對蛋白進行更複雜的調節,並可能在人腦體積和複雜性的增加中發揮了作用。
Wnt受體的捲曲家族與SMO有一定的序列相似性。[68]SMO似乎是G蛋白偶聯受體超家族中功能最不一樣的成員。Wnt和刺蝟信號通路之間的其他相似之處也已被發現。[69]Nusse觀察到,一個基於脂質修飾蛋白和特定膜轉運蛋白的信號系統很古老,Wnt和刺蝟信號通路可能是從那兒演化而來。
有人認為,無脊椎動物和脊椎動物在SMO下游的信號傳遞已經有了很大的分歧。[70]SUFU在脊椎動物中的作用有所增強,而在果蠅中作用相對較小。Costal-2在果蠅中特別重要。蛋白激酶Fu是果蠅SUFU的調節器,但可能在脊椎動物的刺蝟信號通路中不起作用。[71]在脊椎動物中,刺蝟信號與纖毛的發育密切相關。[72]
刺蝟蛋白家族中存在顯著的結構域級進化,N端結構域(hedge)和C端結構域(hog),它們後來拼接在一起成為一個轉錄單元。[73][74]Hog結構域包含一個稱為Hint(刺蝟INTein)的序列,它在序列和功能上與細菌和真菌內含肽相似。[75]Hog結構域存在於許多真核生物的分支中,即紅藻、苔蘚、雙鞭毛蟲、角叉菜和其他單細胞真核生物。[76]領鞭毛蟲(Choanoflagellate)含有一個名為hoglet的基因,該基因也編碼刺蝟C端結構域Hog結構。然而,領鞭毛蟲和低等真核生物不包含任何類似於hedge結構域的區域,這表明hoglet首先進化了。[75][76]多孔動物(Porifera)既有hedge樣蛋白(稱為hedgling),也有hog樣蛋白,但它們作為兩個完全獨立的轉錄單元存在。[73][74]刺胞動物(Cnidaria)含有hedgling和hog這兩種基因,而且它也有完整的hedgehog基因,這說明hedge和hog是在多孔動物和刺胞動物的最後一個共同祖先之後拼接成刺蝟(hedgehog)的。[74]
兩側對稱動物不包含hedgling基因,這表明在這一分支從其他後生動物中分裂出來之前,這些基因已經丟失了。[1]然而,不含Hedge結構域的含Hog結構域的基因存在於幾個兩側對稱譜系中,即冠輪動物和線蟲動物。[77]刺蝟樣基因、PTCH2同系物和PTCH相關基因存在於秀麗隱杆線蟲(Caenorhabditis elegans)中。[78][79]這些基因已被證明是編碼在秀麗隱杆線蟲發育中發揮作用的蛋白質。[78][79]雖然刺嘴綱線蟲保留了真正的刺蝟基因,但色矛綱線蟲已經失去了原型刺蝟基因,取而代之的是進化出了61個不同的半同源基因,這些基因具有與Hog相關的新N端結構域。[76][77]這些與秀麗隱杆線蟲中的Hog有關的N端結構隨後被分類,最初是Warthog(WRT)和Groundhog(GRD),然後是Ground-like(GRL)和Quahog(QUA)。[78][79]秀麗隱杆線蟲以及其他線蟲物種已經失去了GPCR SMO。[78][79]
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.