热门问题
时间线
聊天
视角
阿尔茨海默病
人类疾病 来自维基百科,自由的百科全书
Remove ads
阿尔茨海默病(英语:Alzheimer's disease,AD)是一种发病进程缓慢、随着时间不断恶化的神经退化性疾病,占了痴呆症成因的六至七成[1][2]。阿尔茨海默病早期最常见的症状为丧失短期记忆(难以记住最近发生的事件),当疾病逐渐进展,症状可能逐渐出现,包括语言障碍、定向障碍和自能障碍(包括容易迷路)、情绪不稳、丧失动机、无法自理和许多行为问题[1][2]。当情况恶化时,患者往往会因此和家庭或社会脱节[1],并逐渐丧失身体机能,最终导致死亡[15]。虽然疾程因人而异,但诊断后的平均余命约为三到九年[7][16]。
此条目需要更新。 (2023年8月3日) |
1906年,德国精神学家与病理学家阿洛伊斯·阿尔茨海默首先描述并随后命名了阿尔茨海默病[17]。阿尔茨海默病的真正成因至今仍然不明[1]。目前将阿尔茨海默病视为一种神经退化的疾病,并认为有将近七成的风险因子与遗传有关[4];其他的风险因子还有头部外伤、忧郁症和高血压[1]。疾病的进程与大脑中的纤维状类淀粉蛋白质斑块沉积和Tau蛋白有关[4]。 要诊断阿尔茨海默病,需根据病人病史、行为评估、认知测验、脑部影像检查和血液采检来排除其他可能的因素[5]。阿尔茨海默病患者的发病年龄一般在65岁以上,但大约有4%到5%的患者会在65岁之前就发病,属于早发性阿尔茨海默病[3]。65岁以上的盛行率约为6%[1]。疾病初期的症状常被误认为是正常老化[1]。确诊则需借助脑部组织检验[4]。脑力和身体运动、避免肥胖都有助于减少罹患阿尔茨海默病的风险[4][18]。
2015年,全球大约有2980万人罹患阿尔茨海默病[2][19];同年研究显示,痴呆症造成约190万人死亡[20]。在发达国家中,阿尔茨海默病是耗费最多社会资源的一种疾病[21][22]。目前并没有可以阻止或逆转阿尔茨海默病病程的治疗,亦没有循证证明特定药物或营养补充品对疾病治疗有效[23],只有少数方法或许可以暂时缓解或改善症状[2]。疾病会使患者会越来越需要他人的照护,这对照护者是一大负担;这样的照护压力涵括了社会、生理、精神和经济等各个层面[24]。运动计划能改善病人的日常生活功能,并可能可以改善预后[25]。由痴呆症状引起的行为异常和思觉失调常以抗精神病药治疗,惟其效益不高且可能增加死亡率,因此通常不建议使用[26][27]。
Remove ads
症状和征候
阿尔茨海默病的分期[28]
阿尔茨海默病的病程根据认知能力和身体机能的恶化程度分成四个时期,以下分段说明。
阿尔茨海默病最初的症状常被误认为是老化或是压力[29],但若进行详细的神经心理学检查,甚至能在确诊为阿尔茨海默病八年前就可发现轻微的认知困难[30]。这些早期症状可以影响大部分复杂的日常生活活动[31],最明显的缺陷是短期记忆障碍,主要是难以记住最近发生的事和无法吸收新资讯[30][32]。
其他症状包括注意力管控、计划事情、弹性处理、抽象思考和语义记忆等方面的问题[30]。冷漠也是此时期会出现的症状之一,并会是在病程中持续出现的精神症状[33]。阿尔茨海默病的临床前期也被称作轻微认知障碍(MCI)[34],这是一个介于正常和失忆症之间的过渡状态,但MCI可以是许多综合症的表现,而当它以记忆丧失为主要表现时,则称作失忆性轻微认知障碍(amnestic MCI),此一名词常被用来称呼阿尔茨海默病的临床前期[35]。
Remove ads
阿尔茨海默病病患的学习与记忆障碍会愈见明显,最后使医师能确认诊断。在少部分病患中,语言障碍、执行障碍、认识障碍(失认症)或技能执行障碍(失用症)会比记忆障碍更明显[36]。阿尔茨海默病并不会对所有记忆能力都有同等的影响,相对于新近发生的事情或记忆,病患长期的情节记忆、语义记忆和内隐记忆(身体记住如何做一件事,例如使用叉子吃东西)受到的影响比较少[37][38]。
阿尔茨海默病患者的语言障碍主要为原发性进行性失语症,特征是病患可使用的词汇变少,且流畅度降低,导致病患的口语和书面表达变得困难[36][39]。在这一时期,病患通常还能适当表达简单的想法[36][39][40];当进行精细动作时(如写作、画图、或是穿衣),可能会出现些微的动作不协调和计划困难(失用症),但这些征兆常会被忽略。随着疾病进展,阿尔茨海默病病患通常仍能独立完成许多事情,但是大部分需要认知功能的活动可能就需要协助或是监督。[36]
随着病情恶化,病患将失去独立生活的能力,而无法进行大部分的日常活动[36]。患者的语言障碍逐渐变得明显,常会无法想起词汇(命名不能症),会使用错误的字汇来替换(言语错乱症),同时也渐渐失去读写能力,[36][40]患者在执行复杂的动作序列时会变得不协调,增加了跌倒的风险[36]。在这一时期,记忆问题也会恶化,病患可能无法认出亲近的家属[36],之前仍完整的长期记忆也受到影响[36]。
此时期行为和神经精神病学的变化也更为显著,常见的表现包括游荡、易怒和情绪不稳,这些变化会导致病患突然哭泣、突发的非故意攻击行为、或是拒绝接受照顾[36],此时也会出现日落综合症[41]。大约30%的患者会产生出现妄想错认或其他妄想症状[36],另外也可能会尿失禁[36]。患者无法体认到疾病的进展(病觉缺失症,即缺乏病识感)[36]。这些症状都会对家属或照护者带来压力,由居家照护转至长期照护机构可减轻此类压力[36][42]。
Remove ads
在阿尔茨海默病的最终时期,病患已经完全依赖照护者[36],语言能力退化至简单的词语甚至仅有单字,最后完全失去谈话能力,[36][40]除了失去口语能力之外,病患通常能理解并回应情感刺激[36],虽然攻击行为仍然存在,但大多时间表现得极度冷漠和疲倦[36],病患最终无法独立进行任何简单的事情[36],肌肉品质和行动能力退化至长期卧床,也无法自行进食[36]。阿尔茨海默病是一种绝症,但死因通常是外在因素,例如褥疮感染或肺炎,而不是疾病本身[36]。
病因
大部分病患罹患阿尔茨海默病的原因仍然不明(除了1%到5%的病患可以找到基因差异)[43][44]。目前有几个不同的假说尝试解释阿尔茨海默病的病因。
根据双胞胎和家族研究,阿尔茨海默病的基因遗传性约在49%到79%之间[45][46]。约0.1%家族性遗传的患者为体染色体显性遗传,他们常在65岁前发病,称为早发性家族性阿尔茨海默病[47]。前类淀粉蛋白质基因APP 、早老素基因 PSEN1 和 PSEN2 是目前家族型阿尔茨海默病已知的相关基因中,最有直接证据会导致阿尔茨海默病的基因[48]。这三个突变都会影响前类淀粉蛋白(APP)的切除,导致类淀粉蛋白斑块的主要成分Aβ42在细胞中的产量升高[49],一些突变虽然不增加Aβ42的产量,但会改变细胞内Aβ42和其他主要同型异构物(特别是Aβ40)的比例[50][51]。
阿尔茨海默病患者多数没有上述的体染色体遗传,称为偶发型阿尔茨海默病。但有些基因或环境因素仍可能是罹患此病的危险因子。最著名的基因危险因子是载脂蛋白E(APOE)的ε4等位基因[52][53],约有40%到80%的病患带有至少一个APOEε4等位基因[53],其中异型合子的个体罹患风险增加3倍,而同型合子则增加15倍[47]。然而,环境或基因造成的影响并不一定会完全表现出来。举例来说,不同于其他族群,部分尼日利亚族群罹患阿尔茨海默病的几率和发病年龄与其是否带有APOEε4没有相关[54][55]。遗传学家已经检验超过400个候选基因与迟发性偶发性阿尔茨海默病(LOAD)的关联,但大部分的基因都没有发现明显相关性[47][56]。近期使用全基因组关联分析(GWAS)的研究则找到了19个可能会影响罹病风险的基因区块[57],这些基因为CASS4、CELF1、FERMT2、HLA-DRB5、INPP5D、MEF2C、NME8、PTK2B、SORL1、ZCWPW1、SlC24A4、CLU、PICALM、CR1、BIN1、MS4A、ABCA7、EPHA1和CD2AP[57]。研究也发现TREM2的某些等位基因变异会增加罹患阿尔茨海默病的风险达3到5倍,可能的原因是某些TREM2变异会使脑中的白血球将无法控制大脑中Aβ的产生量[58][59]。2018年的一项研究利用记忆、语言、视觉立体、执行,和功能等五个项目,配合新发表的30个与阿尔茨海默病相关的单核苷酸多态性(SNPs),将阿尔茨海默病分为6大类[60]。
Remove ads
胆碱性假说是最早被提出来的假说,也是现今大部分阿尔茨海默病药物所依据的理论基础[61],该假说认为阿尔茨海默病是由于神经系统减少产生神经传导物质乙酰胆碱而造成的,虽然胆碱性假说的历史悠久,但是没有受到广泛的支持,主要是由于使用药物治疗乙酰胆碱缺乏后,对于阿尔茨海默病的疗效有限[62]。
1991年,学者提出类淀粉胜肽假说,认为β类淀粉胜肽(Aβ)在大脑堆积可能是导致阿尔茨海默病的根本原因[63][64]。有关唐氏症患者的研究支持了这项假说,表现Aβ的前类淀粉蛋白基因(APP)位在21号染色体上,而唐氏症病患多了一个21号染色体的副本,同时唐氏症病患几乎全都在40岁左右时罹患阿尔茨海默病[65][66]。此外,E型载脂蛋白4(APOE4)是上阿尔茨海默病的主要遗传危险因子,虽然载脂蛋白会增强Aβ的降解,但特定的载脂蛋白异构体对此反应的效果较差(如APOE4),导致多余的Aβ在大脑中累积[67]。进一步的证据则是来自于基因克隆鼠实验,研究人员在实验鼠身上表现突变型人类APP基因,结果发现其大脑会产生纤维状类淀粉蛋白斑块(fibrillar amyloid plaques),并出现类似阿尔茨海默病的大脑病理变化及空间学习障碍[68]。
曾有一种实验性疫苗在早期人体试验中可以清除类淀粉蛋白斑块,但此种治疗对痴呆症却没有显著的效果[69]。因此研究者转而怀疑没有形成大型类淀粉蛋白斑块的Aβ寡聚体才是主要的致病型态,这些寡聚体也被称为类淀粉蛋白质衍生可溶性配体(amyloid-derived diffusible ligands, ADDLs),它们会结合到神经细胞表面的受体并改变突触的结构,因此会破坏神经元沟通[70]。其中一种可能的Aβ寡聚体受体可能是普利昂蛋白,这种蛋白的错误构型会引起疯牛病和人类库贾氏症,因此暗示著阿尔茨海默病与其他神经退化性疾病的机转可能互有关联[71]。
2009年,类淀粉胜肽假说有了新的发展,新的研究指出和Aβ关系密切的蛋白质可能才是阿尔茨海默病的罪魁祸首。此类与类淀粉斑块相关的机制会在早年快速发育的时期,使脑部神经元间的连结减少,并在年纪较大后受到老化相关过程的刺激,导致阿尔茨海默病中的神经元退化[72]。该研究发现APP是DR6的一个配体,β-secretase会切下的APP的N端片段产生N-APP(同样的酵素也参与APP修饰为Aβ的过程),N-APP则会与死亡受体6(death receptor 6,DR6,或称TNFRSF21)结合,启动细胞凋亡途径。DR6在阿尔茨海默病患者受影响的脑区中有高量的表现,因此在老化的大脑中,可能就是N-APP/DR6途径被活化而造成了神经元损伤[72]。N-APP/DR6途径所启动的细胞凋亡包含了神经细胞本体和轴突,不同于一般细胞凋亡的机制需要活化caspase-3,轴突的退化需要活化caspase-6。此外,经由caspase-6路径所启动的细胞凋亡,也可能和另一种杭廷顿舞蹈症相关[73]。2017年,β-secretase抑制剂verubecestat的临床试验,证实该药物在轻至中度阿尔茨海默病没有显著效益,且会增加副作用而遭到中止[74]。
中枢神经系统的血管周围的胶淋巴系统在大脑的废物上具有重要功能,其中清除的对象包含β类淀粉胜肽[75]。睡眠期间,胶淋巴系统的清除速度会较清醒时快速,睡眠剥夺会导致胶淋巴系统的排毒效能遭到抑制,进而导致废物累积[76]。

Tau蛋白假说认为Tau蛋白异常是引起阿尔茨海默病病情发展的主因[64]。在这个模型中,过度磷酸化的Tau蛋白会开始与其他Tau蛋白质配对结合,结果在神经细胞中形成了神经纤维纠结[77]。在这种情形下,神经细胞内的微管开始瓦解并导致由细胞骨架构成的运送系统崩坏[78],这将造成神经细胞之间的化学讯息沟通失效,接着导致神经细胞死亡[79]。
新生血管假说认为血脑屏障功能减低也可能和阿尔茨海默病有关[80]。
阿尔茨海默病患者细胞内外金属离子(如铜、铁、锌离子)会不平衡,虽然目前不清楚是蛋白质的改变造成离子不平衡,抑或离子的改变造成蛋白质的变化,这些离子会影响tau蛋白、APP和APOE[81],这些蛋白失调会造成细胞内部的氧化压力,并因此造成相关的病变[82][83][84][85][86]。然而有些相关研究的品质受到批评[87][88],因此这种推论仍有争议[89]。多数的研究者并不支持铝离子和阿尔茨海默病有因果关系[88]。
抽烟是阿尔茨海默病的显著危险因子[90], 先天免疫系统的发炎指标则是迟发型阿尔茨海默病的危险因子[91]。有限的证据指出空气污染可能也是促进阿尔茨海默病发展的一项因素[92]。
牙周炎发生时的螺旋体感染也可能造成失智,并参与阿尔茨海默病的病理机制 [93]。真菌感染也是一个可能的疾病机转[94]。
也有假说认为 寡突胶细胞功能异常以及其在老化过程中产生的髓鞘问题会造成轴突的伤害,最后导致了类淀粉生成和tau蛋白过磷酸化的副作用[95][96]。
逆生假说(Retrogenesis)是贝里·莱斯伯格(Barry Reisberg)在1980年代提出的另一项阿尔茨海默病假说[97]。胎儿发育时会历经一连串的神经发生,这个过程始于神经板形成,终于髓鞘形成,该假说认为阿尔茨海默病患者的神经退化就如同此一过程的逆转,先是神经脱鞘、白质的轴突死亡、最后灰质的神经元死亡[98]。同样地,婴儿会经历认知发展,该假说也认为阿尔茨海默病患者的认知障碍就如同此一过程的倒转[97]。莱斯伯格也发展出了一套称为FAST(功能性评估分级工具,Functional Assessment Staging Tool)的照护评估工具,用以评估阿尔茨海默患者的病程发展到哪个阶段,以此为依据为每个阶段的患者提供适当的照护建议[97][99]。
Remove ads
病生理学


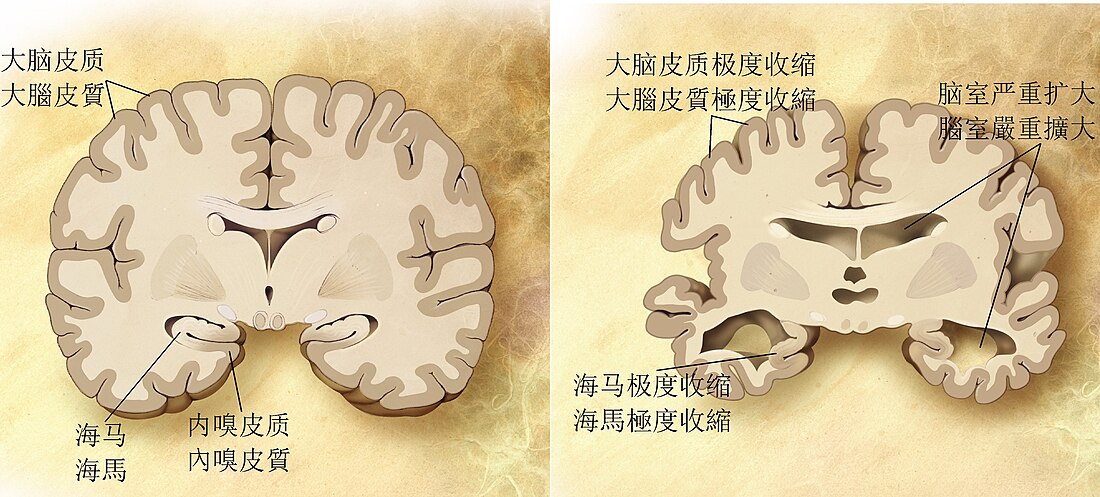
阿尔茨海默病的特征是大脑皮质及特定皮质下区域的神经元和突触丧失。神经元丧失过多的区域甚至会导致巨观解剖上的萎缩,常见主要遭到的进犯部位包含颞叶、顶叶、一部分的额叶,和扣带回[100]。某些脑干的核区可能也会受到影响,如蓝斑核等[101]。磁振造影(MRI)和正子电脑断层扫描(PET)研究已报导患者在疾病进程中部分脑区萎缩的状况,且跟其他健康老年人比较也能发现有部分脑区萎缩[102][103]。
在显微镜下,阿尔茨海默病患者的脑皮质可以看到明显的类淀粉斑块以及神经元纤维缠结[104]。斑块大多由致密且不溶于水的β类淀粉胜肽及细胞衍生物所构成,通常堆积于神经元周围。神经纤维缠结则通常是由微管相关蛋白质Tau所构成,患者的Tau蛋白会过度磷酸化并聚集于细胞内。虽然许多老年人的大脑中都可发现这些因老化形成的斑块和缠结,但阿尔茨海默病患者会在特定脑区出现更多斑块及缠结,例如颞叶等[105]。路易氏体在病患脑中也很常见[106]。
阿尔茨海默病也被视为一种蛋白质折叠错误的疾病(蛋白质构象病),是由于大脑中折叠异常的β类淀粉蛋白和Tau蛋白质堆积而造成[107]。构成斑块的β类淀粉蛋白(Aβ)是由约39至43个氨基酸构成的短链胜肽。Aβ为前类淀粉蛋白(APP)的一小片段,该蛋白为神经元细胞膜上的一种跨膜蛋白,对神经元的生长、存活和受伤后的修复非常重要[108][109]。阿尔茨海默病患者的γ分泌酶及β分泌酶会共同进行蛋白酶解作用,将APP切成小片段[110]。其中某些片段即为β类淀粉蛋白,他们会在神经元的胞外间质堆积,形成老年斑块[104][111]。
还有一种理论认为阿尔茨海默病是Tau蛋白质异常沉积造成。每个神经元都有由微管组成的细胞内支撑系统,称为细胞骨架,这些微管的作用如同轨道,引导营养物质和其他分子在细胞本体和轴突之间来回移动。Tau蛋白质被磷酸化之后可以稳定微管,所以被归类为微管关联蛋白质[112]。在阿尔茨海默病病患中,Tau蛋白质发生突变而过度磷酸化,进而造成微管瓦解。释出的Tau蛋白质会聚集起来,产生神经纤维团块并且瓦解神经元的运输系统[113]。变性后的tau蛋白质将使转座子运作异常,导致神经元死亡[114]。
目前仍不清楚Aβ蛋白的异常合成与异常聚集,如何导致阿尔茨海默病的病理变化[115][116]。类淀粉蛋白假说指出Aβ蛋白的堆积是造成神经元退化的主要原因,聚集的类淀粉蛋白纤维会瓦解细胞的钙离子平衡,并造成细胞凋亡[117]。Aβ蛋白也会选择性地堆积于病灶处细胞的线粒体中,抑制部分酵素的功能以及神经元使用葡萄糖的能力[118]。
多种发炎反应和细胞激素也可能在阿尔茨海默病的病理变化相关[119]。越来越多证据显示脑部神经元与免疫系统之间有很强的交互作用。肥胖与全身性发炎反应等干扰免疫反应的因子,可能都会引起疾病恶化[120]。
不同神经滋养因子(如脑源性神经营养因子)的分布变化,以及其受体的表现状况,都曾有研究指出与阿尔茨海默病有关[121][122]。
诊断

阿尔茨海默病的诊断一般透过病史收集和行为观察获得。临床医师可透过观察患者神经学及神经心理学上的特征,并排除其他诊断来佐证诊断[123][124]。一些医学影像技术,可以协助排除其他大脑病变或痴呆症亚型[125]。此外,医学影像也可以用于预测从轻微认知失调到阿尔茨海默病的转变[126]。
神经心理学评估(包括记忆测试)可以进一步鉴别疾病状态[29],医学组织已经为临床医师建立诊断标准以简化及标准化诊断程序。阿尔茨海默病最准确的诊断方法为尸体病理解剖,直接取得脑组织,经由组织学免疫染色法进行确认诊断[127]。
美国神经与沟通疾患及中风研究院(NINCDS,现改名为美国神经与中风研究院)及阿尔茨海默病及相关疾病协会(ADRDA)于1984年制定了NINCDS-ADRDA阿尔茨海默病诊断标准,为目前最常用的诊断标准之一[127],最新一版于2007年更新[128]。临床诊断标准包含认知功能损害、疑似痴呆症状,并经由神经心理学评估确认。
脑组织的显微镜检可以提供阿尔茨海默病的组织病理学确认诊断。上述的诊断标准在借由组织病理学进行评估后,显示该标准的信度及效度都不错[129]。阿尔茨海默病最常损害的八个智能区块为记忆、语言、知觉、注意力、动作技能、定向力、问题解决能力、执行能力等。这些问题在NINCDS-ADRDA诊断标准及美国精神医学学会发行的《精神疾病诊断与统计手册》(DSM-IV-TR)皆有提到[130][131]。

简短智能测验(MMSE)等神经心理学检查常被用于评估认知功能障碍,以利于后续诊断。若要取得更可信的结果,可以进行更全面的测试,特别是在疾病初期的患者[132][133]。除非有明显的认知功能障碍,神经学检察结果在疾病初期一般会呈现正常,可能无法与其他疾病做出鉴别,包含其他原因造成的痴呆症。
进一步的神经学检查对于阿尔茨海默病的鉴别诊断相当重要[29],与家人会谈也有助于评估病情。主要照护人能够提供患者日常活动功能的重要资讯,以及病人心智功能下降的情形[134]。由于患者通常自己无法查觉自身的异状,因此旁观者的观点对于疾病的评估相当重要[135]。但在痴呆症初期时,家人通常也无法察觉病人的症状,而无法提供医师准确的资讯[136]。
辅助性检查可以提供一些额外资讯,以利排除其他诊断。血液检查也可以协助排除阿尔茨海默病以外的诊断[29],偶见有些病因是可以治愈的[137]。常见的血检项目包含甲状腺功能测试、维生素B12、梅毒检测、代谢性疾病检查(如肾功能检查、电解质水平,以及糖尿病检查)、重金属水平,以及贫血等等。另外也必须谵妄的可能性。
针对抑郁症的心理测验也建议进行,因为阿尔茨海默病常同时伴随抑郁症状,也是认知功能损伤的早期症状之一[138],甚至是原因[139][140]。
电脑断层扫描(CT)、核磁共振成像(MRI)、单光子电脑断层摄影(SPECT),和正子电脑断层摄影(PET)等高阶医学影像技术,可以协助排除脑膜瘤、硬膜下出血等其他脑部疾病或痴呆症亚型[125]。此外,医学影像也可以用于预测从轻微认知失调到阿尔茨海默病的转变[126]。海马回计量(Hippocampal volumetry)的诊断价值或许较高,但大多数医院不易取得[48]。目前核磁共振已经有影像评分系统,可以协助识别皮质萎缩的区域。
C-PIB正子照影(C-PIB PET)在疾病初期的准确率不高,因此不建议用于早期诊断,或预测轻度知能障碍患者进展到阿尔茨海默病的机会[141]。¹⁸F-FDG正子照影(¹⁸F-FDG PET)在预测阿尔茨海默病的发生机会上也没有循证支持[142]。
目前用于阿尔茨海默病的放射性示踪剂中,针对检测大脑中的类淀粉样斑块(可能是阿尔茨海默氏症的生物标记),美国FDA核准的药物有florbetapir F18,flutemetamol F18和florbetabenF18。针对tau20,它们都用于检测大脑中的淀粉样β斑块(可能是阿尔茨海默氏症的生物标记)。[来源请求]
淀粉样蛋白的PET诊断药物目前已有3个药物被FDA核准,但在tau蛋白病变中,Tauvid是第一个可以诊断tau蛋白病变的药物。[来源请求]
目前全球医学界认为阿尔茨海默病病患,主要是在大脑中发现有tau蛋白以及类淀粉样蛋白(amyloid)堆积,并且认为这两种蛋白质可能是造成阿尔茨海默病的病变原因。目前FDA针对淀粉样蛋白的PET诊断药物已有3个药物(florbetapir F18,flutemetamol F18和florbetaben F18)被A核准,但在tau蛋白病变中,flortaucipir F18 (Tauvid)是第一个可以诊断tau蛋白病变的PET药物。[来源请求]
预防

目前循证上没有任何能有效预防阿尔茨海默病的方式[23],有关预防及推迟阿尔茨海默病进程的跨国研究结果经常不一致。流行病学研究推测阿尔茨海默病可能与某些饮食、心血管风险、药物等因子相关。某些智力活动及族群发生阿尔茨海默病的机会可能也不同。但这些相关性是否真的可以用来预防阿尔茨海默病,仍需进一步的研究阐明[23]。
虽然高胆固醇、高血压、糖尿病,及吸烟等心血管风险增强因子,可能与较高的阿尔茨海默病发生率相关[143][144]。但服用降胆固醇用的他汀类药物(Statins)无法有效预防阿尔茨海默病的发生或推迟其进程[145][146]。
长期使用非甾体抗炎药(NSAIDs)在2007年时被认为可能与较低的阿尔茨海默病发生率相关[147]。亦有证据显示NSAID可以减少与类淀粉斑块相关的发炎反应。但由于副作用过高,相关的临床实验提早中止[23]。截至目前为止,尚无预防研究完成试验[23]。NSAID对于治疗阿尔茨海默病没有任何功效,但为预防的候选药物之一[148]。更年期的激素替代疗法可能会增加失智的风险,即使已经停药也一样[149]。
从事某些益智活动的人群罹患阿尔茨海默病的风险似乎较低,如阅读、图版游戏、填字游戏、演奏乐器,及从事日常社交活动等[151]。这点符合认知存量假说,该假说认为有些生活经历会增进神经功能的效能,并扩充个人的认知存量,进而延迟痴呆症的发生[151]。接受教育也会延迟阿尔茨海默病的发生,但并不会改变病程的长短[152]。学习第二语言也有可能可以延迟疾病发生[153]。体能锻炼亦显示可以降低阿尔茨海默病的风险[152],且发生痴呆症的比率较低[154],另外也能减轻患者症状严重程度[155]。
平时身体健康者、日本人、地中海饮食者显示罹患阿尔茨海默病的机会较小[156]。地中海饮食同时也能改善患病者的预后[157]。饮食含有高脂肪酸及简单碳水化合物(simple carbohydrates,单糖或双糖等)患病几率也较高[158]。地中海饮食对心血管正面影响的机制也已有文献发表[159]。
饮食的配方与阿尔茨海默病间的关系目前仍不明朗,因为相关的研究结果没有定论[156]。有限证据显示适量饮酒,与较低的阿尔茨海默病发生率相关,特别是红酒[156]。另有证据表明咖啡因可能为阿尔茨海默病的保护因子[160]。含有高量黄酮类的食物,如可可、红酒、茶,等,也可能与较低的阿尔茨海默病风险相关[161][162]。
目前没有有力证据支持摄取维生素或矿物质对疾病有帮助,此部分已研究的物质包含维生素A[163][164]、C[165][166]、α-生育酚态的维生素E[167]、硒[168]、锌[169][170]、叶酸,以及B12等[171]。一项证据品质中等的随机分派研究指出,α-生育酚态的维生素E可以减缓认知功能下降的速度[167];而叶酸及其他维生素B的临床试验则无法证明有同样功能[172]。植物油及鱼油中常见的Omega-3脂肪酸,以及二十二碳六烯酸(DHA)对于改善阿尔茨海默病没有已知助益[173][174]。
姜黄在动物实验中显示对阿尔茨海默病有帮助,但截至2010年为止,尚无人体实验证实有效[175]。银杏及大麻素目前也尚无有力证据支持其在痴呆症的效果[176][177],但内源性大麻素(endocannabinoids)似乎有一些证据显示有所助益[178]。
熬夜也会增加患上阿尔茨海默病的风险,有充足睡眠减少阿尔茨海默病的风险。
CAIDE风险量表(CAIDE risk score)能够评估20年内罹患痴呆症的机会,该量表考量了年龄、教育水平、性别、血压、BMI、总胆固醇,及日常活动等因子[179]。
治疗
目前阿尔茨海默病尚无法根治,仅有一些症状性治疗,此类疗法大多属于和缓医疗。现行治疗可分为药物治疗、心理治疗和医疗照护。


常见用于改善阿尔茨海默病认知障碍的药物有五种,其中四种为乙酰胆碱酯酶抑制剂(塔克宁、忆思能、加兰他敏、爱忆欣),另外一种为NMDA受体拮抗剂(美金刚胺)。但这些药物的效益都不大[6][180][181],且截至目前为止,仍没有证据证明这些药物能延缓或停止疾病的进程。2023年,美国药监局批准了仑卡奈单抗作为缓解早期阿尔茨海默病的单克隆抗体药物,目前该药对于认知功能完整和晚期患者并无很好的作用。
阿尔茨海默病会降低胆碱性神经元的活性[182],而乙酰胆碱酯酶抑制剂可以减缓乙酰胆碱(ACh)的降解速率,借此提升突触间的乙酰胆碱浓度,以补足因胆碱性神经元死亡而造成乙酰胆碱浓度下降的现象[183]。目前此类药品在轻度至中度的阿尔茨海默病的症状控制上,已经证实有效[181][184][185],有一些证据甚至表示重度患者使用也有效果[185]。轻度知能障碍患者用药并不能延迟阿尔茨海默病的发生[186]。此类药物最常见的副作用为恶心和呕吐,两者皆为胆碱过量的副作用。约10–20%的患者用药后会产生副作用,严重程度从轻度到中度皆有。如有此类问题,可以缓慢调降药量来改善[187]。比较少见的副作用包含肌肉抽搐、心搏过缓、食欲及体重下降,以及胃酸制造增加等等[184]。
麸胺酸为兴奋性神经传递物质,若在脑中含量过多可能会引起兴奋性毒性反应,使细胞因受体过度刺激而死亡。兴奋性毒性反应存在于阿尔茨海默病、帕金森病,以及多发性硬化症等神经性疾病中[188]。美金刚胺为一种非竞争性NMDA受体拮抗剂,一开始被用于治疗流行性感冒,但后来发现它可以借由抑制NMDA受体来达到抑制麸胺酸系统的效果[188][189]。后来的研究显示美金刚胺对于阿尔茨海默病有些许效益[190]。本品已知的不良反应包含偶尔产生轻微幻觉、意识混乱、晕眩、头痛,以及疲劳[191]。美金刚胺与爱忆欣并用的效果统计上呈现显著,但临床效益不大[192]。
非典型抗精神病药对于缓解患者的攻击性及思觉失调症状具有一些效果,但同时此类药物也会造成一些严重副作用,例如中风、动作障碍,已及认知功能损伤等等[193]。长期使用此类药物可能会增加死亡风险,而对于精神症状轻度至中度的长期服药者,停药似乎为安全的选择[194]。石杉碱甲对改善认知功能似乎有正面影响,但目前仍需进一步研究证实其效果[195]。
2019年11月中国国家药品监督管理局批准国产研发公司绿谷制药的“九期一”制剂上市是一种甘露特钠胶囊[9],是长达17年来阿尔茨海默病首次有新药出现上市,根据上海交通大学医学院附属精神卫生中心和北京协和医院联合的三年临床实验证明,此药能显著反转中期患者的病况,且完全无副作用,甚至有病人入组时的认知功能分数26分药后涨到了29分(常人满分30分),据药物研发团队负责人中国科学院上海药物研究所耿美玉研究员介绍:GV-971是一种新型的海洋来源的寡糖,具有多种靶向机制,包括抑制淀粉样β纤维的形成,神经发炎和肠道菌群失调的修复。但需要进一步研究以进一步阐明和确认其有希望的生物学和临床效果。[196][197]“九期一”引起了不少质疑,包括研发单位绿谷制药曾贩卖假药中华灵芝宝(双灵固本散),PubPeer网站对耿美玉课题组发表的4篇论文发出质疑,认为存在图片不当裁剪、一图多用等问题。[198][199]此外,2019年11月29日,首都医科大学校长饶毅实名举报李红良、裴钢、耿美玉造假,称耿美玉的文章“不造假是不可能的”。[200][201]
社会心理治疗可用于辅助药物治疗,分为行为性、情绪性、认知性、刺激性等介入方式。但此类治疗的效度无法测量,且此类研究的研究对象大多收录了所有痴呆症,鲜少明确针对阿尔茨海默病[202]。
行为治疗乃是借由识别问题行为的前因及结果,进而试图减少之。此类治疗虽然无法改善整体功能[203],但可以减少一些特定的问题行为,例如尿失禁[204]。但目前对于游走(wandering)等其他问题并没有足够循证显示其效果[205][206]。音乐治疗可能对于减少行为性或心理性症状有些效果[207]。
情绪导向治疗包括怀旧疗法、确认疗法、支持性心理治疗、 感官统合(或称为多感官治疗)和情境模拟治疗。一份考科蓝的回顾性文章认为此类疗法并无足够循证支持效果[208]。 支持性心理治疗的正式学术研究相当少,但有些治疗者认为对于改善病人的病感有些许效果[202]。怀旧疗法的做法是与病患引导病人回忆过去的经验,治疗者会反复借由照片、日常用品、音乐、录音档,或是病患熟悉的事物引导病人回忆并组织过去的经验。怀旧疗法可以个别进行或以小组模式进行。一份2018年的回顾性文章认为怀旧疗法的一致性不足,且对象规模过小、各团体差异过大,以致不足以彰显其临床意义[209]。情境模拟治疗的理论是建基于依附理论上,治疗者会播放病患熟悉的声音。此疗法在改善病患的挑衅行为有部分证据[210]。最后,确认疗法是基于接受患者所感受到的真实和个人信念,而感官统合疗法则以刺激训练患者的感知为目标。目前没有证据支持这些疗法是否有效[211][212]。
认知导向治疗的目标包含协助病人恢复现实定向(reality orientation)以及认知功能再训练(cognitive retraining)。现实定向的做法是提供病人当下的人、事、时、地、物等现实资讯,以协助病人了解其环境。认知功能再训练则旨在协助病人改善其心智功能。上述两者对于改善认知能力都有一些效果[213][214],虽然在部分研究中,这些效果短暂的,负面效果如使患者感到沮丧也曾被提出[202]。
刺激导向治疗(Stimulation-oriented treatments)包括以艺术、音乐、宠物、运动或其他任何娱乐活动来进行治疗。刺激可以适当地协助患者改善行为、心情和少部分的功能。虽然如此,这些治疗提供的支持除了其本身的效果外,患者习惯的改变也是同等重要的[202]。非侵入性脑刺激和侵入性脑刺激在阿尔茨海默病的效用目前还不明了[215]。
由于阿尔茨海默病无法治愈,且会逐渐使患者无法自理,因此照护实质上是治疗的核心,在整个疾病进程中必须小心处理。在疾病早期,改善居住环境和生活模式可以增进病人安全,并减少照护者的负担[216][217],实务上包括让患者的生活作息符合固定简单的模式、使用安全防护装置、在居家物品上做标示(用以提示患者)或使用特殊设计的生活用具[202][218][219]。若有进食问题,则须将食物切成小块或甚至做成泥状[220];当出现吞咽障碍时,则可能需使用喂食管,对于这样的患者,照护者和家人必须仔细考量药物疗效和喂食与否等伦理议题[221][222]。无论是哪个阶段的阿尔茨海默病的患者,通常都不需要身体拘束,虽然在少数状况下,为了保护患者或照护者仍必须执行拘束[202]。
当疾病逐渐恶化,各式病症也会逐渐出现,如口腔或牙科疾病、褥疮、营养不良、卫生问题、呼吸道感染、皮肤感染、眼感染等。小心的照护管理能避免上述问题产生,但若真的发生了,则需要专业的治疗[223][224]。在疾病的最末期,治疗着重于在患者死亡前缓解其痛楚,通常会需要缓和医疗的协助[225]。
预后

无资料
≤ 50
50–70
70–90
90–110
110–130
130–150
150–170
170–190
190–210
210–230
230–250
≥ 250
阿尔茨海默病早期十分难诊断,通常要到认知障碍影响到日常生活后才会确诊,虽然此时患者可能仍能独立生活。患者的症状会由轻度的认知功能问题(例如记忆力衰退)开始逐渐恶化,到疾病后期完全不可能独自生活。[36]
阿尔茨海默病患者的预期寿命较短[226],诊断后的预期余命约三到十年[226],少于3%的人能活超过14年[227]。会造成存活年数显著减少的特征包括认知障碍严重度增加、生活功能减退、曾经跌倒和神经学检查出现问题。其他共病如心血管疾病、糖尿病、曾经酗酒都和存活年数减少有关[228][229][230]。虽然越年轻时就诊断的患者有越长的存活年数,但事实上年轻的患者相对于健康族群来说寿命较短[231]。男性的预后也较女性差[227][232]。
流行病学
阿尔茨海默病的流行病学研究主要着重在盛行率和发生率上:盛行率指的是某种疾病在任一时间点占群体总人数的比例;发生率则是指特定时期内某人群新发生某一疾病的比率。
在发生率方面,纵贯性世代研究(追踪一群无疾病人口的发病比率)指出,每年痴呆症发生风险约为1-1.5%,而其中阿尔茨海默病的风险则为0.5-0.8%[233][234]。这代表在每年新发生的痴呆症中,有几乎一半是阿尔茨海默病。高龄是阿尔茨海默病的主要风险因子,本病在每个年龄层的发生率不同,年龄越大者发生风险越高。65岁以上的长者,每五年的罹病风险就会增加一倍,[233][234]除年龄外,阿尔茨海默病的发生率还存在性别差异,女性的发生率较男性为高,特别是85岁以上的年长女性[234][235]。在美国,非拉丁裔白人死于阿尔茨海默病的风险,比起非裔高出了26%,更比拉丁裔高出了30%[236]。

0–4
5–8
9–10
11–13
14–17
18–24
25–45
46–114
115–375
376–1266
阿尔茨海默病的盛行率取决于许多因素,包括当地患者的存活率。由于阿尔茨海默病的发生率随年龄增加,考量当地人口的平均年龄是相当重要的。美国的阿尔茨海默病的总人口盛行率和65–74岁的族群盛行率皆为1.6%,但在75–84岁的族群盛行率则为19%,85岁以上的族群更达到42%[237]。低度开发地区的盛行率也因此较低[238]。世界卫生组织估计2005年全球的痴呆症盛行率为0.379%,2015年会增加到0.441%,并在2030年达到0.556%[239];其他研究也有类似的结论[238]。另一项研究估计2006年全球约有0.40%(范围从0.17到0.89%;实际人数约2660万人,范围从1140万到5940万人)的人口受阿尔茨海默病的影响,在2050年以前,盛行率会是现在的三倍,实际人数则会高达四倍[240]。
历史

早在古希腊罗马时代,当时的哲学家和医师就已经发现年老与失智的关联性[17]。1901年,德国精神科医师爱罗斯·阿尔茨海默描述了第一个阿尔茨海默病病例。这名病患是一名名叫奥古斯特·迪特的50岁女性,阿尔茨海默持续追踪迪特的病程进展至病人于1906年死亡为止,并在之后发表该病例[241]。其后五年,陆续又出现了11例类似的病例报告,其中有些论文已经用“阿尔茨海默病”来称呼此疾病[17]。1910年7月15日,艾米尔·克雷珀林于《精神科学课本》(Textbook of Psychiatry)第八版中首次将这些症状描述为一个单一疾病,并将奥古斯特的部分症状(如幻觉和妄想)及病理特征(血管硬化)划出该病的描述范围[242]。艾米尔采用了“阿尔茨海默病”这个名字,并同时将其称为“早发性老年痴呆症”(presenile dementia)将其视为是老年痴呆症的一个亚型[243]。
截至1970年代为止,阿尔茨海默病的诊断仍然仅限于描述45至65岁之间,提早出现特定痴呆症状的患者。直到1977年,一场阿尔茨海默病研讨会共识认定,阿尔茨海默病和老年痴呆症的临床和病理表征大致相同。虽然同时也强调两者的病因学可能不同[244],但这样的共识已促使阿尔茨海默病的诊断,不再应该限定于特定年纪的患者[245]。此后一段时期,超过65岁且拥有阿尔茨海默病症状的患者,另被描述为“阿尔茨海默型老年痴呆症”(senile dementia of the Alzheimer type,SDAT)。如今,阿尔茨海默病已经被接受为医学的正式名词,描述各年龄患者某种共同特定症状的病征[246]。
社会及文化
痴呆症(特别是阿尔茨海默病)已成为欧美社会花费最多的疾病之一[21][22],其他如阿根廷[247]和韩国[248]等国家的花费也节节攀升。这些花费可能会使社会结构老化,进而成为社会问题。与阿尔茨海默病有关的社会成本包括直接的医疗费用(如护理之家照护、在宅日间照护)和间接的成本(如病人和照护者生产力降低)[22]。虽然各个研究的数据有差异,但全球每年在痴呆症上花费约1600亿美元[249],单是美国每年就可能花费了约1000亿美元[22]。
社会成本最大的来源为医疗专业人员的长期照护,特别是机构照护的费用可能占了总花费的2/3[21]。患者在家的生活花费通常很高[21],尤其还需考虑患者家人的非正式成本,如照护时间和因照顾患者而减少的收入[250]。
随着失智的严重度和行为问题增加,患者的花费将会上升[251],需要医疗照护的时间也会增加[250]。因此,任何能减缓认知功能下降、延迟机构照护或减少照护时间的治疗都对经济有帮助,目前的治疗方法在经济评估上已显示正向的结果[22]。
患者的主要照护者通常是其配偶或关系较密切的亲属[252]。阿尔茨海默病会带给照护者社会上、心理上、生理上,和经济上极沉重的负担[24][253][254]。居家照护可以延迟或减少病人接受更昂贵和更专业的照护[255][256],因此通常家属和患者会倾向选择居家照护[255]。但即使如此,痴呆症患者仍然占了护理之家住院人数的三分之二[202]。
痴呆症患者的照护者罹患生理和心理疾患的机会较高[257]。 造成主要照护者有较大心理问题的因素包括患者住在家中、患者为其配偶、患者有令照护较为吃力的行为(如忧郁、行为干扰、幻觉、睡眠问题、行走问题或社交孤立)等[258][259]。在经济层面上,作为照护者的家人平均每周放弃47小时的工作时间来照护阿尔茨海默病患者,照护的代价相当高昂。在美国,每年直接和间接的照护支出从18,000到77,500美元不等,数值因研究而异,[250][252]
许多电影或剧集描述过阿尔茨海默病,例如《长路将尽》(2001,取材自约翰·贝礼描述其妻的回忆录)[261]、《恋恋笔记本》(2004,取材自尼可拉斯·史派克同名小说)[262]、《我脑海中的橡皮擦》(2004)、《Thanmathra》(2005)[263]、《明日的记忆》 (2006,取材自荻原浩同名小说)[264]、《柳暗花明》(2006,取材自艾丽斯·芒罗短篇小说《恨,友谊,追求,爱情,婚姻》)[265]、《我想念我自己》(2014,取材自莉莎·洁诺娃同名小说)。相关纪录片有《马尔柯姆与芭芭拉:爱的故事》(1999,Malcolm and Barbara: A Love Story)和《马尔柯姆与芭芭拉:爱的告别》(2007,Malcolm and Barbara: Love's Farewell),两者都以钢琴家马尔柯姆·波因顿为主角[266][267][268]。
在中国大陆,热播剧《辣妈正传》(2013)、《嘿,老头!》(2015)、《急诊科医生》(2017)、《都挺好》(2019)、《八零九零》(2021)、《您好!母亲大人》(2021)、《天才基本法》(2022)、《谢谢你医生》(2022)、《非凡医者》(2023)、《我的阿勒泰》(2024)、《多大点事儿》(2024)及《好运家》(2024)均刻画了阿尔茨海默病患者的生活。综艺节目《周六夜现场》(中国版;2018)、《忘不了餐厅》(2019~2020)也表达了对此类病患的重视与关怀。
研究方向
在2002到2012的十年中,244种化合物进入了第一、第二和第三期临床试验,但仅有美金刚胺获得美国食品药品监督管理局的核准(有部分仍在申请程序)[269]。现今治疗阿尔茨海默病的药物研究,大体来说可以分成下列几个路径:活化胆碱路径、抑制麸胺酸路径、减少类淀粉斑块、减少神经纤维缠结,以及减少神经发炎反应等[270]。
胆碱路径可分为胆碱脂酶抑制剂、5-HT6受体拮抗剂、H3受体拮抗剂、α7烟碱性胆碱受体兴奋剂。目前已核准的阿尔茨海默病药物,除美金刚胺外为NMDA受体拮抗剂之外,其他全为胆碱脂酶抑制剂,但此类药物目前仅知能暂时减少记忆损失的程度,但不能延缓病程。[270]
减少β类淀粉蛋白是此类开发中药物常见的目标(例如去水吗啡)[271]。免疫治疗或针对类淀粉蛋白的疫苗也是一种研究中的疗法[272]。和预防接种不同的是,开发中的疫苗预计是给已被诊断的患者施打的,希望借由训练免疫系统辨识、攻击、并逆转类淀粉蛋白的堆积来改变疾病的进程[273]。然而目前已发现免疫治疗药物会导致一些令人担忧的药物不良反应,例如类淀粉蛋白相关影像异常[274]。其他研究中的方法还有神经保护物质和降低金属蛋白交互作用的物质(如PBT2)[275]。恩博是一种能阻断TNFα受体的融合蛋白,近年已有部分令人振奋的初步结果[276]。
2008年,两项个别的临床试验显示亚甲蓝对轻至中度阿尔茨海默病有效果,可以抑制tau蛋白的聚集[277][278]。抗组胺药Dimebon[279]的第三期试验则未显示显著效果[280][281][282]。但口服亚甲蓝的肠道生物利用度会被胃酸影响,因此其剂量难以控制[283]。亚甲蓝的前驱药物LMTX已经完成第三期试验,相关结果仍待公布。
有研究显示,睡眠可以促进脑脊髓液排除Tau蛋白的功能,慢性睡眠剥夺则会使脑间质中的tau蛋白累积,可能进而造成阿尔茨海默病[284]。
有前端研究显示冥想在痴呆症恢复记忆和认知功能上或有效果[285]。一篇2015年的回顾性文章认为正念疗法可能在预防和延迟轻度认知损伤及阿尔茨海默病上有效[286]。
研究发现一型单纯疱疹病毒(HSV-1)会出现在和类淀粉斑块相同的区域[289][290],这项发现开启了以抗病毒药物治疗或预防阿尔茨海默病的可能性[289][291]。抗病毒药物在细胞培养实验中已展现了十分有潜力的结果[292]。
阿尔茨海默病与脑部真菌感染的关联也曾被提出[293],这项假说由微生物学家卡拉斯科(L. Carrasco)提出,他的研究团队发现弥漫性真菌症和阿尔茨海默病有统计关联[294]。进一步的研究显示,阿尔茨海默病患者的各个脑区都出现真菌感染的现象,但对照组的一般大众却没有[295][296]。真菌感染似乎解释了阿尔茨海默病患者的症状。阿尔茨海默病患者缓慢的病程,似乎也与一些慢性的全身性真菌感染类似,症状一样不显著、一样难以注意到,自然也难以治愈[295]。真菌感染的假说,也呼应了阿尔茨海默病某些现在已经较为确立的假说,例如类淀粉蛋白假说,同样可以将阿尔茨海默病解释为某种免疫系统对于中枢神经系统感染的反应[297][298][299]。该阿尔茨海默病成因的假说由莫伊尔(R. Moir)和谭兹(R. Tanzi)在大鼠与蠕虫上所建立。
在现在既存的医学影像技术中,单光子计算机断层成像似乎是用于鉴别阿尔茨海默病与其他认知症的最佳方式,比起心智能力测试与病史分析,也能提供更为精确的资料[300]。这样的进展也促进诊断标准的更新,[29][128]
虽然PiB PET目前还仅供研究使用,但已有医疗团队使用类似的正子电脑断层技术,将核医放射示踪剂药物florbetapir用于治疗。Florbetapir于2011年通过美国食品药物管理局审查,可用于阿尔茨海默病的诊断[301][302]。这项药物可以侦测患者脑中的淀粉蛋白斑块[303],若结果显示为阴性,表示淀粉斑块不存在或数量极为稀少,那么就可以考虑排除阿尔茨海默病[304]。2017年一项大型研究亦显示类淀粉斑块追迹药物对于轻度失智患者的临床决策有帮助[305]。
而类淀粉蛋白显影技术与扫描其他生物标记的技术能相辅相成,并不互相取代[306]。计量型的核磁共振影像可以用计算体素的方式估计特定脑区的容量。当阿尔茨海默病的病程持续进行,测量萎缩的脑区是否有所变化,是相当重要的诊断指标。目前许多研究都认为比起其他医学影像的方式,这很有可能会提供较为平价的选择[307]。
目前针对Tau蛋白显影的追踪药物,以氟-18标记的flortaucipir(Tauvid,AV-1451 F18)已被FDA允许用于Tau蛋白的正子计算机断层成像诊断[308]。
现在对阿尔茨海默病的研究致力于在症状发生前诊断出病情[309]。目前已经发展出一些可用于早期检验的生物化学方法,这些检验包括分析脑脊液中β-淀粉样蛋白、tau蛋白与tau181P(磷酸化tau蛋白)总量的浓度测定。但因为抽取脑脊髓液的过程十分疼痛,应避免重复抽取。检测血液中循环的miRNA与发炎指标则是具有潜力的替代指标。[310]
参考文献
延伸阅读
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads