在鍀發現以前,德米特里·門捷列夫就已經預測了它的許多性質。在他的週期表中,門捷列夫把這種尚未發現的元素叫做「類錳」,符號為Em。1937年,鍀成為第一個由人工合成而發現的元素。它的英文名來自希臘語τεχνητός,意為「人造」。
鍀的短壽命同位素鍀-99m具有γ放射性,廣泛用於核醫學。鍀-99僅具有β放射性。商業上,鍀的長壽命同位素是反應堆中鈾-235裂變的副產物,可以從乏燃料中提取得到。鍀的半衰期較短,因此1952年在壽命超過十億年的紅巨星中鍀的發現證明恆星可以合成重元素。
歷史
根據早期的元素週期律,許多研究者急於找到和命名第43號元素,其較低的原子序數似乎顯示它應當比其他未知元素更容易發現。1828年,德國化學家哥特弗雷德·威爾海姆·奧桑(Gottfried Wilhelm Osann)相信他在鉑礦裏發現了43號元素,並命名為Polinium。但後來證明那只不過是不純的銥。1846年,有人聲稱發現了元素ilmenium,但後來被證明是不純的鈮。1847年,有人說發現了新元素Pelopium,但也只是鈮和鉭的混合物。[6][7]
在門捷列夫的元素週期表中,元素鉬(原子序為42)與釕(原子序為44)之間有一個空白。1871年,門捷列夫預言這個當時尚未發現的元素應當排在錳之下,因此與錳有相似的化學性質。門捷列夫把它叫做「類錳」。[8]
1877年,俄羅斯化學家謝爾蓋·柯恩(Serge Kern)稱在鉑礦裏發現了43號元素,並以英國化學家杭弗瑞·戴維(Sir Humphry Davy)的名字命名為Davyum,但最後發現它是銥、銠和鐵的混合物。1896年發現的Lucium最後被確定為釔。1908年,日本化學家小川正孝在方釷石中發現了一種新元素,並稱之為「日本素」(Nipponium)。2004年,日本有學者重新檢驗了小川正孝家族保留下來的方釷石樣品。X-射綫譜證明,該樣品中不含43號元素,而是含有與其同族的75號元素錸。小川正孝可能是發現錸的第一人。[9]
1925年,德國化學家瓦爾特·諾達克、奧托·伯格和伊達·諾達克稱他們發現了75號元素和43號元素,並將43號元素根據諾達克家族的發源地命名為Masurium。[10]他們用電子流轟擊鈮鐵礦石,然後通過對X-射綫波長的分析發現了新元素。[11]因該小組的發現無法重現,他們的發現沒有受到廣泛承認。[12][13]但直到1933年還有人把43號元素叫做Masurium。[14][15]1980年商務印書館的《新華詞典》中,將鎷作為該元素Masurium的中文譯名。至今,1925年諾達克等人是否真正發現了鍀還存在爭議。[15][16]
1936年12月,意大利巴勒莫大學的卡羅·佩里爾(Carlo Perrier)和埃米利奧·吉諾·塞格雷(Emilio Segrè)終於證實了43號元素的存在。[17]1936年中,塞格雷在美國先後訪問了哥倫比亞大學和勞倫斯伯克利國家實驗室。他向迴旋加速器的發明者歐內斯特·勞倫斯要一些迴旋加速器上帶有放射性的廢棄部件。於是勞倫斯寄給他了一些曾用做迴旋加速器偏向板的鉬箔。
塞格雷在同事佩里爾的協助下,用化學方法證明鉬箔的放射性來源於一種原子序數為43的新元素。他們成功的分離出了鍀的同位素鍀-95m和鍀-97。[18][19]巴勒莫大學當局希望他們把新元素以巴勒莫的拉丁文名稱Panormus命名為「Panormium」。[18] 1947年,43號元素根據希臘語τεχνητός命名為鍀,意為「人造」。[7][10]塞格雷再度訪問美國。他和格倫·西奧多·西博格一起分離了鍀的介穩態同位素鍀-99m。現在這種同位素被廣泛用於許多核醫學診斷中。[20]
1952年,美國天文學者保羅·麥裏爾在S-型紅巨星的光譜中觀察到了鍀的發射譜綫。[21]這些星體的年齡是鍀最長壽同位素半衰期的幾千倍。這意味着它們還在通過核反應產生鍀。當時,恆星通過核合成產生重元素只是一個假說。此觀測無疑給這一假說提供了證據。[19]近來,有觀測表明重元素是在s-過程中通過中子俘獲生成的。[22]
自發現以來,人們一直在搜索自然界中的鍀。1962年,有人從比屬剛果的瀝青鈾礦中分離出了鍀-99。其含量極低,每公斤鈾礦僅含有0.2納克鍀,[22]是鈾-238自發裂變的產物。有證據表明,加蓬奧克洛天然核反應堆曾產生大量的鍀-99,但在過去億萬年中已經幾乎全部衰變為釕-99。[22]
性質
鍀是一種銀灰色放射性金屬,外觀與鉑相似。粉狀時呈灰色。純金屬鍀的晶型為六方最密堆積。在原子發射光譜中,鍀的特徵譜綫位於363.3、403.1、426.2、429.7和485.3納米。[23]
金屬鍀具有順磁性。在溫度降到7.46 K時,純金屬鍀的單晶成為二型超導體(type-II superconductor)。[b]在這個溫度以下,鍀具有很高的倫敦穿透深度,在所有金屬中僅次於鈮。[25]
在元素週期表中,鍀處在第五週期和第七族,位於錳和錸之間。根據元素週期律,其化學性質應介於這兩種元素之間。但鍀比較不活潑,容易形成共價鍵,不易生成陽離子。這些性質上鍀與錳不同,而更接近於錸。[26]鍀常見的氧化數有+4、+5和+7。[27]金屬鍀能溶於王水、硝酸和濃硫酸,但不溶於鹽酸。[28]
鍀沒有穩定的同位素,即所有同位素都具有放射性。在元素週期表中,鍀是沒有穩定同位素的元素中原子序最小的;下一個沒有穩定同位素的元素是鉕,其原子序數為61。[27]鍀和鉕是液滴模型的特例,而相鄰元素(鉬及釕)的穩定性也連帶影響了鍀的穩定性。根據馬陶赫同量異位素規則,若兩個在週期表上相鄰的元素各有一個質量數彼此相等的同位素的話,其中一個必然會有放射性[29][30],而和鍀相鄰的鉬與釕都有對β衰變穩定、且質量數位於照理來說鍀的同位素會對β衰變穩定的質量範圍內的同位素,因而造成鍀沒有穩定的同位素。
即使中子數為偶數,原子核中質子數為奇數的核種仍要比質子數為偶數的更不穩定。[31]因此對於原子序數(即質子數)為奇數的元素來說,一般其穩定同位素較少。而前述的鍀和鉕的原子序數皆為奇數,本身可能擁有的穩定同位素數量便少於相鄰的偶數元素,再加上馬陶赫同量異位素規則的影響,造成鍀和鉕可能擁有穩定同位素的質量數被相鄰元素佔去,因而成為原子序數小於83(鉍)的元素中唯二沒有穩定同位素的元素。
鍀最穩定的同位素分別是鍀-97(半衰期為421萬年)、鍀-98(半衰期為420萬年)、鍀-99(半衰期為21.11萬年)。[1]除了上述同位素,鍀還有34種同位素,質量數在86到122之間。[1]這些同位素的半衰期都不超過一個小時,鍀-93(半衰期為2.73小時)、鍀-94(4.88小時)、鍀-95(20小時)和鍀-96(4.3天)除外。[32]
比鍀-98輕的鍀同位素衰變時以電子俘獲為主,產物是鉬(原子序為42);[33]鍀-98及更重的同位素衰變時則以β衰變為主,產物是釕(原子序為44)。唯一的例外是鍀-100:它既可以俘獲電子生成鉬,也可以發生β衰變生成釕。[33][34]
鍀還有很多亞穩態同位素,也稱為核同質異能素。以鍀-97m(97mTc;「m」代表「介穩態」)最為穩定,半衰期為91天。[32]鍀-95m半衰期次之(61天)。鍀-99m半衰期為6.01小時。它會釋放出γ射線,轉變成鍀-99。[32]
鍀-99是核反應堆中鈾-235和鈈-239裂變的主要產物之一,因此是最常見、最易得的鍀同位素。一克鍀-99每秒鐘衰變6.2×108次(即0.62GBq/克)。[35]
化合物
鍀和氫氣反應生成鍀氫化物陰離子TcH2−
9,其晶體結構跟錸氫化物ReH2−
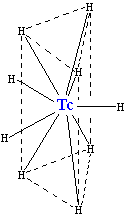
9類似。六個氫原子組成一個三稜柱,鍀位於三稜柱的體心位置。另外三個氫原子位於通過中心鍀原子並與上、下底面平行的平面上,和上、下底面的氫原子呈交錯構象(gauche)。九個氫原子不等同,但是在電子結構上非常相似。鍀在這個離子中的配位數是九。這是鍀化合物的最高配位數。[36]
金屬鍀在潮濕空氣中會漸漸失去光澤。[27]粉狀鍀在氧氣中可以燃燒。現已製得兩種鍀的氧化物:TcO2和Tc2O7。鍀可以被氧化成高鍀酸離子TcO−
4。[35][27]
在400–450 °C,鍀可以被氧化成淺黃色的七氧化二鍀:
- 4 Tc + 7 O2 → 2 Tc2O7
此化合物的結構中心對稱,共有兩種不同的鍀-氧鍵,鍵長分別為167 pm和184 pm。[37]
- Tc2O7 + 2 NaOH → 2 NaTcO4 + H2O
高鍀酸可以通過Tc2O7和水或氧化性酸反應來製備。可用的酸包括硝酸、濃硫酸、王水和硝酸與鹽酸的混酸。深紅色的高鍀酸是強酸,易吸水。和高錳酸(MnO−
4)不同,高鍀酸是一種弱氧化劑。因為水溶性好,高鍀酸鹽是臨床上常用的鍀試劑和催化劑。[40]
高鍀酸陰離子是正四面體結構:四個氧原子在四面體的四角,鍀原子位於四面體的中心。在濃硫酸中,高鍀酸會轉化成八面體結構的異高鍀酸(technetic(VII) acid)TcO3(OH)(H2O)2。[41]
鍀有多種硫化物。鍀可以和硫直接起反應生成TcS2。Tc2S7則是通過高鍀酸與硫化氫的反應製備:
- 2 HTcO4 + 7 H2S → Tc2S7 + 8 H2O
在這個反應中鍀(VII)被還原成四價,過量的硫生成雙硫鍵。七硫化二鍀是聚合物,結構為(Tc3(µ3–S)(S2)3S6)n,類似於鉬的硫化物 Mo3(µ3–S)(S2)62–.[42]
- Tc2S7 → 2 TcS2 + 3 S

金屬鍀中如果有少量碳雜質,會使由部分鍀由六方密堆積轉變成為正交晶系結構。當含碳量超過15-17%時,轉變趨於完全,生成立方晶系的碳化鍀,化學式近似為Tc6C。其結構不會再隨碳含量增加而變化。[45]
鍀有幾種已知的簇合物,包括Tc4、Tc6、Tc8和Tc13。[46][47]較穩定的Tc6和Tc8簇合物擁有稜柱型結構。垂直方向上的鍀原子以三鍵相連接,水平方向的則以單鍵連接。每個鍀原子有六個鍵,剩餘價電子通過直立鍵同一個鹵素原子,或者通過橋鍵與兩個鹵素原子相連接,比如氯和溴。[48]

鍀可以形成衆多的有機配合物。因為它們在核醫學方面的重要性,對鍀配合物的研究較為充分。羰基鍀Tc2(CO)10為白色固體。[50]此化合物中,兩個鍀原子之間的化學鍵很弱,每個鍀原子與五個羰基以八面體結構鍵合。鍀-鍀鍵鍵長為303 pm,[51][52]比金屬鍀中原子間距(272pm)長得多。和鍀同族的錳和錸也可形成類似的羰基化合物。[53]
存象和生產

地殼中僅含有極微量天然鍀,是鈾礦自發裂變的產物。據估計,一公斤鈾礦含有一納克鍀。[19][55][56]某些S型、M型和N型紅巨星的吸收光譜中有鍀的特徵吸收。[28][57]這種紅巨星被戲稱為「鍀星」(technetium stars)。[58]
每年大量的鍀被人類從乏燃料中分離提取出來。反應堆中1克鈾-235裂變可以產生27毫克鍀-99,產額為6.1%。[35]如果以鈾-233為燃料,鍀-99產額為4.9%;如果以鈈-239為燃料,鍀-99產額為6.21%。[59]據估計,從1983年到1994年,人類反應堆中一共產生了78噸鍀,是地球上鍀最主要的來源。[60][61]其中只有一小部分用於商業用途。[c]
鈾-235和鈈-239的裂變都可以產生鍀-99。因此,鍀-99不但存在於核廢料中,也存在於裂變核武器爆炸後產生的放射性落下灰中。在乏燃料貯存過程中,鍀-99的放射性在104到106年之間將居主導地位。[60]據估算,1945年到1994年間大氣層核試驗一共向環境釋放了250公斤鍀。[60][63]截至1986年,人類核反應堆一共排放了1600公斤鍀,主要是在乏燃料再處理過程中排放的;大部分進入海洋。隨着再處理技術的發展,反應堆鍀的排放逐漸減少。到2005年,最主要的排放源是英國謝拉斐爾德再處理厰(Sellafield Ltd)。據估計,1995年到1999年,該廠一共向愛爾蘭海排放了900公斤鍀。[61]2000年後,法律規定該廠每年只能排放140公斤鍀。[64]該廠的排放導致某些海產品含有微量的鍀。比如,英國坎布里亞郡西部捕獲的歐洲龍蝦和魚含有1 Bq/公斤的鍀。[65][66][d]
以鈾或鈈為燃料的核反應堆一直不停地產生介穩態核種鍀-99m。但乏燃料都要經過數年冷卻,到再處理的時候鉬-99和鍀-99m已經完全衰變了。經過鈈鈾提取(PUREX)之後的液料含有高濃度的鍀(以TcO−
4形式存在),基本上全部是鍀-99,鍀-99m已經消失殆盡。[68]
絕大部分醫用鍀-99m是在反應堆裏輻照高濃縮鈾(鈾-235含量超過20%)靶子,然後在再處理厰分離出鉬-99,[69]最後在醫院提取由鉬-99衰變而生成的鍀-99m。[70][71]在鍀-99m製備機中,含有鉬-99的鉬酸(MoO2−
4)被吸附在酸性氧化鋁上,裝載到一個帶有輻射防護屏的色譜柱中。這種機器又被稱為「鍀奶牛」,有時也叫做「鉬奶牛」。鉬-99半衰期為66小時,比較便於運輸。用鹽水(氯化鈉水溶液)做淋洗劑,便可將含有鍀-99m的高鍀酸鹽淋洗下來。
和從裂變產物中提取鉬-99相比,通過輻照高濃縮鈾的方法大大減化了化學分離的步驟。此法的缺點是需要高濃縮鈾-235,會引起諸多的安全問題,比如核材料走私、核擴散等。[72][73]
世界上近三分之二的鍀由兩座反應堆提供:加拿大曹爾克河實驗室的國家研究通用反應堆和荷蘭核研究和咨詢集團的帕滕反應堆。這兩座反應堆建於1960年代,都已經接近退役期限。加拿大擬建的兩座「多功能應用物理晶格實驗」反應堆本來計劃生產超過全世界總需求一倍的鍀,但在2008年在試車成功後被封堆,整個計劃取消。這給鍀將來的供應前景帶來了巨大的不確定性。[74]
2009年8月,曹爾克河實驗室反應堆開始封堆維修,計劃於2010年4月再次運行。2010年2月19日,帕滕反應堆開始了為期六個月的封堆維修。每年千百萬人需要鍀-99m,供應缺口迫使一些醫生重新啓用20年前的老技術。[75]令人稍感寬慰的是,波蘭瑪利亞研究反應堆宣佈開發了一種製備鍀-99m的新技術。[76]曹爾克河實驗室反應堆於2010年8月重新啓動.一個月後帕滕反應堆也再次運轉。[77]鍀-99m的供應危機暫時得以緩解。
鍀-99的半衰期長,容易形成易溶於水的高鍀酸鹽(TcO−
4)。這些對於核廢料的長期儲存和處理以及減少排放不利。在再處理工廠中,許多提取和分離裂變產物的過程和工藝主要針對陽離子,比如銫-137和鍶-90,類似高鍀酸鹽的放射性陰離子則暢通無阻。在現有的陸地埋藏方案中,最大的問題是水污染。高鍀酸鹽和碘離子(I−
)溶解性好,不易被土壤、岩石和礦物吸附,很有可能隨水遷移。比較而言,鈈、鈾和銫更容易被土壤吸附。通過某些微生物活動,鍀可以在一些環境富集,比如在湖底沉積物中。[78]因此,鍀的環境化學是相當活躍的研究領域。[79]
還有一種處理方式是核嬗變。歐洲核子研究組織(CERN)已經證明鍀-99的嬗變可行。用中子流轟擊金屬鍀-99生成短壽命產物鍀-100(半衰期為16秒),後者經過β衰變變成釕-100(穩定同位素)。這個方法對鍀-99靶的純度要求很高。如果靶中有微量錒系元素,比如鎇或者鋦,它們會在中子的轟擊下裂變,生成具有高放射性的裂變產物。該方法還可能生成釕-106(半衰期為374天)。它的存在會延長分離釕-100之前所需要的冷卻時間。[80]
從乏燃料中分離鍀-99是個漫長過程。在再處理工藝中,它出現在鈾和鈈回收後的高放射性廢液中。經過幾年的冷卻後,該廢液的放射性下降到一定程度之後,鍀-99可以用幾種化學萃取方法回收,產生高純度的金屬鍀。[81]
鉬-98經中子活化後可生成鉬-99,然後衰變成鍀-99m。[82]其它鍀同位素在裂變中產額較低,一般通過中子輻照前體同位素製備。比如,鍀-97是用中子轟擊釕-96生產。[83]
1971年,有人在醫用回旋加速器用22兆電子伏特質子轟擊鉬-100(純度>99.5%)靶子,通過反應100Mo(p,2n)99mTc製備鍀-99m。[84]2010年代鍀的短缺讓人們重新審視此法。[75]使用加速器,還可以通過(n,2n)或(γ,n)反應從鉬-100製備鉬-99,進而得到鍀-99m。[85][86][87]
應用
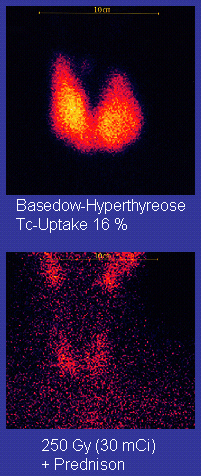
鍀-99m半衰期較短(6.01小時),並釋放出容易檢測的軟γ射線(140千電子伏特),因此在核醫學上用於人體示蹤劑。[19][35]截止2000年,含有鍀-99m的常見放射性藥物有31種,用於大腦、心肌、甲狀腺、肺、肝、膽囊、腎、骨骼、血液等器官和腫瘤的造影和功能性研究。[88]
鍀-99是一種純β輻射源,釋放出低能量β粒子。它的半衰期很長,所以輻射變化很緩慢。從放射性廢物中提取的鍀可以達到很高的化學純度和同位素純度。因此,鍀-99是美國國家標準技術研究所(NIST)認證的標準β輻射源,用於儀器校準。[90]有人提議將鍀-99用於光電器件和納米級的核電池。[91]
同錸和鈀類似,鍀也可以作為催化劑。對某些反應,比如異丙醇脫氫反應,鍀的催化活性比錸和鈀高得多。但是,其放射性限制了它在催化上的應用。[92]
高鍀酸鉀在很低的濃度(55 ppm)就可以防止鋼鐵的銹蝕,甚至在250 °C仍有抗銹的能力。[93]因此,高鍀酸鹽可能可以用作鋼鐵的防銹劑。但是鍀的放射性決定了鍀防銹劑只能用於封閉體系。[94]鉻酸鹽CrO2−
4也能防銹,但其有效濃度是高鍀酸鉀的10倍。在一個實驗中,一塊碳鋼被浸泡在高鍀酸鹽水溶液中20年仍沒有銹蝕。[93]高鍀酸鹽防銹的機理尚不明確,但似乎是在鋼鐵表面形成了一層保護層。一種理論認為,高鍀酸鹽和鋼鐵的表面發生反應,生成了一薄層緻密的二氧化鍀,保護鋼鐵不受氧化。這個理論可以解釋為什麽鐵粉能從水中吸附高鍀酸離子。但當高鍀酸離子濃度下降到某一最小濃度時,鐵粉對該離子的吸附停止。高濃度干擾離子的存在也會抑制鐵粉對高鍀酸離子的吸附。[95]
如上所述,鍀的放射性限制了它作為防銹劑的實際應用。有人提議把高鍀酸鹽用於沸水堆鋼鐵構件的腐蝕防護,但是此建議未獲採用。[95]
鍀的安全使用
在生物體內鍀沒有任何已知的功能。[28]鍀的化學毒性似乎比較小。連續幾個星期給小白鼠餵飼含有15微克/克鍀的食物,其血液、體重、器官重量和進食量未觀察到顯著的變化。[96]鍀的放射毒性取決於鍀化合物組成、輻射類型和鍀同位素的半衰期。[97]
使用所有鍀同位素都必須謹慎。最大的健康風險是吸入帶有鍀同位素的灰塵,可以致肺癌。最常見的同位素鍀-99釋放出低能量β粒子,甚至無法貫穿實驗室的玻璃器皿。因此和鍀化合物接觸時,手套箱基本沒有必要,通風櫥便可以很好的消除其危害。[98]
註釋
參考資料
引用書目
參考書目
外部連結
Wikiwand in your browser!
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.



