蛋白質
由氨基酸殘基鏈組成的生物分子 来自维基百科,自由的百科全书
蛋白質(英語:protein)舊稱「朊」[1][2],常簡稱「蛋白」,是大型生物分子,或高分子,它由一個或多個由α-氨基酸殘基組成的長鏈條組成。α-氨基酸分子呈線性排列,相鄰α-氨基酸殘基的羧基和氨基通過肽鍵連接在一起,最後經過折疊形成有功能的立體結構。蛋白質的α-氨基酸序列是由對應基因所編碼。除了遺傳密碼所編碼的20種「標準」氨基酸,在蛋白質中,某些α-氨基酸殘基還可以以被改變原子的排序而發生化學結構的變化,從而對蛋白質進行活化或調控。多個蛋白質和礦物質可以一起,往往是通過結合在一起形成穩定的蛋白質複合物,這樣的大分子結構就像機械一樣,來發揮某一特定功能。

與其他生物大分子(如多糖和核酸)一樣,蛋白質是地球上生物體中的必要組成成分,參與了細胞生命活動的每一個進程。蛋白酶是最常見的一類蛋白質,它們催化生物化學反應,尤其對於生物體的代謝至關重要。除了酶之外,還有許多結構性或機械性蛋白質,如肌肉中的肌動蛋白和肌球蛋白,以及細胞骨架中的微管蛋白(參與形成細胞內的支撐網絡以維持細胞外形),另外一些蛋白質則參與細胞信號傳導、免疫反應、細胞黏附和細胞週期調控等。同時,蛋白質也是動物飲食中必需的營養物質,這是因為動物自身無法合成所有蛋白氨基酸,動物需要和必須從食物中獲取必需氨基酸。通過消化過程將蛋白質降解為自由氨基酸,動物就可以將它們用於自身的代謝。
生物化學性質


蛋白質是由不同的L型α氨基酸所形成的線性聚合物。目前在絕大多數已鑑定的天然蛋白質中發現的氨基酸有20種(參見標準蛋白氨基酸列表)。不過在自然界中還存在着一些特殊的氨基酸,例如在一種海洋寡毛綱小蠕蟲Olavius algarvensis以及與之存在共生關係的細菌δ1(該細菌屬於δ變形菌)中存在着高含量的硒代半胱氨酸,由原本為終止密碼子的UGA編碼,和吡咯賴氨酸,由終止密碼子UAG編碼[3]。
所有氨基酸都有共同的結構特徵,包括與氨基連接的α碳原子,一個羧基和連接在α碳原子上的不同的側鏈。但脯氨酸有着與這種基本結構不同之處:它含有一個側鏈與氨基連接在一起所形成的特殊的環狀結構,使得其氨基在肽鍵中的構象相對固定。[4] 標準氨基酸的側鏈是構成蛋白質結構的重要元素,它們具有不同的化學性質,因此對於蛋白質的功能至關重要。多肽鏈中的氨基酸之間是通過脫水反應所形成的肽鍵來互相連接;一旦形成肽鍵成為蛋白質的一部分,氨基酸就被稱為「殘基」,而連接在鏈的碳、氮、氧原子被稱為「主鏈」或「蛋白質骨架」。由於肽鍵有兩種共振態,具有一定的雙鍵特性,使得相鄰α碳之間形成肽平面;而肽鍵兩側的二面角確定了蛋白質骨架的局部形態。
由於氨基酸的非對稱性(兩端分別具有氨基和羧基),蛋白質鏈具有方向性。蛋白質鏈的起始端有自由的氨基,被稱為N端或氨基端;尾端則有自由的羧基,被稱為C端或羧基端。
「蛋白質」、「多肽」和「肽」這些名詞的含義在一定程度上有重疊,經常容易混淆。「蛋白質」通常指具有完整生物學功能並有穩定結構的分子;而「肽」則通常指一段較短的氨基酸寡聚體,常常沒有穩定的三維結構。然而,「蛋白質」和「肽」之間的界限很模糊,通常以20-30個殘基為界。[5]「多肽」可以指任何長度的氨基酸線性單鏈分子,但常常表示缺少穩定的三級結構。
合成


每一種蛋白質都有自己獨特的氨基酸序列,而氨基酸序列的組成資訊則由編碼對應蛋白質的基因的核苷酸序列所決定。遺傳密碼是一套由三個核苷酸組成的密碼子,每一種三個核苷酸的組合可以編碼一種特定氨基酸,如mRNA上的AUG(在DNA中為ATG)編碼甲硫氨酸。由於DNA含有四種核苷酸(A、T、C、G),所以對應的可能的密碼子有4×4×4=64種;而標準氨基酸只有20種,因此有部分密碼子是冗餘的,即部分氨基酸可以由多個不同的密碼子所編碼。DNA中的基因首先在RNA聚合酶等蛋白質的作用下被轉錄為前mRNA。在大多數生物體中,前mRNA(或初始轉錄產物)要經過轉錄後修飾以形成成熟的mRNA,隨後mRNA就可以經由核糖體被用作蛋白質合成的模板。在原核生物中,mRNA可能可以在生成後被直接用於蛋白質合成,或者在離開類核後就結合核糖體。而在真核生物中,mRNA在細胞核中被合成,然後通過核膜被轉運到細胞質中;在細胞質中,mRNA才可以被用於蛋白質合成。原核生物的蛋白質合成速率可以達到每秒20個氨基酸,要高於真核生物。[6]
從一個mRNA模板合成一個蛋白質的過程被稱為轉譯。在轉譯過程中,mRNA被一些蛋白質攜帶到核糖體上;然後核糖體在mRNA上從5'端到3'端尋找起始密碼子(大多數情況下為AUG);找到起始密碼子後,即核糖體上起始tRNA的反密碼子與起始密碼子配對後,轉譯就可以開始進行;在起始密碼子後,核糖體每一次閱讀三個核苷酸(或一個密碼子),同樣是通過攜帶對應氨基酸的tRNA上反密碼子與密碼子配對。其中,胺醯tRNA合成酶可以將tRNA分子與正確的氨基酸連接到一起。不斷延長的多肽鏈通常被稱為「新生鏈」。生物體中的蛋白質合成總是從N-端到C-端。
合成的蛋白質的大小可以通過其含有的氨基酸數目或者其分子量(以道耳吞或千道耳吞,即kDa為單位)來衡量。酵母蛋白的平均長度為466個氨基酸或平均分子量為53kDa。[5]目前已知的最大蛋白質是肌聯蛋白,它是肌肉中肌節的組分之一,其分子量為近3,000 kDa,含有近27,000個氨基酸。[7]
除了生物合成外,一些小的蛋白質可以通過多種化學途徑來合成。這些合成方法又被稱為肽合成,其依賴於有機合成技術,如化學連接來高通量生產肽。[8]化學合成允許在合成的肽鏈中引入非天然氨基酸,如加入螢光標記的氨基酸。[9]這些合成方法所合成的產物被大量應用於生物化學和細胞生物學實驗。但是,化學合成無法有效合成殘基數多於300的蛋白質,而且合成的蛋白質可能不具有天然的三級結構。大多數化學合成方法都是從C-端到N-端進行合成,剛好和生物合成反應的方向相反。
降解
對於細胞來說,蛋白質降解有多種用途,包括去除分泌蛋白的N末端信號肽,對前體蛋白進行剪切以產生「成熟」蛋白等。細胞不需要的或受到損傷的非跨膜蛋白質一般由蛋白酶體來進行降解,而真核生物的跨膜蛋白則通過內體運送到溶酶體(動物細胞)或液泡(酵母)中進行降解。[10]降解所生成的氨基酸分子可以被用於合成新的蛋白質。一些蛋白質可以發生自降解。此外,細胞中存在的大量蛋白酶(特別是溶酶體中),可以對外來的蛋白質進行降解,這也是一種細胞自我保護的機制。
生物學實驗中,也經常對蛋白質進行降解分析;例如在蛋白質組學中,利用蛋白酶對特定蛋白質進行降解,並對降解產物進行質譜分析而獲得對應蛋白質的序列資訊和修飾情況;此外,生物化學實驗中,埃德曼降解法常被用於對蛋白質進行氨基酸序列分析。
結構


大多數的蛋白質都自然摺疊為一個特定的三維結構,這一特定結構被稱為天然狀態。雖然多數蛋白可以通過本身氨基酸序列的性質進行自我摺疊,但還是有許多蛋白質需要分子伴侶的幫助來進行正確的摺疊。在高溫或極端pH等條件下,蛋白質會失去其天然結構和活性,這一現象就稱為變性。生物化學家常常用以下四個方面來表示蛋白質的結構:
- 蛋白質一級結構:組成蛋白質多肽鏈的線性氨基酸序列。一個蛋白質是一個聚酰胺。
- 蛋白質二級結構:依靠不同氨基酸之間的C=O和N-H基團間的氫鍵形成的穩定結構,主要為α螺旋和β摺疊。[11]因為二級結構是局部的,不同的二級結構的許多區域可存在於相同的蛋白質分子。
- 蛋白質三級結構:通過多個二級結構元素在三維空間的排列所形成的一個蛋白質分子的三維結構,是單個蛋白質分子的整體形狀。蛋白質的三級結構大都有一個疏水核心來穩定結構,同時具有穩定作用的還有鹽橋 (蛋白質)、氫鍵和二硫鍵,甚至轉譯後修飾。「三級結構」常常可以用「摺疊」一詞來表示。三級結構控制蛋白質的基本功能。
- 蛋白質四級結構:由幾個蛋白質分子(多肽鏈),通常稱為蛋白質亞基所形成的結構,在功能上作為一個蛋白質複合體。

蛋白質並不完全是剛性分子。許多蛋白質在執行生物學功能時可以在多個相關結構中相互轉換。在進行功能型結構重排時,這些相關的三級或四級結構通常被定義為不同「構象」,而這些結構之間的轉換就被稱為「構象變換」。例如,酶的構象變換常常是由基質結合到活性位點所導致。在溶液中,所有的蛋白質都會發生結構上的動態變化,主要表現為熱振動和與其他分子之間碰撞所導致的運動。
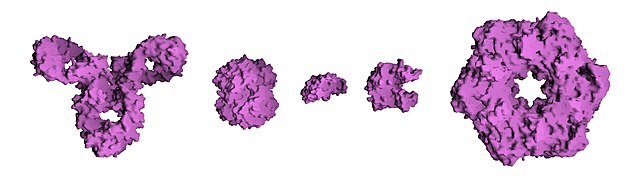
蛋白質可以由三級結構的不同大致分為三個主要類別:球蛋白、纖維蛋白和膜蛋白。幾乎所有的球蛋白都是水溶性的,許多球蛋白是酶。纖維蛋白多為結構性的,例如,結締組織的主要成分膠原蛋白,或頭髮和指甲的蛋白質成分角蛋白。膜蛋白常常作為受體,或提供通道極性的或帶電的分子通過細胞膜。
要了解特定蛋白質的功能,獲得其三級結構或四級結構可以提供重要的結構資訊。目前用於蛋白質的原子解像度結構測定的方法主要是X射線晶體學和NMR光譜學。冷凍電子顯微學也可以提供超大蛋白質複合物(如病毒、核糖體等)的低解像度結構資訊。[11]而電子晶體學在一些情況下也可以提供較高解像度的結構資訊,特別是對於膜蛋白的二維晶體。[12]解析的結構(包括原子坐標和結構解析的相關資訊)通常存放到蛋白質數據庫(PDB),供全世界研究者免費下載。蛋白質結構預測也可以為未知結構(實驗結構)的蛋白質提供結構資訊。
細胞功能
蛋白質是細胞中的主要功能分子。[5]除了特定類別的RNA,大多數的其他生物分子都需要蛋白質來調控。蛋白質也是細胞中含量最為豐富的分子之一;例如,蛋白質占大腸桿菌細胞乾重的一半,而其他大分子如DNA和RNA則只分別佔3%和20%。[13]在一個特定細胞或細胞類型中表達的所有蛋白被稱為對應細胞的蛋白質組。

蛋白質能夠在細胞中發揮多種多樣的功能,涵蓋了細胞生命活動的各個方面:發揮催化作用的酶;參與生物體內的新陳代謝的調劑作用,如胰島素;一些蛋白質具有運輸代謝物質的作用,如離子泵和血紅蛋白;可以消耗能量來轉動並運動的分子馬達;控制神經和反應的神經傳遞物;發揮儲存作用,如植物種子中的大量蛋白質,就是用來萌發時的儲備;許多結構蛋白被用於細胞骨架等的形成,如肌球蛋白;還有免疫、細胞分化、細胞凋亡等過程中都有大量蛋白質參與。
蛋白質功能發揮的關鍵在於能夠特異性地並且以不同的親和力與其他各類分子,包括蛋白質分子結合。蛋白質結合其他分子的區域被稱為結合位點,而結合位點常常是從蛋白質分子表面下陷的一個「口袋」;而結合能力與蛋白質的三級結構密切相關,因為結構決定了結合位點的形狀和化學性質(即結合位點周圍的氨基酸殘基的側鏈的化學性質)。蛋白質結合的緊密性和特異性可以非常高;例如,核糖核酸酶抑制蛋白可以與人的血管促生蛋白以亞飛摩爾(sub-femtomolar,即<10-15 M)量級的解離常數進行結合,[14]但卻完全不結合(解離常數>1 M)angiogenin在兩棲動物中的同源蛋白抗腫瘤核糖核酸酶。)非常微小的化學結構變化,如在結合位點的某一殘基側鏈上添加一個甲基基團,有時就可以幾乎完全破壞結合;例如,胺醯tRNA合成酶可以分辨側鏈結構非常類似的纈氨酸和異白氨酸,而這兩種氨基酸的差別就在於異白氨酸的側鏈多出一個甲基。相同的蛋白質分子結合在一起就可形成同源寡聚體或多聚體,有些多聚體可以形成纖維;而這些形成纖維的蛋白質往往是結構蛋白,它們在單體狀態下是球蛋白,通過自結合來形成剛性的纖維。蛋白-蛋白相互作用可以調控酶的活性和細胞週期中的各種進程,並可以使大型的蛋白質複合物得以形成,這樣可以將參與同一生物學功能的分子結合到一起,從而提高其工作效率;而結合所誘導的蛋白構象變化對於複雜的信號傳導網絡的構建也是必不可少的。還有一些蛋白質(如膜蛋白)可以結合或者插入到細胞膜中。
細胞中,酶是最被廣泛了解和研究最多的蛋白質,它的特點是催化細胞中的各類化學反應。酶的催化反應具有高度的專一性和極高的催化效率。酶在大多數與代謝和異化作用以及DNA的複製、修復和RNA合成等相關的反應中發揮作用。在轉譯後修飾作用中,一些酶(如激酶和磷酸酶)可以在其基質蛋白質上增加或去除特定化學基團(如磷酸基團)。目前已知的酶催化的反應有約4000種。[15]酶可以極大地加速其所催化的反應;例如,與沒有酶催化的情況相比,乳清酸核苷-5'-單磷酸脫羧酶的加速作用最高可達1017倍(形象地說,在沒有酶的情況下完成反應需要七千八百萬年,而存在酶的情況下反應只需18毫秒)。[16]
結合於酶上,並在酶的作用下發生反應的分子被稱為基質。雖然酶分子通常含有數百個氨基酸殘基,但參與與基質結合的殘基只佔其中的一小部分,而直接參與基質催化反應的殘基則更少(平均為3-4個殘基)。[17]這部分參與基質結合和催化的區域被稱為活性位點。有一些酶需要結合一些小分子(輔酶或輔因子)才能夠有效發揮催化作用。酶的活性還可以被酶抑制劑所抑制,或被酶活化劑所提高。

許多蛋白質都參與了細胞中和細胞間的訊號傳遞。一些蛋白質,如胰島素,作為細胞外蛋白質,可以將訊號從一個細胞(合成這些蛋白質的細胞)傳送到身體其他組織中的細胞。還有一些蛋白質,如屬於膜蛋白的受體,可以結合細胞外的訊號分子來引發細胞內的生物化學反應;多數受體都有一個位於細胞外表面的結合域〔結合訊號分子〕和一個位於細胞內的效應結構域(可能具有酶活性或可以發生構象變化以誘發與細胞內其他蛋白質的結合),兩者之間通過跨膜域連接。
抗體是適應性免疫系統中重要的組成蛋白質,其作用為結合抗原或機體中的其他外來物質,通過識別來引發免疫系統消除這些物質。抗體可以被分泌到細胞外環境中或錨合到特異性B細胞(即漿細胞)的細胞膜中。抗體和抗原之間存在很高的親和力,使得抗體可以很快地識別抗原。
在多細胞生物體中,載體運輸蛋白能夠結合特定的小分子並將它們運送到機體中的特定位置。這些蛋白質在運輸的起點(往往具有較高的濃度)必須以高的親和力結合它們的運輸物,而在目的組織中(運輸物質濃度較低)則必須釋放所結合的物質。這就需要運輸蛋白和所結合的物質之間有特定的親和力。一個典型的例子是血紅蛋白,它作用是將氧氣從肺中運輸到其他組織和器官中。[18]
通道蛋白也是重要的物質運輸蛋白,它們能夠改變細胞膜的通透性,使得一些小分子和離子可以進出細胞。膜本身是疏水性的,極性或帶電分子無法通過擴散作用穿過。作為跨膜蛋白的通道蛋白,含有可控制的內部通道,在一定條件下允許這些分子進出細胞。通道蛋白也有專一性,許多離子通道蛋白只選擇性地對特定離子起作用;例如,鉀離子和鈉離子通道分別只識別鉀離子或鈉離子。[19]
1.物理因素:加熱、加壓、攪拌、振盪、紫外線照射、X射線、超聲波等。
引起蛋白質結構的改變,形成沉澱,並引起生理活性的消失。 變性作用破壞了蛋白質的二級、三級、四級結構,一般不會影響其初級結構。
- 溶解度降低。
- 生物活性消失。
- 不能結晶。
- 易受蛋白脢的水解。
- 滴定曲線改變,因可滴定的官能基增加。
- -SH等基團的反應活性增加。
- 變性為不可逆的化學過程。
2.食物加熱烹調使蛋白質變性,利於酶發揮作用使其消化。
濃硝酸與某些蛋白質發生顯色(黃色)反應,可用於蛋白質的檢驗。
結構蛋白能夠形成相對更為剛性的生物組分。多數結構蛋白為纖維蛋白;膠原蛋白和彈性蛋白是結締組織(如軟骨)中關鍵的組分,而角蛋白則存在於頭髮、指甲、羽毛、蹄和一些貝殼中。此外,肌動蛋白和微管蛋白作為單體是球狀可溶蛋白,但一旦多聚化便形成長的剛性纖維用於組成細胞骨架,以保持細胞的大小和形態。
其他結構蛋白還包括馬達蛋白,如肌球蛋白、運動蛋白和動力蛋白,它們能夠產生動力。這些蛋白質對於細胞能動性(特別是精子的運動)、細胞內物質運輸和細胞分裂都具有重要作用;[20][21]它們也為肌肉收縮提供動力。[22]
研究方法
蛋白質是被研究得最多的一類生物分子,對它們的研究包括「體內」(in vivo)、「體外」(in vitro)、和「在矽之中」(in silico)。體外研究多應用於純化後的蛋白質,將它們置於可控制的環境中,以期獲得它們的功能資訊;例如,酶動力學相關的研究可以揭示酶催化反應的化學機制和與不同基質分子之間的相對親和力。相反的,體內研究實驗着重於蛋白質在細胞或者整個生物中的活性作用,從而可以了解蛋白質發揮功能的場所和相應的調節機制。在矽之中研究使用的計算方法來研究蛋白質。
為了進行體外(in vitro)研究,必須先將目的蛋白質從其他細胞組分中分離提純出來。這一過程通常從細胞裂解開始(對於分泌性蛋白質的提純則不需要裂解細胞),通過破壞細胞膜將細胞內含物釋放到溶液中,從而獲得含有目的蛋白質的細胞裂解液。然後通過超速離心將細胞裂解液中膜脂和膜蛋白、細胞器、核酸以及含有可溶蛋白質的混合物。鹽析法是一種較為常用的通過沉澱從裂解液中分離濃縮蛋白質的方法。基於目的蛋白質的化學性質(如分子量、帶電情況和結合活性),可以利用不同的色譜法來進一步分離提純蛋白質。純化的程度可以用電泳(已知目的蛋白質的分子量)、光譜學(目的蛋白質具有獨特的光譜學特徵)或者酶活分析反應(目的蛋白質具有特定的酶活性)來衡量。另外,蛋白質可以使用電聚焦根據其電荷被分離 [23]。
對於天然蛋白質,可能需要一系列的純化步驟才能獲得純度足以用於實驗室應用的蛋白質。為了簡化這一過程,通常採用基因工程的手段在目的蛋白質上添加一些化學特性,在不改變其結構和生物學活性的情況下使純化過程更為簡單。通常是將含有特定氨基酸序列的「標籤」連接在目的蛋白質的N-端或C-端。例如,含有連續多個組氨酸的序列,稱為組氨酸標籤;將含有帶組氨酸標籤蛋白質的裂解液流過含有鎳的親和層析柱,組氨酸就可以與鎳螯合從而結合在柱子上,而裂解液中其他蛋白質由於沒有組氨酸標籤而直接流出柱子,從而達到分離目的。[24]通過基因工程(即DNA重組)改造而獲得的蛋白質被稱為重組蛋白質。

in vivo的蛋白質研究常常專注於蛋白質在細胞中的合成和定位。雖然已經知道許多細胞內蛋白質是在細胞質中合成,而膜結合蛋白質或分泌性蛋白質是在內質網中合成,但蛋白質定位到特定細胞器或細胞結構的特異性是如何達到的,目前還不清楚。一些有助於獲得特定蛋白質在細胞中定位的方法得到了發展,特別是用基因工程將目的蛋白質上連接上「報告者」(如綠色螢光蛋白),將這樣的融合蛋白在細胞中表達後,就可以通過顯微鏡觀察螢光來了解融合蛋白在細胞中的分佈。[25]
另一種常用的同樣是基因工程的方法為定點突變。利用這一方法,研究者可以改變蛋白質序列,從而改變其結構、細胞內定位以及調控機制;而這些改變可以在in vivo的情況下通過連接綠色螢光蛋白,或者在in vitro的情況下通過酶動力學的方法以及結合實驗進行觀察。
在一定時間內一個細胞或一類細胞中存在的所有蛋白質被稱為蛋白質組,研究如此大規模的數據的領域就被稱為蛋白質組學,與基因組學的命名方式相似。蛋白質組學中關鍵的實驗技術包括用於檢測細胞中大量種類蛋白質相對水平的蛋白質微陣列技術,和用於系統性研究蛋白-蛋白相互作用的雙雜交篩選技術。此外,還有探究所有組分之間的可能的生物學相互作用的相互作用組學,以及系統性地解析蛋白質結構,並揭示其中的可能的摺疊類型的結構基因組學。
分析基因組和蛋白質組數據,這就需要應用計算技術於生物學問題,如基因識別和支序分類。生物資訊學領域現在是基因和蛋白質的分析必不可少的。
大量的計算方法已經被開發來分析蛋白質的結構,功能和進化。
這樣的工具的開發是由可用的多種生物體(包括人類基因組)的大量基因組和蛋白質組數據驅動的。根本不可能通過實驗來研究所有的蛋白質,因此只有少數蛋白質被得到實驗室實驗,而計算工具用於外推到相似的蛋白質。

作為結構基因組研究的互補,蛋白質結構預測的目標是發展出有效的能夠提供未知結構(未通過實驗方法得到)蛋白質的可信的結構模型。目前最為成功的結構預測方法是同源建模;這一方法是利用序列相似的蛋白質(已知結構)的結構作為「模板」。而結構基因組的目標正是通過解析大量蛋白質的結構來為同源建模提供足夠的模板以獲得剩餘的未解析的同源蛋白結構。從序列相似性較差的模板計算出精確的結構模型對於同源建模法還是一個挑戰,問題在於序列比對準確性的影響,如果能夠獲得「完美」的比對結果,則能夠獲得精確的結構模型。[26]許多結構預測方法已經被用於在蛋白質工程領域,在這些方法的幫助下,研究者們設計出一些新型的蛋白質摺疊類型。[27]更為複雜的結構計算是預測蛋白質分子之間的相互作用,需要應用分子對接法和蛋白-蛋白相互作用預測。
利用分子動力學的方法可以模擬蛋白質的摺疊和結合過程。通過分佈式計算,如Folding@Home計劃,為分子動力學模擬注入了活力。小的α螺旋蛋白結構域,如絨毛蛋白的頭部[28]和HIV輔助蛋白[29]已經成功地在計算機中(in silico)被模擬。將標準的分子動力學和量子力學計算相結合的混合方法已經被用於探索視紫紅質分子的電子態。[30]
蛋白質含量檢測
蛋白質含量檢測,通常是檢測樣本裏的含氮量比例。但是,凱氏分析與杜馬斯方法,分辨不出蛋白質與三聚氰胺的差異。一份純瘦肉的雞胸肉以凱氏分析,可以測得數值約31%左右。
- 凱氏分析(凱氏定氮法)
- 杜馬斯方法(杜馬斯燃燒定氮法)
- 近紅外光譜法
營養作用
大多數微生物和植物能夠合成所有20種標準氨基酸;動物則由於缺乏某些氨基酸合成途徑中特定氨基酸合成反應所需的關鍵酶,如從天冬氨酸生成離胺酸、甲硫氨酸和蘇氨酸的合成反應第一步中發揮催化作用的天冬氨酸激酶,而只能合成部分氨基酸。因此,動物必須從食物中獲取這些自身無法合成的氨基酸。[13]一個生物體所無法合成而需從食物中獲取的氨基酸被稱為必需氨基酸;而食物中缺少必需氨基酸的蛋白質,被定位為不完全蛋白質。如果環境中存在所需氨基酸,微生物能夠直接攝取這些氨基酸,而下調其自身的合成水平,從而節省了原來需要用於合成反應的能量。
動物所攝取的氨基酸來源於食物中所含的蛋白質,每公克蛋白質可供給4大卡熱量。攝入的蛋白質通過消化作用而被降解,這一過程通常包括蛋白質在消化系統的酸性環境下發生變性,變性後的蛋白質被蛋白酶水解成氨基酸或小段的肽。隨後這些降解片段就可以被吸收。部分吸收後的氨基酸被用於蛋白質的合成,其餘的則通過糖質新生作用被轉化為葡萄糖或進入三羧酸循環進行代謝。蛋白質的營養作用在飢餓環境下顯得特別重要,此時機體可以利用自身的蛋白質,特別是肌肉中的蛋白質,來產生能量以維持生命活動。[31]蛋白質/氨基酸也是食物中重要的氮源.
蛋白質進入口腔時無法被分解,進而到胃。胃蛋白酶可斷裂芳香族氨基酸或白氨酸氨基端肽鍵,凝乳酶可將牛奶中的酪蛋白(Casein)催化成含鈣的副乾酪素(Ca paracaseinate)。 到了小腸,胰蛋白酶、糜蛋白酶、羧基肽酶開始作用;胰蛋白酶可斷裂離胺酸或精氨酸的羧基端肽鍵,糜蛋白酶可斷裂色氨酸、酪氨酸、苯丙氨酸的羧基端肽鍵,羧基肽酶可斷裂肽鏈羧基端的最後一個肽鍵。 人體所需蛋白質在許多食物中都含量豐富,如動物肌肉、乳製品、蛋、豆類、穀類和蕈類等。人體中蛋白質缺乏可以導致全身浮腫、皮膚乾燥病變、頭髮稀疏脫色、肌肉重量減輕、免疫力下降等。[32]
食物中的蛋白質有時會引起過敏反應。
歷史和詞源
在18世紀,安東尼奧·弗朗索瓦和其他一些研究者發現蛋白質是一類獨特的生物分子,他們發現用酸處理一些分子能夠使其凝結或絮凝。當時他們注意到的例子有來自蛋清、血液、血清白蛋白、纖維素和小麥麵筋裏的蛋白質。荷蘭化學家格哈杜斯·約翰內斯·穆德對一般的蛋白質進行元素分析發現幾乎所有的蛋白質都有相同的實驗式。用「蛋白質」這一名詞來描述這類分子是由穆德的合作者永斯·貝采利烏斯於1838年提出。穆德隨後鑑定出蛋白質的降解產物,並發現其中含有為氨基酸的白氨酸,並且得到它(非常接近正確值)的分子量為131原子質量單位。
對於早期的生物化學家來說,研究蛋白質的困難在於難以純化大量的蛋白質以用於研究。因此,早期的研究工作集中於能夠容易地純化的蛋白質,如血液、蛋清、各種毒素中的蛋白質以及消化性和代謝酶(獲取自屠宰場)。1950年代後期,Armour Hot Dog公司純化了一公斤純的牛胰腺中的核糖核酸酶A,並免費提供給全世界科學家使用。目前,科學家可以從生物公司購買越來越多的各類純蛋白質。

著名化學家萊納斯·鮑林成功地預測了基於氫鍵的規則蛋白質二級結構,而這一構想最早是由威廉·阿斯特伯里於1933年提出。隨後,沃爾特·考茲曼在總結自己對變性的研究成果和之前凱伊·林諾斯特倫·郎的研究工作的基礎上,提出了蛋白質摺疊是由疏水相互作用所介導的。1949年,弗雷德里克·桑格首次正確地測定了胰島素的氨基酸序列,並驗證了蛋白質是由氨基酸所形成的線性(不具有分叉或其他形式)多聚體。原子解像度的蛋白質結構首先在1960年代通過X射線晶體學獲得解析;到了1980年代,核磁共振也被應用於蛋白質結構的解析;近年來,冷凍電子顯微學被廣泛用於對於超大分子複合體的結構進行解析。
蛋白質這一概念最早是由瑞典化學家永斯·貝采利烏斯於1838年提出,但當時人們對於蛋白質在機體中的核心作用並不了解。1926年,詹姆斯·B·薩姆納揭示尿素酶是蛋白質,首次證明了酶是蛋白質。[35]
第一個被測序的蛋白質是胰島素,由弗雷德里克·桑格完成,他也因此獲得1958年度的諾貝爾化學獎。[36]首先被解析的蛋白質結構包括血紅蛋白和肌紅蛋白的結構,所用方法為X射線晶體學;[37][38]該工作由馬克斯·佩魯茨和約翰·肯德魯於1958年分別完成,他們也因此獲得1962年度的諾貝爾化學獎[39]。截至到2017年,蛋白質數據庫(PDB)中已存有接近126,000個原子級解像度的蛋白質及其相關複合物的三維結構的坐標[40]。
參見
參考文獻
外部連結
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

