多发性硬化症
来自维基百科,自由的百科全书
多发性硬化症(multiple sclerosis,MS)或多发性脑脊髓硬化症(multiple cerebrospinal sclerosis[8]),是一种以中枢神经系统白质炎性脱髓鞘病变为主要特点的自身免疫疾病,因病变具有部位(空间)多发和时间多发的特点,且产生许多硬性的胶质瘢痕(glial scar)而得名。
| 多发性硬化症 | |
|---|---|
| 异名 | 弥漫性硬化症、弥漫性脑脊髓炎 |
 | |
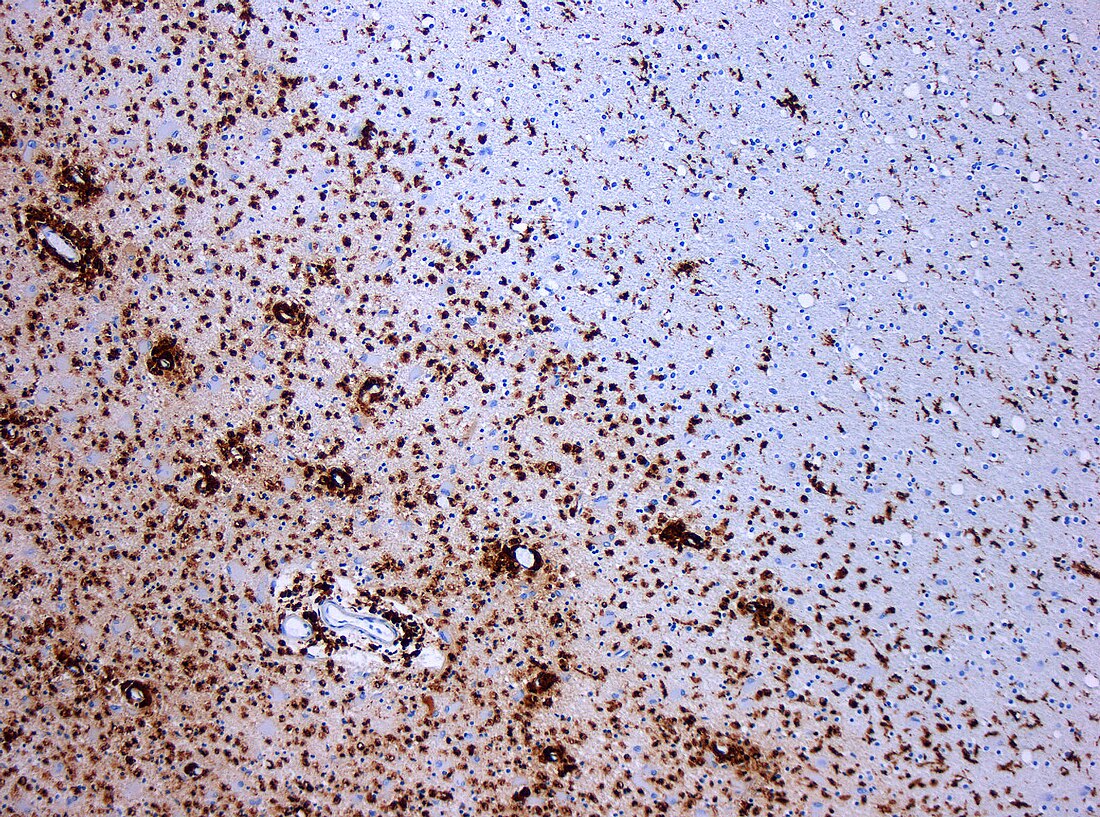
| CD68标记的组织病理切片。CD68是一种巨噬细胞的表面标记,多发性硬化症造成的脱髓鞘性病灶附近常可以看到许多CD68+的巨噬细胞存在。 | |
| 症状 | 复视、单侧视力受损、肌肉无力、感觉受损、协调障碍[1] |
| 起病年龄 | 20–50岁[2] |
| 病程 | 慢性[1] |
| 类型 | 脱髓鞘病[*]、中枢神经系统脱髓鞘病[*]、中枢神经系统自体免疫性疾病[*]、疾病 |
| 病因 | 未知[3] |
| 诊断方法 | 基于症状和医学检验[4] |
| 治疗 | 药物、物理治疗[1] |
| 预后 | 预期余命减少5-10年[5] |
| 患病率 | 200万分之一(2015)[6] |
| 死亡数 | 18,900(2015)[7] |
| 分类和外部资源 | |
| 医学专科 | 神经内科 |
| ICD-11 | 8A40 |
| ICD-9-CM | 340 |
| OMIM | 612594、612596、612595 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine | 1146199、1214270、342254 |
多发性硬化症最常侵犯的部位是脑室周围白质、视神经、脊髓、脑干传导束和小脑白质等处。患者脑或脊髓中的神经细胞表面的绝缘物质(即髓鞘)受到破坏[1],神经系统的信号转导受损,导致一系列可能发生的症状,影响患者的活动、心智、甚至精神状态[5][9][10]。
多发性硬化症依损害部位不同而临床表现多样,常见表现有视力下降(复视、单侧视力受损)、感觉异常或迟钝、肢体无力、共济失调或协调障碍、大小便障碍等[1]。
病情多变,病程中常有缓解与复发、继发与进展,也可能初次发病后持续加剧。在每次发作之间,症状有可能完全消失,但永久性的神经损伤仍然存在,这在病情严重的患者特别明显[11]。
虽然具体的成因不明,但多发性硬化症的机制可能为髓鞘受到免疫系统破坏或生成髓鞘的细胞发生问题[3],可能的原因包括遗传与环境因素,例如受病毒感染的刺激而引发自身免疫反应[9][12]。多发性硬化症的诊断需借助临床表现和相关的影像学证据支持[4]。
目前尚无根治多发性硬化症的方法[1],现有的治疗多为改善患者发作后的日常功能,并预防疾病再度复发[9]。物理治疗则能改善患者的功能[1]。许多人会寻求替代疗法,尽管其疗效缺乏证据支持[13]。多发性硬化症的长期预后很难预测,通常女性、较年轻发作、反复复发缓解(relapsing-remitting)和一开始发作次数较少的患者有较佳的预后[14]。患者的预期寿命较一般人少5至10年[5]。
多发性硬化症是最常见的中枢神经系统免疫疾病[15]。2015年全球约有230万人罹患此病,但不同地区和种群的盛行率差异极大[6][16];同年,约有18,900人死于多发性硬化症,相较于1990年的12,000人高出许多[7][17]。多发性硬化症通常在20到50岁之间发病,女性的发生率为男性的2倍[2]。1868年,让-马丁·沙可首次描述了多发性硬化症,意指大脑白质和脊髓中有许多疤痕(sclerae,可理解为现在所称的斑块或病灶)[18][19]。多种新的治疗与诊断方法都正在研究当中[20]。
症状

多发性硬化症患者可能出现任何神经学症状,其中自主神经、视觉、运动和感觉问题最常出现[5]。确切的症状则依患者病灶的实际位置而异,可能有感觉丧失或感觉异常(如刺痛感或麻木等)、肌肉无力、视力模糊[21]、反射增强、痉挛或运动困难、无法维持协调与平衡(共济失调)、发音困难或吞咽障碍、视觉问题(如眼球震颤、视神经炎或复视)、疲劳、急性或慢性疼痛、膀胱与肠胃蠕动问题等等,思考障碍或情绪问题(如忧郁症或情绪不稳)也很常见。乌托夫现象(Uhthoff's phenomenon,温度较高时症状较严重)和莱尔米特征候(Lhermitte's sign,即把颈部前弯时会感到一股电流传到背上)则是多发性硬化症典型的征候[5]。扩展残疾状态量表(EDSS)是用来量化疾病严重度和患者失能程度的主要指标,其他指标如多发性硬化症功能复合量表也越来越常用于研究中[22][23][24]。
约85%的患者一开始仅出现临床单一症状(CIS,即发生一次疑似多发性硬化症的发作),几天后45%的患者未出现运动或感觉问题、20%有视神经炎、10%有和脑干相关的症状,剩下的25%则有超过一种前述的问题[4]。症状最初通常以两种形式出现:患者可能会有几次持续数天到数个月的急性恶化并随后改善(85%);也可能缓慢逐渐恶化而没有任何好转的迹象(10–15%)[2];病程也可能混合上述两种形式[11],或一开始会发作和改善,但之后却转为持续恶化[2]。症状的发作通常没有征兆,因此难以预测,但很少一年超过两次[5]。然而有些患者的发作会受特定因素刺激,因此在春夏较常出现[25]。同样地,病毒感染(如感冒、流行性感冒或肠胃炎)也会增加风险[5],压力也可能引起疾病发作[26]。 患有多发性硬化症的妇女在怀孕后会较少发作,但生产后的头几个月发作风险会增加;整体而言,怀孕不会影响长期预后。目前已知许多因素都不会影响多发性硬化症的复发率,包括接种疫苗、喂乳[5]、身体创伤[27]和乌托夫现象(Uhthoff's phenomenon)[25]。
病因
多发性硬化症的病因未明,但一般相信是由遗传和环境因素(如感染)共同造成[5]。有许多理论试图将临床数据和假说相结合,但仍没有确切的答案。虽然目前已知有若干环境风险因子是能透过人为改善的,但消除此类环境因子是否能预防多发性硬化症还有待进一步研究[28]。
多发性硬化症在纬度较高的地区较常出现[5][29],但此分布也有例外。某些住在高纬地区的种族盛行率较低,例如萨米人、美洲原住民、加拿大胡特尔人、新西兰毛利人[30]和加拿大因纽特人[2];某些住在赤道附近的种群盛行率则相对较低,例如萨丁尼亚人[2]、西西里人[31]、巴勒斯坦人和帕西人[30]。造成此种地理分布的原因未知[2],虽然目前南北分布差异逐渐缩小[29],但到2010年为止仍然存在[2]。
多发性硬化症在北欧种群较常见[5],这反映了此类高风险种群的全球分布状况[2],部分学者认为这和高纬地区阳光照射较少导致体内维生素D较少有关[32][33][34]。出生季节和多发性硬化症的关联支持前项假说,北半球十一月出生的人相较于五月出生的人较容易发生多发性硬化症[35]。儿童时期的环境因子可能也有重要的影响,一些研究发现15岁前移居其他地方居住的孩童适用于移居处的发病率;但若15岁以后才搬家,则风险与其家乡较为相近[5][28]。其他证据则显示15岁以后移居仍会对罹病风险产生影响[5]。

普遍不认为多发性硬化症是一种遗传疾病,但一些遗传变异可能会增加罹病风险[36],有些此类的基因在微胶细胞中似乎有超乎预期的表现量[37]。患者的亲属罹患多发性硬化症的几率较一般人高,血缘关系亲近者风险更高[9];同卵双胞胎的另一人约有30%的罹病率,而异卵双胞胎则只有5%,手足更只有2.5%,同父异母或同母异父的手足几率更低[5][9][38]。若双亲都有多发性硬化症,则孩童的发生率为一般人的十倍[2]。此外,特定族裔的盛行率也比较高[39]。
目前已发现许多和多发性硬化症有关的基因,其中就包括了人类白细胞抗原(HLA),这是一群在第六染色体上作为主要组织相容性复合体(MHC)的蛋白质[5]。HLA和多发性硬化症之间的关联最初在1980年代发现,现在该区域已证实和其他自身免疫疾病(如1型糖尿病和全身性红斑狼疮)有关[40]。目前已知和多发性硬化症最有关的MHC等位基因为DR15和DQ6,另有些基因座如HLA-C554和HLA-DRB1*11似乎对多发性硬化症有保护作用[5]。整体而言,HLA的改变对多发性硬化症贡献了20%至60%的遗传倾向。透过现代的遗传学方法(如全基因组关联分析),科学家已发现其他至少12个HLA基因座以外的基因可能会增加多发性硬化症的罹病率[40]。
科学家曾提出多种微生物可能会诱发多发性硬化症,但没有一种获得证实[9]。早年就移居到世界上的其他地方会改变之后罹患多发性硬化症的风险,针对这种现象的一种解释是移居地可能会有原住居处少见的感染症[12];其他解释则有卫生假说和盛行假说。卫生假说认为在生命早年暴露于特定的感染源能增强个体的保护力,若长大后才接触那些病源则会造成疾病[5]。盛行假说则认为多发性硬化症是由盛行地区某种感染源造成,但多数受感染的人没有症状,只有少数个案在数年后才真的造成脱鞘病变[12][41]。目前卫生假说较盛行假说获得更多支持[12]。
多数多发性硬化症的患者脑和脑脊髓液中含有寡株落条带,部分研究者认为这可能是病毒感染的证据,该现象也会出现在某些人类病毒性脱鞘性脑脊髓炎和动物的病毒性脱鞘性疾病[42]。目前怀疑人类疱疹疹病毒是最可能的感染源[43]。未曾被EB病毒感染的人罹患多发性硬化症的几率较低,但在成人早年受感染的人比更年轻就被感染的人有更高的罹病风险[5][12]。有些学者认为此项假说和卫生假说抵触,因为未受感染的人可能有较好的卫生教育[12];其他学者则相信两者并不冲突,因为相较于卫生假说中的早期感染源,患者是在生命较后期才接触到刺激多发性硬化症的病源菌。其他相关的病毒感染可能还包括麻疹、腮腺炎和德国麻疹[5]。
目前已知吸烟是多发性硬化症的一个独立风险因子[32]。压力也可能会增加罹病风险,但相关的证据较为薄弱。职业毒物暴露(主要为有机溶剂)的影响也曾受评估,但没有明确的结果。以往的研究对疫苗接种做过因果分析,但多数没有找到关联性[28]。其他可能的风险因子(如饮食和贺尔蒙摄取)也曾被科学家检视,但这些因素和多发性硬化症间的关系都较薄弱且缺乏说服力[32]。多发性硬化症的患者罹患痛风的比率较低,血中的尿酸浓度也较低;因此有假说认为尿酸对多发性硬化症有保护作用,但目前对于尿酸扮演的角色仍属未知[44]。
病生理学


多发性硬化症发生的三个重要特征包含出现中枢神经系统病灶、发炎反应,以及髓鞘破坏等。关于上述特征如何出现,以及这些机转如何导致临床症状,目前尚未完全了解[5]。目前相信胆固醇结晶会导致髓鞘破坏,并加强发炎反应[45][46]。多发性硬化症目前认为是一种免疫发炎引起的疾病,意即疾病乃是因个体的免疫系统引起的发炎反应破坏了神经系统。可能是遗传或其他尚未证实的环境因子使然[9]。

多发性硬化症会造成受侵犯的神经病灶处产生疤痕,并以此得名。本疾病最常进犯视神经、脑干、基底核、脊髓,以及侧脑室周围的白质[5]。白质主要由神经纤维构成,负责传递灰质脑区间的信息。多发性硬化症较少侵犯周边神经系统[9]。
更精确一点来说,多发性硬化症会造成寡突胶质细胞的丧失。寡突胶质细胞会产生和维持包覆神经纤维的髓鞘,帮助动作电位的传导[5];若寡突胶质细胞受到进犯,可能会导致髓鞘消失或变薄,甚至使神经元的轴突受损退化。髓鞘消失后,神经元的传导效率会下降[9],因此寡突胶细胞会启动再髓鞘化的程序修复髓鞘。这种修复现象可以疾病初期看到,但寡突胶的修复能力并无法完全重建髓鞘。若髓鞘反复受损,再髓鞘化的效能会逐渐下降,最后导致受损轴突周围堆满了疤痕状的斑块[47]。这些疤痕会导致多发性硬化症的症状。在症状发作时,磁振照影(MRI)时常会显示脑部出现十几个新斑块。这种现象可能代表患者脑部其实存在有大量的病灶,但因为神经的自愈功能,使患者平时没有出现明显症状。另外,病灶处也会因为神经损伤而导致星状细胞异常增多[5]。目前有许多关于多发性硬化症的病理特征已经被描述[48]。
除脱髓鞘现象外,发炎反应也是多发性硬化症的重要体征之一。T细胞在多发性硬化症的发炎反应中扮演重要角色[9],平时中枢神经系统会受到血脑障壁保护,一旦这层屏障受到破坏,T细胞就会进到中枢神经,将髓鞘视为外来物进行攻击,这些攻击自身的淋巴细胞又称自体反应性淋巴细胞(autoreactive lymphocytes)[5]。髓鞘遭受攻击后会诱发免疫反应的产生,使免疫细胞释放细胞激素和抗体,扩大发炎反应。持续扩大的发炎反应可能会导致血脑障壁的瓦解,进而出现一系列神经受损的现象,例如神经水肿、巨噬细胞激活、细胞激素释放,以及出现许多遭受破坏的蛋白质[9]。发炎反应也会透过至少三种途径影响讯息的传导,发炎介质会阻滞周围正常神经的信息传递,另外髓鞘的破坏也会减少神经信息的传递效率[5]。
血脑障壁是中枢神经系统血管外一层防止血液中的物质进入脑脊髓的屏障,同时也能阻挡T细胞进入。但如果中枢神经遭到病毒或细菌感染时,血脑障壁的通透性会增大。感染消退后,血脑障壁会自行修复,但当初跑进来的T细胞会残留在脑中[9]。钆是一种没有办法穿透正常血脑障壁的元素,因此钆增强磁振造影(gadolinium-enhanced MRI)可以用于检测血脑障壁瓦解与否[49]。
诊断


临床症状是诊断多发性硬化症的重要依据,配合医学影像和医学检验可以辅助诊断[4]。但症状常与其他疾病类似,造成诊断较为困难,特别是在疾病初期[5][50]。麦克唐纳诊断标准(McDonald criteria)是目前最常使用的诊断工具,该标准收录了临床、检验,以及放射医学的证据[16]。舒马克和波色诊断标准是过去常用的诊断标准,但已被麦氏标准取代[51]。惟2010年的麦氏标准在部分疾病的诊断描述上,与其他疾病重叠(如泛视神经脊髓疾病等),因此2016年,欧洲多发性硬化症核磁共振影像学会连线(European Magnetic Resonance Imaging in Multiple Sclerosis,MAGNIMS)提出了MAGNIMS共识,加入影像学的判断,为麦式标准的内容进行修订[52]。
若患者有多次特异性较高的事件发作,可能直接透过临床证据即可诊断多发性硬化症。但若仅有发作过一次,则必须进行其他测试来辅助诊断。最常见的工具有神经影像学、脑脊髓液分析,以及诱发电位测试。核磁共振影像可以显示脑部喊脊随脱髓鞘的区域,以及斑块等病灶。静脉输注含钆的显影剂可以标定活跃斑块,且也可以显影无症状性的斑块病灶[53][54]。脑脊髓液分析可以显示中枢神经系统是否存在慢性发炎,需透过腰椎穿刺采检取得。技术员会将脑脊液进行电泳,检视电泳胶片上是否带有IgG的寡克隆条带(oligoclonal band),75–85%的多发性硬化症患者的脑脊液分析可以找到特征[53][55]。此外,由于脱髓鞘现象,患者的视神经和感觉神经对于刺激的敏感度也会下降,这些现象可以透过视神经和感觉神经的诱发电位侦测而得[56]。
上述的诊断方式皆属于非侵入性的诊断方式[5],但有时必须透过遗体解剖和病灶的组织活检才能确诊[53][57]。截至目前为止,尚无单一检验(包括组织活检)可以确诊多发性硬化症[58]。
分型
截至2013年为止,美国国家多发性硬化症学会(National Multiple Sclerosis Society)和国际多发性硬化症联合会(Multiple Sclerosis International Federation)已描述了四种分型。分型有利于从过去病史推断为来的预后,且对未来的治疗策略也有重要意义[59][60][61]:
- 临床单一综合征(Clinically isolated syndrome,CIS)
- 复发缓解型多发性硬化症(Relapsing-remitting MS,RRMS)
- 原发进行性多发性硬化症(Primary progressive MS,PPMS)
- 续发进行性多发性硬化症(Secondary progressive MS,SPMS)
复发缓解型(RRMS)多发性硬化症中最常见的一型,占所有首次发作病患的80%左右。此类患者在单次发作后,会进入数月到数年的缓解期,在此期间病患的症状会相对稳定,但在之后会无预期性地复发。每次发作后所造成的神经功能缺损可能会几乎缓解,但也有约40%的病人会有后遗症,且发作时间越久,发生后遗症的机会越大[5][4]。由于此类患者在发作后会缓解,有时又被视为“良性多发性硬化症”(benign MS)[62],但长期下来,患者的神经损伤仍然会累积,最终导致神经功能退化[5]。另一方面,所谓“恶性多发性硬化症”则是描述在短期即会造成神经功能明显减退的类型[63]。临床单一综合征(CIS)是描述病人发生一次疑似脱髓鞘的症状,但尚未符合多发性硬化症的诊断标准[5][64]。约有30-70%的CIS最后会进展为多发性硬化症,而RRMS大多也会以CIS最为其初始表现[64]。
原发进行性多发性硬化症(PPMS)约占多发性硬化症患者的10–20%,此类患者在初始发作后,症状即会不断恶化,完全不会缓解或改善[11][4][65]。此类病人会较复发缓解型晚发病。复发缓解型和续发进行性大约都是在40岁左右发病[5]。虽然此类病人的表现与RRMS有极大差异,但期病程进展速度其实大致相同[66]。
续发进行性(SPMS)常以RRMS作为初始表现,约有65%初始诊断为RRMS的病患为SPMS。此类型的特点是在每次发作之后,神经功能都会有所减退,且之间没有明显的缓解期[5][11]。此类患者的症状偶尔会再发或轻微缓解[11]。一般来说,RRMS会进展到SPMS之间常会间隔19年左右[67]。
除了上述四种类型之外,还有多种疑似多发性硬化症的亚型也已被描述,这些亚型被统称为特发性发炎性脱髓鞘病。如视神经脊髓炎、弥漫性脱髓鞘硬化症、同心圆性硬化症、马尔堡多发性硬化症。目前关于这些疾病是否真的属于多发性硬化症仍有争议[68]。儿童多发性患者的表现与成人不同,其进展到进行期(progressive stage)的速度较慢,不过仍然会在一般成人达到进行期的平均年龄之前[5]。
治疗
虽然目前无法治愈多发性硬化症,但部分疗法已被证实能有效控制疾病。治疗的目标为恢复患者的功能、预防再次发作和失能。一般会建议有发作过一次并有两处以上MRI病灶的患者开始使用药物介入[69]。就如同其他许多药物一样,多发性硬化症的治疗可能会带来一些副作用。人们也不断尝试另类疗法,即便这些疗法的效果缺乏证据支持[13]。
在患者症状发作时,通常会静脉注射高剂量类固醇(如甲基培尼皮质醇)[5],口服类固醇似乎也有类似的效果和安全性[70]。整体而言,虽然类固醇能暂时缓解症状,但似乎对长期预后没有显著影响[71]。而对类固醇没有反应的严重发作则可考虑以血浆置换术治疗[5]。
截至2019年,已有11种药物核准用于复发缓解型多发性硬化症的疾病调节,这些药物分别为干扰素β-1a、干扰素β-1b、醋酸格拉替雷 (glatiramer acetate)、米托蒽醌(mitoxantrone)、那他珠单抗(natalizumab)、芬戈莫德(fingolimod)、特立氟胺(teriflunomide)[72][73]、富马酸二甲酯(dimethyl fumarate)[74]、阿仑单抗(alemtuzumab)[75][76]、奥美珠单抗(ocrelizumab)[77],和西普尼莫德(siponimod)[78]。
截至2012年,药物治疗的成本效益仍然未明[79]。2017年3月,美国食品药品监督管理局(FDA)核准奥美珠单抗用于治疗复发缓解型,该药物为一种抗CD20的人源化单克隆抗体[80][81],仍有多项第四期临床试验进行中[82]。
减少发作次数对于复发缓解型的病程有一定的效果[72]。目前的第一线治疗为干扰素和格拉替美[4],两者大约皆可减少复发几率30%左右[83],且成人跟儿童的效果大致相仿[84]。提早开始长期治疗的疗程可以改善预后,且安全性无虞[85][86]。那他珠单抗降低复发机会的效果,比起第一线治疗更加显著。但因为拥有一些副作用,因此做为第二线疗法,用于对其他疗法反应不佳[4],或拥有严重不良反应的病人[83]。米托蒽醌的使用受制于严重的不良反应,因此目前归为第三线治疗,用于对前两线治疗反应不佳的病人[4]。临床单一综合征(CIS)用干扰素治疗可以减少病人进展为多发性硬化症的几率[5][87]。截至2011年,芬戈莫德、特立氟胺,以及富马酸二甲酯等较新药物的效果尚未明朗[88]。
截至2017年,尽管利妥昔单抗(rituximab)尚未核准用于多发性硬化症的治疗,但临床上仍常用于治疗复发缓解型多发性硬化症[89]。
2017年以前,利妥昔单抗(rituximab)广泛被作为原发进行性多发性硬化症的仿单标示外治疗[89]。2017年3月,美国食品药品监督管理局(FDA)核准了奥美珠单抗(ocrelizumab),使之成为第一个核准用于治疗原发进行性多发性硬化症的药物[80][81],美国FDA并要求对该药物进行若干第四期临床试验[82]。
截至2011年[update],米托蒽醌(mitoxantrone)是唯一一种核准用于治疗续发进行性多发性硬化症的药物[90]。在这些患者中,目前的证据暂时支持蒽醌 I能适度缓解疾病恶化,并减少两年内发作的几率[91][92]。

干扰素及格拉替美(glatiramer)等疾病调节剂最常见的副作用之一是注射处红肿(皮下注射90%几率,肌肉注射33%几率)。且注射一段时间后,注射处的脂肪组织会崩解,形成一个明显的凹痕,此现象称为脂萎缩(lipoatrophy)[93]。干扰素还可能会造成类似流行性感冒的症状[94]。有些人注射格拉替美后产生的潮红、胸闷、心悸,和焦虑,通常这些现象不会持续超过30分钟[95]。疾病调节剂还有其他更危险但罕见的副作用,如干扰素有造成肝损伤的风险[96];米托蒽醌则有可能造成心脏收缩问题(12%)、不孕,以及急性骨髓性白血病(0.8%)等问题[91][97];那他珠单抗则有机会造成进行性多灶性白质脑病(PML,1/600人)[4][98]。
芬戈莫德(Fingolimod)可能导致高血压、心率下降、黄斑部水肿、肝指数上升,或淋巴细胞减少[88]。目前证据倾向支持短期使用芬戈莫德似乎安全,常见副作用包含头痛、疲倦、恶心、脱发,和四肢疼痛[72]。更严重的不良反应包含肝衰竭、进行性多灶性白质脑病,以及致畸性都曾有报导[88]。富马酸二甲酯的常见副作用为潮红和肠胃道副作用[74][88]。马酸二甲酯还可能会导致白细胞数量减少,但目前试验并无伺机性感染的报导[99][100][101]。
药物和神经复健都可以改善部分症状,但两者皆无法逆转病程[102]。有些症状如膀胱功能失调和痉挛等症状对药物有显著效果,但其他症状的效果就相对不佳。其他神经学症状需依赖科际合作来改善病人的生活品质。由于多发性硬化症的病程及医疗涉及多项医学专科,因此难以界定所谓的“核心团队”[5]。良好的科际整合复健计划可以增进患者的活动功能(activity)和参与功能(participation),但对改善患者的身体功能损伤没有助益[103]。目前关于个别治疗计划的效果证据有限[104][105],但有良好证据显示运动[106][107]和心理治疗对疾病有些帮助[108]。认知行为疗法则显示对于多发性硬化症造成的疲惫症状有所助益[109]。
超过50%的多发性硬化症患者会寻求替代医疗(此比率依替代医疗的定义而有差异),但替代医疗的疗效通常证据薄弱或缺乏证据支持[13][110]。这些未经验证的疗法包括饮食补充与配方[13][111][112]、维生素D[113]、瑜珈等放松技巧[13]、草药(包括医用大麻)[13][114][115]、高压氧治疗[116]、自行吞下钩虫、区域反射疗法、针灸[13][117]和正念疗法[118]。采用这些疗法的患者以女性、长时间罹病、失能严重或对常规医疗满意度低的患者较多[13]。
血管外科医师保罗·赞博尼在2008年提出了慢性脑脊髓静脉回流不足(CCSVI)假说,认为多发性硬化症和脑部的静脉狭窄有关。因此推行血管手术试图改善多发性硬化症。但后来研究发现手术介入并无任何效益[119],且徒增副作用及死亡风险[120],因此不建议进行[119]。
预后

32-68
68-75
77-77
77-88
88-105
106-118
119-119
120-148
151-462
470-910
多发性硬化症的病程取决于疾病的亚型、个人的性别与年龄、最初的症状和患者失能的程度。女性、复发缓解型、一开始有视神经炎或感觉症状、最初几年较少发作、较早发病的患者有较好的预后[14][121]。
发病后的平均预期余命为30年,较未得病的群体少了5到10年[5]。接近40%的患者能活到七十几岁[121],但三分之二的死亡直接与此疾病相关[5]。患者的自杀率也较高,对肢体障碍的患者而言感染和其他并发症的风险则特别高[5]。
约有80%的多发性硬化症患者一开始是以临床单一综合征表现。若核磁共振扫描发现未进犯的神经区域有异常的影像学变化,在未来两年内有50%的几率会发生脱髓鞘疾病,20年内的几率甚至高达八成[122]。约有三成男性且较年轻发病的患者会在54岁时会失去独立行走的能力[123]。
流行病学

0-0
1-1
2-2
3–5
6–12
13–25
多发性硬化症是最常见的中枢神经自身免疫疾病[15]。2017年,全球约有160至195万名患者(约每10万人30名)[16][2],估计每年造成18,000人死亡[124]。个别区域来看,非洲地区的盛行率每10万人不到0.5人,东南亚每10万人2.8人,美国每10万人8.3人,欧洲每10万人80人[16],部分北欧族裔更超过每10万人200人[2]。全球每年的发生率(新发生个案)则约为每10万人2.5人[16]。
多发性硬化症的发生率似乎正在上升,但这或许可以用诊断技术的进步来解释[2]。近年来,种群研究和地理分布研究越来越普遍[41],科学家也据此相继提出了一些解释此现象的理论[12][28][32]。
多发性硬化症常在成年发生,特别是25到35岁,但在少数的情形下也可发生在孩童或大于50岁的人身上[16][2],其中50几岁的人较常见原发进行性多发性硬化症[65]。就如同许多其他的自身免疫疾病,多发性硬化症在女性较常见,这样的趋势正在增加中[5][29]。到2008年为止,女性的发生率约为男性的2倍[16];在儿童中,女性的发生率则比男性高出更多[5];但在超过50岁的人口中,男女的发生率则差不多[65]。
历史

英国病理学家罗伯特·凯斯威尔教授(1793–1857)和法国解剖病理学家让·克吕维耶教授(1791–1873)曾描述许多与多发性硬化症症状类似的疾病细节,但当时他们都尚未把他划分为独立诊断[125]。凯斯威尔当时以描述这种疾病为“合并萎缩的脊髓病灶”[5]。1863年,瑞士病理学家乔治·爱德华·林德弗雷奇(1836–1908)在显微镜检下发现沿血管发生的发炎性神经病灶[126][127]。
1868年,法国神经学家让-马丁·沙可(1825–1893)在回顾过去文献,加上自己的临床和病理观察后,首次建立多发性硬化症此一诊断[125]。
在沙可建立诊断的同时,他也尝试首度建立多发性硬化症的诊断标准,并提出著名的“沙可三重症”(Charcot's triad)[注 1]。所谓沙可三重症包含眼球震颤、意向性颤抖、电报式语言等等[128]。沙可另外还观察到患者有认知功能改变的问题,他描述病人在记忆功能上有明显减退,且在概念形成上也比较缓慢[18][19]。
自此,沙可三重症成为多发性硬化症的标准诊断依据,直到1965年舒马克首度提出标准化的诊断标准才逐渐式微。舒马克导入了散在性病灶、发病时间差,以及“症状无法以其他解释”等标准[128]。上述几项新增的内容都为后来的波色诊断标准及现今广泛使用的麦克唐纳诊断标准所收录。
到了20世纪,关于此病症病理机转的理论开始有些进展,到了1990年代之后更发展出了数项治疗[5]。2010年重新修订后的麦氏诊断标准容许利用单一病灶进行多发性硬化症的诊断(即临床单一症后群)[129]。2013年更将临床单一症后群列为多发性硬化症的一种表型。自此,不再有“从临床单一症后群进展为多发性硬化症”的说法存在[130]。

在沙可建立此诊断之前,相关诊断无法进行。下列病例在重新回顾分析后,可能也是多发性硬化症的患者。
11世纪左右,有一名居住于冰岛的年轻女性哈朵拉(Halldora)突然失去视力和运动功能,在祈祷之后的七天奇迹似地恢复。斯希丹的圣李维娜(1380–1433)是一名荷兰修女,她可能是目前已知最古老的可诊断病例之一。圣李维娜从16岁到她53岁病逝之间的岁月里,身受间歇性疼痛、下肢无力、视力丧失等症状所苦,而上述症状都是典型多发性硬化症的症状[131]。上述的这两个病例,也使后人提出多发性硬化症可能源自维京人的假说[132]。
英国国王乔治三世的孙子,奥古斯特·弗德里克·德斯特(1794–1848),是萨塞克斯公爵奥古斯都·腓特烈和茉蕊夫人之子。德斯特在28岁参加完朋友葬礼之后,出现了短暂性视觉丧失的现象。之后他又发生了下肢无力,双手麻木及动作不协调,膀胱失调,以及阴茎不举等等,到了1844年他开始使用轮椅辅助他的行动。尽管疾病缠身,德斯特仍然维持乐观的态度面对人生。他从1822年到1846年的日记至今仍留存于世,纪载了他22年于疾病共生的生活。详实的病程纪载,使他几乎可以直接确诊为多发性硬化症[133][134]。
英国日记作家布鲁斯·弗雷德里克·卡明斯(Bruce Frederick Cummings,1889–1919)以笔名“W·N·P·巴贝利昂”在他的日记详实纪载他的病程和他的心路历程[134]。他的日记后来于1919年以《郁人日志》(The Journal of a Disappointed Man)为书名集结出版[135]。
研究

为多发性硬化症找寻更有效、更安全,及更方便的药物治疗仍是目前研究重点。其他研究方向包含神经保护策略以及症状治疗方针等等[20]。
自21世纪以来,有多种口服药物已经核准上市,用药也逐渐普及[136]。目前仍有多种口服药物仍在开发中,如ozanimod、拉喹莫德(laquinimod)、雌三醇。拉喹莫德于2012年8月宣布进行治疗多发性硬化症的临床试验,目前已在进行第三期试验,但其二期试验并未显示显著效果[137]。除了新药的开发之外,现有药物的改良也持续进行中。例如将干扰素β-1a进行聚乙二醇高分子修饰(PEGylated),以期用更少剂量达到相同效果[138][139]。雌三醇是人体自然存在的性激素,后被发现可能可以治疗复发缓解型多发性硬化症,目前已进入第二期试验[140][141]。
单克隆抗体的高度选择性使其成为研究重点之一。截至2012年,已有多种单抗显示可能有潜力对抗多发性硬化症,如阿仑单抗(alemtuzumab)、达利珠单抗(daclizumab),以及利妥昔单抗(rituximab)、奥美珠单抗、奥法木单抗(ofatumumab)等抗CD20的单克隆抗体[101]。美国食品药品监督管理局(FDA)已于2017年3月核准奥美珠单抗用于复发缓解型的治疗[80]。但由于单抗具有免疫抑制的效果,所以有伺机性感染的风险[136]。JC病毒一种一旦感染即会潜伏于体内的病毒,在潜伏期内因为有免疫系统压制因此不会出现症状,但那他珠单抗(natalizumab)的使用可能会使病毒打破潜伏,导致进行性多灶性白质脑病(PML)[136]。因此后来建议在用药前侦测血液中抗JC病毒抗体的多寡,来评估用药的安全性[136]。从上例可以看出,随着单克隆抗体在治疗多发性硬化症的重要性逐渐上升,发展相关的监测机制也能提升用药者的安全[136]。
联合疗法是指同时使用多种药物进行治疗的策略,其发展与创新也是目前的研究焦点之一。若加入另一种药物能够提升治疗效果的总和,则这样的作用称为协同作用。目前已有多种临床试验测试联合疗法的效果,但目前为止仍尚未发展出足够有效的联合疗法[142]。
疾病初期的神经保护及神经再生的研究也是目前的研究重点之一,如干细胞疗法等等[143]。但目前为止尚未有任何疗法能够有效对抗进行性多发性硬化症。目前有多项药物正在开发中[136]。
多发性硬化症目前尚属于一种类似症状集合而成的表现。有些谱系的患者拥有特殊的自身抗体,日后可能透过对于这些自身抗体的研究,将疾病进行更精确的分类。
视神经脊髓炎曾被视为是多发性硬化症的一个分型,后来发现此类患者身上拥有抗AQP4自身抗体。自此与抗AQP4自身抗体相关的疾病光谱,被独立成为泛视神经脊髓炎谱系(NMO spectrum diseases)[144]。
后来又发现拥有抗MOG自身抗体的患者,在表现上与马尔堡多发性硬化症类似,也可能以急性弥漫性脑脊髓炎表现,因此日后此类疾病可能会形成另一种疾病光谱[144]。
抗神经束蛋白自身抗体则是第三种被发现与多发性硬化症相关的自身抗体,此类患者的兰氏节会遭到破坏,此类疾病主要以周边神经脱髓鞘疾病表现,但可能出现于慢性原发进行性多发性硬化症或合并中枢神经推髓鞘症状[145]。
除了上述几种自身抗体之外,另有四种脱髓鞘疾病于多发性硬化者患者中发现,代表此疾病现在仍为一个异质性相当高的诊断,有待更精确的分类和分型[146]。

虽然可以预期近期内多发性硬化症的诊断标准不会改变,但科学家仍持续在寻找能帮助诊断和预测疾病活性的生物标记分子[136],正在研发中的诊断方法包括抗髓鞘抗体、血清和脑脊髓液分析等,但目前都还没有显著的进展[148]。
目前没有任何检验能预测多发性硬化症的预后,一些有潜力的分子包括白介素-6、一氧化氮与一氧化氮合成酶、骨桥蛋白和胎球蛋白-A。由于疾病的预后取决于神经元退化的结果,一些神经组织退化时会出现的蛋白质也正被研究,例如神经丝、tau蛋白和N-乙酰天冬氨酸。此外,研究者也正在寻找能预测患者是否会对药物有反应的生物标记分子[148]。
正子断层造影(PET)和核磁共振成像(MRI)等神经影像技术的进步带来了更好的诊断力和预后预测能力,虽然这些进步要实际应用到临床上往往需要数十年的时间[136]。在MRI的部分,数种研究中的技术已证实具实用价值,可逐步导入临床实务,例如双反转回复序列(DIR)、磁矩转移、扩散磁振造影(DWI)和功能性核磁共振成像(fMRI)。这些技术相较于现有的技术有更高的专一性,但仍缺乏标准化的检验流程和常模数值。还有一些仍在开发中的技术,例如能量测周边巨噬细胞、发炎或神经失能的程度的显影剂,以及能测量铁沉积量或大脑灌流量的技术[149]。同样地,新的PET放射性追踪剂能观测特定生物反应的变化,例如脑组织发炎、皮质病灶、细胞凋亡或再髓鞘化(remylienation)[150]。抗Kir4.1钾离子通道抗体也可能和多发性硬化症有关[151]。
大众文化
- 《黄金庭院》
注释
参见
参考文献
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.