วัคซีนโควิด-19 ของไฟเซอร์-ไบออนเทค
วัคซีนโควิด-19 ของไฟเซอร์-ไบออนเทค จากวิกิพีเดีย สารานุกรมเสรี
วัคซีนโควิด-19 ของไฟเซอร์-ไบออนเทค (อังกฤษ: Pfizer-BioNTech COVID-19 vaccine) หรือ โทซิแนเมแรน (อังกฤษ: Tozinameran เป็นชื่อระหว่างประเทศที่ไม่มีเจ้าของ หรือ INN) หรือมีตราสินค้า โคเมอร์เนที (อังกฤษ: Comirnaty)[3] เป็นวัคซีนโควิด-19 ที่ใช้เทคโนโลยีเอ็มอาร์เอ็นเอ ใช้ฉีดให้แก่บุคคลอายุ 12 ปีหรือยิ่งกว่าในเขตปกครองบางที่และ 16 ปีหรือยิ่งกว่าในที่อื่น ๆ เพื่อสร้างภูมิต้านทานของร่างกายและป้องกันการติดไวรัสโควิด-19 (SARS-CoV-2) ซึ่งก่อโรคโควิด-19[3][15][18][19][20] บริษัทไบออนเทคในเยอรมนีเป็นผู้พัฒนาวัคซีนในเบื้องต้น แล้วต่อมาจึงร่วมมือกับบริษัทไฟเซอร์ในสหรัฐในด้านการทดลองทางคลินิก โลจิสติกส์ และการผลิตทั่วโลก[21][22] ในประเทศจีน ไบออนเทคร่วมมือกับบริษัทจีนคือโฟสันฟาร์มาซูทิคอล (Fosun Pharmaceutical) เพื่อพัฒนา วางตลาด และแจกจำหน่ายวัคซีน โดยวัคซีนเรียกในจีนว่า วัคซีนโควิด-19 ของโฟสัน-
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |
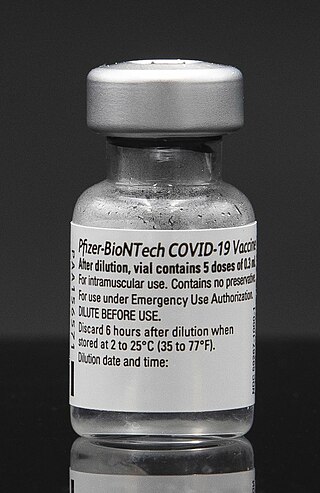
 ขวดวัคซีนโควิด-19 ของบริษัทไฟเซอร์-ไบออนเทค | |
| รายละเอียดวัคซีน | |
|---|---|
| โรคที่เป็นข้อบ่งชี้ | โควิด-19 |
| ชนิด | เอ็มอาร์เอ็นเอ |
| ข้อมูลทางคลินิก | |
| การอ่านออกเสียง | Tozinameran /ˌtoʊzɪˈnæmərən/ TOH-zih-NAM-ər-ən โทซิแนเมแรน Comirnaty /koʊˈmɜːrnəti/ koh-MUR-nə-tee โคเมอร์เนที[1] |
| ชื่อทางการค้า | Comirnaty[2][3] |
| ชื่ออื่น | BNT162b2, Pfizer-BioNTech COVID-19 Vaccine, COVID-19 mRNA vaccine (nucleoside-modified) |
| AHFS/Drugs.com | Multum Consumer Information |
| MedlinePlus | a621003 |
| ข้อมูลทะเบียนยา |
|
| ระดับความเสี่ยงต่อทารกในครรภ์ | |
| ช่องทางการรับยา | ฉีดเข้ากล้ามเนื้อ |
| รหัส ATC |
|
| กฏหมาย | |
| สถานะตามกฏหมาย | [5][6]
|
| ตัวบ่งชี้ | |
| เลขทะเบียน CAS | |
| PubChem SID | |
| DrugBank | |
| UNII | |
| KEGG | |
| ข้อมูลทางกายภาพและเคมี | |
| มวลต่อโมล | ~1388 kDa |
วัคซีนใช้ฉีดเข้ากล้ามเนื้อ เป็นวัคซีนอาร์เอ็นเออันประกอบด้วยเอ็มอาร์เอ็นเอที่ดัดแปลงนิวคลีโอไซด์ (Nucleoside-modified messenger RNA หรือ modRNA) ให้เข้ารหัสโปรตีนหนาม (spike) ที่กลายพันธุ์ (mutated) ของไวรัสโควิด-19 (SARS-CoV-2) แล้วหุ้มด้วยอนุภาคนาโนที่เป็นลิพิด (lipid nanoparticle)[30] ในเบื้องต้น วัคซีนแนะนำให้ฉีดสองครั้งโดยห่างกัน 21 วัน[17][31][32][33] แต่ต่อมาได้ยืดออกไปเป็น 42 วันในสหรัฐ[17][34] และอาจยืดไปถึง 4 เดือนในแคนาดา[35][36]
การทดลองทางคลินิกได้เริ่มตั้งแต่เดือนเมษายน 2020[31] เมื่อถึงเดือนพฤศจิกายน 2020 การทดลองก็ได้ดำเนินไปถึงระยะที่ 3 โดยมีอาสาสมัครเกิน 40,000 คน[37] การวิเคราะห์ผลการทดลองในระหว่าง (interim analysis) แสดงว่า วัคซีนมีประสิทธิศักย์ (efficacy) ที่ร้อยละ 91.3 เพื่อป้องกันการติดโรคแบบแสดงอาการโดยภูมิเกิดภายใน 7 วันหลังได้โดสที่สอง[33][38] ผลข้างเคียงสามัญที่สุดก็คือเจ็บปวดเล็กน้อยจนถึงปานกลางที่จุดฉีด ล้า และปวดศีรษะ[39][40] จนถึงเดือนธันวาคม 2020 ก็มีรายงานผลข้างเคียงรุนแรง เช่น ปฏิกิริยาภูมิแพ้ น้อยมาก[A] และยังไม่มีรายงานผลข้างเคียงระยะยาว[3][42] ผลปฐมภูมิ (primary outcome) ต่าง ๆ ของวัคซีนจะเฝ้าติดตามไปจนถึงเดือนสิงหาคม 2021 และผลทุติยภูมิจนถึงเดือนมกราคม 2023[31] โดยจะประเมินการป้องกันสายพันธุ์ใหม่ ๆ ของไวรัสโควิด-19 ไปด้วย[31]
วัคซีนนี้เป็นวัคซีนโควิด-19 แรกที่ได้รับอนุมัติจากองค์กรควบคุมที่องค์การอนามัยโลกจัดว่าเข้มงวดในการอนุมัติเวชภัณฑ์ เพื่อใช้เป็นการฉุกเฉิน[43][44] และใช้โดยทั่วไป[2] ในเดือนธันวาคม 2020 สหราชอาณาจักรเป็นประเทศแรกที่อนุมัติให้ใช้เป็นการฉุกเฉิน[42] ต่อมาได้อนุมัติให้ใช้ในประเทศต่าง ๆ โดยมากในโลก[45][46][47][48]
จนถึงปลายเดือนมีนาคม 2021 ไฟเซอร์และไบออนเทคมีแผนผลิตวัคซีนประมาณ 2.5 พันล้านโดสในปี 2021[49][50] แต่ก็มีการสั่งจองล่วงหน้าแล้วถึง 3,000 ล้านโดสจากสหรัฐ สหภาพยุโรป สหราชอาณาจักร ญี่ปุ่น แคนาดา เปรู สิงคโปร์ และเม็กซิโก[51][52] การแจกจำหน่ายและเก็บวัคซีนเป็นเรื่องท้าทายทางโลจิสติกส์เพราะวัคซีนต้องแช่แข็งในอุณหภูมิที่ต่ำมาก[53] บริษัทกำลังตรวจสอบวัคซีนแบบทำให้แห้งเยือกแข็ง (freeze-dried) ซึ่งไม่ต้องแช่แข็งในอุณหภูมิที่ต่ำมาก[54]
ในต้นเดือนพฤษภาคม 2021 อนุทิน ชาญวีรกุล รัฐมนตรีว่าการกระทรวงสาธารณสุขของไทยในขณะนั้น ระบุว่า บริษัทได้สำรองวัคซีนเพื่อส่งให้แก่ประเทศไทยเป็นจำนวน 10-20 ล้านโดสโดยจะจัดส่งให้ในไตรมาสที่ 3-4[55] ทั้งนี้ จนถึงกลางเดือนพฤษภาคม รัฐบาลไทยยังกำหนดจะให้วัคซีนนี้เฉพาะแก่เด็กอายุ 12-18 ปี (ประมาณ 10 ล้านคน)[56] ในปลายเดือนมิถุนายน อย. ได้ขึ้นทะเบียนวัคซีนนี้[57] ในกลางเดือนกรกฎาคม มีการลงนามสัญญาเพื่อจัดส่งวัคซีนให้ไทย 20 ล้านโดส
ในวันที่ 17 สิงหาคม 2021 ครม. ได้อนุมัติงบประมาณ 9,372 ล้านบาทสำหรับวัคซีน 20 ล้านโดสที่สั่งจองแล้ว โดยเป็นค่าวัคซีน 8,439 ล้านบาท[B] และค่าบริหารจัดการ 933 ล้านบาท[60][61] ต่อมาวันที่ 20 ส.ค. กรมควบคุมโรคได้ลงนามเซ็นสัญญากับบริษัทเพื่อจัดซื้อวัคซีนเพิ่มอีกประมาณ 10 ล้านโดสรวมที่สั่งแล้วทั้งหมด 30 ล้านโดสโดยจะ "ทยอยจัดส่งได้ในช่วงไตรมาสที่ 4 ปีนี้เป็นต้นไป"[62] ต่อมาวันที่ 30 ปลายเดือน ครม. ก็ได้อนุมัติงบประมาณอีก 4,745 ล้านบาทสำหรับวัคซีน 9,998,820 โดส[63]
การแพทย์
สรุป
มุมมอง
วัคซีนนี้ใช้เพื่อป้องกันโรคโควิด-19 ซึ่งเกิดจากการติดเชื้อไวรัสโคโรนาสายพันธุ์ใหม่ (SARS-CoV-2) โดยกระตุ้นให้ภูมิคุ้มกันร่างกายตอบสนองต่อแอนติเจน S[3][15] วัคซีนใช้เพื่อลดอาการและความตายอันเนื่องกับโรค[17] วัคซีนบรรจุในขวดที่ใช้ฉีดได้หลายโดสโดยมีสีขาวหรือออกขาว ๆ ปลอดเชื้อ ไร้สารกันบูด เป็นสารแขวนลอยแช่แข็ง เพื่อฉีดเข้ากล้ามเนื้อ[15][16] โดยต้องละลายจนถึงอุณหภูมิห้องแล้วทำให้เจือจางด้วยน้ำเกลือธรรมดาก่อนจะฉีด[16]
ในเบื้องต้น วัคซีนให้ฉีดสองโดส[17] โดยองค์การอนามัยโลกแนะนำให้ฉีดห่างกัน 3-4 สัปดาห์ระหว่างโดส การเลื่อนฉีดโดสที่สองไปจนถึง 12 สัปดาห์ทำให้ภูมิคุ้มกันตอบสนองเพิ่มขึ้นแม้แต่ในคนชรา และสามารถต่อต้านสายพันธุ์โควิด-19 ที่น่าเป็นห่วง (Variant of concern ตัวย่อ VOC)[64] กลุ่มนักวิชาการที่ทำงานศึกษาหนึ่ง (Pitch study) ในสหราชอาณาจักรเชื่อว่า ระยะห่างการฉีดวัคซีนที่ดีสุดเพื่อต่อต้านไวรัสสายพันธุ์เดลตาอยู่ที่ราว ๆ 8 สัปดาห์ แต่ถ้าเว้นห่างยิ่งกว่านั้นอาจทำให้เสี่ยงโรค[64] เพื่อลดอัตราการตายเมื่อมีวัคซีนจำกัด องค์การอนามัยโลกจึงแนะนำให้ยืดการฉีดวัคซีนโดสที่สองออกไปจนถึง 12 สัปดาห์เพื่อให้ฉีดวัคซีนโดสแรกแก่กลุ่มบุคคลเสี่ยงให้ได้เร็วขึ้น[65]
ประสิทธิภาพ/ประสิทธิผล
งานศึกษามีกลุ่มควบคุม (case-control study) ที่ตีพิมพ์ในวารสารการแพทย์นิวอิงแลนด์เดือนพฤษภาคม 2021 พบว่า สำหรับคนที่ได้รับวัคซีนในประเทศกาตาร์ วัคซีนของไฟเซอร์มีประสิทธิภาพ/ประสิทธิผล (effectiveness) ป้องกันการติดแล้วตรวจพบเชื้อสายพันธุ์อัลฟา (B.1.1.7) ที่ร้อยละ 89.5 และสายพันธุ์เบตา (B.1.351) ที่ร้อยละ 75 งานศึกษาเดียวกับรายงานว่า ประสิทธิภาพของวัคซีนป้องกันการติดเชื้อที่มีอาการรุนแรง วิกฤติ หรือถึงชีวิตสำหรับโควิด-19 ทุก ๆ สายพันธุ์อยู่ที่ร้อยละ 97.4[66] ยกเว้นจะระบุ ค่าประสิทธิผลที่จะระบุต่อไปเป็นค่าหลังจากฉีดวัคซีนโดสที่ 2 ไปแล้ว 2 สัปดาห์ ทั่วไปแล้ว วัคซีนจัดว่ามีประสิทธิภาพถ้ามีค่าประเมิน ≥50% และมีค่าล่างของช่วงความเชื่อมั่น (CI) แบบ 95% ขั้นต่ำ >30%[67]
| โดส | ความรุนแรง | อัลฟา | เบตา | แกมมา | เดลตา | สายพันธุ์อื่น ๆ ที่เคยมี[a] |
|---|---|---|---|---|---|---|
| 1 | ไม่มีอาการ | 38% (29–45%)[69] | 17% (10–23%)[66] | ไม่มีรายงาน | 30% (17–41%)[69] | 60% (53–66%) |
| มีอาการ | 27% (13–39%)[69] | 43% (22–59%)[70] | 33% (15–47%)[69] | 66% (57–73%) | ||
| ต้องเข้า รพ. | 83% (62–93%)[b] | 0% (0–19%)[66] | 56% (−9 to 82%)[70] | 94% (46–99%)[b] | 78% (61–91%) | |
| 2 | ไม่มีอาการ | 92% (90–93%)[69] | 75% (71–79%)[66] | ไม่มีรายงาน | 79% (75–82%)[69] | 92% (88–95%) |
| มีอาการ | 92% (88–94%)[69] | 88% (61–96%)[70] | 83% (78–87%)[69] | 94% (87–98%) | ||
| ต้องเข้า รพ. | 95% (78–99%)[b] | 100% (74–100%)[66] | 100%[c][70] | 96% (86–99%)[b] | 87% (55–100%) | |
- เป็นการเฝ้าระวังสายพันธุ์กลายพันธุ์ในอิสราเอลระหว่างวันที่ 20 ธันวาคม 2020 ถึง 1 กุมภาพันธ์ 2021[68] ข้อมูลจาก Nextstrain ระบุว่า ในช่วงนี้ สายพันธุ์หลักคือ B.1.1.50 แต่อัลฟาก็กำลังจะกลายเป็นสายพันธุ์หลัก
กลุ่มประชากรโดยเฉพาะ ๆ
อาศัยผลเบื้องต้นของการศึกษางานหนึ่ง ศูนย์ควบคุมและป้องกันโรคสหรัฐจึงแนะนำให้หญิงมีครรภ์ฉีดวัคซีนนี้[73][74]
ส่วนคำแถลงการณ์ของหน่วยงานสหราชอาณาจักรคือสำนักงานกำกับผลิตภัณฑ์ด้านสุขภาพและยา (Medicines and Healthcare products Regulatory Agency, MHRA) และคณะกรรมการเวชภัณฑ์มนุษย์ (Commission on Human Medicines, CHM) สรุปว่า วัคซีนปลอดภัยและมีประสิทธิภาพกับเด็กอายุระหว่าง 12-15 ปี[75][76]
ในวันที่ 19 พฤษภาคม 2021 ผู้ชำนาญการผู้ที่ได้รับมอบหมายจากสำนักงานเวชภัณฑ์นอร์เวย์ (Norwegian Medicines Agency) สรุปว่า วัคซีนของไฟเซอร์น่าจะเป็นเหตุให้ผู้ป่วยชราที่อ่อนแอในสถานดูแลคนชราเสียชีวิตถึง 10 ราย แล้วจึงระบุว่า ผู้มีอายุเหลือน้อยไม่ค่อยได้ประโยชน์จากการฉีดวัคซีน เพราะมีโอกาสเสี่ยงผลไม่พึงประสงค์รุนแรงในช่วงสุดท้ายของชีวิตและอาจทำให้เสียชีวิตก่อนถึงเวลา[77]
รายงานปี 2021 ของรัฐนิวเซาท์เวลส์ในออสเตรเลียพบว่า วัคซีนไฟเซอร์ปลอดภัยสำหรับคนที่มีภูมิคุ้มกันบกพร่อง (immunodeficiency) หรือกินยากดภูมิคุ้มกัน (immunosuppression) แต่ก็ระบุว่า ข้อมูลสำหรับกลุ่มเหล่านีจำกัดเพราะเป็นกลุ่มที่กันไม่ให้เข้าร่วมงานทดลองวัคซีนต่าง ๆ ที่ทำในปี 2020 แล้วให้ข้อสังเกตว่า องค์การอนามัยโลกได้ระบุวัคซีนนี้เป็นหนึ่งในวัคซีน 3 ชนิด (รวมทั้งของโมเดอร์นาและของแอสตร้าเซนเนก้า) ที่ปลอดภัยสำหรับคนที่ภูมิคุ้มกันบกพร่อง และว่าผู้เชี่ยวชาญส่วนใหญ่แนะนำให้คนกลุ่มนี้ฉีดวัคซีน รายงานระบุว่า วัคซีนก่อการตอบสนองทางภูมิคุ้มกันของคนกลุ่มนี้ แม้จะในระดับน้อยกว่าคนปกติ และแนะนำให้คนไข้โดยเฉพาะ ๆ เช่น ที่เป็นมะเร็ง ลำไส้อักเสบเรื้อรัง (inflammatory bowel disease) และโรคตับต่าง ๆ ให้ได้ฉีดวัคซีนก่อนคนกลุ่มอื่น ๆ ที่ไม่มีพยาธิสภาพเช่นนั้น[78]
ผลไม่พึงประสงค์
ผลไม่พึงประสงค์สำหรับวัคซีนนี้คล้ายกับวัคซีนที่ให้กับผู้ใหญ่อื่น ๆ[33] ในช่วงการทดลองทางคลินิก ผลข้างเคียงที่จัดว่าสามัญมาก[A] รวมทั้ง (ตามลำดับอัตราการเกิด) เจ็บและบวมที่จุดฉีด เหนื่อย ปวดศีรษะ ปวดกล้ามเนื้อ หนาวสะท้าน ปวดข้อ และเป็นไข้[79] หลังจากฉีดวัคซีนครั้งที่สอง การเป็นไข้จะเกิดบ่อยขึ้น[79] ผลเยี่ยงนี้ปกติ จึงเป็นเรื่องควรรู้ล่วงหน้าเพื่อไม่ให้ประชาชนกังวลเกี่ยวกับการฉีดวัคซีน[80]
การแพ้อย่างรุนแรง (แอนาฟิแล็กซิส) เกิดราว ๆ 11 กรณีต่อวัคซีนล้านโดสที่ฉีด[81][82] ตามรายงานของศูนย์ควบคุมและป้องกันโรคสหรัฐ กรณีร้อยละ 71 เกิดภายใน 15 วันหลังฉีดวัคซีน และโดยมากคือร้อยละ 81 เกิดกับคนที่มีประวัติภูมิแพ้หรือเกิดปฏิกิริยาแพ้[81] สำนักงานควบคุมผลิตภัณฑ์การแพทย์และดูแลสุขภาพ (MHRA) แห่งสหราชอาณาจักรจึงแนะนำในวันที่ 9 ธันวาคม 2020 ว่า ผู้ที่มีประวัติเกิดปฏิกิริยาแพ้อย่างสำคัญ (significant) ไม่ควรรับวัคซีนโควิด-19 ของไฟเซอร์-ไบออนเทค[83][84][85] ต่อมาวันที่ 12 ธันวาคม องค์กรควบคุมของแคนาดาจึงแนะนำเช่นเดียวกันโดยให้ข้อสังเกตว่า "บุคคลทั้งสองในสหราชอาณาจักรมีประวัติเกิดปฏิกิริยาแพ้อย่างรุนแรงและต้องมีเข็มฉีดเอพิเนฟรีนอยู่กับตัว ทั้งสองได้รักษาและฟื้นตัวแล้ว"[86]
สำนักงานการแพทย์ยุโรป (EMA) ตรวจทบทวนข้อมูลความปลอดภัยของวัคซีนนี้อยู่เรื่อย ๆ[3] รายงานวันที่ 4 มีนาคม 2021 ขององค์กรสรุปว่า "ประโยชน์ของโคเมอร์เนทีในการป้องกันโควิด-19 ยังคงมีมากกว่าความเสี่ยง จึงไม่มีการเปลี่ยนแปลงการใช้วัคซีนนี้ที่แนะนำ"[3] สำนักงานได้เพิ่มผื่นที่ผิวหนังและอาการคันว่าเป็นผลข้างเคียงที่ไม่สามัญ (เกิดน้อยกว่า 1 ใน 100 คน), ลมพิษและ angioedema (การบวมใต้ผิวหนังอย่างรวดเร็ว) ว่าเป็นผลข้างเคียงที่มีน้อย (เกิดน้อยกว่า 1 ใน 1,000 คน) ในเดือนเมษายน 2021[3][87]
ตามกระทรวงสาธารณสุขอิสราเอล การฉีดวัคซีนโดสที่สองอาจสัมพันธ์กับการเกิดกล้ามเนื้อหัวใจอักเสบ (myocarditis) ในชายจำนวนน้อยอายุระหว่าง 16-30 ปี ในระหว่างเดือนธันวาคม 2020 ถึงพฤษภาคม 2021 มีกรณีเกิดกล้ามเนื้อหัวใจอักเสบ 55 กรณีต่อคนล้านคนที่ฉีดวัคซีน โดยร้อยละ 95 จัดว่าเบา[88] ตั้งแต่เดือนเมษายน 2021 มีรายงานเกิดกล้ามเนื้อหัวใจอักเสบและเยื่อหุ้มหัวใจอักเสบ (pericarditis) เพิ่มขึ้นในสหรัฐ โดยมีอัตราประมาณ 13 รายในเยาวชน 1 ล้านคน โดยมากเป็นชาย อายุยิ่งกว่า 16 ปี หลังจากได้ฉีดวัคซีนของไฟเซอร์หรือของโมเดอร์นา[89] และโดยมากฟื้นตัวได้อย่างรวดเร็วเมื่อได้การรักษาและการพักผ่อนที่ควร[90]
เภสัชวิทยา
เทคโนโลยีที่ใช้ในวัคซีนเป็นเอ็มอาร์เอ็นเอที่ดัดแปลงนิวคลีโอไซด์ (modRNA) ซึ่งเข้ารหัสโปรตีนหนาม (spike protein) แบบยาวอย่างสมบูรณ์แต่กลายพันธุ์ ซึ่งพบที่ผิวของไวรัสโควิด-19[91] เพื่อกระตุ้นให้ภูมิคุ้มกันตอบสนองเมื่อประสบกับโปรตีนของไวรัสช่วงติดเชื้อ[92]
ลำดับยีน
โทซินาเมแรนมีลำดับ modRNA เป็นนิวคลีโอไทด์ยาว 4,284 ตัวโดยมีมวลโมเลกุลที่ประมาณ 1,388 kDa (กิโลดอลตัน)[93][94] ลำดับไม่มี uridine residues เพราะได้แทนที่ด้วย 1-methyl-3′-pseudouridine[94] การแทนที่ด้วย proline แบบ 2P (ดังจะกล่าวต่อไป) ในโปรตีนหนามดั้งเดิมทำขึ้นเพื่อวัคซีนโรคเมอร์สโดยนักวิจัยที่สถาบันภูมิแพ้และโรคติดเชื้อแห่งชาติสหรัฐ (National Institute of Allergy and Infectious Diseases, NIAID) โดยร่วมมือกับสถาบันอื่น ๆ รวมทั้งมหาวิทยาลัยเท็กซัส ออสติน[95] ลำดับ modRNA ประกอบด้วย
- 5′ cap[C] หนึ่งส่วน
- 5′ untranslated region หนึ่งส่วนที่เป็นลำดับยีนอนุพัทธ์ของยีน "Hemoglobin, alpha 1" ในมนุษย์
- signal peptide[D] หนึ่งส่วนที่เบส 55-102 โดยมีการแทนที่ด้วย proline 2 ตำแหน่ง (K986P และ V987P ซึ่งเรียกสั้น ๆ ว่า "2P") ซึ่งทำให้แสดงออกโปรตีนหนามโดยมีโครงร่างแบบก่อนที่จะทำให้เซลล์ติดเชื้อ (prefusion-stabilized conformation) จึงลดการรวมตัวเข้ากับเยื่อหุ้มเซลล์ เพิ่มการแสดงออกของโปรตีน และกระตุ้นให้เกิดสารภูมิต้านทานแบบกำจัดฤทธิ์ (neutralizing antibodies)[30]
- ลำดับยีนเต็มแต่ย่อสุด (codon-optimized) ที่เข้ารหัสลำดับยีนโปรตีนหนาม (spike portein) ของไวรัสโควิด-19 โดยอยู่ที่เบส 103-3,879[30][95]
- three prime untranslated region[E] หนึ่งส่วนที่เบส 3,880-4,174 ซึ่งรวมยีน AES และ mtRNR1 เพื่อเพิ่มการแสดงออกของโปรตีนและเพิ่มเสถียรภาพของเอ็มอาร์เอ็นเอ[100]
- poly (A) tail หนึ่งส่วนที่ประกอบด้วยเรซิดิวอะดีโนซีน 30 เรซิดิว, 10-nucleotide linker sequence และเรซิดิวอะดีโนซีนอื่นอีก 70 เรซิดิว อยู่ที่เบส 4,175-4,284[94]
เคมี
นอกเหนือจากโมเลกุลเอ็มอาร์เอ็นเอ วัคซีนมีส่วนประกอบ (ส่วนเติมเนื้อยา) ที่ไม่ออกฤทธิ์ดังนี้[12][86][79]
- ALC-0315 = ((4-hydroxybutyl)azanediyl)bis(hexane-6,1-diyl)bis(2-hexyldecanoate)
- ALC-0159 = 2-[(polyethylene glycol)-2000]-N,N-ditetradecylacetamide
- 1,2-distearoyl-sn-glycero-3-p*1,2-distearoyl-sn-glycero-3-phosphocholine (DSPC)
- คอเลสเตอรอล
- dibasic sodium phosphate dihydrate
- monobasic potassium phosphate
- โพแทสเซียมคลอไรด์
- โซเดียมคลอไรด์
- ซูโครส
- น้ำ
ส่วนประกอบ 4 อย่างแรกเป็นลิพิด ซึ่งประกอบกับ modRNA รวมตัวกันเป็นอนุภาคนาโน (nanoparticle) ซึ่งไม่เพียงเป็นตัวส่ง modRNA เข้าไปในเซลล์มนุษย์เท่านั้น แต่ยังเป็นตัวเสริมยาที่ช่วยเพิ่มการตอบสนองของภูมิคุ้มกันต่อวัคซีนอีกด้วย[101] ส่วน ALC-0159 เป็น polyethylene glycol conjugate (คือลิพิดแบบ PEGylated)[102]
การผลิต


ไฟเซอร์และไบออนเทคผลิตวัคซีนในโรงงานของตน ๆ ในสหรัฐและยุโรป ส่วนโฟสันมีสิทธิผลิตและแจกจำหน่ายวัคซีนในจีนเพราะได้ลงทุนกับไบออนเทค[22][23] ในวันที่ 9 พฤศจิกายน 2020 บริษัทไฟเซอร์ระบุว่า อาจผลิตวัคซีนได้ถึง 50 ล้านโดสก่อนถึงสิ้นปี 2020 และอีก 1,300 ล้านโดสที่จะแจกจำหน่ายทั่วโลกในปี 2021[33] ในเดือนกุมภาพันธ์ 2021 ไบออนเทคประกาศว่า จะเพิ่มสมรรถภาพผลิตวัคซีนให้ได้ 2,000 ล้านโดสในปี 2021[103] โดยเพิ่มในเดือนมีนาคมเป็น 2,500 ล้านโดสสำหรับปี 2021[50]
กระบวนการผลิตวัคซีนมี 3 ขั้นตอน ขั้นตอนแรกเป็นการโคลนพลาสมิดดีเอ็นเอที่เข้ารหัสโปรตีนหนาม (spike protein) ของไวรัสโควิด-19 โดยใส่มันเข้าไปในแบคทีเรีย Escherichia coli สำหรับตลาดทั่วโลก ขั้นตอนนี้ทำในสหรัฐ[104] ในโรงงานนำร่องเล็ก ๆ ของไฟเซอร์ในเมืองเชสเตอร์ฟิลด์ใกล้ ๆ เมืองเซนต์หลุยส์ รัฐมิสซูรี[105][106] หลังจากให้ไวรัสเพาะพันธุ์ในแบคทีเรียเป็นเวลา 4 วัน แบคทีเรียก็จะตายแล้วแตกออก สิ่งที่อยู่ในเซลล์ก็จะทำให้บริสุทธิ์เป็นเวลาสัปดาห์ครึ่งเพื่อให้ได้ผลิตภัณฑ์ดีเอ็นเอที่ต้องการ แล้วเก็บไว้ในขวดเล็ก ๆ และแช่แข็งเพื่อส่ง การขนส่งดีเอ็นเออย่างปลอดภัยและรวดเร็วในขั้นนี้สำคัญจนกระทั่งต้องใช้เครื่องบินและเฮลิคอปเตอร์ของบริษัทเองช่วยขนส่ง[107]
ขั้นตอนที่สองทำที่โรงงานไฟเซอร์ในสหรัฐ (รัฐแมสซาชูเซตส์)[108] และโรงงานไบออนเทคในเยอรมนี[104] ดีเอ็นเอที่ได้จะใช้เป็นแบบสร้างสายเอ็มอาร์เอ็นเอที่ต้องการ[107] ซึ่งใช้เวลาประมาณ 4 วัน[104] เมื่อสร้างและทำให้บริสุทธิ์แล้ว ก็จะแช่เแข็งในถุงพลาสติกเท่ากับถุงช็อปปิ้งใหญ่ ซึ่งแต่ละถุงจะมีวัสดุที่ใช้ทำวัคซีนได้ถึง 10 ล้านโดส ถุงจะใส่บนชั้นวางพิเศษบนรถบรรทุกเพื่อส่งไปยังโรงงานลำดับต่อไป[107]
ขั้นตอนที่สามทำที่โรงงานไฟเซอร์ในสหรัฐ (ใกล้เมืองแคละมะซู รัฐมิชิแกน)[109] และประเทศเบลเยียม (เทศบาล Puurs ใกล้เมืองแอนต์เวิร์ปและกรุงบรัสเซลส์) ซึ่งรวมเอ็มอาร์เอ็นเอเข้ากับอนุภาคนาโนที่เป็นลิพิด (lipid nanoparticle) แล้วบรรจุใส่ขวด ใส่ขวดในกล่อง แล้วแช่แข็ง[107] บริษัทลูกของ Avanti Polar Lipids คือ Croda International เป็นผู้ผลิตลิพิดสำคัญดังที่ว่า[110] จนถึงเดือนพฤศจิกายน 2020 จุดคอคอดในกระบวนการผลิตก็คือการรวมอาร์เอ็นเอกับลิพิดในขั้นนี้[107] ขั้นตอนนี้ใช้เวลาแค่ 4 วันในการประกอบเอ็มอาร์เอ็นเอกับลิพิดแล้วบรรจุขวด แต่วัคซีนแต่ละล็อตต้องผ่านการตรวจสอบคุณภาพถึง 40 ขั้นตอนเป็นเวลาหลายอาทิตย์โดยต้องเก็บแช่แข็งในอุณหภูมิต่ำมาก[104]
ก่อนเดือนพฤษภาคม 2021[111] โรงงานไฟเซอร์ในเบลเยียมบรรจุดขวดวัคซีนทั้งหมดสำหรับตลาดนอกสหรัฐ[104] ดังนั้น วัคซีนที่ใช้ในทวีปอเมริกานอกเหนือจากสหรัฐทั้งหมดต้องส่งทางเครื่องบินข้ามมหาสมุทรแอตแลนติก 2 เที่ยว คือเพื่อส่งดีเอ็นเอสำหรับวัคซีนไปยังยุโรป แล้วส่งขวดวัคซีนกลับมายังทวีปอเมริกา[104]
ในเดือนกุมภาพันธ์ 2021 ไฟเซอร์เปิดเผยว่า กระบวนการผลิตทั้งหมดใช้เวลา 110 วันโดยเฉลี่ย โดยบริษัทกำลังทำการเพื่อลดให้เหลือ 60 วัน[112] เวลาเกินครึ่งใช้เพื่อตรวจคุณภาพสำหรับการผลิตทั้ง 3 ขั้น[112] ไฟเซอร์ยังระบุด้วยว่า การผลิตมีองค์ประกอบ 280 อย่างโดยต้องอาศัยบริษัทอื่น ๆ เป็นผู้ส่ง 25 บริษัทในประเทศ 19 ประเทศ[104]
- พนักงานบริษัทไฟเซอร์ในเบลเยียมใส่น้ำแข็งแห้งในกล่องเพื่อรักษาวัคซีนในระหว่างการขนส่ง
- กล่องบรรจุวัคซีน ณ โรงงานของบริษัทไฟเซอร์ในเบลเยียม
- ตู้แช่แข็งวัคซีนในโรงงานของบริษัทไฟเซอร์ในเบลเยียม
ผู้ผลิตวัคซีนปกติต้องใช้เวลาหลายปีเพื่อปรับการผลิตวัคซีนให้เร็วสุดและมีค่าใช้จ่ายน้อยสุดก่อนจะเริ่มผลิตวัคซีนเป็นจำนวนมาก ๆ[112] แต่เพราะความเร่งด่วนเนื่องกับการระบาดทั่วของโควิด-19 ไฟเซอร์และไบออนเทคจึงเริ่มผลิตทันทีโดยใช้กระบวนการตามที่ทำในแหล็บ ต่อมาจึงเริ่มหาวิธีเร่งความเร็วและเพิ่มผลผลิต[112]
ไบออนเทคประกาศในเดือนกันยายน 2020 ว่าได้ตกลงซื้อโรงงานในเมืองมาร์บวร์ค ประเทศเยอรมนีจากบริษัทยาโนวาร์ติสเพื่อเพิ่มสมรรถภาพการผลิตวัคซีน[113] ซึ่งเมื่อลงตัวแล้ว ก็จะสามารถผลิตวัคซีนถึง 750 ล้านโดสต่อปี หรือมากกว่า 60 ล้านโดสต่อเดือน เป็นโรงงานของไบออนเทคที่สามในยุโรปที่ผลิตวัคซีน โดยไฟเซอร์เองก็ยังมีโรงงานอีก 4 แห่งในสหรัฐและยุโรป[113]
โรงงานในมาร์บวร์คเคยผลิตเวชภัณฑ์เกี่ยวกับการรักษามะเร็งด้วยการก่อภูมิคุ้มกัน (cancer immunotherapy) ให้แก่บริษัทโนวาร์ติส[114] ณ ปลายเดือนมีนาคม 2021 ไบออนเทคก็ได้ปรับปรุงโรงงานเพื่อผลิตวัคซีนเอ็มอาร์เอ็นเอเสร็จสิ้น โดยได้หัดงานใหม่ให้แก่พนักงานเดิม 300 คน แล้วได้รับอนุมัติให้เริ่มผลิตวัคซีน[114] นอกจากจะผลิตเอ็มอาร์เอ็นเอเองแล้ว โรงงานนี้ยังรวมเอ็มอาร์เอ็นเอกับลิพิดให้เป็นอนุภาคนาโนที่เป็นลิพิด แล้วส่งผลผลิตไปยังโรงงานอื่น ๆ เผื่อใส่ขวด ปิดป้าย แล้วใส่ในบรรจุภัณฑ์[114]
ท้ายเดือนเมษายน 2021 สำนักงานการแพทย์ยุโรปอนุมัติให้เพิ่มจำนวนการผลิตในแต่ละรอบสำหรับโรงงานในเบลเยี่ยม ซึ่งคาดว่า จะมีผลอย่างสำคัญต่อจำนวนโดสวัคซีนที่ส่งให้สหภาพยุโรป[115][116] ท้ายเดือนเมษายนเช่นกัน มีรายงานว่า ไฟเซอร์เริ่มส่งวัคซีนจากโรงงานในสหรัฐไปยังเม็กซิโกและแคนาดา ซึ่งใกล้กว่าโรงงานในเบลเยียมที่เคยส่งวัคซีนไปยังประเทศทั้งสอง[111]
โลจิสติกส์

วัคซีนต้น ๆ ส่งในขวดที่เมื่อทำให้เจือจางแล้ว ก็จะมีวัคซีน 2.25 มล. (คือ ส่วนที่แช่เข็ง 0.45 มล. บวกกับสารทำให้เจือจาง 1.8 มล.)[117] แต่ตามป้าย ขวดหนึ่งมีวัคซีน 5 โดสขนาด 0.3 มล. (รวมเป็น 1.5 มล.) ดังนั้น ก็ยังมีเศษเหลือใช้ได้อีก 1-2 โดส[117][118] ดังนั้น สำนักงานการแพทย์ยุโรปจึงแนะนำให้ใช้กระบอกฉีดยาที่เสียยาน้อย (low dead space syringe) เพื่อให้ได้โดสเพิ่มขึ้น โดยยาที่เหลือในขวดควรทิ้ง[117][119] สำนักงานการแพทย์อิตาลีได้อนุมัติอย่างเป็นทางการให้ใช้โดสที่เหลือจากขวดเดี่ยว ๆ[120] ส่วนสำนักงานสาธารณสุขของเดนมาร์กอนุญาตให้ผสมวัคซีนที่เหลือจากขวดสองขวด[121] ต่อมาในวันที่ 8 มกราคม 2021 บริษัทจึงระบุว่าขวดหนึ่งมี 6 โดส[79][122][123][119] ส่วนในสหรัฐ ขวดวัคซีนหนึ่ง ๆ ถือว่ามี 5 โดสเมื่อส่งกับกระบอกฉีดยาธรรมดาและ 6 โดสเมื่อส่งกับกระบอกฉีดยาที่เสียยาน้อย[124] วัคซีนต้องเก็บและขนส่งโดยแช่แข็งที่อุณหภูมิระหว่าง -80 ถึง -60 องศาเซลเซียส[53][125][52][126][127] จนกระทั่ง 30 วันก่อนจะฉีด[52][53] แล้วจึงสามารถเก็บไว้ที่อุณหภูมิระหว่าง 2-8 องศาเซลเซียส โดยสามารถเก็บไว้ที่อุณหภูมิยิ่งกว่านั้นจนถึง 25[128][15] หรือ 30[129][130] องศาเซลเซียสได้ถึงสอง ชม. ในเดือนกุมภาพันธ์ 2021 องค์การอาหารและยาสหรัฐอัปเดตใบอนุมัติให้ใช้วัคซีนเป็นการฉุกเฉินโดยอนุญาตให้ส่งและเก็บขวดวัคซีนที่ได้แช่แข็งแต่ยังไม่ได้ทำให้เจือจางในอุณหภูมิระหว่าง -25 ถึง -15 องศาเซลเซียส ได้ถึง 2 อาทิตย์ก่อนจะใช้[117][131][132]
แม้ประเทศรายได้สูงก็ยังมีสมรรถภาพจำกัดในการบริหาร "โซ่เย็น" คือการต้องขนส่งและเก็บวัคซีนไว้ที่อุณหภูมิต่ำมาก[52] วัคซีนต้องเก็บและขนส่งโดยแช่แข็งที่อุณหภูมิต่ำมากระหว่าง -80 ถึง -60 องศาเซลเซียส[53][125][52][133][134] ซึ่งเย็นกว่าวัคซีนโควิด-19 ของโมเดิร์นาอันเป็นวัคซีนที่คล้ายกันมาก จนกระทั่งผู้บริหารบริษัทยารัฐวิสาหกิจของอินโดนีเซียคือไบโอฟาร์มาระบุว่า การซื้อวัคซีนนี้จากไฟเซอร์เป็นไปไม่ได้สำหรับประเทศ เพราะไม่มีสมรรถภาพโซ่เย็นที่จำเป็นเลย เช่นเดียวกัน เครือข่ายโซ่เย็นของอินเดียก็สามารถรับรองอุณหภูมิได้เพียงระหว่าง 2-8 องศาเซลเซียส ซึ่งสูงกว่าที่จำเป็นในการเก็บและขนส่งวัคซีนนี้มาก[135][136]
ประวัติ
สรุป
มุมมอง
ก่อนโรคโควิด-19 วัคซีนสำหรับโรคติดต่อปกติต้องใช้เวลาพัฒนาหลายปี เมื่อเกิดการระบาดทั่วของโควิด-19 ก็ยังไม่มีวัคซีนป้องกันการติดเชื้อไวรัสโคโรนาในมนุษย์โดยประการทั้งปวงอีกด้วย[137] หลังจากที่ตรวจพบไวรัสโควิดในเดือนธันวาคม 2019[138] บริษัทเทคโนโลยีชีวภาพเยอรมันคือไบออนเทคก็เริ่มพัฒนาวัคซีนในวันที่ 10 มกราคม 2021 เมื่อศูนย์ควบคุมและป้องกันโรคจีนได้ตีพิมพ์ลำดับยีนของไวรัสโควิด[139][140][141] ซึ่งจุดชนวนให้นานาชาติเตรียมตอบสนองต่อโรคระบาดและเร่งการพัฒนาวัคซีนป้องกันโรค[142][143]
การพัฒนาวัคซีนเริ่มขึ้นเมื่อผู้จัดตั้งบริษัทไบออนเทคแห่งเยอรมนีผู้มีเชื้อสายชาวตุรกีคือ อูเออร์ ซาฮิน (Uğur Şahin) ได้อ่านบทความในวารสารการแพทย์ The Lancet ซึ่งทำให้เขาเชื่อว่า โรคโควิด-19 จะก่อเหตุการณ์ระบาดทั่วโลกอีกไม่นาน เขาจึงขอให้นักวิทยาศาสตร์บริษัทยกเลิกการลาหยุดงานแล้วเริ่มพัฒนาวัคซีนโควิด-19 ในเดือนมกราคม 2020[144] ไบออนเทค ได้เริ่มโปรแกรมความเร็วแสง (Lightspeed) เพื่อพัฒนาวัคซีนป้องกันไวรัสโควิด-19 โดยใช้เทคโนโลยีเอ็มอาร์เอ็นเอที่บริษัทมีอยู่แล้ว[37] ซึ่งบริษัทได้ยพยายามพัฒนาขึ้นตั้งแต่นักวิจัยผู้เชี่ยวชาญหญิงทางเอ็มอาร์เอ็นเอคือ แคแทลิน คาริโก ได้เข้าร่วมงานกับบริษัทในปี 2013[145] วัคซีนแปรหลายรูปแบบได้ทำขึ้นในแหล็บเมืองไมนทซ์แล้วจึงได้ให้ผู้เชี่ยวชาญที่สถาบันเพาล์แอร์ลิช (Paul-Ehrlich-Institute) ในรัฐเฮ็สเซินตรวจวิเคราะห์[146]
การลงทุน
ตามไฟเซอร์ การวิจัยและพัฒนาวัคซีนนี้มีค่าใช้จ่ายเกือบถึง 1,000 ล้านดอลลาร์สหรัฐ (ประมาณ 31,000 ล้านบาท)[147]
ในเดือนมีนาคม 2020 บริษัท Fosun (จีน) ได้ลงทุน 135 ล้านดอลลาร์สหรัฐ (ประมาณ 4,200 ล้านบาท) กับบริษัทไบออนเทคโดยแลกเปลี่ยนกับหุ้น 1.58 ล้านหุ้น และสิทธิในการพัฒนาและวางตลาดขายวัคซีนในประเทศจีน[23] ฮ่องกง มาเก๊า และไต้หวัน[148]
ในเดือนเมษายน 2020 ไฟเซอร์ลงทุน 185 ล้านดอลลาร์สหรัฐ (ประมาณ 5,800 ล้านบาท) กับไบออนเทคโดยเป็นการซื้อหุ้น 113 ล้านดอลลาร์สหรัฐ[149][150][151]
ในเดือนมิถุนายน 2020 ไบออนเทคได้รับเงินกู้ 200 ล้านยูโร (ประมาณ 3,500 ล้านบาท) จากคณะกรรมาธิการยุโรปและธนาคารเพื่อการลงทุนยุโรป[152] ธนาคารเริ่มคุยกับบริษัทตั้งแต่ตอนต้น ๆ ของเหตุการณ์ระบาดทั่ว เมื่อพนักงานของธนาคารทบทวนการลงทุนเดิมของธนาคารแล้วพบว่า ไบออนเทคเป็นบริษัทหนึ่งที่อาจพัฒนาวัคซีนโควิด-19 ขึ้นมาได้ โดยธนาคารได้เคยลงทุนในบริษัทนี้เป็นครั้งแรกตั้งแต่ปี 2019 แล้ว[153][154]
ในเดือนกันยายน 2020 รัฐบาลเยอรมันได้ให้เงินทุนแก่ไบออนเทค 375 ล้านยูโร (ประมาณ 13,000 ล้านบาท) โดยเป็นส่วนของโปรแกรมพัฒนาวัคซีนของชาติ[155]
ในเดือนพฤศจิกายน 2020 ประธานบริหารบริษัทไฟเซอร์ระบุว่า เขาตัดสินใจไม่รับเงินทุนจากโปรแกรมปฏิบัติการความเร็วเหนือแสง (Operation Warp Speed) ของรัฐบาลกลางสหรัฐในการพัฒนาวัคซีนก็ "เพราะผมต้องการป้องกันนักวิทยาศาสตร์ของบริษัทจากระเบียบราชการ เช่น ต้องให้รายงาน ต้องตกลงว่าจะใช้จ่ายเงินทุนแบบขนานหรือร่วมกับบริษัทอื่น ๆ เป็นต้น" แต่บริษัทก็ได้ตกลงกับสหรัฐในการแจกจำหน่ายวัคซีนเหมือนกับที่ทำกับประเทศอื่น ๆ[156]
การทดลองทางคลินิก

การทดลองระยะที่ 1-2 ได้เริ่มในเยอรมนีวันที่ 23 เมษายน 2020 และในสหรัฐในวันที่ 4 พฤษภาคม 2020 โดยมีวัคซีนแคนดิเดต 4 อย่างเข้าสู่การทดลอง[31][37] แล้วจึงเลือกวัคซีนแคนดิเดต BNT162b2 ว่ามีอนาคตดีที่สุดในบรรดาวัคซีนซึ่งใช้เทคโนโลยีคล้ายกัน 3 อย่างที่บริษัทได้พัฒนาขึ้น[158][31][92] ก่อนจะเลือก ไบออนเทคและไฟเซอร์ได้ทำการทดลองระยะที่ 1 ในเยอรมนีและสหรัฐ และบริษัทโฟสันก็ได้ทำในจีน[30][159] แล้วพบว่า วัคซีนนี้ปลอดภัยกว่าวัคซีนแคนดิเดต 3 อย่างอื่น ๆ ของบริษัท[159][158][160]
ผลการทดลองทางคลินิกระยะที่ 1-2 เบื้องต้นที่ตีพิมพ์ในเดือนตุลาคม 2020 แสดงว่า วัคซีน BNT162b2 อาจมีประสิทธิศักย์และความปลอดภัย[30][158] ในเดือนเดียวกัน สำนักงานการแพทย์ยุโรป (European Medicines Agency, EMA) ก็เริ่มตรวจทบทวนข้อมูลของ BNT162b2 แบบทำเป็นระยะ ๆ[161]
ในเดือนพฤศจิกายน 2020 การทดลองวัคซีนยังอยู่ในระยะที่ 3[31] เป็นการทดลองแบบสุ่ม มีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ เพื่อหาขนาดยา (dose-finding) และตรวจประสิทธิศักย์ (efficacy) ในบุคคลที่สุขภาพดี[31] การทดลองเบื้องต้นตรวจความปลอดภัยและหาขนาดยา โดยเริ่มขยายการทดลองในกลางปี 2020 เพื่อประเมินประสิทธิศักย์และความปลอดภัยในอาสาสมัครจำนวนมากขึ้นจนถึงเป็นหมื่น ๆ คน ในประเทศหลายประเทศที่ร่วมมือกับบริษัทไฟเซอร์และโฟสัน[33][23]
การทดลองระยะที่ 3 ตรวจสอบความปลอดภัย ประสิทธิศักย์ ความอดทนรับยาได้ (tolerability) และการก่อภูมิคุ้มกัน (immunogenicity) สำหรับยาขนาดกลาง ๆ ฉีดสองครั้งห่างกัน 21 วัน มีอาสาสมัครแบ่งเป็น 3 วัยคือ 12-15 ปี, 16-55 ปี และเกิน 55 ปี[31] ผลการทดลองระยะที่ 3 ซึ่งระบุว่า วัคซีนมีประสิทธิภาพร้อยละ 95 ได้ตีพิมพ์ในวันที่ 18 พฤศจิกายน 2020[37] สำนักงานการแพทย์ยุโรป (European Medicines Agency, EMA) ได้ยืนยันประสิทธิศักย์ของวัคซีนที่ร้อยละ 95 เมื่อให้อนุมัติวัคซีน[162] โดยภายหลังชี้แจงว่า โดสที่สองควรฉีด 3 สัปดาห์หลังโดสแรก[163]
วันที่ 14 หลังจากได้โดสที่ 1 อาการเกิดโรคโควิด-19 แบบสะสมเริ่มต่างกันระหว่างกลุ่มที่ได้วัคซีนกับกลุ่มที่ได้ยาหลอก ความเข้มข้นของแอนติบอดีลบล้างฤทธิ์ (neutralizing antibodies) ถึงระดับสูงสุดที่ 7 วันหลังจากได้โดสที่สองสำหรับผู้ใหญ่ทั่วไปและ 14 วันหลังจากโดสที่สองสำหรับคนชรา[162]
| กลุ่ม | ประสิทธิศักย์ของวัคซีน (ช่วงความเชื่อมั่นที่ 95%) [%] |
|---|---|
| ทุกช่วงอายุ | 95.0% (90.0–97.9%) |
| อายุ 12-17 ปี | ประเมินไม่ได้เพราะไม่มีผู้มีอาการในกลุ่มยาหลอก |
| อายุ 18-64 ปี | 95.1% (89.6–98.1%) |
| อายุ 65-74 ปี | 92.9% (53.1–99.8%) |
| อายุ ≥75 | 100.0% (−13.1 to 100.0%) |
| ทุกช่วงอายุหลังโดส 1 แต่ก่อนได้โดส 2 | 52.4% (29.5–68.4%) |
| ทุกช่วงอายุ ≥10 วันหลังโดส 1 แต่ก่อนได้โดส 2 | 86.7% (68.6–95.4%) |
| ทุกช่วงอายุ <7 วันหลังโดส 2 | 90.5% (61.0–98.9%) |
| ทุกช่วงอายุ ≥7 วันหลังโดส 2 | 94.8% (89.8–97.6%) |
| ทุกช่วงอายุในสหรัฐ | 94.9% (88.6–98.2%) |
| ทุกช่วงอายุในอาร์เจนตินา | 97.2% (83.3–99.9%) |
| ทุกช่วงอายุในบราซิล | 87.7% (8.1–99.7%) |
การทดลองระยะที่ 3 ซึ่งดำเนินการระหว่างปี 2020-2022 ทำเพื่อประเมินสมรรถภาพป้องกันการติดเชื้ออย่างรุนแรง และระยะเวลาที่เกิดภูมิคุ้มกัน[33][164][125]
ฤทธิ์ระดับสูงของแอนติบอดียังคงอยู่อย่างน้อย 3 เดือนหลังจากฉีดโดสที่สอง โดยมีค่าประเมินครึ่งชีวิตที่ 55 วัน ตามข้อมูลนี้ งานศึกษาหนึ่งจึงเสนอว่า อาจยังสามารถตรวจเจอแอนติบอดีได้ถึงราว ๆ 554 วัน[165]
ผลงานเบื้องต้นจากงานทดลองทางคลินิกที่ทำในประเทศหลายประเทศพบว่า ประสิทธิศักย์ป้องกันการติดเชื้อแบบแสดงอาการลดลงจาก 96% (95% CI, 93–98%) เหลือ 84% (75–90%) หลังจากได้วัคซีนโดสที่สอง 4 เดือน[166]
กลุ่มโดยเฉพาะ ๆ
ไฟเซอร์และไบออนเทคได้เริ่มการทดลองระยะที่ 2-3 ที่จัดกลุ่มโดยสุ่มและมีกลุ่มควบคุมสำหรับหญิงมีครรภ์ผู้มีสุขภาพดีและมีอายุ 18 ปีหรือยิ่งกว่า[167] งานศึกษาจะตรวจการให้วัคซีนขนาด 30 ไมโครกรัมหรือให้ยาหลอก ซึ่งฉีดเข้ากล้ามเนื้อสองโดสโดยห่างกัน 21 วัน งานศึกษาระยะ 2 จะมีหญิงมีครรภ์ในระหว่าง 27-34 สัปดาห์ 350 คนเป็นอาสาสมัคร ครึ่งหนึ่งจะได้รับวัคซีน อีกครึ่งจะได้ยาหลอก งานศึกษาระยะ 3 จะตรวจความปลอดภัย ความอดทนรับยาได้ และการก่อภูมิคุ้มกันของวัคซีนเทียบกับยาหลอกสำหรับหญิงมีครรภ์ในระหว่าง 24-34 สัปดาห์ บริษัทประกาศในวันที่ 18 กุมภาพันธ์ว่า อาสาสมัครคนแรกได้รับวัคซีนโดสแรกแล้ว[168]
งานศึกษาที่ตีพิมพ์ในวารสารสูติศาสตร์และนรีเวชวิทยาอเมริกัน (AJOG) สรุปว่า วัคซีนเอ็มอาร์เอ็นเอสำหรับโควิด-19 รวมทั้งของไฟเซอร์-ไบออนเทคและของโมเดอร์นา ปลอดภัยและมีประสิทธิภาพป้องกันการติดเชื้อสำหรับหญิงมีครรภ์และหญิงที่กำลังให้นมบุตร อนึ่ง แอนติบอดีที่ระบบภูมิคุ้มกันของมารดาสร้างขึน ยังส่งต่อไปให้ทารกผ่านรกหรือผ่านนมของมารดา ทำให้ทารกมีภูมิคุ้มกันป้องกันโรค งานศึกษายังพบด้วยว่า ภูมิคุ้มกันเนื่องกับวัคซีนที่เกิดขึ้นยังมีกำลังอย่างมีนัยสำคัญทางสถิติเหนือกว่าภูมิคุ้มกันที่ได้เมื่อหายจากโรคที่ติดโดยธรรมชาติ งานศึกษายังรายงานอีกว่า ผลข้างเคียงทั้งโดยโอกาสเกิดและความรุนแรงในหญิงมีครรภ์และหญิงที่กำลังให้นมบุตร ก็คล้ายกับคนทั่วไปอื่น ๆ คือโดยทั่วไปเล็กน้อยและอดทนได้ดี ส่วนมากเป็นการเจ็บที่จุดฉีด ปวดศีรษะ ปวดกล้ามเนื้อ หรือล้า โดยเป็นน้อยและในระยะเวลาสั้น ๆ[169]
ในปลายเดือนมกราคม 2021 ไฟเซอร์ระบุว่าได้รับสมัครเด็กอาสามัครอายุระหว่าง 12-15 ปี 2,259 คนเรียบร้อยแล้วเพื่อศึกษาความปลอดภัยและประสิทธิศักย์กับกลุ่มนี้[170] ในวันที่ 31 มีนาคม 2021 ผลเบื้องต้นจากการทดลองระยะที่ 3 แสดงว่า วัคซีนมีประสิทธิภาพเต็มร้อยสำหรับเด็กกลุ่มนี้โดยกำลังทดลองกับเด็กอายุน้อยกว่านั้นต่อไป[171]
จดหมายเชิงวิจัยที่ตีพิมพ์ในวารสารการแพทย์ JAMA รายงานว่า วัคซีนดูเหมือนจะปลอดภัยสำหรับผู้ที่ได้รับปลูกถ่ายอวัยวะที่กินยากดภูมิคุ้มกันอยู่ แต่การตอบสนองของแอนติบอดีก็แย่กว่าผู้ที่มีภูมิคุ้มกันปกติอย่างพอควรเมื่อได้รับวัคซีนเพียงแค่หนึ่งโดส จดหมายยอมรับว่า ได้ตรวจข้อมูลหลังจากได้วัคซีนเพียงแค่โดสเดียวจากวัคซีนที่ปกติต้องได้สองโดส[172]
ในปลายเดือนกรกฎาคม 2021 กลุ่มนักวิจัยประเทศเนเธอร์แลนด์ได้ตีพิมพ์ผลงานวิจัยก่อนจะทบทวนโดยผู้รู้เสมอกันซึ่งพบว่า วัคซีนโควิด-19 ของโมเดอร์นาซึ่งเป็นวัคซีนเอ็มอาร์เอ็นเอเช่นเดียวกับของไฟเซอร์ สามารถฉีดเข้าใต้ผิวหนังอย่างปลอดภัยและสร้างการตอบสนองทางแอนติบอดีสำหรับผู้ที่ได้รับวัคซีนอายุระหว่าง 18-30 ปี งานศึกษาพบว่า ระดับความเข้มข้นของแอนติบอดี (antibody titer) ของผู้ที่ได้รับวัคซีนใต้ชั้นผิวหนังขนาด 10 หรือ 20 ไมโครกรัม (เทียบกับปกติต้องฉีด 100 ไมโครกรัมต่อโดส) ต่อโดส โดยฉีดสองโดส จะสูงกว่าผู้ที่หายจากการติดโรคโดยธรรมชาติถึง 14-20 เท่า อนึ่ง ผู้ที่ได้วัคซีนใต้ใช้ผิวหนังทั้งสองขนาดดังที่ว่า หรือผู้ที่ได้ฉีดวัคซีนเพียง 20 ไมโครกรัมเข้ากล้ามเนื้อ ยังมีระดับแอนติบอดีเท่ากับผู้ที่ได้ฉีดวัคซีนเข้ากล้ามเนื้อในขนาดปกติที่ 100 ไมโครกรัมอีกด้วย[173][174] นี่มีข้อดีคือใช้ปริมาณในการฉีดน้อยลง 5-10 เท่า โดยทั้งหมดนี้ยังอยู่ระหว่างการศึกษาวิจัย[175]
การอนุมัติ
สรุป
มุมมอง
เป็นการเร่งด่วน
ในวันที่ 2 ธันวาคม 2020 สำนักงานควบคุมผลิตภัณฑ์การแพทย์และดูแลสุขภาพ (Medicines and Healthcare products Regulatory Agency, MHRA) แห่งสหราชอาณาจักรได้ให้อนุมัติวัคซีนอย่างชั่วคราวโดยทำอย่างรวดเร็วเพื่อแก้ปัญหาทางสาธารณสุขที่สำคัญเช่นโรคระบาดทั่วตามอำนาจกฎหมายที่ให้ในปี 1968[176] เป็นประเทศแรกที่อนุมัติวัคซีนนี้หลังจากได้ทำการทดลองขนาดใหญ่[177] เป็นประเทศตะวันตกแรกที่ให้อนุมัติเป็นการฉุกเฉินแก่วัคซีนโควิด[176][178][179] เป็นวัคซีนเอ็มอาร์เอ็นเอแรกที่อนุมัติให้ใช้ในมนุษย์[178] แม้การตัดสินใจให้อนุมัติที่เร็วแบบนี้ก็ถูกวิจารณ์โดยผู้เชี่ยวชาญบางท่าน[180]
ต่อมาประเทศต่าง ๆ จึงอนุมัติให้ใช้วัคซีนโควิด-19 ของไฟเซอร์-ไบออนเทครวมทั้ง ออสเตรเลีย[181] แคนาดา[11][182] ฮ่องกง[183] อิสราเอล[184] มาเลเซีย[185] ฟิลิปปินส์[186] สิงคโปร์[187] เกาหลีใต้[188][189] และสหรัฐ[14]
องค์การอนามัยโลกก็ได้อนุมัติให้ใช้วัคซีนนี้เป็นการฉุกเฉินเมื่อปลายเดือนธันวาคมแล้ว[190]
องค์การอาหารและยาสหรัฐระบุว่า การอนุมัติให้ใช้เป็นการฉุกเฉิน (emergency use authorization, EUA) เป็น "กลไกที่อำนวยการทำให้มีและการใช้วิธีแก้ปัญหาทางแพทย์รวมทั้งวัคซีน ในช่วงความฉุกเฉินทางสาธารณสุข เช่น การระบาดทั่วของโควิด-19 ในปัจจุบัน"[191] เมื่ออนุมัติให้ใช้วัคซีนเป็นการฉุกเฉินแล้ว ผู้พัฒนาวัคซีนก็ยังต้องดำเนินการทดลองระยะที่ 3 ต่อไปเพื่อบูรณาการข้อมูลความปลอดภัยและประสิทธิศักย์ของวัคซีน โดยในที่สุดก็จะยื่นคำขออนุมัติแบบเต็ม[191][192][193] ในวันที่ 14 ธันวาคม คณะที่ปรึกษาเรื่องแนวปฏิบัติสร้างภูมิคุ้มกันแห่งศูนย์ควบคุมและป้องกันโรคสหรัฐ (Centers for Disease Control and Prevention, CDC) ก็แนะนำให้อนุมัติใช้วัคซีนนี้สำหรับคนที่อายุ 16 ปีหรือยิ่งกว่า[194][195]
ในวันที่ 5 พฤษภาคม 2021 กระทรวงสาธารณสุขแคนาดา (Health Canada) อนุมัติให้ใช้วัคซีนกับเด็กอายุระหว่าง 12-15 ปี[196] ในวันที่ 10 ต่อมา องค์การอาหารและยาสหรัฐจึงอนุมัติให้ใช้วัคซีนกับเด็กอายุระหว่าง 12-15 ปี[197][198][117][199][118] ในวันที่ 18 ต่อมา สำนักงานวิทยาศาสตร์ทางสาธารณสุข (Health Sciences Authority) ของสิงค์โปร์จึงอนุมัติให้ใช้วัคซีนกับเด็กอายุระหว่าง 12-15 ปี[200] ต่อมาวันที่ 28 สำนักงานการแพทย์ยุโรปจึงได้อนุมัติเช่นเดียวกัน[201]
ในวันที่ 4 มิถุนายน 2021 สำนักงานควบคุมผลิตภัณฑ์การแพทย์และดูแลสุขภาพแห่งสหราชอาณาจักรได้อนุมัติให้ใช้วัคซีนกับเด็กอายุระหว่าง 12-15 ปี[75][76]
ให้ใช้ทั่วไป
วันที่ 19 ธันวาคม สำนักงานควบคุมผลิตภัณฑ์การรักษา (Swissmedic) แห่งสวิตเซอร์แลนด์ได้อนุมัติให้ใช้วัคซีนนี้อย่างเต็มตัว โดยทำภายในสองเดือนที่ได้รับคำขอ และระบุว่า วัคซีนผ่านเกณฑ์ความปลอดภัย ประสิทธิศักย์ และคุณภาพอย่างสมบูรณ์ นี่เป็นการอนุมัติตามกระบวนการปกติโดยเกิดเป็นประเทศแรก เพราะสวิตเซอร์แลนด์ไม่มีการอนุมัติให้ใช้เป็นการฉุกเฉิน[2][202]
วันที่ 21 ธันวาคม คณะกรรมการเวชภัณฑ์สำหรับใช้ในมนุษย์ (Committee for Medicinal Products for Human Use) ของสำนักงานการแพทย์ยุโรป (EMA) แนะนำการให้อนุมัติวัคซีนนี้เพื่อวางตลาดอย่างมีเงื่อนไขโดยมีตราสินค้าว่า Comirnaty (โคเมอร์เนที)[3][203][204] ซึ่งคณะกรรมาธิการยุโรปก็ตกลงยอมรับในวันเดียวกัน[203][205]
ในวันที่ 23 กุมภาพันธ์ 2021 องค์กรควบคุมสุขภาพแห่งบราซิลลงทะเบียนให้ใช้วัคซีนนี้ตามกระบวนการอนุมัติให้วางตลาดตามปกติ สำหรับบราซิล นี้เป็นวัคซีนโควิด-19 แรกที่ได้ลงทะเบียนตามปกติ ไม่ใช่แค่เพื่อใช้เป็นการฉุกเฉิน[206] ในเดือนธันวาคม ก็อนุมัติขยายให้ใช้กับเด็กอายุ 12 ปีและยิ่งกว่า[207][208]
ในเดือนกรกฎาคม 2021 องค์การอาหารและยาสหรัฐจัดคำขออนุมัติทั่วไป (biologics license application) สำหรับวัคซีนให้ได้รับการพิจารณาก่อน (priority review) โดยมุ่งหมายจะตัดสินใจในเดือนมกราคม 2022[209][210]
พัฒนาการอื่น
การฉีดบูสต์ด้วยวัคซีนชนิดเดียวกัน
ในกลางเดือนสิงหาคม 2021 องค์การอาหารและยาสหรัฐและศูนย์ควบคุมและป้องกันโรคสหรัฐได้อนุญาตให้ฉีดวัคซีนเป็นโดสที่สามแก่ผู้ที่มีภูมิคุ้มกันบกพร่อง[211][212]
ประเทศไทย
สรุป
มุมมอง
| วันที่ | รายละเอียด |
|---|---|
| ก่อน เม.ย. 64 | กระทรวงสาธารณสุขของไทยติดต่อกับไฟเซอร์ |
| 16 เม.ย. | ประชุม ศบค. มีมติให้จัดหาวัคซีน |
| 20 เม.ย. | ครม. รับทราบมติการเร่งจัดหาวัคซีนไฟเซอร์ ตามที่ ศบค. เสนอ |
| 29 เม.ย. | ลงนามสัญญาการเก็บรักษาความลับระหว่างกัน |
| 3 พ.ค. | คร. ส่งร่างข้อตกลงผูกพันในการจองวัคซีนให้ อสส. พิจารณา |
| 25 พ.ค. | คร. ส่งร่างข้อตกลงผูกพันในการจองวัคซีนที่เจรจาเพิ่มเติมให้ อสส. พิจารณา |
| 28 พ.ค. | อสส. แจ้งผลการพิจารณา |
| 10 มิ.ย. | ลงนามในข้อตกลงการจองซื้อวัคซีน |
| 11 มิ.ย. | ไฟเซอร์ยื่นขอขึ้นทะเบียนวัคซีนต่อ อย. |
| 24 มิ.ย. | อย. ขึ้นทะเบียนวัคซีน |
| 26 มิ.ย. | ไฟเซอร์ส่งร่างความตกลงการผลิตและการจัดหาวัคซีน |
| 28 มิ.ย. | คร. ส่งร่างความตกลงการผลิตและการจัดหาวัคซีนให้ อสส. พิจารณา |
| 5 ก.ค. | อสส. ส่งร่างความตกลงการผลิตและการจัดหาวัคซีนที่พิจารณาแล้วกลับให้ คร. |
| 6 ก.ค. | สธ. นำเข้าให้ ครม. พิจารณาซึ่งมีมติให้ลงนามในความตกลงดังกล่าวได้ |
| 20 ก.ค. | ลงนามเซ็นสัญญาจัดหาวัคซีน 20 ล้านโดส |
| 30 ก.ค. | วัคซีน 1.5 ล้านโดสที่สหรัฐอเมริกาบริจาคได้มาถึงประเทศไทย |
| 9 ส.ค. | เริ่มฉีดวัคซีน |
| 17 ส.ค. | ครม. อนุมัติงบประมาณเพื่อสั่งซื้อวัคซีน 20 ล้านโดส |
| 20 ส.ค. | ลงนามเซ็นสัญญาเพื่อจัดซื้อวัคซีนเพิ่มอีก 10 ล้านโดส |
| 30 ส.ค. | ครม. อนุมัติงบประมาณ 4,745 ล้านบาทสำหรับวัคซีนอีก 9,998,820 โดส |
| ไตรมาส 4 (2021) | เริ่มทยอยจัดส่งวัคซีน[62] คาดว่า ก.ย. จะได้ 2 ล้านโดส, ต.ค. 8 ล้านโดสและ พ.ย. กับ ธ.ค. เดือนละ 10 ล้านโดส[216] |
ในวันที่ 7 พฤษภาคม 2021 รมว. กระทรวงสาธารณสุขไทย (นายอนุทิน ชาญวีรกูล) ระบุว่า ไฟเซอร์ได้ยืนยันว่า ได้สำรองวัคซีนเพื่อส่งให้แก่ประเทศไทยเป็นจำนวน 10-20 ล้านโดสโดยจะจัดส่งให้ในไตรมาสที่ 3-4 และบริษัทจะยื่นเอกสารขึ้นทะเบียนแก่คณะกรรมการอาหารและยา (อย.) หลังสามารถตกลงกับรัฐบาล รัฐบาลไม่สามารถเปิดเผยราคาวัคซีนได้เพราะเหตุผลทางการค้า ในเบื้องต้น บริษัทจะส่งวัคซีนให้แก่รัฐบาลก่อน หลังจากนั้น เอกชนก็จะสามารถเจรจาซื้อได้[55] ทั้งนี้ จนถึงวันที่ 14 พฤษภาคม รัฐบาลยังกำหนดจะให้วัคซีนนี้เฉพาะแก่เด็กอายุ 12-18 ปี (ประมาณ 10 ล้านคน) เพราะตอนนี้ สำหรับบุคคลผู้มีอายุเกิน 18 ปี รัฐมีวัคซีนของซิโนแว็กและของแอสตร้าเซนเนก้าเพียงพอสำหรับแผนการฉีดวัคซีนให้แก่ประชาชน[56]
ในวันที่ 24 มิถุนายน อย. ได้ขึ้นทะเบียนวัคซีนนี้แล้ว[57]
ในวันที่ 20 กรกฎาคม มีการลงนามสัญญาเพื่อจัดส่งวัคซีนให้ไทย 20 ล้านโดสโดยจะจัดส่งในไตรมาสที่ 4 คือระหว่างเดือนตุลาคม-ธันวาคม[58] ในวันที่ 30 กรกฎาคม วัคซีน 1.5 ล้านโดสที่สหรัฐอเมริกาบริจาคได้มาถึงประเทศไทย[59] นี้เป็นความมุ่งมั่นของประธานาธิบดีสหรัฐ โจ ไบเดิน ที่จะบริจาควัคซีนให้แก่ประเทศต่าง ๆ ทั่วโลก 500 ล้านโดสให้เสร็จสิ้นภายในหนึ่งปี[217] ศบค. ได้จัดสรรวัคซีนชุดนี้แก่
- บุคลากรทางการแพทย์ด่านหน้า (ให้ฉีดเป็นเข็มที่ 3) 700,000 โดส
- บุคคลเสี่ยงรวมทั้งผู้สูงอายุ ผู้มีโรคเรื้อรัง (รวมเด็กอายุ 12 ปีขึ้น) และหญิงตั้งครรภ์ 645,000 โดส
- ชาวต่างชาติในไทยโดยเฉพาะผู้มีโรคเรื้อรัง หญิงตั้งครรภ์ และผู้ที่ต้องไปต่างประเทศรวมนักศึกษา 150,000 โดส
- เพื่อการศึกษาและการวิจัย 5,000 โดส
- การสำรองส่วนกลางและการเตรียมตอบโต้เชื้อกลายพันธุ์ 40,000 โดส
ในวันที่ 17 สิงหาคม ครม. ได้อนุมัติงบประมาณ 9,372 ล้านบาทสำหรับวัคซีน 20 ล้านโดสที่สั่งจองโดยเป็นค่าวัคซีน 8,439 ล้านบาท (ประมาณ 422 บาทต่อโดสหรือ 12.65 ดอลลาร์สหรัฐ)[B] และค่าบริหารจัดการ 933 ล้านบาท[60][61] ต่อมาวันที่ 20 กรมควบคุมโรคได้ลงนามเซ็นสัญญากับบริษัทเพื่อจัดซื้อวัคซีนเพิ่มอีกประมาณ 10 ล้านโดสรวมที่สั่งแล้วทั้งหมด 30 ล้านโดสโดยจะ "ทยอยจัดส่งได้ในช่วงไตรมาสที่ 4 ปีนี้เป็นต้นไป"[62] ในวันที่ 30 ต่อมา ครม. ก็ได้อนุมัติงบประมาณอีก 4,745 ล้านบาทสำหรับวัคซีน 9,998,820 โดส (ประมาณ 475 บาทต่อโดสรวมค่าบริหารจัดการ)[63] โดยตั้งเป้าฉีดให้บุคคลเป้าหมาย 6 กลุ่มหลักคือ[220]
- เด็กวัยรุ่นอายุระหว่าง 12-17 ปี
- หญิงมีครรภ์ 12 สัปดาห์ขึ้น
- บุคลากรทางแพทย์และสาธารณสุขด่านหน้าเพื่อกระตุ้นภูมิ
- ผู้สูงอายุและผู้มีโรคประจำตัวชนิดเสี่ยง 7 กลุ่ม
- ชาวต่างชาติที่อาศัยอยู่ในประเทศไทยโดยเน้นผู้สูงอายุและผู้ป่วยโรคเรื้อรัง
- ผู้ที่ต้องฉีดวัคซีนนี้ก่อนเดินทางไปต่างประเทศ เช่น นักศึกษาและทูตเป็นต้น
สังคมและวัฒนธรรม
สรุป
มุมมอง
ชื่อ
BNT162b2 เป็นชื่อรหัสเมื่อกำลังพัฒนาและทดสอบวัคซีน[30][221] ส่วน tozinameran เป็นชื่อระหว่างประเทศที่ไม่มีเจ้าของ (INN)[222] และ Comirnaty ก็เป็นตราสินค้า[2][3] ซึ่งตามบริษัท ชื่อ Comirnaty รวมมาจากคำว่า COVID-19, mRNA, community (ชุมชน) และ immunity (ภูมิคุ้มกัน)[223][1]
วัคซีนยังมีชื่อสามัญว่า "COVID-19 mRNA vaccine (nucleoside-modified)"[3] ในสหรัฐ วัคซีนอาจติดป้าย Pfizer‑BioNTech COVID‑19 Vaccine[224]
เศรษฐกิจ
ไฟเซอร์ได้รายงานรายรับ 154 ล้านดอลลาร์สหรัฐ (ประมาณ 4,800 ล้านบาท) จากวัคซีนที่ขายในปี 2020[151]
ในเดือนกรกฎาคม 2020 โปรแกรมปฏิบัติการความเร็วเหนือแสง (Operation Warp Speed) ของสหรัฐได้สั่งวัคซีนล่วงหน้าเป็นมูลค่า 1,950 ล้านดอลลาร์สหรัฐ (ประมาณ 61,000 ล้านบาท) เพื่อวัคซีน 100 ล้านโดสเมื่อวัคซีนพบว่าปลอดภัยและมีประสิทธิผล[22][225][226][227] ในกลางเดือนธันวาคม ไฟเซอร์ยังตกลงส่งวัคซีน 300 ล้านโดสให้สหภาพยุโรป[228], 120 ล้านโดสให้ญี่ปุ่น[229], 40 ล้านโดสให้สหราชอาณาจักร (โดย 10 ล้านโดสจะส่งก่อนปี 2021)[125], 20 ล้านโดสให้แคนาดา[230], ส่งวัคซีนไม่ระบุจำนวนให้สิงค์โปร์[231] และ 34.4 ล้านโดสให้เม็กซิโก[232]
ส่วนบริษัทโฟสันยังตกลงส่งวัคซีน 10 ล้านโดสให้แก่ฮ่องกงและมาเก๊า[233] โดยรัฐบาลฮ่องกงระบุว่า จะได้รับวัคซีนล้านโดสแรกในไตรมาสแรกปี 2021[234]
ไบออนเทคร่วมกับโฟสันตกลงจะส่งวัคซีนให้จีนแผ่นดินใหญ่ 100 ล้านโดสในปี 2021 โดยขึ้นอยู่กับการได้รับอนุมัติจากองค์กรควบคุม[25][235] และจะเริ่มส่งจากโรงงานของไบออนเทคในเยอรมนี[25][235]
วันที่ 8 ธันวาคม 2020 หญิงจากเทศมณฑลเฟอร์แมนาอายุ 90 ปี คือ มาร์กาแร็ต "แมกกี้" คีนาน เป็นผู้ได้รับวัคซีนเป็นคนแรกนอกการทดลองทางคลินิก[236] โดยพิพิธภัณฑ์วิทยาศาสตร์ในนครลอนดอนได้เก็บขวดและเข็มวัคซีนไว้สำหรับนิทรรศการในอนาคต[237] จนถึงวันที่ 20 ธันวาคม ผู้อยู่อาศัยในสหราชอาณาจักร 521,594 รายได้รับวัคซีนโดยเป็นส่วนของโปรแกรมให้วัคซีนโควิด-19 ทั่วประเทศ โดยผู้ได้ร้อยละ 70 มีอายุ 80 ปีหรือยิ่งกว่า[238]
ในวันที่ 23 ธันวาคม หญิงเมืองลูเซิร์นอายุ 90 ปี เป็นบุคคลแรกที่ได้รับวัคซีนในสวิตเซอร์แลนด์[239] เป็นการเริ่มฉีดวัคซีนนี้ให้แก่ประชาชนในแผ่นดินใหญ่ยุโรป[240]
ในเดือนมกราคม 2021 บริษัทไฟเซอร์-ไบออนเทคได้เสนอขายวัคซีน 50 ล้านโดสให้แก่บุคลากรทางแพทย์ทั่วแอฟริการะหว่างเดือนมีนาคมจนถึงสิ้นปี 2021 ในราคาที่ลดลงเหลือเป็น 10 ดอลลาร์สหรัฐต่อโดส (ประมาณ 313 บาท)[241] แอฟริกาใต้จึงสั่งวัคซีน 20 ล้านโดสซึ่งคาดว่าจะได้เป็นล็อต ๆ หลังเดือนมีนาคม[242]
ในวันที่ 23 เมษายน 2021 สหภาพยุโรปประกาศสัญญาฉบับที่ 3 กับไฟเซอร์-ไบออนเทคเพือให้ส่งวัคซีนจนถึง 1,800 ล้านโดสเพื่อแจกจำหน่ายใน 2 ปี[243]
ในวันที่ 6 พฤษภาคม 2021 คณะกรรมการโอลิมปิกสากลได้ซื้อวัคซีนเพื่อฉีดให้แก่อาสาสมัคร พนักงาน และนักกีฬาที่เข้าร่วมงานโอลิมปิกฤดูร้อน 2020ซึ่งจัดทำในนครโตเกียว[244]
ในวันที่ 9 มิถุนายน ประธานาธิบดีสหรัฐโจ ไบเดิน ได้สัญญาว่าจะบริจาควัคซีนไฟเซอร์ 500 ล้านโดสให้แก่ประเทศประมาณ 100 ประเทศโดยจะส่งให้เสร็จสิ้นภายในปีหนึ่ง[217]
ข้อมูลผิด
ในเดือนพฤษภาคม 2021 มีวิดีโอที่กระจายไปตามสื่อสังคมซึ่งแสดงบุคคลที่มีแม่เหล็กติดอยู่ที่แขนหลังฉีดวัคซีน เพื่อยืนยันทฤษฎีสมคบคิดว่าวัคซีนมีไมโครชิป แต่วิดีโอเหล่านี้ก็ถูกลบล้างว่าไม่จริงแล้ว[245][246][247][248][249]
ดูเพิ่ม
- MRNA-1273 ซึ่งเป็นวัคซีนโควิด-19อีกอย่างที่ใช้เทคโนโลยี modRNA
เชิงอรรถ
- ตามหนังสืออ้างอิงอังกฤษคือ British National Formulary และพจนานุกรมศัพท์แพทย์คือ MedDRA ผลข้างเคียงจัดว่าสามัญมาก (very common) เมื่อเกิด 1/10, สามัญ (common) เมื่อเกิดระหว่าง 1/100-1/10, ไม่สามัญ (uncommon) ระหว่าง 1/1,000-1/100, น้อย (rare) ระหว่าง 1/10,000-1/1,000 และน้อยมาก (very rare) เมื่อเกิดน้อยกว่า 1/10,000[41]
- ถ้าวัคซีน 20 ล้านโดสมีราคา 8,439 ล้านบาท[60] วัคซีนโดสหนึ่งก็จะมีราคาประมาณ 422 บาทหรือประมาณ 12.65 ดอลลาร์สหรัฐ เทียบกับสหภาพยุโรปที่ได้วัคซีนในราคาประมาณ 420 บาท[218] และกับที่สหรัฐได้ในราคาประมาณ 650 บาท[219]
- ในอณูชีววิทยา five-prime cap (5′ cap) เป็นนิวคลีโอไทด์ที่แปลงไปโดยเฉพาะ ๆ ที่ส่วนสุดด้าน 5′ ของ primary transcript บางชนิดเช่น precursor mRNA กระบวนการนี้ ซึ่งเรียกว่า mRNA capping ต้องควบคุมเป็นอย่างดี และสำคัญยิ่งเพื่อให้สร้างเอ็มอาร์เอ็นเอได้อย่างเสถียรและสมบูรณ์อันสามารถเข้าร่วมกับกระบวนการแปลรหัสเมื่อสังเคราะห์โปรตีน เอ็มอาร์เอ็นเอของไมโทคอนเดรีย[96] และคลอโรพลาสต์[97] จะไม่ผ่านกระบวนการนี้
- signal peptide หรือ signal sequence หรือ targeting signal หรือ localization signal หรือ localization sequence หรือ transit peptide หรือ leader sequence หรือ leader peptide เป็นเพปไทด์สั้น ๆ ปกติมีกรดอะมิโนต่อกันยาว 16-30 ตัว[98] อยู่ที่ปลายเอ็น (N-terminus) ของโปรตีนที่สังเคราะห์ขึ้นใหม่โดยมากที่จะใช้ใน secretory pathway[99] โปรตีนเหล่านี้รวมทั้งที่อยู่ในออร์แกเนลล์บางอย่าง (เช่น endoplasmic reticulum, Golgi apparatus หรือเอนโดนโซม), โปรตีนที่หลั่งออกจากเซลล์ หรือที่สอดเข้าไปในเยื่อหุ้มเซลล์โดยมาก
- ในอณูพันธุศาสตร์ three prime untranslated region (3'-UTR) เป็นส่วนของเอ็มอาร์เอ็นเอที่อยู่ถัดไปจาก translation termination codon
อ้างอิง
แหล่งข้อมูลอื่น
Wikiwand - on
Seamless Wikipedia browsing. On steroids.