கல்சியம்
From Wikipedia, the free encyclopedia
கால்சியம் அல்லது சுண்ணாம்பு ஆவர்த்தன அட்டவணையில் இடம் பெற்றுள்ள ஒரு வேதியியல் தனிமம் ஆகும். இதன் குறியீடு Ca, அணுவெண் 20. இது மென் சாம்பல் நிறம் கொண்ட ஒரு காரமண் உலோகம். இது தோரியம், ஸிர்க்கோனியம், யுரேனியம் ஆகியவற்றின் பிரித்தெடுப்பில் தாழ்த்து கருவியாகப் பயன்படுகின்றது. புவி மேலோட்டில் காணப்படும் தனிமங்களில், அளவின் அடிப்படையில் ஐந்தாவது இடத்தை வகிப்பது கல்சியமாகும்.[2] இது உயிரினங்களுக்கு மிகவும் அவசியமான ஒரு தனிமமாகும். உயிரினங்களில் மிகவும் பொதுவாகக் காணப்படும் உலோகமும் இதுதான்.
| கல்சியம் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
20Ca | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
மங்கலான சாம்பல், வெள்ளி கல்சியத்தின் நிறமாலைக்கோடுகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | கல்சியம், Ca, 20 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உச்சரிப்பு | /ˈkælsiəm/ KAL-see-əm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| தனிம வகை | காரமண் உலோகம் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 2, 4, s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
40.078(4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
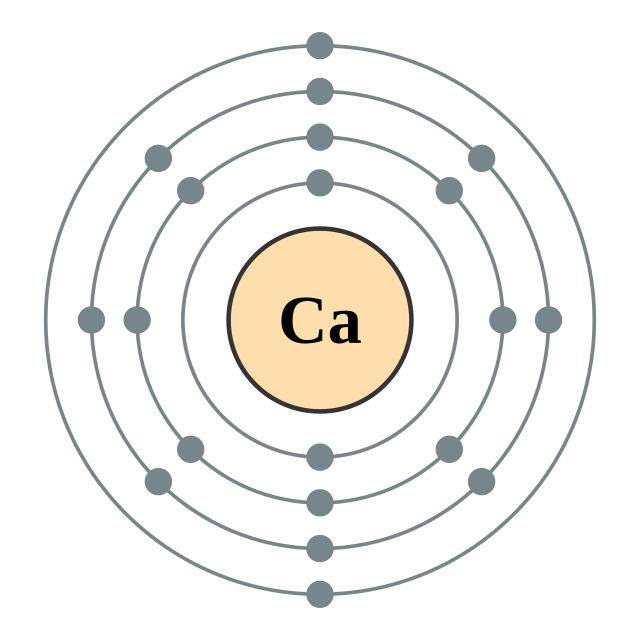
| இலத்திரன் அமைப்பு | [Ar] 4s2 2, 8, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நிலை | திண்மம் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 1.55 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 1.378 g·cm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகுநிலை | 1115 K, 842 °C, 1548 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கொதிநிலை | 1757 K, 1484 °C, 2703 °F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 8.54 கி.யூல்·மோல்−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 154.7 கி.யூல்·மோல்−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 25.929 யூல்.மோல்−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஆவி அழுத்தம் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | +2, +1[1] (வலிமையான கார ஒக்சைட்டு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 1.00 (பாலிங் அளவையில்) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) |
1வது: 589.8 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2வது: 1145.4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3வது: 4912.4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 197 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 176±10 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 231 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பிற பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | face-centered cubic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 33.6 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 201 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 22.3 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 3810 மீ.செ−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| யங் தகைமை | 20 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நழுவு தகைமை | 7.4 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பரும தகைமை | 17 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.31 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) |
1.75 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பிரிநெல் கெட்டிமை | 167 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS எண் | 7440-70-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: கல்சியம் இன் ஓரிடத்தான் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
குறிப்பிடத்தக்க இயல்புகள்
கல்சியம் வெண்மையான, பளபளப்புடைய ஓரளவிற்கு மிதமான கடினத் தன்மை கொண்ட உலோகமாகும்.[3] தொழில் ரீதியாக கல்சியம் ஆக்சைடை அலுமினியத்துடன் சேர்த்து உருக்கி கல்சியத்தைத் தனித்துப் பிரித்தெடுக்கின்றார்கள். கல்சியம் ஒரு கார மண் உலோகமாகும். உலோக நிலையில் கல்சியம் தனித்துக் காணப்படவில்லை. ஆனால் அதன் கூட்டுப் பொருட்கள் பூமியில் பெருமளவு கிடைக்கின்றன.[4] கல்சியத் தாதுக்கள், கார்போனைட், கால்சைட், அரகோனைட் ஆகவும், மார்பிள், ஐஸ்லாண்டு படிவு, சுண்ணாம்புக்கல்(lime stone), சாக்கட்டி ஆகவும் கிடைகின்றன. சல்பேட்டாக ஜிப்சமாகவும்,புளூரைடாக புளூரோ படிவுகளாகவும் இயற்கையில் காணப்படுகின்றன. இவை தவிர கல்சியம் பாஸ்பேட்டாக எலும்புகளில் உறைந்துள்ளது.[5] இது ஆற்று நீரிலும்,சுனை நீரிலும், எரிமலைக் குழம்பின் வீழ்படிவுப் பாறைகளிலும் சேர்ந்துள்ளது.[6][7]
பூமியின் மேலோட்டுப் பகுதியில் செழுமையின் வரிசையில் கால்சியம் ஐந்தாவதாக உள்ளது. இதன் வேதிக் குறியீடு Ca ஆகும்.இதன் அணு வெண் 20; அணு நிறை 40.08; அடர்த்தி 1550 கிகி/கமீ; உருகு நிலையும் கொதி நிலையும் முறையே 1124 K, 1713 K ஆகும். கால்சியத்தைக் காற்றில் எரிக்கும் போது சிவப்பு ஒளியுடன் எரிந்து ஆக்சைடு மற்றும் நைட்ரைடு கலவையைத் தருகிறது. இது ஆக்சிஜனில் மிகப் பிரகாசமாய் எரிகிறது. இது பெரும்பாலான அலோகங்களுடன் நேரடியாகக் கூடுகின்றது. நீரில் மெதுவாகக் கரைந்தும், அமிலங்களில் விரைந்து கரைந்தும் நைட்ரஜனைத் தருகின்றது.
இது சுண்ணம் புளோரைட்டு (calcium fluoride) என்னும் சேர்வையில் இருந்து மின்னாற்பகுப்பு (electrolysis) மூலம் பிரித்தெடுக்கப்படுகின்றது. இது மஞ்சள்-செம்மை நிறம் கொண்டச் சுடருடன் எரியும். வளியில் திறந்து வைக்கப்படும்போது அதன் மேற்பரப்பில் வெள்ளை நிற நைத்திரைட்டுப் பூச்சொன்று உண்டாகும். நீருடன் தாக்கமுற்று நீரிலுள்ள ஒரு ஐதரசனைப் பிரதியீடு செய்வதன் மூலம் சுண்ணம் ஹைட்ராக்ஸைடு (calcium hydroxide) உருவாக்குகின்றது.
சுண்ணம் தசைகளுக்கும், உறுதியான எலும்புகள், பற்களின் உருவாக்கத்திற்கும் மிகவும் அவசியமானது.[8] அத்துடன், இரத்தம் உறைதல், நரம்பு மண்டலங்களில் கணத்தாக்கக் கடத்துகை, இதயத் துடிப்பை ஒழுங்கு படுத்தல், திசுள்களுக்குள் (cell) திரவச் சமநிலையைப் பேணுதல் போன்றவற்றுக்கும் சுண்ணம் இன்றியமையாதது.[5]
கல்சியத்தைப் பிரித்தெடுத்தல்
1808 ல் மின்னார் பகுப்பு மூலம் தூய கல்சியத்தைப் பிரித்தெடுத்து கண்டுபிடித்த பெருமைக்குரியவர் சர் ஹம்பிரி டேவி என்பாராவர்.[9] சோடியம்,பொட்டசியத்தைக் கண்டுபிடித்ததும் இவரே. கிராபைட்டினால் ஆன தொட்டியில் உருகிய கால்சியம் குளோரைடுடன் எளிதில் உருகுவதற்காக கல்சியம் புளூரைடையும் சேர்த்து,கிராபைட் தொட்டியை நேர்மின் வாயாகவும் இரும்புத் தண்டை உருகிய குழம்பில் அமிழ்த்தி எதிர்மின் வாயாகவும் கொண்டு மின்னார் பகுப்பு செய்வர். அப்போது கல்சியம் இரும்புத் தண்டில் தொடர்ந்து படிக்கிறது. இரும்புத் தண்டை மெல்ல மெல்ல மேலுயர்த்த கல்சியம் உறைந்து ஒரு படிகத் துண்டாக வளர்ச்சி பெறுகிறது. இத் தண்டை ஒட்டி அதன் புறப்பரப்பில் உறைந்துள்ள கல்சியம் குளோரைடு உட்புறத்திலுள்ள கல்சியம் ஆக்ஸிசனேற்றம் பெறுவதைத் தடுக்கிறது. நேர்மின் வாயில் வெளிப்படும் குளோரின் வளிமம் வெளியேறி காற்றோடு கலக்கிறது. இலத்தீன் மொழியில் கால்க்ஸ்(Calx)என்றால் சுண்ணாம்பு என்று பொருள்.[10]
நீரின் கடினத் தன்மை

பெரும்பாலான குடிநீரில் கால்சியம் எதோ ஒரு உப்பாக கரைந்திருக்கிறது. இது நீருக்கு ஒரு கடினத் தன்மையை வழங்கிவிடுகிறது. நீர் கடினத் தன்மை கொண்டிருந்தால் அதில் சோப்பு நுரை தருவதில்லை. கடினத் தன்மையில் இரு வகையுண்டு. தற்காலிகக் கடினத் தன்மை, நிரந்தரக் கடினத் தன்மை. தற்காலியக் கடினத் தன்மை கால்சியம் அல்லது மக்னீசியத்தின்பை கார்பனேட்டுக்களினால் உண்டாகிறது. நீரைக் கொதிக்க வைத்தும் கால்சியம் ஹைட்ராக்சைடு எனப்படும் சுண்ணாம்பு நீரைச் சிறிதளவு சேர்த்தும் இவ்வகைக் கடினத் தன்மையை நீக்கலாம். தேவைக்கு அதிகமாகச் சுண்ணாம்பு நீரைச் சேர்க்கும் போது அது நீரில் கரைந்து மீண்டும் நீருக்குக் கடினத் தன்மையை அளித்து விடுகிறது.
நிரந்தரக் கடினத் தன்மை நீரில் கரைந்துள்ள கால்சியம் அல்லது மக்னீசியத்தின் குளோரைடுகள்மற்றும் சல்பேட்டுகளினால் ஏற்படுகின்றது. நீரில் சோடியம் கார்பொனேட்டைச் சேர்த்து அதில் கரைந்துள்ள கால்சியம் அல்லது மக்னீசிய உப்புக்களைக் கரைவுறா கார்பொனேட்டுகளாக மாற்றி வீழ்படியச் செய்து அகற்றி விடுவார்கள். ஜியோலைட்(zeolite) எனப்படுகின்ற அலுமினோ சிலிகேட்டுகளினாலும் இதைச் செய்ய முடியும். கடின நீர் சலவைக்கும், நீராவிக் கலன்களில் கொதிக்க வைப்பதற்கும் உகந்ததில்லை. சாயத் தொழில்,காகிதம் மற்றும் சக்கரை ஆலைகளுக்கு கடின நீர் பயன் தருவதில்லை.

கால்சியத்தின் கூட்டுப்பொருள்கள்
கால்சியத்தின் கட்டுமானப் பொருட்களான கால்சியம் கார்போனேட் என்ற சுண்ணாம்புக்கல், கால்சியம் ஆக்சைடு என்ற சுண்ணாம்பு, (சுண்ணாம்புக் கல்லைச் சூடு படுத்தக் கிடைப்பது),கால்சியம் ஹைட்ராக்சைடு என்ற நீர்த்த சுண்ணாம்பு, அல்லது சுண்ணாம்பு நீர் (Slaked lime) போன்றவையும், வீடு கட்ட உதவும் காரை (Mortar) (நீர்த்த சுண்ணாம்பும் மணலும் நீரும் கலந்த கலவை), சிமெண்டு, மார்பிள், ஜிப்சம் போன்ற கட்டுமானப் பொருட்களை வழங்கியுள்ளன. மார்பிள், ஜிப்சமும் ஆகியவை கால்சியத் தாதுக்களாகும். மார்பிள் என்பது கால்சியம் கார்போனேட் ஆகும். இது அமிலங்களுக்கு மிகவும் உணர் திறன் கொண்டது . கால்சியம் சல்பேட் டை ஹைட்ரேட்டே ஜிப்சமாகும். இதை 120 டிகிரி C வரை சூடு படுத்த ஜிப்சம் நீரை இழந்து பாதி ஹைட்ரேட்டாக உருமாறுகிறது. இதையே பட்டிச் சாந்து (Plaster of Paris) என்பர். இதை நீருடன் கலக்கும் போது அது அரை மணி நேரத்தில் ஜிப்சமாகத் திடமாக உறைகிறது. சிலைகளுக்கான வார்ப்புகள், வீட்டுச் சுவர் பூச்சு, உட் கூரைகளில் தற்காலிகத் தள வரிசை, எலும்பு முறிவிற்கான மாக்கட்டு போன்றவைகளுக்கு இது பயன் தருகிறது. ஜிப்சம் படிக வடிவில் கிடைக்கும் போது அதை அலாபாஸ்டர் (alabaster)என அழைக்கின்றார்கள். இது ஒளி உட்புகும் தன்மை கொண்டது; சிலை வடிக்கப் பயன்படுகிறது; கண்ணாடியை உலோகத்துடன் இணைப்பதற்கு ஜிப்சம் பயன்படுகிறது. அமோனியம் சல்பேட் என்ற உர உற்பத்தி முறையில் ஜிப்சம் ஒரு மூலப்பொருளாகும்.
கால்சியத்தின் பிற பயன்கள்

சுண்ணாம்புக் கல்லைச் சூடுபடுத்தி உயர் வெப்ப நிலையில் இருத்தி வைத்தால் அது இளம் நீல நிற ஒளியைத் தருகிறது. இதை வெப்ப ஒளிர்தல் (thermo luminescence) என்பர். முற்காலத்தில் இவ்வொளி திரைப் படப்பிடிப்பில் பயன்படுத்தப்பட்டது. சுண்ணாம்புடன் இரும்புத் தாதுவைக் கலந்து வெடிப்புலையில் வைத்து சூடு படுத்துவார்கள். சுண்ணாம்பு வேற்றுப் பொருட்களுடன் சேர்ந்து உருகிய கண்ணாடி போன்ற கசடை உருவாக்குகின்றது. இது உலையின் அடிப்பக்கத்தில் சேருவதால் அதைத் தனித்துப் பிரித்துவிட முடிகிறது. தெளிந்த சுண்ணாம்பு நீரை கார்பன் டை ஆக்சைடு பால் போல் வெண்மையாக்கி விடுகிறது. எனவே கார்பன் டை ஆக்சைடு வளிமத்தின் செழுமையைச் சோதிக்க இது பயன் தருகிறது. இது வெளுப்புக் காரம் உற்பத்தி, தோல் பதனிடுதல், சக்கரை சுத்திகரிப்பு, எரி வளிமம் சுத்திகரிப்பு, கண்ணாடி உற்பத்தி, மென்நீராக்கும் வழிமுறை, சுவர்களுக்கான வெள்ளைப் பூச்சு போன்றவைகளுக்காகப் பயன்படுகிறது.
கால்சியம் குளோரைடு வளிமங்களை வறட்சிப் படுத்தவும், உணவுப் பண்டங்கள் கேட்டுப் போய் விடாமல் பாதுகாக்கும் ஒரு வேதிப் பொருளாகவும் பயன்படுகிறது. கால்சியம் பாஸ்பேட், கால்சியம் சல்பேட் கலவை ஒரு சிறந்த உரமாகும். இது நீரில் கரைவதில்லை. ஆனால் அடர் கந்தக அமிலத்தில் இட்டால் அது சுண்ணாம்பின் சூப்பர் பாஸ்பேட்டாகி விடுகிறது. இது உடனடியாக நீரில் கரையக் கூடியதாக இருப்பதால் தாவரங்களுக்கு உடனடியாகக் கிடைகிறது. கால்சியம் நைட்ரேட் உரம், வெடிகள், தீக்குச்சி, பட்டாசுகள் போன்றவை தயாரிக்கப் பயன்படுகிறது. கால்சியம் புளூரைடு உலோகவியலில் உருக்க வேண்டிய பொருளின் உருகு நிலையைக் குறைக்கப் பயன்படுகிறது.
கால்சியமும் உடல் நலமும்
கால்சிய சத்து எலும்பு மற்றும் பற்களின் வளர்ச்சிக்கும் உறுதிக்கும் தேவை.[8] குழந்தை பெற்ற தாய்மார்களுக்கு பால் சுரக்கவும், இதயத் துடிப்பு மிகவும் துல்லியமாகச் சீராக இருக்கவும், இரத்தம் உறைவதைத் தூண்டி வெட்டுக் காயங்களிலிருந்து இரத்தம் வீணாக வெளியேறுவதைத் தடுக்கவும் இந்த கால்சியம் துணை புரிகிறது. தசைகளின் விரிதல்- சுருங்குதல் இயக்கம், இவ்வியக்கங்களில் சீரான இயக்கம், இதயத் தசையின் நெகிழ்வு, நரம்பு வழிச் செய்திப் பரிமாற்றம் போன்றவற்றிற்கும் கால்சியம் இன்றியமையாததாகும்.[13][14]
வளர் சிதை மாற்ற வினைகளில் கால்சியம்

வளர் சிதை மாற்ற வினைகளிலும் கால்சியம் பங்கேற்றுள்ளது. கால்சியம் உட்கவர்தல் எனபது கால்சியத்தின் செரிமானத்தைப் பொறுத்தது . உணவு செரிக்கப் படும்போது ஊடகத்தின் தன்மை அமில நிலையா அல்லது கார நிலையா என்பதைப் பொறுத்தது. உணவாக உட்கொள்ளப்படும் கூடுதல் பாஸ்பேட்டுகள், கார நிலையில் கரைவுறா டிரை கால்சியம் பாஸ்பேட்டாக மாறி விடுவதாலும், அமில நிலையில் கரைவுறு கால்சியம் பாஸ்பேட்டாக மாறி விடுவதாலும் கால்சியம் செரிமானத்திற்கு அமில நிலையே உகந்தது.[15] எனவே கார நிலையில் குறைந்த அளவு கால்சியம் கூட உடலால் உட்கிரகித்துக் கொள்ளப்படாமல் உபரியாகி விடுகிறது. இவை வெளியேற்றப்படும் போது சிறு நீரகப் பகுதிகளில் கல்லாகப் படியும் வாய்ப்பைப் பெறுகின்றது.[16][17][18] சிறு நீரகக் கல்லில் தாழ்ந்த மூலக்கூறு எடையுடன் கூடிய கால்சியம், ஆக்சிலேட், பாஸ்பேட்டுகள், கார்போனேட்டுகள், யுரேட்டுகள் போன்றவையுள்ளன. உடலில் உபரியான கால்சியத்தை உறிஞ்ச உயிர்ச்சத்து டி தேவை. சிறு நீரகக் கல்லை அறுவைச் சிகிச்சை, சிறு நீரக அகநோக்கி (endoscope) கேளா ஒலி (ultrasonic) போன்றவற்றால் அகற்றிக் கொள்ள முடியும்.
மேற்கோள்கள்
குறிப்புகள்
வெளியிணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.