ஈலியம்
2 ஆம் அணுவெண்ணைக் கொண்ட மூலம் From Wikipedia, the free encyclopedia
ஈலியம் (Helium) அல்லது பரிதியம் அல்லது எல்லியம் என்பது He என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட தனிமமாகும். நிறமற்ற, மணமற்ற, சுவையற்ற, நச்சுத்தன்மையற்ற, கூடிய அளவில் வேதி வினையில் ஈடுபடாத ஒரு வளிமமுமாகும். இத்தனிமம் (மூலகம்) தனிம அட்டவணையில் இரண்டாமிடத்தில் இருக்கிறது. இதன் உருகுநிலையும் கொதிநிலையும் எல்லாத் தனிமங்களை விடவும் குறைவானதாகும்.
| ஈலியம் | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
2He | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||
நிறமற்ற வளிமம், உயர் மின்னழுத்தப்புலத்தில் வைக்கும் போது சிவப்பு-செம்மஞ்சள் ஒளிர்வை வெளியிடுகிறது ஈலியத்தின் நிறமாலைக்கோடுகள் | |||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | ஈலியம், He, 2 | ||||||||||||||||||||||||
| உச்சரிப்பு | /ˈhiːliəm/ HEE-lee-əm | ||||||||||||||||||||||||
| தனிம வகை | நிறைம வளிமம் | ||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 18, 1, s | ||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) |
4.002602(2) | ||||||||||||||||||||||||
| இலத்திரன் அமைப்பு | 1s2 2 | ||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||
| கண்டுபிடிப்பு | P. Janssen & N. Lockyer (1868) | ||||||||||||||||||||||||
| முதற்தடவையாகத் தனிமைப்படுத்தியவர் |
W. Ramsay, P. Cleve & A. Langlet (1895) | ||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||
| நிலை | வளிமம் | ||||||||||||||||||||||||
| அடர்த்தி | (0 °C, 101.325 kPa) 0.1786 g/L | ||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 0.145 g·cm−3 | ||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி கொ.நி.யில் | 0.125 g·cm−3 | ||||||||||||||||||||||||
| உருகுநிலை | (at 2.5 MPa) 0.95 K, −272.20 °C, −457.96 °F | ||||||||||||||||||||||||
| கொதிநிலை | 4.22 K, −268.93 °C, −452.07 °F | ||||||||||||||||||||||||
| மாறுநிலை | 5.19 K, 0.227 MPa | ||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 0.0138 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 0.0829 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||
| வெப்பக் கொண்மை | 5R/2 = 20.786 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||
| ஆவி அழுத்தம் (ITS-90 ஆல் வரையறுக்கப்பட்டது) | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 0 | ||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | no data (பாலிங் அளவையில்) | ||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் | 1வது: 2372.3 kJ·mol−1 | ||||||||||||||||||||||||
| 2வது: 5250.5 kJ·mol−1 | |||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 28 pm | ||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 140 பிமீ | ||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||
| படிக அமைப்பு | hexagonal close-packed | ||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic[1] | ||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 0.1513 W·m−1·K−1 | ||||||||||||||||||||||||
| ஒலியின் வேகம் | 972 மீ.செ−1]] | ||||||||||||||||||||||||
| CAS எண் | 7440-59-7 | ||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: ஈலியம் இன் ஓரிடத்தான் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
இதன் அணு எண் 2. இதுவே அண்டத்தில் மிகுந்து காணப்படும் தனிமங்களில் இரண்டாவது ஆகும். இதுவே நீரியத்திற்கு அடுத்து எளிய அமைப்புக் கொண்ட தனிமமும் ஆகும். பூமியின் கடல் மட்டத்தில் காற்றுமண்டலத்தில் ஈலியம் 6ஆவதாக, நைதரசன், ஒட்சிசன், ஆர்கான், காபனீரொட்சைட்டு, நியானுக்கு அடுத்ததாகச் செறிவுற்றுள்ளது. இதன் செழுமை மில்லியனில் 5.2 பங்குகள் ஆகும். பூமியில் அரிதாகக் கிடைத்தாலும் அண்டப் பெருவெளியில் நீரியத்திற்கு அடுத்து மிகுதியாக இருப்பது ஈலியமாகும். இதன் பங்கு 7%. நீரியமும் ஈலியமும் சேர்ந்து அண்டப் பெருவெளியில் 99.9%ஆக உள்ளது.
வரலாறு
ஈலியம் கண்டறிதல்
பரிதியம் / எல்லியம் / ஈலியம் பூமியில் கண்டுபிடிக்கப்படுவதற்கு முன்னால் அது இருப்பதாக ஒருவாறு உணரப்பட்டது. 1868 ல் பிரான்சு நாட்டின் வானவியலாரான பியர் இழோன்சன் (Pierre Jonsson) என்பார் பிரித்தானிய இந்தியாவில் குண்டூர் பகுதியில் ஏற்பட்ட முழு சூரிய கிரகணத்தைப் பற்றி ஆராய்ந்த போது எதிர்பாராத விதமாக ஒளியுமிழ் நிறமாலை வரிசையில் மஞ்சள் பகுதியில் ஒரு புதிய வரியைக் கண்டார்.[2][3] அது அப்போது கண்டறியப்பட்ட எந்தத் தனிமத்திற்கும் அக்கோடு ஒத்துப் போகவில்லை என்பதால் அவ்வரி புதிய ஒரு தனிமத்தாலோ மூலக்கூறாலோ ஏற்பட்டிருக்க வேண்டும் என்று தீர்மானித்தார்.
அப்போது இங்கிலாந்து நாட்டிலிருந்து வெளி வந்த இயற்கை என்ற அறிவியல் இதழின் ஆசிரியரான லாக்கியர் என்பாரும் பிராங் லாண்டு என்பாரும், இதற்கு ஈலியம் எனப் பெயரிட்டனர்.[4] கிரேக்க மொழியில், எலியோசு என்பது சூரியனைக் குறிக்கும் கடவுளாகும்.[5][6][7]



ஏறக்குறைய 27 ஆண்டுகளுக்குப் பிறகு 1895 ல் இசுகாட்லாந்தின் வில்லியம் இராம்சே (William Ramsay) என்பார், தோரியம், யுரேனியத்தின் ஒரு சில கனிமங்கள் மந்த வளிமங்களை வெளியிடுவதாகக் கண்டறிந்தார். கதிரியக்கத் தனிமங்கள் உமிழ்ந்த மந்த வளிமங்களை நிறமாலைக்கு உட்படுத்த அது ஈலியம் என்று உறுதி செய்தார். அதன் நிறமாலை பியரி இழோன்சன் இனமறிந்த நிறமாலையின் வரிகளோடு ஒத்துப் போயிற்று. பூமியில் ஈலியம் தனிமத்தை முதன் முதலாக உறுதியுடன் அறிவித்ததால், அதை கண்டுபிடித்த பெருமை இராம்சேக்குக் கிடைத்தது.[3][4][8][9][10][11][12][13] 1907 ல் இரதர்போர்டு கதிரியக்கக் கதிர்களைப் பற்றி ஆராய்ந்து அயனியாக்கப்பட்ட ஈலியமும், ஆல்பாக் கதிரும் ஒன்றே என்று நிறுவினார். உண்மையில் ஈலியம் அணுக்கரு என்பதை முதலில் அறியாததால் இதற்கு ஆல்பாத் துகள் எனப் பெயரிட்டார்.
இயற்கை எரி வளிமத்தில் மீதேன் முக்கியமாக இருந்தாலும் அதில் 0.3% ஈலியமாகும். பகுதி காய்ச்சி வடித்தல் மூலம் ஈலியத்தை மீத்தேனிலிருந்து பிரித்தெடுக்கின்றார்கள். பகுதி காய்ச்சி வடித்தலின் நுட்பம், கொதி நிலையில் உள்ள வேறுபாட்டைப் பயன்படுத்தி நீர்மக் கலவையிலிருந்து நீர்மங்களைப் பிரிப்பதாகும் ஈலிய வளிமத்தை எளிதில் குளிர்வூட்டி நீர்மமாக்க முடிவதில்லை. அதன் கொதி நிலை மிகவும் தாழ்ந்த -268.9 பாகை செல்சியசு ஆகும். இது பிற வளிமங்களைக் காட்டிலும் குறைவானது. காற்றைக் குளிர்வூட்டி நீர்மமாக்கும்போது அதிலுள்ள எல்லா வளிமங்களும் நீர்மமாக்கப் பட்டாலும், ஈலியம் மட்டும் நீர்மமாக நிலை மாறாமல் வளிமமாகவே எஞ்சி நிற்கும் ஈலியத்தை இப்படியும் மீட்டுப் பெறமுடியும். 1908 ஆம் ஆண்டில், ஈலியம் முதல் இடச்சு இயற்பியலாளர் எய்க்கு காமர்லிங் ஆன்சு என்பவர் முதன் முதலில் ஒரு கெல்வினுக்கும் குறைவான வெப்பநிலையில் ஈலியத்தைக் குளிர்வித்து நீர்ம ஈலியத்தைப் பெற்றார்.[14]
நிறமாலை மூலம் இன்றைக்கு விண்மீன்களில், குறிப்பாக வெப்ப நிலை மிக்க விண்மீன்களில், ஈலியம் அதிகமுள்ளதாகக் கண்டு பிடித்துள்ளனர். உண்மையில் அங்கு ஈலியம் ஐதரசனை மூலப்பொருளாகக் கொண்டு தொகுப்பாக்கம் (Synthesis) மூலம் உண்டாக்கப்படுகிறது. இது அவற்றின் ஆற்றல் மூலமாக விளங்குகின்றது. உயர் வெப்ப நிலையில் ஏற்படும் இரு விதமான வெப்ப அணுக்கரு வினைகளை "நேர்மின்னி-நேர்மின்னித் தொடர்" (புரோட்டான்-புரோட்டான் தொடர்), என்றும், கார்பன்-நைதரசன் சுற்று என்றும் குறிப்பிடுவர். இதில் நான்கு நேர்மின்னிகள் இணைந்து ஒரு ஈலியம் அணுக்கருவாக மாறுகின்றது. ஐதரசன் குண்டிலும் இவ்வினையே தூண்டப்பட்டு ஆற்றல் வெளிப்படுகின்றது.
பண்புகள்
He என்ற வேதிக் குறியீட்டுடன் கூடிய ஈலியம் இயல்பான சூழலில் வளிமமாக இருக்கின்றது. இதன் அணு வெண் 2, அணு நிறை 4 .003, அடர்த்தி 0.166 கிகி /க மீ .இதன் உறை நிலையும், கொதி நிலையும் முறையே 1.72 K, 4.22 K ஆகும்.
நீர்ம ஈலியம் தாழ்ந்த வெப்ப நிலையில் மற்றொரு நிலை மாற்றம் பெறுகிறது. இதன் லாம்டா நிலை மாற்றம் என்பர். சாதாரண நீர்ம ஈலியத்தை நீர்ம ஈலியம் – I என்றும்,[4] லாம்டா நிலை மாற்றம் பெற்ற நீர்ம ஈலியத்தை நீர்ம ஈலியம் –II என்றும் கூறுவர். 2.174 டிகிரி K வெப்ப நிலையில் நிகழும் இந்த லாம்டா நிலை மாற்றத்தினால் நீர்ம ஈலியத்தின் சுய வெப்பம், பாய் திறன் வெப்பங் கடத்தும் திறன் போன்றவற்றில் முரண்பாடான மாற்றங்கள் ஏற்படுகின்றன நீர்ம ஈலியம் -II, நீரூற்று விளைவு,[15] உயரளவு பாகு நிலைத் தன்மை, கூடுதலான வெப்பங் கடத்தும் திறன் போன்ற வேறுபட்ட பண்புகளைக் கொண்டுள்ளது.[16]
தோற்றமும் உற்பத்தியும்
இயற்கைத்தோற்றம்
பூமியில் அரிதானது என்றாலும் புவியில் அறியப்பட்ட வாயுக்களில் இரண்டாவதாக மிக அதிகமான அளவில் (பேரியான் நிறை அளவில் 23% அளவு) காணப்படுவது ஈலியம் ஆகும் [3]. ஐதரசன் வாயு முதல் இடத்தைப் பிடிக்கிறது. பெரு வெடிப்புக்குப் பின்னர் ஒன்று முதல் மூன்று நிமிடங்கள் வரை பெருவெடிப்பு உட்கரு தொகுப்பு மூலம் பெரும்பாலான ஈலியம் உருவானது. அதனுடைய அளவின் அளவுகள் அண்டவியல் மாதிரிகளின் அளவிடலில் இது பங்களிக்கிறது. விண்மீன்களில், புரோட்டான்-புரோட்டான் சங்கிலி வினைகளைக் கொண்ட ஐதரசன் அணுக்கரு இணைவு மற்றும் கார்பன் நைட்ரசன் ஆக்சிசன் சுழற்சி மூலம் ஈலியம் உருவாகிறது [17]. புவியின் வளிமண்டலத்தில் ஈலியம் வாயுவின் அடர்த்தி ஒரு மில்லியனுக்கு 5.2 பாகங்களை மட்டுமே கொண்டது ஆகும்[18][19]. பூமியின் வளிமண்டலத்தில் பெரும்பாலான ஈலியம் பல செயல்முறைகள் வழியாக விண்வெளிக்கு சென்று விட்டாலும் கூட புதிய ஈலியம் வாயு தொடர்ச்சியாக உற்பத்தியாவதால் குறைவான இந்த அடர்த்தியானது மாறாமல் நிலையாக உள்ளது[18][19]. வளிமண்டலத்தின் ஒரு பகுதியான பூமியின் வெப்ப மண்டலத்தில் ஈலியம் மற்றும் மற்ற இலேசான வாயுக்கள் மிக அதிகமான அளவில் உள்ளன.
கதிரியக்கச் சிதைவு மூலமும் ஈலியம் உற்பத்தியாகிறது. கிளிவெய்ட்டு, பிட்சுபிளண்டு, கார்னோடைட்டு மற்றும் மோனசைட்டு உள்ளிட்ட யுரேனியம், தோரியத்தின் கனிமங்களில் ஈலியம் கலந்து காணப்படுகிறது. ஏனெனில் இவை ஆல்பா கதிர்களை உமிழ்கின்றன. இவ்வழிமுறையில் இக்கற்கோளத்தில் ஆண்டுக்கு 3000 மெட்ரிக் டன் ஈலியம் உற்பத்தியாகிறது [20][21][22]. புவி மேலோட்டில் ஈலியத்தின் அடர்த்தி பில்லியனுக்கு 8 பகுதிகள் ஆகும். கடல் நீரில் ஈலியத்தின் அடர்த்தி பில்லியனுக்கு 4 பகுதிகள் ஆகும். கனிம நீரூற்றுகள், எரிமலை வாயு மற்றும் விண்கல் இரும்பு போன்ற பகுதிகளிலும் ஈலியம் சிறிய அளவில் காணப்படுகிறது. நிலத்தடியில் இயற்கை வாயு சிக்கியிருப்பது போல ஈலியமும் சிக்குகிறது. இதனால் இயற்கை வாயுவில் ஈலியத்தின் அடர்த்தி அதிகமாகும். வர்த்தக ரீதியான பயன்பாட்டுக்குரிய ஈலியம் இயற்கை வாயுவிலிருந்து தயாரிக்கப்படுகிறது. நியூ மெக்சிகோ போன்ற இடங்களில் ஈலியம் வாயுவின் அடர்த்தி மில்லியனுக்கு 5 முதல் 7 பகுதிகள் வரை மாறுபடுகிறது [23][24]. 2011 ஆம் ஆண்டின் கணக்கெடுப்பின்படி உலக ஈலியம் இருப்பு 40 பில்லியன் கனமீட்டர் என மதிப்பிடப்பட்டுள்ளது. இதில் கால் பாகம் கத்தார் மற்றும் ஈரான் நாடுகளில் காணப்படுவதாகவும் மதிப்பீடுகள் தெரிவிக்கின்றன [25]. வட அமெரிக்கா [26] மற்றும் கிழக்கு ஆப்பிரிக்கா [27] போன்ற நாடுகளில் ஈலியம் மேலும் இருப்பு இருக்கலாம் என அறிவிக்கப்பட்டுள்ளது.
நவீன தயாரிப்பு முறைகள்
இயற்கை வாயுவிலிருந்து பின்னக் காய்ச்சி வடித்தல் மூலம் ஈலியம் பேரளவில் தயாரிக்கப்படுகிறது. இயற்கை எரிவாயுவில் ஈலியம் 7% காணப்படுகிறது[28]. ஈலியம் வேறு எந்த தனிமத்தையும் விட குறைவான கொதிநிலையைக் கொண்டிருப்பதால், குறைந்த வெப்பநிலை மற்றும் உயர் அழுத்தத்தில் கிட்டத்தட்ட மற்ற அனைத்து வாயுக்களையும் விட இதை திரவமாக்கலாம். இதன் விளைவாகத் தோன்றும் கச்சா எண்ணெய் படிப்படியாக வெப்பநிலைகள் குறைக்கப்பட்டு ஈலியம் தூய்மையாக்கப்படுகிறது. மீதமுள்ள நைட்ரசன் மற்றும் பிற வாயுக்கள் வாயு கலவையிலிருந்து வீழ்படிவாக்கப்பட்டு வெளியேற்றப்படுகின்றன. கிளர்வூட்டப்பட்ட கரியானது இறுதி சுத்திகரிப்பு படிநிலையாகப் பயன்படுத்தப்படுகிறது, இதன் மூலம் பொதுவாக 99.995% தூய தரம் மிக்க ஈலியம் உருவாகிறது[4]. நியான் ஈலியத்தின் முதன்மையான மாசாக கலந்திருக்கிறது. குளிரூட்டும் முறையில் திரவமாக்கி ஈலியம் இறுதிபடிநிலையில் தயரிக்கப்படுகிறது. சில பயன்பாடுகளுக்கு நீர்ம ஈலியம் அவசியமாகிறது.
பயன்கள்
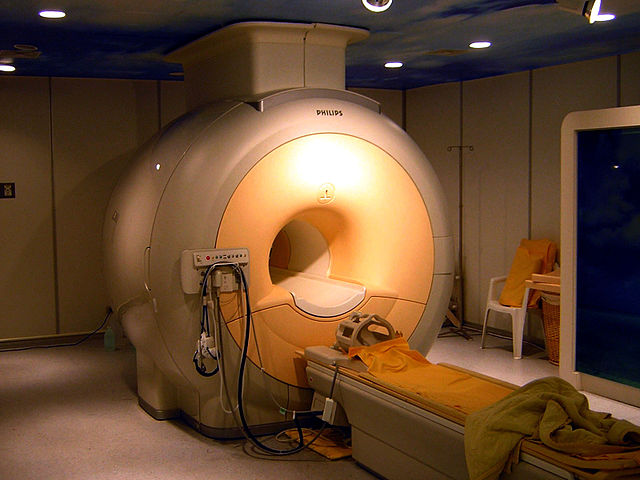
ஈலியம் எல்லாத் தனிமங்களைக் காட்டிலும் மிகத்தாழ்ந்த உறைநிலையைத் தனிச் சுழி வெப்பநிலைக்கு மிக அருகாமையில் கொண்டுள்ளது. அதனால் இது தாழ்ந்த வெப்பநிலை ஏற்படுத்தும் தொழில்நுட்பத்துக்குப் பெரிதும் உதவியாய் இருக்கின்றது.[29]
மீக்கடத்தும் காந்தங்கள் பற்றிய ஆய்வுகளுக்கும்,விண்வெளியில் அணுக் கதிர் ஆய் கருவிகளை குளிர் வூட்டுவதற்கும், தாழ்ந்த வெப்ப நிலை ஆய்வுகளுக்கும், நீர்ம ஈலியம் பயன் தருகிறது.[30] வெப்பஞ் சார்ந்த அதிர்வுகளால் உண்டாகும் தாறுமாறான மின் சமிக்கைகள் (செய்தி தராத வெறும்) இரைச்சலாகக் கருதப்படும். அவற்றை நீர்ம ஈலியம் மூலம் குறைப்பதால் புள்ளி விவரங்களைத் துல்லியமாகப் பெறமுடிகிறது. வெப்பநிலையைத் தனிச் சுழி வெப்பநிலை வரை குறைத்தாலும் வளி மண்டல அழுத்தத்தில் ஈலியம் நீர்மமாக மட்டுமே மாறும், திண்மமாக உறைவதில்லை. செயல்படும் சூழ் அழுத்தத்தை அதிகரித்து இதைச் செய்யமுடியும். இவ் அழுத்தத்தைச் செயல்படுத்தி அதன் பருமன் 30 %. அளவு மாறுபடுமாறு செய்ய முடிகிறது.[31][32]
ஈலியம் இலேசான வளிமமாக இருப்பதாலும், காற்றை விட அடர்த்தி குறைவாக இருப்பதாலும், மந்த வளிமமாக இருப்பதாலும், பலூன்களில் இட்டு நிரப்பி வானவெளியில் பறந்து அதிக உயரங்களில் இருந்து கொண்டு வளி மண்டல ஆய்வுகளை மேற்கொள்ள முடிகிறது. எனினும் ஐதரசனை விட அடர்த்தி மிக்கதாய் இருப்பதால் 98 % மிதவைத் திறனையே ஈலியம் பெற்றுள்ளது.[33]
நீர் நிலைகளில் அதிக ஆழங்களில் உள்ள அதிகமான புற அழுத்தத்தில் செயல்படும் முத்துக்குளிப்பவர்கள் உள்ளிழுக்கும் மூச்சுக் காற்றில் ஆக்சிசன் 20 % உம், ஈலியம் 80 % உம் கலந்திருக்கும். இதில் நைதரசனை நீக்கி விட்டு அதற்குப் பதிலாக ஈலியத்தைச் சேர்த்திருப்பார்கள். ஈலியம், நைதரசனை விடக் குறைவாக நீரில் கரைகிறது.[34][35] அதனால் இரத்தத்திலும் குறைவாகக் கரைந்து உறைகிறது. இது காற்றழுத்த நோயிலிருந்து பாதுகாப்பளிக்கிறது. நீரில் மூழ்கியவர் நீரின் மேற்பரப்பிற்கு வந்தவுடன், தாழ்ந்த அழுத்தத்தினால் இரத்தத்தில் கரைந்த வளிமம் குமிழ்களாக வெளியேறும் (சோடா பாட்டிலின் மூடியைத் திறந்தவுடன் அதில் கரைந்துள்ள காற்று குமிழ்களாக வெளியேறுவதைப் போல) இப்படி உடலுக்குள் வெளியேறும் வளிமம் மூட்டுகளில் உறையும் வாய்ப்பைப் பெறும்.[36][37] இது மூட்டுவலியைத் தரும். இதனால் நீரில் மூழ்கி வேலை செய்வவர்கள் விரைவில் சோர்ந்து விடுவர்.[38]
காற்றை விட அடர்த்தி குறைவான ஈலியத்தை மூச்சிழுப்பதால், குரலின் சுரமும், தரமும் குறிப்பிடும் படியாக மாறிப்போகின்றன. இதனால் திடீரென்று ஒருவர் உரத்த குரலில் பேசுவது போலத் தோன்றும்.[3][39] ஈலியத்தில் ஒலியின் வேகம் காற்றில் இருப்பதை விட 3 மடங்கு அதிகம். அடைக்கப்பட்ட ஒரு வளிமத்தில் அடிப்படை அதிர்வெண் அந்த வளிமத்தில் ஒலியின் வேகத்தைப் பொருத்தது. அதனால் ஈலியத்தை மூச்சிழுக்க குரலின் சுரம் மாறிப் போகிறது.[40][41]
ஈலியத்தின் இணைதிறன் சுழி என்றாலும், இயல்பான சூழலில் அது எவ்விதமான வேதிச் சேர்மத்தையும் தோற்றுவிப்பதில்லை. ஈலியம்-டை-புளூரைடு தோற்றுவிப்பதற்கான ஆய்வுகள் தொடருகின்றன. ஈலியம்-நியான், ஈலிய அயனி மூலக் கூறுகள், He 2 +, மற்றும் He2 ++ போன்றவைகள் கண்டறியப் பட்டுள்ளன. பற்றவைப்பு முறையில், மந்த வெளிச் சூழலை நிறுவ ஈலியம் பயன்படுத்தப்படுகிறது.[29]
இதே காரணத்திற்காக தைட்டானியம் சிர்க்கோனியம் உற்பத்தி முறையிலும், சிலிக்கான், செருமானியம் படிகங்களை வளர்க்கும் வழி முறையிலும் அணு உலைகளில் குளிர்வூட்டியாகவும் ஒலியை விஞ்சும் வேகத்தில் இயங்கும் வானவூர்திகளில் உந்திச் செல்ல பின்னால் எக்கித் தள்ளப்படும் வளிமமாகவும், ஈலியம் பயன்படுகிறது.[42][43]
ஈலியத்தின் மற்றொரு முக்கியமான பயன்பாடு ஈலியம்-நியான் வளிம சீரொளியாகும் (இலேசராகும்).[3] இது அலி சாவன் என்ற அமெரிக்க அறிவியலாளரால் கண்டு பிடிக்கப்பட்டது. ஏறக்குறைய ஒன்றுக்கொன்று நெருக்கமான உயர் ஆற்றல் நிலைகளைக் கொண்ட இரு வளிமங்களுக்கிடையே இடையீட்டுச்செயல் (interaction) காரணமாக கிளர்வூட்டப்பட்ட ஈலியத்தின் செழுமையை அதிகரித்து வளிம ஊடகத்தில் தூண்டல் உமிழ்வை (stimulated emission) ஏற்படுத்த முடிகிறது. இதன் ஒளி, ஓரலைநீளத் தன்மை (Monochromatic) சிதறாமல் நெடுந்தொலைவு கடந்து செல்லுமாறு ஒருதிசை போக்குத்தன்மை (directonality), ஒத்த அலைமுகம் (coherence) இவற்றைப் பெற்றிருந்தாலும் திறன் வெளிப்பாடு மில்லி வாட் நெடுக்கையில் இருக்கின்றது.
ஈலியம்-நியான் சீரொளி கீற்றணி போல பல வரிக்கோடுகளால் சுட்டுக் குறியிடப்பட்ட பொருட்கள், புத்தகங்கள், மாணவர்கள் எழுதும் விடைத் தாள்கள், பல் பொருள் அங்காடியில் விற்பனை செய்யப்படும் பொருட்கள் போன்றவற்றை இனமறியப்பயன்படுகிறது. விளம்பரத் தட்டிகளில் நியான் விளக்குகள் பயன்படுகின்றன, இது விளம்பரத்தை நெடுந்தொலைவு தெரியுமாறு செய்ய உதவுகிறது.
ஈலியம் ஆக்சிசனை இடப்பெயர்வால் நீக்கம் செய்கிறது, அதனால் நச்சுத் தன்மையற்ற ஈலியத்தை தொடர்ந்து சுவாசித்தால், ஆக்சிசன் போதாமையால், உடல் நலம் பாதிக்கப்படவும் மரணமும் நிகழ வாய்ப்புள்ளது.[3][40][44][45]
புறச் சூழல்களாலும் வில்லைகளில் ஏற்படும் வெப்பநிலை மாற்றங்களாலும் ஒளியியல் கருவிகளில் விளையும் பிறழ்ச்சியை ஈலியத்தினால் குறைக்க முடிகிறது.[4] இதற்குக் காரணம் ஈலியம் குறைந்த ஒளிவிலகல் எண்ணைப் பெற்றுள்ளது. இது விண்வெளி ஆய்வுகளுக்காக எடுத்துச் செல்லப்படும் தொலை நோக்கிகளில் பயன்படுத்தப் படுகிறது.[46] வெற்றிடத்துடன் கூடிய தொலை நோக்கிகள் அதிக எடையுள்ளவை என்பதால் அவற்றை விண்வெளிக்கு எடுத்துச் செல்வது உதவியாக இராது.[47]
மீக்கடத்தும் காந்தங்களைக் குளிர்விக்க நீர்ம ஈலியம் பயன்தருகிறது. மீக்கடத்தும் காந்தங்கள் இன்றைக்கு காந்த ஒத்ததிர்வுப் பட (MRI) வரிக் கண்ணோட்டக்கருவிகள்[48] அதி வேக ஒற்றைத் தண்டவாள இரயில் வண்டிகள் , நுண் அளவில் சுருக்கப் பட்ட, மின் காந்தங்களால் செயல்படும் சாதனங்களில் பயன்படுகின்றன.[49],
ஏவூர்திகளில் எரிபொருளாகப் பயன்படும் ஐதரசன் மற்றும் ஆக்சிசனை குளிர்வித்து நீர்ம நிலையில் வைத்துக் கொள்ள ஈலியம் பயன் படுகிறது. யுரேனியமும் தோரியமும் கொண்ட பழம் பாறைப் படிவுகளின் வயதை ஈலியத்த்தால் அளக்க முடிகிறது.[3][4]
மேலும் காண்க
மேற்கோள்கள்
துணை நூல்கள்
வெளியிணைப்புகள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

