இட்ரியம்(III) குளோரைடு
From Wikipedia, the free encyclopedia
இட்ரியம்(III) குளோரைடு (Yttrium(III) chloride) என்பது YCl3 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இட்ரியம் மற்றும் குளோரின் சேர்ந்து உருவாகும் இச்சேர்மம் நீரிலி (YCl3) மற்றும் நீரேற்று (YCl3(H2O)6) ஆகிய இரண்டு வடிவங்களில் காணப்படுகிறது. இரண்டுமே நிறமற்ற திண்மங்களாக தண்ணீரில் நன்றாக கரைந்து நீர்மயமாகின்றன.
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்s
இட்ரியம்(III) குளோரைடு இட்ரியம் முக்குளோரைடு | |
| இனங்காட்டிகள் | |
| 10361-92-9 | |
| ChemSpider | 59696 |
| யேமல் -3D படிமங்கள் | Image |
| வே.ந.வி.ப எண் | ZG3150000 |
| |
| பண்புகள் | |
| YCl3 | |
| வாய்ப்பாட்டு எடை | 195.26 g/mol |
| தோற்றம் | வெண் திண்மம் |
| அடர்த்தி | 2.67 கி/செ.மீ3 |
| உருகுநிலை | 721 °C (1,330 °F; 994 K) |
| கொதிநிலை | 1,507 °C (2,745 °F; 1,780 K) |
| 82 கி/100 மி.லி | |
| கரைதிறன் | 60.1 கி/100 மி.லி எத்தனால் (15 °செ) 60.6 கி/100 மி.லி பிரிடின் (15 °செ)[1] |
| கட்டமைப்பு | |
| படிக அமைப்பு | ஒற்றைச்சரிவு, mS16 |
| புறவெளித் தொகுதி | C12/m1, No. 12 |
| தீங்குகள் | |
| தீப்பற்றும் வெப்பநிலை | எளிதில் தீப்பற்றாது |
| தொடர்புடைய சேர்மங்கள் | |
| ஏனைய எதிர் மின்னயனிகள் | இட்ரியம்(III) புளோரைடு இட்ரியம்(III) புரோமைடு இட்ரியம்(III) அயோடைடு |
| ஏனைய நேர் மின்அயனிகள் | இசுக்காண்டியம்(III) குளோரைடு இலந்தனம்(III) குளோரைடு ஆக்டினியம்(III) குளோரைடு |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
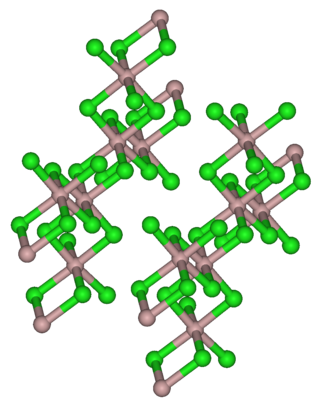
அமைப்பு
திண்மநிலை YCl3 , குளோரைடு அயனிகளின் கனசதுர நெருக்கப் பொதிவு கட்டமைப்பை ஏற்றுள்ளது. இட்ரியம் அயனிகள் எண்முகத் துளைகளின் மூன்றில் ஒரு பங்கு பொதிவை நிரப்புகின்றன. விளைகின்ற YCl6 அடுத்தடுத்த எண்முகத்தின் முனைகளை பகிர்ந்து கொண்டு அடுக்குக் கட்டமைப்பைத் தருகிறது[2] This structure is shared by a range of compounds notably AlCl3.
.இந்தக் கட்டமைப்பு பெரும்பாலான சேர்மங்களால் , குறிப்பாக AlCl3 சேர்மத்தால் பகிர்ந்து கொள்ளப்படுகிறது.
தயாரிப்பு மற்றும் வினைகள்
பெரும்பாலும் அமோனியம் குளோரைடு வழியாகத்தான் YCl3 தயாரிக்கப்படுகிறது. இவ்வினையின் தொடக்கம் Y2O3 அல்லது நீரேற்ற குளோரைடு அல்லது ஆக்சிகுளோரைடு [3][4] அல்லது YCl3•6H2O. இவற்றில் ஒன்றிடமிருந்துதான் தொடங்குகிறது. இம்முறைகளில் (NH4)2[YCl5]:சேர்மம் தயாரிக்கப்படுகிறது.
- 10 NH4Cl + Y2O3 → 2 (NH4)2[YCl5] + 6 NH3 + 3 H2O
- YCl3·6H2O + 2 NH4Cl → (NH4)2[YCl5] + 6 H2O
இப்பென்டாகுளோரைடு வெப்பத்தால் பின்வருமாறு சிதைவடைகிறது.இவ்வெப்ப முறிவு வினை (NH4)[Y2Cl7]என்ற இடைநிலையின் வழியாக மேலும் தொடர்கிறது.
- (NH4)2[YCl5] → 2 NH4Cl + YCl3
Y2O3 உடன் நீர்க்கரைசலான HCl சேர்த்து வினைப்படுத்தினால் நீரேற்ற குளோரைடை YCl3· 6H2O உற்பத்தி செய்கிறது.[5] இவ்வுப்பைச் சூடுபடுத்தினால் இது நீரிலியைக் கொடுப்பதில்லை, மாறாக ஓர் ஆக்சி குளோரைடைக் கொடுக்கிறது.(NH4)2[YCl5]:
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.