இருகுளோரின் ஏழாக்சைடு
From Wikipedia, the free encyclopedia
இருகுளோரின் ஏழாக்சைடு (dichlorine heptoxide, டைகுளோரின் எப்டாக்சைடு) என்பது Cl2O7 என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு கனிம வேதியியல் சேர்மமாகும். இது பெர்குளோரிக் அமிலத்தின் நீரிலியாகும். பாசுபரசு ஐந்தாக்சைடு முன்னிலையில் பெர்குளோரிக் அமிலத்தை கவனமாகக் காய்ச்சி வடித்து இருகுளோரின் ஏழாக்சைடைத் தயாரிக்கலாம்.:[1]
- 2 HClO4 + P4O10 → Cl2O7 + H2P4O11
 | |
 | |
| பெயர்கள் | |
|---|---|
| ஐயூபிஏசி பெயர்
டைகுளோரின் எப்டாக்சைடு | |
| வேறு பெயர்கள்
குளோரின்(VII) ஆக்சைடு; பெர்குளோரிக் நீரிலி; (பெர்குளோரைலாக்சி)குளோரேன் மூவாக்சைடு | |
| இனங்காட்டிகள் | |
| 10294-48-1 | |
| ChEBI | CHEBI:52356 |
| ChemSpider | 109884 |
| யேமல் -3D படிமங்கள் | Image |
| பப்கெம் | 123272 |
| |
| பண்புகள் | |
| Cl2O7 | |
| வாய்ப்பாட்டு எடை | 182.901 கி/மோல் |
| தோற்றம் | நிறமற்ற எண்ணெய் |
| அடர்த்தி | 1900 kg m−3 |
| உருகுநிலை | −91.57 °C (−132.83 °F; 181.58 K) |
| கொதிநிலை | 82 °C (180 °F; 355 K) |
| தீங்குகள் | |
| முதன்மையான தீநிகழ்தகவுகள் | ஆக்சிசனேற்றி, தொடுகையில் வெடிக்கும் [1] |
மாறுதலாக ஏதும் சொல்லவில்லை என்றால் கொடுக்கப்பட்ட தரவுகள் யாவும் பொருள்கள் அவைகளின் இயல்பான வெப்ப அழுத்த நிலையில் (25°C, 100kPa) இருக்கும். | |
இறுதி விளை பொருள் கலவையில் இருந்து இச்சேர்மத்தை வடித்துப் பிரிக்கலாம்.
குளோரின் மற்றும் ஓசோன்[2] கலந்த கலவையை ஒளியூட்டுவதாலும் இருகுளோரின் ஏழாக்சைடு தயாரிக்க முடியும். பின்னர் இது மெல்ல நீராற்பகுப்பு அடைந்து பெர்குளோரிக் அமிலமாக மீள்கிறது. நீரிலியாக இருக்கும் போது பெர்குளோரிக் அமிலமும் ஒரு நச்சாகவே இருக்கிறது.
அமைப்பு
இருகுளோரின் ஏழாக்சைடு ஒரு வெப்பங்கொள் மூலக்கூறாகும். அதாவது உள்ளார்ந்த முறையில் இது நிலைப்புத் தன்மை அற்றதாகக் காணப்படுகிறது.
- 2 Cl2O7 → 2 Cl2 + 7 O2 (ΔH = −135 kJ/mol)
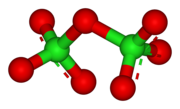
Cl2O7 வளைந்த Cl-O-Cl மூலக்கூறு அமைப்புடன் பிணைப்புக் கோணம் 118.6° அளவைக் கொண்டு C2 சீரொழுங்குள்ள மூலக்கூறு அமைப்புடன் காணப்படுகிறது. விளிம்பு நிலை Cl-O பிணைப்புகளின் நீளம் 1.709 Å ஆகவும் மற்றும் Cl=O பிணைப்பின் பிணைப்பு நீளம் 1.405 Å [1] ஆகவும் உள்ளது. இச்சேர்மத்தில் சகப்பிணைப்பு இருந்தபோதிலும் குளோரின் அதனுடைய அதிகபட்ச ஆக்சிசனேற்ற நிலை எண் +7 இல் காணப்படுகிறது.
வேதியியல்
கார்பன் நாற்குளோரைடு கரைசலில் உள்ள முதல்நிலை மற்றும் இரண்டாம்நிலை அமீன்களுடன் இருகுளோரின் ஏழாக்சைடு வினைபுரிந்து N- பெர்குளோரைல்களைக் கொடுக்கிறது.:[3]
- 2 RNH
2 + Cl
2O
7 → 2 RNHClO
3 + H
2O - 2 R
2NH + Cl
2O
7 → 2 R
2NClO
3 + H
2O
ஆல்க்கீன்களுடனும் வினைபுரிந்து ஆல்க்கைல் பெர்குளோரேட்டுகளைத் தருகிறது. உதாரணமாக இது கார்பன் நாற்குளோரைடில் உள்ள புரோப்பீனுடன் வினைபுரிந்து ஐசோபுரோபைல் பெர்குளோரேட்டு மற்றும் 1-குளோரோ-2-புரோபைல் பெர்குளோரேட்டுகளைத் தருகிறது.[4]
இருகுளோரின் ஏழாக்சைடு ஓரு வலிமையான அமில ஆக்சைடாகும். கரைசலில் இது பெர்குளோரிக் அமிலத்துடன் சமநிலை கொண்டுள்ள சேர்மமாக உருவாகிறது.
பாதுகாப்பு
அதிக நிலைப்புத் தன்மை கொண்ட சேர்மமாக இருந்தபோதிலும் இருகுளோரின் ஏழாக்சைடு ஒரு வலிமையான ஆக்சிசனேற்றியாகவும் தீச்சுவாலை அல்லது சிறு அதிர்வு அல்லது அயோடினுடன் தொடர்பு ஆகியவற்றால் வெடிக்கும் தன்மையைப் பெறுகிறது. பிற குளோரின் ஆக்சைடுகளைவிட குறைவாகவே ஆக்சிசனேற்றம் அடைவதால், இது கந்தகம், பாசுபரசு அல்லது காகிதம் ஆகியவை ஈரமாக இருக்கும் போது அவற்றைப் பாதிப்பதில்லை. குளோரின்[5] மனிதனுக்கு உண்டாக்கும் தீங்குகள் அனைத்தையும் இதுவும் உண்டாக்குகிறது. எனவே குளோரினுக்கு எடுக்க வேண்டிய பாதுகாப்பு நடவடிக்கைகள் அனைத்தும் இதற்கும் அவசியாமாகும்.[6]
மேற்கோள்கள்
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
