From Wikipedia, the free encyclopedia
Јаглерод (од латински: carbo "јаглен") — хемиски елемент со симбол C и атомски број 6. Тој е неметал и тетравалнетен—составен од четири електрони со кои се формираат ковалентни хемиски врски. Тој припаѓа на група 14 од периодичниот систем.[14] Три негови изотопи се сретнуваат во природата, 12C и 13C кои се стабилни, додека 14C е радионуклид, кој има рок на распаѓање од околу 5,730 години.[15] Јаглерод е едно од неколкуте елементи, кои биле познати уште од античко време.[16]
 Најпознати алотропи на јаглеродот: графит (лево) и дијамант (десно) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Спектрални линии на јаглеродот | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Општи својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име и симбол | јаглерод (C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Изглед | графит: црн дијамант: безбоен | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Алотропи | графит, дијамант | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Јаглеродот во периодниот систем | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски број | 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Стандардна атомска тежина (Ar) | 12,011[1] (12,0096–12,0116)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Категорија | повеќеатомски неметал, понекогаш се смета за металоид | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Група и блок | група 14 (јаглеродна), p-блок | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Периода | II периода | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронска конфигурација | [He] 2s2 2p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
по обвивка | 2, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Физички својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза | цврста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Точка на сублимација | 3915 K (3642 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Густина близу с.т. | аморфен: 1,8–2,1 г/см3[3] графит: 2,267 г/см3 дијамант: 3,515 г/см3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Тројна точка | 4600 K, 10,800 kPa[4][5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлина на топење | графит: 117 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Моларен топлински капацитет | графит: 8,517 J/(mol·K) дијамант: 6,155 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Атомски својства | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Оксидациони степени | +4, +3,[6] +2, +1,[7] 0, −1, −2, −3, −4[8] (благо кисел оксид) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електронегативност | Полингова скала: 2,55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Енергии на јонизација | I: 1086,5 kJ/mol II: 2352,6 kJ/mol II: 4620,5 kJ/mol (повеќе) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентен полупречник | sp3: 77 pm sp2: 73 pm sp: 69 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ван дер Валсов полупречник | 170 пм | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Разни податоци | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | графит: проста шестаголна (црн) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Кристална структура | дијамантска коцкеста | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Брзина на звукот тенка прачка | дијамант: 18,350 м/с (при 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинско ширење | дијамант: 0,8 µм/(m·K) (при 25 °C)[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Топлинска спроводливост | графит: 119–165 W/(m·K) дијамант: 900–2300 W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Електрична отпорност | графит: 7,837 µΩ·m[10] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Магнетно подредување | дијамагнет[11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на растегливост | дијамант: 1050 GPa[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на смолкнување | дијамант: 478 GPa[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Модул на збивливост | дијамант: 442 GPa[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поасонов сооднос | дијамант: 0,1[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Мосова тврдост | графит: 1–2 дијамант: 10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-број | 7440-44-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Историја | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Откриен | старите Египќани и Сумерци[12] (3750 г. п.н.е.) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Препознаен како елемент од | Антоан Лавоазје[13] (1789) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Најстабилни изотопи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Јаглерод е петнаесеттиот најзастапен елемент во Земјината кора, а четвртиот најзастапен елемент во универзумот со маса по водород, хелиум, и кислород. Јаглеродот е насекаде, својата застапеност кај органските соединенија, и својата необична способност да формира полимери овозможува овој елемент да служи како заеднички елемент на се она што е живо. Јаглерод е вториот најзастапен елемент во човечкото тело со маса (за 18.5%) по кислород.[17]
Атомите на јаглерод можат да се поврзат на различни начини. Супстанците кои се формираат се нарекуваат алтропи на јаглерод. Најпознати се графит, дијамант, и аморфниот јаглерод.[18] Физичките својства на јаглеродот варираат од формата на алтропот. На пример, графит е нетранспарентен и црн додека дијамантот е проѕирен. Графитот е доволно мек за да остаи трага на хартија (оттука потекнува неговото име, од грчкиот глагол "γράφειν" што значи "да напишеш"), додека дијамантот е најјакиот природен материјал кој му е познат на човекот. Графит е добар електричен спроводник додека дијамантот има ниска електрична спроводливост. Во нормални услови, дијамантот, јаглеродните наноцевки, и графенот ја имаат највисоката топлинска спроводливост. Сите јаглеродни алтропи се цврсти супстанци во нормални услови, каде што графитот е нај термодинамички стабилна форма при стандардна температура и притисок. Тие се хемиски отпорни и бараат висока температура да реагираат дури и со кислород.
Најчестите оксидациска состојба на јаглерод во неоргански соединенија е +4, додека со +2 е присутен во јаглерод моноксид и комплексите на преоден метал карбонил. Најголемите извори на неоргански јаглерод се варовникот, доломити и јаглерод диоксид, но и значителни количества се сретнуваат во органски депозити на јаглен, тресет и масло. Јаглерод формира голем број на соединенија, повеќе од било кој друг елемент, со речиси десет милиони соединенија,[19] а тој број е дел од бројот на теоретски можни соединенија под стандардни услови. Поради оваа причина, јаглерод често се нарекува "крал на елементи".[20]

Алтропите на јаглерод вклучуваат графит, еден од најмеката позната супстанца, и дијамант, најјаката природна супстанција. Јаглеродот се сврзува лесно со други помали атоми, вклучувајќи и други атоми јаглерод, и е способен да формира повеќе стабилни ковалентни врски со соодветен мултивалентен атом. За јаглерод е познато дека формира скоро десет милиони различни соединенија, голем дел од сите хемиски соединенија. Јаглерод, исто така, има највисока точка на сублимација од сите елементи. Во атмосферскиот притисок тој нема точка на топење, тројна точка му е помеѓу 10.8 ± 0.2 MPa и 4,600 ± 300 K (~4,330 °C или 7,820 °F), па тоа сублимира на околу 3,900 К.[21][22] Графит е многу по реактивен отколку дијамантот во стандардни услови, и покрај тоа што е повеќе термодинамички стабилен. На пример, графит може да се оксидизира со топла концентрирана азотна киселина во стандардни услови во мелитичка киселина, В6(CO2H)6, која ги зачувува шестаголните единици на графитот додека ја растура поголемата структура.[23]
Јаглеродот сублимира во јаглеродниот лак, кој има температура од околу 5800 К (5,530 °C или 9,980 °F). На тој начин, без оглед на својата алтрописка форма, јаглеродот останува цврст на повисоки температури од највисоките точки на топење на метали, како што се волфрам или рениум. Иако термодинамички подложен на оксидација, јаглеродот е по отпорен на оксидација отколку елементи како железо и бакар, кои се послаби при намалување на агенти на собна температура.
Јаглерод е шестиот елемент, со електронска конфигурација на 1s22s22p2, од кои четрите надворешни електрони се валентните електрони. Неговите први четири јонизациски енергии, 1086.5, 2352.6, 4620.5 и 6222.7 kJ/mol, се многу повисоки од оние на потешките елементи од група-14. Електронегативноста на јаглерод е за 2,5, значително повисоки од елементите на потешката група-14 (1.8–1.9), но блиску до електронегативноста на повеќето од околните неметали, како и некои од вториот и третиот ред на преодните метали. Јаглеродниот ковалентен полупречник е околу 77.2 pm (C−C), 66.7 pm (C=C) и 60.3 pm (C≡C), иако овие може да варираат во зависност од координатниот број и оној елемент со кој е сврзан. Во принцип, ковалентниот полупречник се намалува со пониски координациски број и високиот редослед на врски.[24]
Соединенијата на јаглерод ја формираат основата на животот на Земјата, и јаглерод–азотниот циклус го обезбедува делот на енергијата произведена од Сонцето и другите ѕвезди. Иако формира голем број различни соединенија, повеќето форми на јаглерод се релативно нереактивни во нормални услови. Во стандардна температура и притисок, тоа е отпорен на сите, освем на најсилните оксидирачи. Не реагира со сулфурна киселина, хлороводородна киселина, хлор или било кои бази. При повишени температури, јаглерод реагира со кислород при што се формира јаглеродни оксиди и ќе земат кислород од металните оксиди и ќе го остави само елементарниот метал. Оваа екзотермична реакција се користи во железната и челичната индустрија при топење на железо и за да ја контролира содржината на јаглерод во челик:
Јаглерод моноксидот може да се рециклира за да се стопи повеќе железо:
со сулфур се формира јаглерод дисулфид и со пареа во јаглен-гас реакција:
Јаглерод се комбинира со некои метали на високи температури и формира метални карбиди, како што е железниот карбид цементит во челикот и волфрам карбид,што се користи како абразив и при правење цврсти врвови за алатки.
Системот на јаглеродни алтропи опфаќа голем број екстремни вредности:
| Графит е еден од најмеките материјали. | Синтетичкиот нанокристалински дијамант е најцврст материјал познат на човекот.[25] |
| Графитот е многу добрп мазиво.[26] | Дијамантот е крајно абразивен. |
| Графитот е проводник на електрична енергија.[27] | Дијамантот е одличен електричен изолатор,[28] и го има најголемиот пад на електричното поле од било кој друг познат материјал. |
| Некои форми на графит се користат за термоизолација, но некои други форми се добри топлински проводници. | Дијамантот е најдобриот природен топлински проводник |
| Графитот е нетранспарентен. | Дијамантот е многу транспарентен. |
| Графитот кристализира во шестаголен систем.[29] | Дијамантот кристализира во кубен систем. |
| Аморфниот јаглерод е целосен изотоп. | Јаглеродните наноцевки се нај анисотропски од сите други познати материјали. |
Атомскиот јаглерод е многу краткотраен вид и, според тоа, јаглеродот се стабилизирана во различни мулти-атомски структури со различни молекуларни конфигурации наречени алотропи. Три најпознати алтропи на јаглерод се аморфниот јаглерод, графит и дијамантот. Порано познати како редки и егзотични, фулирените, во денешно време најчесто се синтетизираат и да се користат во истражувања; тие вклучуваат бакминстерфулеренот,[30] јаглеродната наноцевка,[31] јаглерод нанобуди[32] и нановлакната.[33][34] Неколку други егзотични алотропи, исто така, биле откриени, како што е стаклениот јаглерод, јаглеродната нанопена[35] и линеарниот ацетилен јаглерод (карбин).[36]
Графенот е дво-димензионална површина од јаглерод со атоми наредени во шестаголни решетки. Од 2009 година, графинот станува најсилниот материјал кој некогаш бил тестиран.[37] Неговиот процес на одделување од графитот бара некои понатамошен технолошки развој пред да стане економичен при индустриски процеси.[38] Ако е успешен, графинот би можел да се користи при изградба на вселенски лифт. Тој исто така може да се користи за безбедно чување на водородот во мотори кои користат водород.[39]

Аморфната форма е составена од јаглеродот атоми во не-кристалиран, нерегулирана, стаклена состојба. Присутен е како прав, и е главен составен дел на супстанциите, како што се јаглен, саѓа и активиран јаглен. При нормални притисоци, јаглеродот добива форма на графит, во кој секој атом се поставува триагонално со три други во рамнина составена од споени шестаголни прстени, исто како оние во ароматичните јаглеводороди.[40] како резултат од тоа, мрежата е 2-димензионална, а поради тоа рамнините се поврзуваат со слаби врски наречени van der Waals-ови сили. Ова му ја дава на графитот својата мекост и неговите својства за расцепување (графитните листови се лизгаат лесно еден со друг). Поради делокализација на еден од надворешните електрони од секој атом, се формира π-облак, графитот спроведува електрична енергија, но само во областа на секоја ковалентно сврзана рамнина. Ова резултира во помала електрична спроводливост на јаглерод отколку на другите метали. Делокализацијата исто така ја создва енергетската стабилност на графитот кој е поголем од оној на дијамантот на собна температура.
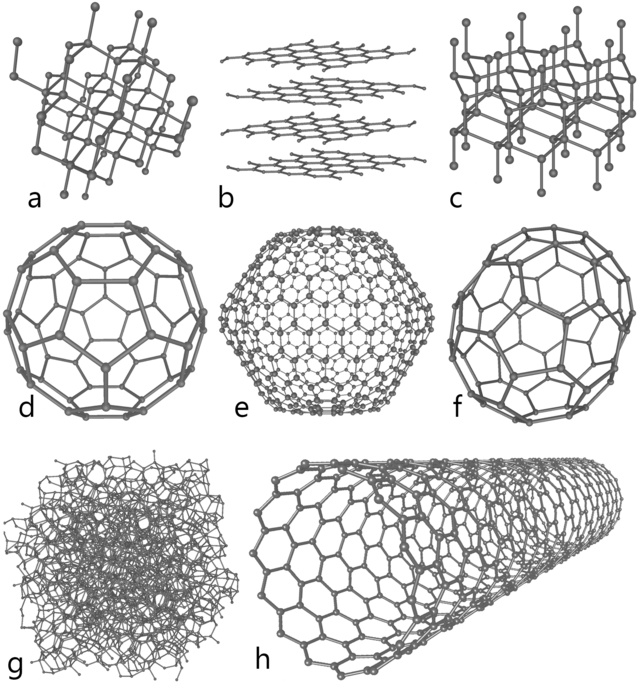
На многу висок притисок, јаглеродот формира на повеќе компактниот алтроп, дијамант, со речиси двапати поголема густина од графит. Тука, секој атом е да поставен тетраголно со четири други, формира 3-димензионална мрежа со прстени составени од шест атоми. Дијамантот има иста кубни структура како и силициумот и германиумот, и поради силата на јаглерод-јаглерод врските, тоа е една од најјаките природни супстанци со најголема отпорност на гребење. Спротивно на верувањето дека "дијамантите се засекогаш", тие се термодинамички нестабилни (ΔfG°(дијамант, 298 K) = 2.9 KJ/mol[41]) под нормални услови (298 K, 105 Pa) и се трансформира во графит. Поради високата енергија на активација, транзицијата во графит е толку бавен процес во нормална температура што не се забележува и е минимален. Долниот лев агол на дијаграмот за јаглерод не е прегледан експериментално. Сепак, едно неодамнешно компјутерско истражување на функционална теорија за густина, стигнало до заклучок дека T → 0 K и p → 0 Pa, дијамантот станува се постабилен од графит со околу 1.1 kJ/mol разлика.[42] Под некои услови, јаглеродот кристализира како јонски далеит, а шестаголните кристални решетки се сплотени ковалентно со другите атоми и својствата се слични со оние на дијамантот.
Фулирените се синтетички кристални формации со структури како графитот, но на местото на шестаголниците, фулирените се формираат со пентагони (или дури и хептагони) на јаглеродните атоми. Вишокот или оние атоми кои фалат ги искривуваат на ранините во сфери, елипси, или цилиндри. Својствата на фулеринот (поделен на бакитопки, бакицевки, и нанобуди) сè уште не е целосно анализирана областа на наноматеријалите. Имињата "фулирен" и "бакбалс" се дадени од страна на Бакминистер Фулер , популаризирач на геодецичките куполи, кои потсетуваат на структурата на фулерините. Бакибалс има прилично големи молекули формирани целосно од јаглероди врзани триагонално, формирајќи сфероиди (најпознат и наједноставниот е обликот C60 бакминстерфулерин). Јаглеродните наноцевки се структурно слични на бакибалс, освен дека секој атом е да е поставен триагонално во крива рамнина која формира шуплив цилиндар. Наноцевките за првпат биле пријавени во 2007 година и се хибридни баки цевки/ бакицевки (бакибалс се ковалентно сврзани на надворешниот ѕид на наноцевките) кои ги комбинираат својствата на двете во една структура.
Од други откриени алотопи, јаглерод нанопената е феромагнетички алотроп откриен во 1997 година. Тој се состои од кластер на јаглеродни атоми со ниска густина нанижани во една лабава три-димензионална мрежа, во која атомите се сврзани триагоналнно во шест и седум-делни прстени. Тој е најлесната позната супстанца, со густина од околу 2 кг/m3.[43] на Сличен начин, стаклениот јаглерод содржи висок процент на порозност, но, спротивно на нормалниот графит, графитните слоеви не се рангирани како страници во книга, но имаат по неорганизиран редослед. Линеарниот ацетилен јаглерод ја има хемиската структура −(C:::C)n−. Јаглерод во оваа модификација е линеарен со sp орбитална хибридизација, и е полимер со наизменични единечни и тројни врски. Овoј карбин е важен за нанотехниката , бидејќи нејзиниот модул на Јанг е 40 пати поголем од таа на најцврстиот материјал – дијамантот.[44]
Во 2015 година, тимот во Државниот Универзитет во Северна Каролина најави развој на друг алотроп кој го нарекле П-јаглерод, создаден со ласерски пулс со висока енергија мало времетраење врз аморфна јагленова прашина. П-јаглерод прикажувал својства на феромагнетизам, флуоресценција, и цврстина супериорна во однос на дијамантот.[45]



Јаглерод е четвртиот најзастапен хемиски елемент во универзумот по водород, хелиум, и кислород. Јаглеродот е изобилство на Сонцето, ѕвездите, кометите, и во атмосфери на повеќето планети. Некои метеорити содржат микроскопски дијаманти кои биле формирани кога сончевиот Систем бил уште протопланетарен диск.[46] Микроскопски дијаманти, исто така може да се формираат со интензивен притисок и висока температура на мастата каде паѓа метеорот.[47]
Во 2014 година НАСА објавила унапредена база на податоци за следење на полициклистичките ароматични јаглеводороди (PAHs) во универзумот. Повеќе од 20% јаглерод во вселената може да биде PAH, комплексни соединенија на јаглерод и водород без кислород.[48] Овие соединенија поседуваат хипотеза дека имаат улога во абиогенезата и започнувањето на живот. PAHs се претпоставува дека да се формирале "неколку милијарди години" по Биг Бенг, тие се широко распространети низ универзумот, и се во врска со нови ѕвезди и егсопланети.[49]
Се проценува дека земјата како целина содржи 730 ppm јаглерод, со 2000 ppm во јадрото и 120 ppm во плаштот и кората.[50] Со оглед на тоа дека масата на земјата е 5.972×1024 кг, ова значи дека има 4360 милиони гигатони јаглерод. Ова е многу повеќе од износот на јаглерод во океаните или атмосферата (подолу).
Во комбинација со кислород во јаглерод диоксид, јаглеродот се наоѓа и во Земјината атмосфера (околу 810 гигатони јаглерод) и растворен во сите водни басени (околу 36,000 гигатони на јаглерод). Околу 1,900 гигатони на јаглерод се наоѓаат во биосферата. Јаглеводороди (како што се јаглен, нафта и природен гас), содржат јаглерод, како и. Јагленските "резерви" изнесуваат околу 900 гигатони со околу 18,000 Gt ресурси.[51] Нафтените резерви се околу 150 Gt. Докажани извори на природен гас се околу 175×1012 кубни метри (содржат околу 105 Gt јаглерод), но истражувањата покажале други 900×1012 кубни метри "неконвенционални" депозити како што шкрилци гас, знесуваат околу 540 Gt јаглерод.[52]
Јаглеродот е, исто така, застапен во метан хидрати во поларните региони и под морето. Различни проценки естимираат помеѓу 500, 2500 Gt,[53] или 3,000 Gt јаглерод.[54]
Во минатото, количините на јаглеводороди биле поголеми. Според еден извор, во периодот од 1751 до 2008 година, 347 Gt јаглерод биле испуштени како јаглерод диоксид во атмосферата од согорување на фосилни горива.[55] Друг извор костатира дека износот за периодот од 1750 е 879 Gt, и вкупниот јаглерод заедно во атмосферата, морето и земјата е речиси 2,000 Gt.[56]
Јаглерод е составен дел (околу 12% од масата) на карбонат каменот (варовник, доломит, мермер). Јагленот е многу богат со јаглерод (антрацитот содржи 92-98%)[57] и е најголем комерцијален извор на минерален јаглерод, кој дава 4,000 Gt или 80% од фосилните горива.[58]
Изотопите на јаглерод се атомски јадра кои содржат шест протони плус голем број на неутрони (варираат од 2 до 16). Јаглеродот има две стабилни, природни изотопи. Изотопот јаглерод-12 (12C) застапува 98.93% од јаглеродот на Земјата, додека јаглерод-13 (13C) ги застапува останатите 1.07%. Концентрацијата на 12C е поголема во биолошките материјали, бидејќи биохемиските реакции го дискриминираат 13C.[59] Во 1961 година, Меѓународниот сојуз за чиста и применета хемија (IUPAC) го усвоила изотопот јаглерод-12 како основа за атомска тежина.[60] Идентификацијата на јаглеродот во експерименти за јадрената магнетна резонанца (NMR) се прават со изотопот 13C.
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.