Սպիտակուցներ
բարձրմոլեկուլային օրգանական նյութ From Wikipedia, the free encyclopedia
Սպիտակուցներ (պրոտեիններ, պոլիպեպտիդներ[Ն 1]), բարձրամոլեկուլային օրգանական միացություններ, որոնք կազմված են պեպտիդային կապով իրար միացած ալֆա-ամինաթթուներից։ Կենդանի օրգանիզմներում սպիտակուցների ամինաթթվային հաջորդականությունը որոշվում է գենետիկական կոդով, սինթեզելիս հիմնականում օգտագործվում է ամինաթթուների 20 տեսակ։ Ամինաթթուների տարբեր հաջորդականություններն առաջացնում են տարբեր հատկություններով օժտված սպիտակուցներ։ Ամինաթթվի մնացորդները սպիտակուցի կազմում կարող են ենթարկվել նաև հետատրանսլյացիոն ձևափոխությունների, ինչպես բջջում ֆունկցիայի իրականացման ժամանակ, այնպես էլ մինչև ֆունկցիայի իրականացումը։ Հաճախ կենդանի օրգանիզմներում սպիտակուցի երկու տարբեր մոլեկուլներ միանում են միմյանց՝ առաջացնելով բարդ սպիտակուցային կոմպլեքսներ, ինչպիսին, օրինակ, ֆոտոսինթեզի սպիտակուցային կոմպլեքսն է։

Կենդանի օրգանիզմներում սպիտակուցների գործառույթները բազմազան են։ Սպիտակուց ֆերմենտները կատալիզում են օրգանիզմում ընթացող կենսաքիմիական ռեակցիաները և կարևոր դեր են խաղում նյութափոխանակության մեջ։ Որոշ սպիտակուցներ կատարում են կառուցվածքային և մեխանիկական գործառույթ՝ առաջացնելով բջջային կմախքը։ Սպիտակուցները կարևոր դեր են կատարում նաև բջիջների ազդանշանային համակարգում, իմունային պատասխանում և բջջային ցիկլում։
Սպիտակուցները մարդու և կենդանիների սննդի կարևոր մասն են կազմում (միս, թռչնամիս, ձուկ, կաթ, ընկուզեղեն, ընդավոր, հացահատիկային բույսեր), քանի որ այս օրգանիզմներում սինթեզվում է միայն անհրաժեշտ սպիտակուցների մի մասը։ Մարսողության գործընթացում սննդի մեջ պարունակվող սպիտակուցները քայքայվում են մինչև ամինաթթուներ, որոնք հետագայում օգտագործվում են սպիտակուցի կենսասինթեզում՝ օրգանիզմի սեփական սպիտակուցների սինթեզի համար, կամ քայքայման գործընթացը շարունակվում է էներգիա ստանալու համար։
Սեքվենավորման մեթոդով առաջին սպիտակուցի՝ ինսուլինի ամինաթթվային հաջորդականության բացահայտման համար Ֆրեդերիկ Սենգերը 1958 թվականին ստացավ Նոբելյան մրցանակ քիմիայի բնագավառում։ Ռենտգենային ճառագայթների դիֆրակցիայի մեթոդով 1950-ական թվականներին առաջին անգամ ստացվել է հեմոգլոբինի և միոգլոբինի եռաչափ կառույցները Մաքս Պեուցի և Ջոն Քենդրյուի կողմից համապատասխանաբար, որոնց համար 1962 թվականին նրանք ևս ստացել են քիմիայի բնագավառում Նոբելյան մրցանակ[1][2]։
Ուսումնասիրման պատմություն

Սպիտակուցները՝ որպես առանձին կենսաբանական մոլեկուլների դաս, առանձնացվել են 18-րդ դարում ֆրանսիացի քիմիկոս Անտուան դե Ֆուրկուրի և այլ գիտնականների կողմից, ովքեր հայտնաբերեցին սպիտակուցների՝ թթվի կամ ջերմության ազդեցությամբ կոագուլացվելու (դենատուրացվելու) ընդունակությունը։ Այդ ժամանակ ուսումնասիրվեցին ալբումինը կամ ձվի սպիտակուցի սպիտակուցը, ֆիբրինը՝ արյան սպիտակուցը և գլյուտենը՝ հացահատիկներից։
19-րդ դարի սկզբում արդեն որոշ տեղեկություններ կային սպիտակուցի տարրական կառուցվածքի մասին։ Հայտնի էր, որ հիրդրոլիզվելիս սպիտակուցներն առաջացնում են ամինաթթուներ։ Այդ ամինաթթուներից որոշները, օրինակ՝ գլիցինը և լեյցինը, մանրամասն նկարագրվել են։ Հոլանդացի գիտնական Գերարդ Մուլդերը սպիտակուցների քիմիական կազմի հիման վրա ենթադրեց, որ համարյա բոլոր սպիտակուցներն ունեն նման էմպիրիկ բանաձև։ 1836 թվականին Մուլդերը առաջ քաշեց սպիտակուցների կառուցվածքի առաջին մոդելը։ Հիմնվելով ռադիկալների տեսության վրա՝ նա որոշ ճշգրտումներից հետո եզրահանգեց, որ սպիտակուցի տարրական կառուցվածքային միավորը ունի հետևյալ բաղադրությունը՝ C40H62N10O12։ Այս միավորը Մուլդերն անվանեց «պրոտեին» (Pr) (հունարեն՝ πρῶτος, պրոտոս՝ առաջին,առաջնային), իսկ տեսությունը՝ «պրոտեինի տեսություն»[3]։ Պրոտեին տերմինը առաջարկել էր դեռ շվեդ քիմիկոս Յակոբ Բերցելիուսը[4]։ Մուլդերի պատկերացումների համաձայն՝ յուրաքանչյուր սպիտակուց կազմված է մի քանի պրոտեինային միավորներից, ֆոսֆորից և ծծբից։ Օրինակ՝ ֆիբրինի բանաձևը նա առաջարկում էր գրել այսպես՝ 10PrSP: Մուլդերը ուսումնասիրել է նաև սպիտակուցների քայքայման պրոդուկտները՝ ամինաթթուները, և տվել լեյցինի մոլեկուլային զանգվածը սխալի փոքր տոկոսով՝ 131 դալտոն։ Մինչև 1850-ական թվականների ավարտը պրոտեինի տեսությունը լայնորեն տարածված էր, սակայն նոր տվյալների կուտակման հետ այն սկսեց ենթարկվել քննադատության։
19-րդ դարի վերջում արդեն ուսումնասիրվել էին սպիտակուցի կազմի մեջ մտնող ամինաթթուների մեծ մասը։ 1880-ական թվականների վերջում ռուս գիտնական Ալեքսանդր Դանիլևսկին հայտնաբերեց սպիտակուցի մոլեկուլում (CO-NH) պեպտիդային խմբերի առկայությունը[5][6]։ 1894 թվականին գերմանացի ֆիզիոլոգ Ալբրեխտ Կոսելը առաջ քաշեց մի տեսություն, որով փաստեց, որ հենց ամինաթթուներն են սպիտակուցների կառուցվածքային միավորները[7]։ 20-րդ դարի սկզբում գերմանացի քիմիկոս Էմիլ Ֆիշերը փորձնականորեն ապացուցեց, որ սպիտակուցները կազմված են ամինաթթուների մնացորդներից, որոնք միմյանց միացած են պեպտիդային կապերով։ Նա էլ հենց իրականացրեց սպիտակուցի ամինաթթվային հաջորդականության առաջին վերլուծությունը և բացատրեց պրոտեոլիզի երևույթը։
Օրգանիզմում սպիտակուցների ունեցած կենտրոնական դերը անբացահայտ մնաց մինչև 1926 թվականը, երբ ամերիկացի քիմիկոս Ջեյմս Սամները (Քիմիայի Նոբելյան մրցանակի դափնեկիր) ցույց տվեց, որ ուրեազ ֆերմենտը սպիտակուց է[8]։

Մաքուր սպիտակուցների առանձնացման բարդությունը դժվարացնում էր այդ բնագավառում ուսումնասիրությունների ընթացքը։ Սպիտակուցների առաջին ուսումնասիրությունները տարվել են այն պոլիպեպտիդների վրա, որոնք հեշտությամբ և մեծ քանակով մաքրվում էին՝ արյան սպիտակուցներ, ձվի սպիտակուց, տարբեր թույներ, խոշոր եղջերավոր անասունների մարսողական ֆերմենտներ։ 1950-ականների վերջում Armour Hot Dog Co. ընկերությունը կարողացավ առանձնացնել ցուլի ենթաստամոքսային գեղձի ռիբոնուկլեազ A ֆերմենտը, որը շատ հետազոտությունների օբյեկտ դարձավ։
Այն գաղափարը, թե սպիտակուցի երկրորդային կառուցվածքը ամինաթթվային հիմքերի միջև առաջացող ջրածնային կապերի արդյունք է, առաջ է քաշել Ուիլյամ Աստբերին 1933 թվականին, բայց երկրորդային կառուցվածքը բացատրած առաջին գիտնականը Լայնուս Պոլինգն է։ Հետագայում Ուոլտեր Կաուզմանը, հիմնվելով Կայ Լինդերստրյոմ-Լանգանի աշխատանքների վրա, բացատրեց սպիտակուցի երրորդային կառուցվածքում առաջացող կապերի առաջացման մեխանիզմները։ 1940-50-ական թվականներին Ֆրեդերիկ Սենգերը մշակեց սպիտակուցների սեքվենավորման մեթոդ, որի միջոցով 1955 թվականին նա բացահայտեց ինսուլինի երկու շղթաների ամինաթթվային հաջորդականությունները[9][10][11]՝ ապացուցելով, որ սպիտակուցները ամինաթթուների գծային, այլ ոչ թե ճյուղավորված պոլիմերներ են։ Խորհրդային գիտնականների կողմից սեքվենավորված առաջին սպիտակուցը եղել է ասպարտատամինոտրանսֆերազ ֆերմենտը (1972)[12][13].
Սպիտակուցների առաջին տարածական կառույցները ստացվել են ռենտգենային ճառագայթների դիֆրակցիայի մեթոդով և հայտնի են դարձել 1950-60-ական թվականներին, իսկ միջուկային մագնիսական ռեզոնանսի մեթոդով ստացված կառույցները՝ 1980-ականներին։ 2012 թվականին «Սպիտակուցների շտեմարանը» (Protein Data Bank) պարունակում էր սպիտակուցների ավելի քան 87000 կառույցներ[14]։
21-րդ դարում սպիտակուցների հետազոտությունները նոր թափ ստացան, սկսեցին ուսումնասիրվել ոչ միայն առանձին սպիտակուցները, այլ տարբեր բջիջների, հյուսվածքների և օրգանիզմների մեծ քանակով սպիտակուցների քանակական և հետտրանսլյացիոն ձևափոխությունները։ Կենսինֆորմատիկայի մեթոդով հնարավոր դարձավ մշակել ոչ միայն ռենտգենակառուցվածքային անալիզի տվյալները, այլև կանխորոշել սպիտակուցի հնարավոր կառուցվածքը՝ հիմնվելով նրա ամինաթթուների հաջորդականության վրա։ Ներկայումս խոշոր սպիտակուցների կոմպլեքսների կրիոէլեկտրոնային ուսումնասիրությունը և համակարգչային ծրագրերի օգնությամբ սպիտակուցների դոմենների կառուցվածքի կանխորոշումն ունեն համարյա ատոմային մակարդակի ճշտություն[15]։
Հատկություններ
Չափսեր
Սպիտակուցի չափսը կարող է չափվել ամինաթթվային մնացորդների քանակով կամ դալտոններով (մոլեկուլային զանգված), բայց մոլեկուլների հարաբերական մեծության պատճառով այն արտահայտվում է կիլոդալտոններով՝ կԴա։ Խմորասնկերի սպիտակուցները միջինում կազմված են 466 ամինաթթուների մնացորդներից և ունեն 53 կԴա մոլեկուլային զանգված։ Ներկայումս հայտնի ամենամեծ սպիտակուցներից մեկը՝ տիտինը, մտնում է մկանի սարկոմերների կազմության մեջ։ Այս սպիտակուցի իզոմորֆ ձևերն ունեն 3000-3700 կԴա մեծություն։ Մարդու ձկնաձև մկանի (լատին․՝ soleus) տիտին սպիտակուցը կազմված է 38 138 ամինաթթուներից[16]։
Սպիտակուցների մոլեկուլային զանգվածի որոշման համար օգտագործվում են գել-ֆիլտրացիայի, պոլիակրիլամիդային գելում էլեկտրոֆորեզի, մաս-սպեկտորոսկոպիկական անալիզի, սեդիմենտացիոն անալիզի և այլ մեթոդներ[17]։
Ֆիզիկաքիմիական հատկություններ
Ամֆոտերություն

Սպիտակուցներն օժտված են ամֆոտերությամբ. արտաքին պայմաններից կախված՝ կարող են ցուցաբերել թթվային կամ հիմնային հատկություններ։ Սպիտակուցների կազմում կան մի քանի տեսակի ֆունկցիոնալ խմբեր, որոնք ջրային միջավայրում իոնացվում են, դրանք են թթու ամինաթթուների կողմնային կարբօքսիլ խմբերը (ասպարգինաթթու, գլուտամինաթթու) և ազոտ պարունակող կողմնային շղթաների ամինաթթուները (առաջին հերթին լիզինի ε-ամինոխումբը և արգինինի ամիդային CNH(NH2 մնացորդը, ավելի քիչ՝ հիստիդինի իմիդազոլային մնացորդը։ Յուրաքանչյուր սպիտակուց բնութագրվում է իզոէլեկտրական կետով (pI), որը միջավայրի թթվայնության (pH-ի) արժեքն է այն միջավայրում, որտեղ սպիտակուցի մոլեկուլի գումարային էլեկտրական լիցքը զրո է, այսինքն՝ մոլեկուլը չի տեղափոխվում էլեկտրական դաշտում (օրինակ՝ էլեկտրոֆորեզի ժամանակ)։ Իզոէլեկտրական կետում սպիտակուցի հիդրատացիան և լուծելիությունը ունեն նվազագույն արժեքը։ pI-ի մեծությունը կախված է ամինաթթուների հիմնական թթվային և հիմնային խմբերի հարաբերությունից։ Մեծ թվով թթվային մնացորդներ պարունակող սպիտակուցների իզոէլեկտրական կետը գտնվում է թթվային հատվածում, հիմնային մնացորդների դեպքում՝ հիմնային հատվածում։ pI-ի արժեքը կարող է փոփոխվել՝ իոնային ուժից և բուֆերային լուծույթից կախված, քանի որ չեզոք աղերն ազդում են սպիտակուցի ֆունկցիոնալ խմբերի իոնիզացման վրա։ pI-ը կարելի է որոշել թթվահիմնային տիտրավորման կամ իզոէլեկտրոֆոկուսավորման մեթոդներով[17].
pI-ն ընդհանուր առմամբ կախված է սպիտակուցի կատարած գործառույթից. ողնաշարավորների շատ հյուսվածքային սպիտակուցների իզոէլեկտրական կետը ընկած է 5,5-7,0-ի սահմաններում, սակայն որոշ դեպքերում այն կարող է ընդունել խիստ տարբերվող արժեք, օրինակ՝ պեպսինի՝ ստամոքսահյութի ֆերմենտի դեպքում pI ~ 1[18], իսկ սալմինի՝ սաղմոնի սերմնահյութի պրոտամինի դեպքում՝ pI ~ 12՝ արգինինի մեծ պարունակության հաշվին։ Նուկլեինաթթուներին ֆոսֆատային խմբի էլեկտրոստատիկական փոխհարաբերության հաշվին միացող սպիտակուցները, հաճախ հիմնական սպիտակուցներն են։ Այսպիսի սպիտակուցներ են հիստոններն ու պրոտամինները։
Լուծելիություն
Սպիտակուցները տարբերվում են ըստ ջրում լուծելիության։ Ջրում լուծվող սպիտակուցներն անվանում են ալբումիններ, որոնցից են, օրինակ, արյան և կաթի սպիտակուցները։ Ջրում չլուծվող սպիտակուցներից կամ սկլերոպրոտեիններից են, օրինակ, կերատինը, ֆիբրոինը, որը մտնում է մետաքսաթելի և սարդոստայնի բաղադրության մեջ[19]։ Սպիտակուցի լուծելիությունը պայմանավորված է ոչ միայն կառուցվածքով, այլ նաև արտաքին գործոններով՝ լուծիչի բնույթով, իոնային ուժով, լուծույթի pH-ով[17]։
Սպիտակուցները լինում են նաև հիդրոֆիլ (ջուր ձգող) և հիդրֆոբ (ջուր վանող)։ Հիդրոֆիլ սպիտակուցներ են ցիտոպլազմայի, կորիզի, միջբջջային նյութի սպիտակուցների մեծ մասը, այդ թվում կերատինը և ֆիբրիոինը։ Հիդրոֆոբ սպիտակուցներ են կենսաբանական թաղանթի կազմի մեջ մտնող սպիտակուցները, որոնք փոխհարաբերության մեջ են մտած թաղանթի հիրդոֆոբ լիպիդների հետ[20] (այս սպիտակուցները, որպես կանոն, ունեն նաև հիդրոֆիլ հատվածներ)։
Բնափոխում

Սպիտակուցի բնափոխումը կամ դենատուրացիան երկրորդային, երրորդային կամ չորրորդային կառուցվածքի կորստի հետ կապված ցանկացած փոփոխությունն է, որը հանգեցնում է սպիտակուցի ակտիվության և/կամ ֆիզիկաքիմիական հատկությունների փոփոխությանը։ Որպես կանոն, սպիտակուցները օրգանիզմում բավականին կայուն են և հարմարված օրգանիզմի ներքին պայմաններին[8]։ Այս պայմանների կտրուկ փոփոխությունը բերում է սպիտակուցի բնափոխմանը։ Բնափոխման պատճառները կարող են լինել մեխանիկական (կտրուկ տեղափոխում, թափահարում), ֆիզիկական (տաքացում, սառեցում, ուլտրաձայն, ճառագայթում) և քիմիական (թթուներ և հիմքեր, մակերեսային ակտիվ նյութեր, միզանյութ)[17]։
Սպիտակուցի բնափոխումը կարող է լինել նաև ամբողջական կամ մասնակի, դարձելի և անդարձելի։ Անդարձելի բնափոխման ամենատարածված օրինակը ձվի սպիտակուցի բնափոխումն է բարձր ջերմաստիճանի ազդեցությամբ։ Թափանցիկ օվալբումին սպիտակուցը խտանում է, դառնում անլուծելի և անթափանց։ Բնափոխումը որոշ դեպքերում դարձելի է, ինչպես, օրինակ, ջրում լուծվող սպիտակուցների՝ ամոնիումի աղերով նստեցման և մաքրման մեջ կիրառման ժամանակ[21]։
Կառուցվածք

Սպիտակուցի մոլեկուլները գծային պոլիմերներ են, որոնք կազմված են α-L-ամինաթթուների մնացորդներից (մոնոմերներ)։ Սպիտակուցի կազմի մեջ կարող են մտնել նաև ձևափոխված ամինաթթվային մնացորդներ և ոչ ամինաթթվային ծագում ունեցող բաղադրիչներ։ Սպիտակուցների կազմում ամինաթթուների նշանակման համար օգտագործում են մեկ կամ երեք տառից բաղկացած կրճատումներ։ Քանի որ կենդանի օրգանիզմների կազմի մեջ մտնող սպիտակուցների մեծամասնությունը կազմված են 20 ամինաթթուներից, այս պատճառով կարող է թվալ, թե սպիտակուցների հնարավոր թիվը փոքր է և սահմանափակ։ Իրականում, օրինակ՝ հինգ ամինաթթվային մնացորդ պարունակող սպիտակուցի մոլեկուլների հնարավոր թիվը գերազանցում է 3 միլիոնը, 100 ամինաթթվային մնացորդի դեպքում տարբերակների թիվը 10130-ից ավելի է։
2-10 ամինաթթվային մնացորդից կազմված մոլեկուլները հաճախ անվանվում են պեպտիդներ, իսկ ավելի բարդ պոլիմերները՝ սպիտակուցներ։ Այս բաժանումը, սակայն, պայմանական է։
Սպիտակուցի կազմավորման ժամանակ մի ամինաթթվի α-կարբօքսիլ խմբի (-COOH) և մյուսի α-ամինոխմբի (-NH2) միջև առաջանում է պեպտիդային կապ։ Սպիտակուցի ծայրերն կոչվում են N- և C- ծայրեր, ինչը պայմանավորված է նրանով, թե որ ֆունկցիոնալ խմբերն են ազատ՝ -NH2-ը, թե -COOH-ը։ Ռիբոսոմի վրա սպիտակուցի կենսասինթեզի ժամանակ առաջին N-ծայրային ամինաթթվային մնացորդը սովորաբար մեթիոնինն է, մյուս ամինաթթուները միանում են նախորդի C- ծայրին։
Կազմավորման մակարդակներ

Լինդեստրյոմ-Լանգը առաջարկել է առանձնացնել սպիտակուցի կազմավորման 4 մակարդակ՝ առաջնային, երկրորդային, երրորդային և չորրորդային կառուցվածքներ։ Չնայած այսպիսի բաժանումը որոշ դեպքերում հնացած է, այն շարունակվում է լայնորեն օգտագործվել[3]։ Պոլիպեպտիդի առաջնային կառուցվածքը (ամինաթթվային մնացորդների հաջորդականությունը) որոշվում է գենով և գենետիկական գաղտնագրով, ավելի բարձր մակարդակները ձևավորվում են սպիտակուցների ֆոլդինգի ընթացքում (անգլ.՝ fold՝ ծալել)[22]։ Չնայած որ սպիտակուցի տարածական կառուցվածը որոշվում է հիմնականում ամինաթթվային հաջորդականությամբ, այն բավական շարժուն է և կարող է պայմանավորվել արտաքին միջավայրի պայմաններով։ Այս պատճառով արտաքին միջավայրում սպիտակուցը ընդունում է էներգետիկ տեսակետից ավելի ձեռնտու տարածական կառուցվածք[3]։
Առաջնային կառուցվածք

Առաջնային կառուցվածքը պոլիպեպտիդային շղթայում ամինաթթվային մնացորդների հաջորդականությունն է։ Սպիտակուցի առաջնային կառուցվածքը, որպես կանոն, նկարագրում են մեկ կամ երեք տառերից բաղկացած նշանակումների օգտագործմամբ։
Առաջնային կառուցվածքի կարևոր հատկություններից է կոնսերվատիվ միտումը, որը որոշակի գործառույթ ունեցող ամինաթթվային մնացորդների խմբերի կայուն ամբողջությունն է և հանդիպում է շատ սպիտակուցներում։ Կոնսերվատիվ միտումները պահպանվում են տեսակների էվոլյուցիայի ընթացքում։ Դրանք օգտագործվում են անհայտ սպիտակուցի ֆունկցիան պարզելու համար[23]։ Սպիտակուցների ամինաթթվային կազմի համանմանությամբ կարելի է պարզել տաքսոնների միջև գոյություն ունեցող էվոլյուցիոն կապերը։
Սպիտակուցի առաջնային կառուցվածքը հնարավոր է որոշել սպիտակուցների սեքվենավորման կամ մՌՆԹ-ի առաջնային կառուցվածքի միջոցով՝ օգտագործելով գենետիկական գաղտնագիրը։
Երկրորդային կառուցվածք
Երկրորդային կառուցվածքը սպիտակուցի պոլիպեպտիդային շղթայի հատվածների տեղային դասավորությունն է, որը կայունացվում է ջրածնային կապերի միջոցով։ Ստորև ներկայացված են սպիտակուցի երկրորդային կառուցվածքի տիպերը[22]՝
- α-պարույր՝ մոլեկուլի երկար առանցքի շուրջը խիտ դասավորված են պարույրները, մեկ պարույրում կա 3,6 ամինաթթվային մնացորդ, մեկ քայլը 0,54 նմ է (մեկ ամինաթթվային մնացորդը՝ 0,15 նմ)[24]։ Պարույրը պահպանում է իր ձևը պեպտիդային խմբերի H և O ատոմների միջև առաջացող պեպտիդային կապերով։ α-պարույրը կարող է լինել աջ և ձախ պարուրված, սպիտակուցներում գերակշռում է աջ պարուրված տարբերակը։ Պարույրը քանդվում է գլուտամինաթթվի, լիզինի, արգինինի էլեկտրոստատիկ փոխհարաբերությունը։ Ասպարգինի, սերինի, թրեոնինի և լեյցինի մնացորդները միմյանց մոտ դասավորվելիս կարող են խանգարել պարույրի ձևավորմանը, պրոլինի մնացորդն առաջացնում է շղթայի ծռում, որը նույնպես քանդում է α-պարույրը։
- β-պարույր (շարժական շերտեր)՝ մի քանի կեռմանաձև պոլիպեպտիդային շղթաներ, որոնցում ջրածնային կապեր առաջանում են հադնիպակաց շղթաների կամ միմյանցից հեռու դասավորված ամինաթթվային մնացորդների միջև[25]։ Այս շղթաներն իրենց N-ծայրով ուղղված են հակառակ (հակազուգահեռ կողմնորոշում)։ β-պարույրի առաջացման համար կարևոր կողմնային ամինաթթվային մնացորդներից են գլիցինն ու ալանինը։
- π-պարույր,
- 310-պարույր,
- չկարգավորված հատվածներ։
Երրորդային կառուցվածք

Երրորդային կառուցվածքը պոլիպեպտիդային շղթայի տարածական դասավորությունն է։ Այն կազմված է երկրորդային կառուցվածքի տարրերից, որոնք կայունացվում են տարբեր փոխհարաբերությունների, հատկապես հիդրոֆոբ փոխհարաբերության շնորհիվ։ Կայուն երրորդային կառուցվածքում կան՝
- կովալենտ կապեր ցիստեինի երկու մնացորդների միջև՝ դիսուլֆիդային կապեր,
- իոնային կապեր հանդիպակաց դասավորված ամինաթթվային մնացորդների երկու խմբերի միջև,
- ջրածնային կապեր,
- հիդրոֆոբ փոխհարաբերություն։ Սպիտակուցի մոլեկուլը ջրի հետ փոխհարաբերվելիս ընդունում է այնպիսի կառուցվածք, որտեղ ոչ բևեռային ամինաթթուների կողմնային խմբերը մեկուսանում են ջրային լուծույթից, իսկ բևեռային խմբերը՝ հայտնվում մոլեկուլի մակերեսին։
Սպիտակուցների երրորդային կառուցվածքի ուսումնասիրությունը ցույց է տվել, որ երկրորդային և ատոմային տարածական կառուցվածքների միջև կարելի է առանձնացնել նաև երրորդ մակարդակը՝ կառուցվածքային դրդապատճառը։ Այն որոշվում է սպիտակուցի դոմենի սահմաններում երկրորդային կառուցվածքի տարրերի (α-պարույր և β-պարույր) միմյանց նկատմամբ ունեցած դասավորությամբ։ Սպիտակուցի դոմենը կոմպակտ գլոբուլին է, որը կարող է ինքնուրույն գոյություն ունենալ կամ մտնել ավելի մեծ սպիտակուցի կազմության մեջ։ Պատկերի աջում պատկերված գլոբուլյար սպիտակուցի՝ տրիոզոֆոսֆատիզոմերազի կառուցվածքային դրդապատճառն անվանվում է α/β-գլան։ 8 զուգահեռ դասավորված β-պարույրներն առաջացնում են β-գլան, որն իր հերթին գտնվում է 8 α-պարույրներից կազմված մեկ այլ գլանի ներսում։ Այսպիսի կառուցվածք ունեն սպիտակուցների 10%-ը[26]։
Կառուցվածքային դրդապատճառները հանդիպում են նաև այն սպիտակուցների մոտ, որոնք չունեն ֆունկցիոնալ և էվոլյուցիոն կապեր։ Կառուցվածքային դրդապատճառներն օգտագործվում են սպիտակուցների դասակարգման մեջ, ինչպես, օրինակ, CATH-ը կամ SCOP-ն է[26]։
Սպիտակուցի տարածական կառուցվածքի որոշման համար օգտագործվում են ռենտգենկառուցվածքային անալիզը, միջուկային մագնիսական ռեզոնանսը և մի շարք մանրադիտակային մեթոդներ։
Չորրորդային կառուցվածք
Չորրորդային կամ ենթամիավորումային, դոմենային կառուցվածքը մեկ սպիտակուցային կոմպլեքսի ներսում տարբեր պոլիպեպտիդային շղթաների փոխադարձ դասավորությունն է։ Չորրորդային կառուցվածքի մեջ մտնող սպիտակուցի մոլեկուլները ռիբոսոմի վրա առաջանում են առանձին-առանձին և միայն սպիտակուցի սինթեզից հետո ձևավորում վերմոլեկուլային չորրորդային կառույցը։ Չորրորդային կառուցվածքի մեջ կարող են մտնել ինչպես նման, այնպես էլ տարբերվող պոլիպեպտիդային շղթաներ։ Չորրորդային կառուցվածքի կայունացմանը մասնակցում են նույն փոխհարաբերությունները, ինչ երրորդայինի դեպքում։ Վերմոլեկուլային այսպիսի սպիտակուցային կառուցվածքները կարող են պարունակել տասնյակ մոլեկուլներ։
Դասակարգումն ըստ կառուցվածքի
Ըստ ընդհանուր կառուցվածքի՝ սպիտակուցները բաժանվում են երեք խմբերի՝
- Ֆիբրիլյար սպիտակուցներ - առաջացնում են պոլիմերներ, նրանց կառուցվածքը սովորաբար կայուն է, որը պահպանվում է շղթաների միջև առկա փոխհարաբերությունների շնորհիվ։ Ֆիբրիլյար սպիտակուցներն առաջացնում են միկրոթիթեղներ, միկրոխողովակներ, ֆիբրիլներ, պահպանում հյուսվածքների և բջիջների կառուցվածքը տարածության մեջ։ Ֆիբրիլյար սպիտակուցներից են կերատինը և կոլագենը։
- Գլոբուլյար սպիտակուցներ - ջրում լուծվող սպիտակուցներ, մոլեկուլի ձևը փոքրիշատե գնդաձև է։
- Թաղանթային սպիտակուցներ - ունեն բջջաթաղանթը հատող դոմեններ, բայց հիմնական մասը ուղղված է դեպի ցիտոպլազմա կամ միջբջջային տարածություն։ Թաղանթային կամ մեմբրանային սպիտակուցները կատարում են ռեցեպտորների դեր, իրականացնում են ազդակի փոխանցումը և ապահովում տարբեր միացությունների միջմեմբրանային տեղափոխությունը։
Պարզ և բարդ սպիտակուցներ

Բացի պեպտիդային շղթաներից, շատ սպիտակուցների կազմի մեջ կարող են մտնել նաև ոչ ամինաթթվային խմբեր։ Այս առանձնահատկությունը հաշվի առնելով՝ սպիտակուցները բաժանվում են երկու խմբի՝ պարզ և բարդ սպիտակուցներ (պրոտեիդներ)։ Պարզ սպիտակուցները կազմված են միայն պոլիպեպտիդային շղթաներից, բարդ սպիտակուցները պարունակում են նաև ոչ ամինաթթվային կամ պրոսթետիկ խմբեր։ Պրոսթետիկ խմբի բնույթից կախված՝ տարբերում են բարդ սպիտակուցների հետևյալ դասերը[19]՝
- Գլիկոպրոտեինների պրոսթետիկ խումբը կովալենտ կապով միացած ածխաջրերի մնացորդներ են։ Մուկոպոլիսախարարիդային մնացորդներ պարունակող գլիկոպրոտեինները պատկանում են պրոտեոգլիկանների շարքին։ Ածխաջրային մնացորդների հետ կապի առաջացմանը մասնակցում են սերինի կամ թրեոնինի հիդրօքսիլ խմբերը։ Ներկորիզային սպիտակուցների մեծ մասը և հատկապես իմունոգլոբուլինները գլիկոպրոտեիններ են։ Պրոտեոգիլկաններում ածխաջրային մասը կազմում է մոլեկուլի ընդհանուր զանգվածի մոտ 95%-ը, այն ներբջջային կմախքի հիմնական մասն է։
- Լիպոպրոտեինների պրոսթետիկ խումբը ոչ կովալենտ կապով կապված լիպիդներ են։ Արյան մեջ լիպիդների տեղափոխմանը մասնակցում են սպիտակուց-ապոլիպոպրոտեինները՝ կապվելով լիպիդների հետ։
- Մետաղպրոտեիդները պարունակում են դոնոր-ակցեպտորային կապով միացած մետաղի իոններ։ Մետաղպրոտեիդների շարքում կան այնպիսի սպիտակուցներ, որոնք կատարում են դեպոնացնող և տրանսպորտային ֆունկցիաներ (օրինակ՝ երկաթ պարունակող ֆերիտինը, տրանսֆերինը, ֆերմենտներ՝ ցինկ պարունակող՝ կարբոանհիդրազ և այլ սուպերօքսիդդիսմուտազներ, որոնք ակտիվ կենտրոնում պարունակում են պղնձի, մագնեզիումի, երկաթի և այլ մետաղների իոններ։
- Նուկլեոպրոտեիդները պարունակում են ոչ կովալենտ կապով կապված ԴՆԹ կամ ՌՆԹ։ Նուկլեոպրոտեիդներից է քրոմատինը, որից կազմված են քրոմոսոմները։
- Ֆոսֆոպրոտեինների պրոսթետիկ խումբը ոչ կովալենտ կապով կապված ֆոսֆորական թթվի մնացորդն է։ Ֆոսֆատը բարդ եթերային կապ է հաստատում սերինի, թրեոնինի և թիրոզինի հիդրօքսիլ խմբի հետ։ Ֆոսֆոպրոտեին է օրինակ կաթի կազեին սպիտակուցը[27]։
- Քրոմպրոտեիդների պրոսթետիկ խումբը տարբեր քիմիական բնույթ ունեցող մնացորդ է, որը, սակայն, գունավորված է։ Քրոմպրոտեիդներ են մետաղ պարունակող պորֆրինիային խմբով սպիտակուցները, որոնք կատարում են տարբեր գործառույթներ, օրինակ՝ հեմոպրոտեինները, որոնք՝ որպես պրոսթետիկ խումբ, պարունակում են հեմ (հեմոգլոբին և ցիտոքրոմներ), ֆլավոպրոտեիդներ ֆլավինային խմբով և այլն։
Սպիտակուցի կենսաֆիզիկա
Սպիտակուցի ֆիզիկական հատկությունները բջջում շատ բարդ են։ Վարկածներից մեկի համաձայն՝ սպիտակուցը բջջում ունի կարգավորված բյուրեղանման կառուցվածք՝ ապերիոդիկ բյուրեղի տեսք[28][29]։ Այս վարկածը հաստատվում է ռենտգենկառուցվածքային անալիզի (մինչև 1 անգստրեմ չափում)[30], փաթեթավորման մեծ պտության[31], բնափոխման գործընթացի համակարգայնության[32] և այլ փաստերի միջոցով[33]։
Մյուս վարկածի՝ ներգլոբուլյար շարժումների ժամանակ սպիտակուցի՝ հեղուկանման կառուցվածք ունենալու օգտին են խոսում նեյրոնների սփռման[34], մյոս-բաուերովյան սպեկտրոսկոպիայի[35][36] վերաբերյալ տվյալները։
Սինթեզ

Կենսասինթեզ
Ունիվերսալ եղանակ՝ ռիբոսոմային սինթեզ
Սպիտակուցները կենդանի օրգանիզմների կողմից սինթեզվում են ամինաթթուներից՝ գեներում գաղտնագրված տեղեկատվության հիման վրա։ Յուրաքանչյուր սպիտակուց կազմված է ամինաթթվային մնացորդների մենահատուկ հաջորդականությունից, որը որոշվում է սպիտակուցը գաղտնագրող գենի նուկլեոտիդային հաջորդականությամբ։ Տրանսլյացիան պոլիպեպտիդային շղթայի ամինաթթվային հաջորդականությունը նուկլեոտիդային հաջորդականության վերածելու հատուկ եղանակ է։ Այս գաղտնագիրը որոշվում է կոդոններով, որոնք ՌՆԹ-ի եռնուկլեոտիդ հաջորդականություններ են և այն ամինաթթուներով, որոնք մտնում են պոլիպեպտիդի կազմի մեջ։ Օրինակ՝ ԱՈՒԳ հաջորդականությանը համապատասխանում է մեթիոնին ամինաթթուն։ Քանի որ ԴՆԹ-ն բաղկացած է 4 տեսակի նուկլեոտիդներից, հնարավոր կոդոնների թիվը 64-ն է։ Իսկ սպիտակուցների կազմի մեջ մտնող ամինաթթուների թիվն ընդամենը 20-ն է։ Այս պատճառով, շատ ամինաթթուներ որոշվում են մեկից ավելի կոդոններով։ 3 կոդոններ ծառայում են որպես պոլիպեպտիդային շղթայի սինթեզի ավարտն ազդարարողներ։ Այս կոդոններն անվանվում են տերմինալ կամ ստոպ կոդոններ[37]։
Սպիտակուցը գաղտնագրող գեները, սկզբում տրանսկրիպցվում են ՌՆԹ պոլիմերազների միջոցով՝ առաջացնելով մատրիցային ՌՆԹ (մՌՆԹ)։ Դեպքերի ճնշող մեծամասնության ժամանակ կենդանի օրգանիզմների սպիտակուցները սինթեզվում են ռիբոսոմներում, որոնք ցիտոպլազմայում գտնվող բազմաբաղկացուցիչ մոլեկուլային համալիրներ են։ Ռիբոսոմներում պոլիպեպտիդային շղթայի սինթեզը մՌՆԹ-ի հիմքի վրա անվանվում է տրանսլյացիա[37]։
Սպիտակուցների ռիբոսոմային սինթեզը նույնանման է պրոկարիոտների և էուկարիոտների մոտ, բայց որոշ առումներով տարբերվում է։ Այսպես, օրինակ՝ պրոկարիոտների մՌՆԹ-ն կարող է տրանսլացվել տրանսկրիպցիայից անմիջապես հետո և նույնիսկ մինչև տրանսկրիպցիայի ավարտը[38]։ Էուկարիոտների մոտ առաջնային տրանսկրիպտը սկզբում պետք է ենթարկվի որոշ հետտրանսկրիպցիոն ձևափոխությունների, որն անվանվում է ՌՆԹ պրոցեսինգ և տեղափոխվել ցիտոպլազմային այն հատվածը, որտեղ տեղի է ունենալու տրանսլյացիան։ Սպիտակուցի սինթեզի արագությունն ավելի մեծ է պրոկարիոտների մոտ և կարող ա հասնել մեկ վայրկյանում 20 ամինաթթու արագության[39].
Մինչև տրանսլյացիայի սկիզբը ամինոացիլ-փՌՆԹ-սինթետազները մենահատուկ կերպով միանում են ամինաթթուներին համապատասխանող փՌՆԹ-ների հետ։ ՓՌՆԹ-ի հակակոդոն անվանվող հատվածը կոմպլեմենտար կերպով կարող միանալ մՌՆԹ-ի կոդոնի հետ՝ ապահովելով գենետիկական գաղտնագրի համապատասխան փՌՆԹ-ի ամինաթթվային մնացորդի միացումը պոլիպեպտիդային շղթային։
Տրանսլյացիայի սկզբնական փուլի՝ ինիցիացիայի ընթացքում, ռիբոսոմը ճանաչում է ինիցիացիայի կոդոնը, որին սպիտակուցային ինցիացիայի գործոնների միջոցով միանում է ամինոացիլ մեթիոնինային փՌՆԹ-ն։ Ստարտ կոդոնի ճանաչումից հետո ռիբոսոմի փոքր ենթամիավորմանն է միանում մեծ ենթամիավորումը և սկսվում է տրանսլյացիայի երկրորդ փուլը՝ էլոնգացիան։ ԻՌՆԹ-ի վրա 5'-ից 3' ռիբոսոմի կատարած յուրաքանչյուր քայլում ընթերցվում է մեկ կոդոն, ջրածնային կապեր են առաջանում փՌՆԹ-ի հակակոդոնի և իՌՆԹ-ի կոդոնի միջև, համապատասխան ամինաթթվային մնացորդը միանում է աճող պեպտիդի վերջին ամինաթթվային մնացորդին՝ ձևավորվում է պեպտիդային կապ։ Այս գործը կատալիզում է պեպտիդիլտրանսֆերազային կենտրոնը ձևավորող ռիբոսոմային ՌՆԹ-ն։ Այս կենտրոնում ազոտի և ածխածնի ատոմները գրավում են այնպիսի դիրք, որի դեպքում ռեակցիան կարող է հաջողությամբ իևականանալ։ Տրանսլյացիայի վերջին եզրափակիչ փուլը տերմինացիան է, երբ ռիբոսոմը հասնում է ստոպ կոդոնին։ Ստոպ կոդոնին հասնելուց հետո տերմինացիայի գործոնները հիդրոլիզում են վերջին փՌՆԹ-ի և պոլիպեպտիդային շղթայի միջև. սպիտակուցի սինթեզը դադարում է։ Ռիբոսոմում սպիտակուցները միշտ սինթեզվում են N- կամ C- ծայրից[37]։
Ոչ ռիբոսոմային սինթեզ
Ստորակարգ սնկերի և որոշ բակտերիաների մոտ հայտնի է լրացուցիչ, ոչ ռիբոսոմային կամ բազմաֆերմենտային պեպտիդների սինթեզը։ Այս պեպտիդների սինթեզը, իրականացվում է բարձրամոլեկուլային համալիրի՝ NRS-սինթազի միջոցով, առանց ռիբոսոմների անմիջական մասնակցության։ NSR- սինթազը սովորաբար կազմված է մի քանի դոմեններից կամ առանձին սպիտակուցներից, որոնք իրականացնում են ամինաթթուների ընտրությունը, պեպտիդային կապի առաջացումը և սինթեզված պեպտիդի անջատումը։ Այս դոմենները միասին առաջացնում են մոդուլ։ Յուրաքանչյուր մոդուլը ապահովում է մի ամինաթթվի միացումը սինթեզվող պեպտիդին։ NRS-սինթազները, այսպիսով, կարող են բաղկացած լինել մեկ կամ ավելի մոդուլներից։ Այս համալիրների ներսում կարող են մտնել նաև այնպիսի դոմեններ, որոնք կարողանում են իզոմերացնել L-ամինաթթուները D-ձևի[40][41]։
Քիմիական սինթեզ
Կարճ սպիտակուցները կարող են սինթեզվել քիմիական եղանակով՝ օրգանական սինթեզի մեթոդների, օրինակ՝ լիգազի կիրառությամբ[42]։ Պեպտիդի քիմիական սինթեզը հիմնականում տեղի է ունենում C-ից դեպի N- ծայրը, ի հակառակ՝ ռիբոսոմներում ընթացող սինթեզի։ Քիմիական անալիզի մեթոդով ստանում են կարճ իմունոգեն պեպտիդներ՝ էպիտոպներ, որոնք հետագայում ներարկում են կենդանիներին՝ յուրահատուկ հակամարմինների և հիբրիդոմների ստացման նպատակով։ Բացի այդ, այս մեթոդն օգտագործվում է նաև որոշ ֆերմենտների ինհիբիտորների ստացման համար[43]։ Քիմիական սինթեզը թույլ է տալիս սպիտակուցի կազմի մեջ ներառել մյուս սպիտակուցներում չհանդիպող ամինաթթվային մնացորդներ, որոնց կողմնային շղթաներին, օրինակ, միացած են ֆլյոուրեսցենտ (լուսարձակող) նշագրեր։ Սպիտակուցների քիմիական սինթեզի մեթոդներն ունեն որոշ սահմանափակումներ. 300-ից ավելի ամինաթթվային մնացորդ պարունակող պեպտիդների սինթեզը ոչ արդյունավետ է, սինթեզված պեպտիդները կարող են ունենալ ոչ ճիշտ երրորդային կառուցվածք, բացակայեն բնութագրական հետտրանսլյացոն ձևափոխությունները։
Հետտրանսլյացիոն ձևափոխություններ
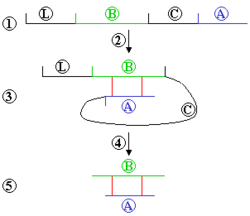
Տրանսլյացիայից հետո սպիտակուցների մեծ մասը ենթարկվում է հետագա քիմիական ձևափոխությունների, որոնք միասին անվանվում են հետտրանսլյացիոն ձևափոխություններ[44]։ Հայտնի է սպիտակուցների հետտրանսլյացիոն ձևափոխությունների ավելի քան երկու հարյուր եղանակ[45].
Հետտրանսլյացիոն ձևափոխությունները կարող են կարգավորել սպիտակուցի գոյության տևողությունը բջջում, սպիտակուցի ֆերմենտային ակտիվությունը և փոխհարաբերությունը այլ սպիտակուցների հետ։ Որոշ դեպքերում հետտրանսլյացիոն ձևափոխությունները կարևոր են սպիտակուցների հասունացման համար։ Օրինակ՝ ինսուլինի և որոշ հորմոնների հասունացման ժամանակ պոլիպեպտիդային շղթայի օրգանական պրոտեոլիզը անհրաժեշտ է, պլազմային թաղանթի սպիտակուցների դեպքում՝ գլիկոզիլացումը։
Հետտրանսլյացիոն ձևափոխությունները կարող են լինել լայնորեն տարածված, այնպես էլ հազվադեպ հանդիպող և մենահատուկ։ Ունիվերսալ ձևափոխության օրինակ է ուբիքվիտինացումը (սպիտակուցին մի քանի մոլեկուլից կազմված ուբիքվիտինի շղթայի միացումը), որը ծառայում է պրոռեասոմայի կողմից սպիտակուցի ճեղքման ազդանշան[46]։ Հաջորդ տարածված ձևափոխությունը գլիկոզիլացումն է․ ընդունված է, որ մարդու սպիտակուցների կեսից ավելին գլիկոզիլացված են[47]։ Հազվադեպ հանդիպող ձևափոխություններից է տուբուլինի թիրոզինացումը, դեթրիոզինացումը և պոլիգլիցիլացումը[48]։
Միևնույն սպիտակուցը կարող է ենթարկվել բազմակի ձևափոխությունների։ Այսպես օրինակ, հիստոնները՝ էուկարիոտների քրոմատինի կազմի մեջ մտնող սպիտակուցները, տարբեր պայմաններում կարող են ենթարկվել ավելի քան 150 տարբեր ձևափոխությունների[49]։
Հետտրանսլյացիոն ձևափոխությունները բաժանվում են հետևյալ խմբերի՝
- գլխավոր շղթայի ձևափոխություն,
- մեթիոնինի N-ծայրային մնացորդի ճեղքում,
- օրգանական պրոտեոլիզ․ մոլեկուլի ծայրից կամ կենտրոնից սպիտակուցի հատվածի հեռացումը,
- տարբեր քիմիական խմբերի միացում ազատ ամինո- և կարբօքսիլ խմբերին (N-ացիլացում, միրիստոիլացում և այլն),
- ամինաթթուների կողմնային շղթաների ձևափոխություն,
- ոչ մեծ քիմիական խմբերի միացում և ճեղքում (գլիկոլիզացում, ֆոսֆորիլացում և այլն),
- լիպիդների և ածխաջրերի միացում,
- ստանդարտ ամինաթթվային մնացորդների փոխարինում ոչ ստանդարտով (ցիտրուլինի առաջացում),
- ցիստեինի մնացորդների միջև դիսուլֆիդային կամրջակների առաջացում,
- ոչ մեծ սպիտակուցների միացում (սումոիլացում, ուբիքվիտինացում)։
Կյանքի ցիկլ
Ներբջջային տրանսպորտ և դասավորում

Էուկարիոտ բջիջների ցիտոպլազմայում սինթեզվող սպիտակուցները պետք է տեղափոխվեն բջջի տարբեր օրգանոիդներ, դեպի բջջակորիզ, միտոքոնդրիումներ, էնդոպլազմային ցանց, Գոլջիի ապարատ, լիզոսոմներ և այլ։ Որոշ սպիտակուցներ էլ պետք է դուրս բերվեն արտաբջջային տարածություն[50]։ Որպեսզի սպիտակուցը տեղափոխվի կամ հայտնվի բջջի անհրաժեշտ հատված, այն պետք է օժտված լինի յուրահատուկ պիտակով։ Այս պիտակը դեպքերի մեծ մասում հենց տվյալ սպիտակուցի ամինաթթվային հաջորդականության մի մասն է (գլխավորող պեպտիդ կամ սպիտակուցի ազդանշանային հաջորդականություն)․ որոշ դեպքերում այս պիտակը օլիգոսախարիդներ են, որոնք մոլեկուլին միանում են հետտրանսլյացիոն ձևափոխությունների արդյունքում[51]։
Սպիտակուցների տեղափոխումը էնդոպլազմային ցանց ընթանում է սպիտակուցի սինթեզին զուգահեռ, քանի որ ԷՑ-ի ազդանշանային հաջորդականություն կրող սպիտակուցներ սինթեզող ռիբոսոմները նստում են ԷՑ-ի արտաքին մեմբրանի վրա[52]։ ԷՑ-ից սպիտակուցի մոլեկուլները տեղափոխվում են Գոլջիի ապարատ, լիզոսոմներ և ապա արտաքին մեմբրան կամ արտաբջջային տարածություն՝ վեզիկուլյար տրանսպորտի միջոցով։ Սպիտակուցները կորիզ են թափանցում կորիզի անցուղիների միջոցով։ Միտոքոնդրիումներ և քլորոպլաստներ թափանցումը կատարվում է հատուկ սպիտակուցիային անցուղի-տրանսլոկատորների միջոցով՝ շապերոնների մասնակցությամբ։
Կառուցվածքի պահպանում և դեգրադացիա
Սպիտակուցի կանոնավոր տարածական կառուցվածքի պահպանումը կարևոր է նորմալ կենսագործունեության համար։ Սպիտակուցների ագրեգացիա առաջացնող ոչ ճիշտ ֆոլդինգը կարող է պայմանավորված լինել մուտացիաներով, օքսիդացմամբ, սթրեսային պայմաններով կամ բջջի ֆիզիոլոգիայի ընդհանուր փոփոխություններով։ Սպիտակուցների ագրեգացիան օրգանիզմի ծերացման բնորոշ երևույթ է։ Ենթադրվում է, որ սպիտակուցների ոչ կանոնավոր ֆոլդինգը պատճառ է դառնում շատ հիվանդությունների՝ մուկովիսցիդոզի, նեյրոդեգեներատիվ հիվանդությունների (Ալցհայմերի, Հանդինգտոնի, Պարկինսոնի հիվանդություններ) սրմանը[53]։
Էվոլյուցիայի ընթացքում բջիջները ձեռք են բերել սպիտակուցների ագրեգացիային հակազդելու չորս հիմնական մեխանիզմներ։ Առաջին երկուսը՝ շապերոնների միջոցով կրկնակի ֆոլդինգը կամ ռեֆոլդինգը և պորտեազների միջոցով՝ սպիտակուցի ճեղքումը, հանդիպում է բակտերիաների և բարձրակարգ օրգանիզմների մոտ։ Աուտոֆագիան և ոչ ճիշտ ֆոլնդինգի ենթարկված սպիտակուցների կուտակումը հատուկ մեմբրանային օրգանելներում հատուկ է միայն էուկարիոտներին[25][54]։
Շապերոններ

Սպիտակուցների՝ բնափոխումից հետո կանոնավոր եռաչափ կառուցվածքը վերականգնելու հատկությունը թույլ է տալիս ենթադրել, որ սպիտակուցի վերջնական կառուցվածքի մասին առկա ամբողջ տեղեկատվությունը պահվում է մոլեկուլի ամինաթթվային հաջորդականությունում։ Սպիտակուցի կայուն կոնֆորմացիան (անգլ.՝ conformation՝ տարածական կառուցվածք) մյուս հնարավոր կոնֆորմացիաների համեմատ օժտված է նվազագույն ազատ էներգիայով[55]։
Բջիջներում կան սպիտակուցի հատուկ խմբեր, որոնց ֆունկցիան մյուս սպիտակուցների ճիշտ ֆոլդինգ իրականացնելն է վերջիններիս սինթեզից հետո, ինչպես նաև սպիտակուցների կառուցվածքը վերականգնելը վնասումից հետո, սպիտակուցային համալիրների կառուցումը և դիսոցացումը։ Այս սպիտակուցներն անվանվում են շապերոններ։ Շատ շապերոնների կոնցենտրացիան բջջում, աճում է արտաքին միջավայրի ջերմաստիճանի բարձրացման հետ․ այս շապերոնները պատկանում են Hsp (անգլ.՝ heat shock proteins խմբին[56]։ Շապերոնների նորմալ աշխատանքը կարելի է ցույց տալ α-կրիստալինի շապերոնի օրինակով։ Այն մտնում է մարդու աչքի ոսպնյակի կազմի մեջ․ շապերոնի մուտացիան բերում է ոսպնյակի մթագմանը, առաջանում է կատարակտ[57]։
Պրոտեոլիզ
Սպիտակուցի մոլեկուլները բջջի կողմից ոչնչացվում են, եթե երրորդային կառուցվածքը հնարավոր չի վերականգնել։ Սպիտակուցների դեգրադացիան իրականացնող ֆերմենտներն անվանվում են պրոտեազներ։ Պրոտեազները բաժանվում են երկու խմբի՝
- Էնդոպեպտիդազներ կամ պեպտիդային շղթայի ներսում պեպտիդային կապերը խզող ֆերմենտներ, որոնք ճանաչում և կապվում են սուբստրատի կարճ ամինաթթվային հաջորդականության հետ և յուրահատուկ կերպով հիդրոլիզում որոշակի ամինաթթվային մնացորդներ։
- Էկզոպեպտիդազներ կամ ֆերմենտներ, որոնք ճեղքում են շղթայի ծայրերի պեպտիդային կապերը։ Ամինոպեպտիդազները ճեղքում են N-ծայրի, իսկ կարբոքսիպեպտիդազները՝ C-ծայրի պեպտիդային կապերը, դիպեպտիդազները ճեղքում են միայն դիպեպտիդները։
Կատալիզի մեխանիզմի հիման վրա կենսաքիմիայի և մոլեկուլային կենսաբանության համաշխարհային միությունը առանձնացնում է մի քանի պրոտեազների դասեր՝ սերինային պրոտեազներ, ասպարգինային պրոտեազներ, ցիստեինային պրոտեազներ և մետաղպրոտեազներ[58]։
Պրոտեազի հատուկ տեսակ՝ պրոտեասոմը, մեծ բազմաենթամիավորում պրոտեազ է, որն առկա է էուկարիոտների, արքեաների և որոշ բակտերիաների կորիզում և ցիտոպլազմայում[59][60]։
Թիրախ սպիտակուցը պրոտեասոմայով քայքայելու համար, այն պետք է նշվի փոքր սպիտակուցով՝ ուբիկվիտինով։ Ուբիկվիտինի միացումը կատալիզում է ուբիքվիտինլիգազը։ Ուբիքվիտինի առաջին մոլեկուլի միացումը լիգազի համար ազդանշան է մյուս մոլեկուլների միացման համար։ Արդյունքում սպիտակուցին միանում է պոլիուբիքվիտինային շղթա, որը միանում է պորտեասոմայի հետ և ապահովում թիրախ-սպիտակուցի ճեղքումը[59][60]։ Այս համակարգն անվանվում է ուբիքվիտին-կախյալ սպիտակուցների դեգրադացում։ Ներբջջային սպիտակուցի 80-90%-ը դեգրադացվում է պրոտեասոմաների միջոցով։
Սպիտակուցների դեգրադացումը պերօքսիսոմներում կարևոր է շատ բջջային գործընթացների նորմալ ընթացքի համար, այդ թվում՝ բջջային ցիկլ, գեների էքսպրեսիայի կարգավորում և օքսիդային սթրեսի պատասխանի ձևավորում։
Աուտոֆագիա

Աուտոֆագիան լիզոսոմներում (կաթնասուններ) կամ վակուոլներում (խմորասնկեր) երկարակյաց կենսամոլեկուլների, հատկապես, սպիտակուցների և օրգանոիդների դեգրադացիայի գործընթացն է։ Աուտոֆագին ցանկացած նորմալ բջջի կենսագործունեության մի մասն է, այն կարող են խթանել օրգանիզմում սննդարար նյութերի բացակայությունից առաջացող ազդակները, վնասված օրգանոիդների առկայությունը և վերջապես ցիտոպլազմայում մասամբ բնափոխված սպիտակուցների և նրանց մնացորդների առկայությունը[61]։
Տարբերում են աուտոֆագիայի երեք տեսակ՝ միկրոաուտոֆագիա, մակրոաուտոֆագիա և շապերոն-կախյալ աուտոֆագիա։
ՄԻկրոաուտոֆագիայի ժամանակ մակրոմոլեկուլները և բջջաթաղանթի մնացորդները կլանվում են լիզոսոմի կողմից։ Այսպիսով բջիջը ընդունակ է քայքայել սպիտակուցները էներգիայի կամ կառուցվածքային նյութի բացակայության պայմաններում։ Միկրոաուտոֆագիան տեղի է ունենում նորմալ պայմաններում ևս և ընտրողական գործընթաց չէ։ Միկրոաուտոֆագիայի ժամանակ կարող են կլանվել նաև օրգանոիդները։ Այսպես օրինակ խմորասնկերի մոտ նկարագրված է պերօքսիսոմների և կորիզի մասնակի աուտոֆագիան, որի դեպքում սակայն բջիջը պահպանում է իր կենսագործունեությունը[61]։
Մակրոաուտոֆագիայի ժամանակ ցիտոպլազմայի մի հատվածը, որը պարունակում է որոշ օրգանոիդներ, շրջափակվում է թաղանթային կառուցվածք ունեցող գոյացությամբ, որը նման է էնդոպլազմային ցանցին։ Արդյունքում այդ հատվածը առանձնանում է ցիտոպլազմայի մյուս տեղամասերից երկշերտ թաղանթով։ Այսպիսի երկմեմբրան գոյացություններն անվանվում են աուտոֆագոսոմներ։ Աուտոֆագոսոմները ձուլվում են լիզոսոմների հետ՝ ձևավորելով աուտոֆագոլիզսոսոմներ, որոնցում օրգանոիդները և աուտոֆագոսոմների մյուս պարունակությունը քայքայվում է և մարսվում։ Ենթադրվում է, որ մակրոաուտոֆագիան նույնպես ընտրողական գործընթաց չէ, չնայած հաճախ նշվում է, որ մակրոաուտոֆագիայի միջոցով բջիջը կարող է ընտրողաբար ազատվել ծերացած օրգանոիդներից[61]։
Աուֆոֆագիայի երրորդ տեսակը շապերոն-կախյալ աուտոֆագիան է, որի ժամանակ տեղի է ունենում մասամբ բնափոխված սպիտակուցների ուղղորդված տեղափոխությունը լիզոսոմի թաղանթով դեպի նրա ներսը, որտեղ այս սպիտակուցները քայքայվում են։ Աուտոֆագիայի այս տեսակը նկարագրված է միայն կաթնասունների մոտ և խթանվում է սթրեսով[54]։

JUNQ և IPOD
Սթրեսի ժամանակ, երբ էուկարիոտ բջիջը չի կարողանում հաղթահարել մեծ քանակով չբնափոխված սպիտակուցների առկայությունը, այն կարող է ուղղորդել սպիտակուցները JUNQ և IPOD ժամանակավոր օրգանոիդների մեջ[62]։
JUNQ-ը (անգլ.՝ JUxta Nuclear Quality control compartment, մերձկորիզային գոյացություն, որը կարգավորում է սպիտակուցների որակը), կապված է կորիզաթաղանթի արտաքին թաղանթի հետ և պարունակում է ուբիքվիտինային սպիտակուցներ, որոնք կարող են արագ անցնել ցիտոպլազմա, շապերոններ և պրոտեոսոմներ։ JUNQ-ի ենթադրելի ֆունկցիան սպիտակուցների վերաֆոլդինգն է և/կամ սպիտակուցների դեգրադացիան[25]։
IPOD-ը (անգլ.՝ Insoluble Protein Deposit անլուծելի սպիտակուցների պահպանման վայր) գտնվում է կենտրոնական վակուոլի մոտ և պարունակում է անշարժ ագրեգատներ, որոնք ֆոմիրացնում են սպիտակուցների ամիլոիդները։ Այս սպիտակուցների կուտակումը IPOD-ում կանխարգելում է վերջիններիս փոխհարաբերությունը նորմալ բջջային կառույցների հետ, որի պատճառով ենթադրում են, որ այս գործընթացն ունի պաշտպանական նշանակություն[25]։
Սպիտակուցի ֆունկցիաներն օրգանիզմում
Ինչպես մյուս կենսաբանական մակրոմոլեկուլները (բազմաշաքարներ, լիպիդներ և նուկլեինաթթուներ), սպիտակուցները բոլոր կենդանի օրգանիզմների անհրաժեշտ բաղադրամաս են և խաղում են կարևոր դեր բջջի կենսագործունեությունում։ Սպիտակուցները իրականացնում են նյութափոխանակության գործընթացները։ Նրանք կազմում են ներբջջային կառույցները՝ օրգանոիդները և բջջակմախքը, արտազատվում են միջբջջային տարածություն, որտեղ կարող են իրականացնել միջբջջային հաղորդակցությանը, մասնակցել սննդանյութերի հիդրոլիզին և միջբջջային նյութի ձևավորմանը։
Ըստ գործառույթի` սպիտակուցների դասակարգումը շատ պայմանական է, քանի որ նույն սպիտակուցը կարող է իրականացնել մի քանի ֆունկցիա։ Այսպիսի բազմաֆունկցիոնալ սպիտակուցի օրինակ է լիզիլ-փՌՆԹ-սինթետազը, որը ամինոացիլ-փՌՆԹ-սինթետազ է, այն ոչ միայն միացնում է լիզինի մնացորդը փՌՆԹ-ին, այլև կարգավորում է որոշ գեների տրանսկրիպցիան[63]։
Շատ սպիտակուցներ ունեն ֆերմենտատիվ ակտիվություն։ Ֆերմենտ է շարժողական միոզին սպիտակուցը, կարգավորիչ սպիտակուցներ պրոտեինկինազները, փոխադրիչ սպիտակուց նատրիում-կալիումական ադենոզինֆոսֆատազ և այլն։

Կատալիտիկ ֆունկցիա
Սպիտակուցների ամենից հայտնի ֆունկցիան օրգանիզմում տարբեր քիմիական ռեակցիաների կատալիզն է։ Ֆերմենտները սպիտակուցներ են, որոնք օժտված են յուրահատուկ կատալիտիկ ակտիվությամբ, այսինքն յուրաքանչյուր ֆերմենտ կատալիզում է մեկ կամ համանման ռեակցիաներ։ Ֆերմենտները կատալիզում են բարդ մոլեկուլների ճեղքումը (կատաբոլիզմ) և սինթեզը (անաբոլիզմ), ինչպես նաև ռեպլիկացիան, ռեպարացիան և ՌՆԹ-ի մատրիցային սինթեզը։ 2013 թվականի տվյալներով նկարագրված է ավելի քան 5000 տարբեր ֆերմենտներ[64][65]։ Ֆերմենտների մասնակցությամբ ռեակցիայի արագությունը կարող է շատ շեշտակի աճել։ Օրինակ՝ օրոտիդի-5'-ֆոսֆատդեկարբօքսիլազի կողմից կատալիզվող ռեակցիան 1017 անգամ ավելի արագ է ընթանում չկատալիզվող ռեակցիայի համեմատությամբ[66]։ Այն մոլեկուլները, որոնք միանում են ֆերմենտին և փոփոխվում են ռեակցիայի արդյունքում, անվանվում են սուբստրատներ։
Չնայած որ ֆերմենտները կազմված են հարյուրավոր ամինաթթվային մնացորդներից, սուբստրատի հետ փոխազդում է նրանց միայն մի փոքր մասը, իսկ 3-4` առաջնային կառուցվածքում միմյանցից հեռու դասավորված ամինաթթվային մնացորդներ ուղղակիորեն մասնակցում են կատալիզին[67]։ Ֆերմենտի մոլեկուլի այն հատվածը, որն ապահովում է սուբստրատի միացումը և կատալիզը, անվանվում է ֆերմենտի ակտիվ կենտրոն։
1992 թվականին կենսաքիմիայի և մոլեկուլային կենսաբանության միջազգային միությունը առաջարկեց ֆերմենտների անվանակարգման վերջնական տարբերակ, որը հիմնված էր կատալիզվող ռեակցիայի բնույթի վրա[68]։ Այս անվանակարգման համաձայն՝ ֆերմենտի անվանումը միշտ պետք է ունենա -ազ վերջավորությունը և ձևավորվի կատալիզվող ռեակցիայի և սուբստրատի անվանումներից։ Յուրաքանչյուր ֆերմենտ ստանում է յուրահատուկ կոդ, որով հեշտությամբ հնարավոր է պարզել նրա դիրքը ֆերմենտների հիերարխիայում։ Ըստ կատալիզվող ռեակցիայի բնույթի` ֆերմենտները բաժանվում են 6 դասերի՝
- ՖԴ 1։ Օքսիդոռեդուկտազներ, կատալիզում են օքսիդավերականգնման ռեակցիաները
- ՖԴ 2։ Տրանսֆերազներ, կատալիզում են քիմիական խմբերի տեղափոխումը սուբստրատի մի մոլեկուլից դեպի մյուսը
- ՖԴ 3։ Հիդրոլազներ, կատալիզում են քիմիական կապերի հիդրոլիզը
- ՖԴ 4։ Լիազներ, կատալիզում են քիմիական կապերի ճեղքումն առանց հիդրոլիզի պրոդուկտներից մեկում կրկնակի կապերի առաջացմամբ
- ՖԴ 5։ Իզոմերազներ, կատալիզում են սուբստրատի մոլեկուլում կառուցվածքային և երկրաչափական փոփոխությունները
- ՖԴ 6։ Լիգազներ, դիֆոսֆատային կապի կամ եռֆոսֆատի հիդրոլիզի միջոցով կատալիզում են քիմիական կապերի առաջացումը։
Կառուցվածքային ֆունկցիա
Բջջակմախքի կառուցվածքային սպիտակուցները բջջին և օրգանոիդներին տալիս են որոշակի ձև և մասնակցում են բջջի ձևի փոփոխմանը։ Կառուցվածքային սպիտակուցների մեծամասնությունը ֆիլամենտային է. օրինակ՝ ակտինի և տուբուլինի մոնոմերները՝ գլոբուլյար, լուծվող սպիտակուցներ են, բայց պոլիմերիզացումից հետո առաջացնում են երկար շղթաներ, որոնցից էլ կազմվում է բջջակմախքը[69]։ Կոլագենը և էլաստինը, շարակցական հյուսվածքի (օրինակ՝ աճառի) միջբջջային նյութի կարևոր բաղադրամասերն են, իսկ կերատինից են կազմված մազերը, եղունգները, թռչունների փետուրները և որոշ օրգանիզմների խեցիները։

Պաշտպանական ֆունկցիա
Տարբերում են սպիտակուցների պաշտպանական ֆունկցիայի մի քանի տեսակներ.
- Ֆիզիկական պաշտպանություն։ Օրգանիզմի ֆիզիկական պաշտպանությունը ապահովում է կոլագենը, որը ձևավորում է շարակցական հյուսվածքի միջբջջային նյութը, կերատինը՝ պոզերի, մազերի, փետուրների, թեփուկների և էպիդերմիսի այլ հավելվածների գլխավոր բաղադրամասը։ Այս սպիտակուցները հիմնականում համարվում են կառուցվածքային սպիտակուցները։ Այս սպիտակուցներից է նաև ֆիբրինոգենը և թրոմբինը[70], որոնք մասնակցում են արյան մակարդմանը։
- Քիմիական պաշտպանություն։ Թույների հետ սպիտակուցի մոլեկուլների միացումը կարող է ապահովել դետոքսիկացումը։ Մարդու կարևոր նշանակություն ունեն լյարդի բջիջների դետոքսիկացնող ֆերմենտները, որոնք քայքայում են թույները, դարձնում լուծելի և ապահովում օրգանիզմից արագ դուրսբերումը[71]։
- Իմունային համակարգ։ Սրանք արյան և այլ կենսաբանական հեղուկների կազմի մեջ մտնող պիտակուցներն են, որոնք մասնակցում են վնասվածքի և ախտածինների հանդեպ ձևավորվող իմունային պատասխանի ձևավորմանը։ Կոմպլեմենտի համակարգի սպիտակուցները և հակամարմինները (իմունոգլոբուլինները) մասնակցում են ախտածինների դեմ պայքարին, նրանք չեզոքացնում են բակտերիաները, վիրուսները և օտարածին այլ սպիտակուցներ։ Հակամարմինները կարող են ներզատվել միջբջջային տարածություն կամ ամրանալ հատուկ մասնագիտացած B-լիմֆոցիտների՝ պլազմոցիտների թաղանթների վրա[72]։
Կարգավորիչ ֆունկցիա
Բջջում իրականացվող շատ գործընթացներ կարգավորվում են սպիտակուցների կողմից, որոնք էներգիայի աղբյուր չեն և կառուցվածքային նյութ չեն բջջի համար։ Այս սպիտակուցներն ապահովում են բջջային ցիկլի, տրանսկրիպիցիայի, տրանսլյացիայի, սպլայսինգի (անգլ.՝ splice՝ միահյուսել) և բազմաթիվ այլ գործընթացների կարգավորումը։ Սպիտակուցների կարգավորիչ ֆունկցիան իրականանում է կամ ֆերմենտատիվ ակտիվության կամ այլ մոլեկուլների հետ սպեցիֆիկ կապի շնորհիվ։ Այսպես օրինակ՝ տրանսկրիպցիայի գործոնները, ակտիվատոր սպիտակուցները և ռեպրեսոր սպիտակուցները կարող են կարգավորել գեների տրանսկրիպցիայի ինտենսիվությունը՝ կապվելով կարգավորիչ հաջորդականությունների հետ։ Տրանսլյացիայի մակարդակում շատ ի-ՌՆԹ-ների ընթերցումը կարգավորվում է նաև սպիտակուցային գործոնների միացումով[73]։
Ներբջջային գործընթացների կարգավորման մեջ կարևոր դեր են խաղում պրոտեինկինազները և պոտեինֆոսֆատազները. սրանք այն ֆերմենտներն են, որոնք ակտիվացնում կամ ճնշում են այլ սպիտակուցների ակտիվությունը՝ միացնելով կամ ճեղքելով ֆոսֆատային խումբը։

Ազդանշանային ֆունկցիա
Ազդանշանային ֆունկցիան սպիտակուցների` որպես ազդանշանային նյութեր ծառայելու հատկությունն է։ Սպիտակուցները մասնակցում են բջիջների, հյուսվածքների, օրգանների և օրգանիզմների միջև ազդանշանի փոխանցմանը։ Հաճախ սպիտակուցների ազդանշանային և կարգավորիչ ֆունկցիաները միացվում են, քանի որ շատ ներբջջային կարգավորիչ սպիտակուցներ նույնպես մասնակցում են ազդանշանի փոխանցմանը։
Ազդանշանային ֆունկցիան իրականացնում են սպիտակուց հորմոնները, ցիտոկինները, աճի գործոնները և այլն։
Հորմոնները տեղափոխվում են արյան միջոցով։ Կենդանական հորմոնների մեծամասնությունը սպիտակուցներ են կամ պեպտիդներ։ Ռեցեպտորի հետ հորմոնի միացումն ապահովում է ազդանշանը, որին հաջորդում է բջջի պատասխան ռեակցիան։ Հորմոնները կարգավորում են արյան և բջիջների նյութերի կոնցենտրացիան, աճը, բազմացումը և այլ գործընթացներ։ Այսպիսի սպիտակուցներից է, օրինակ, ինսուլինը, որն արյան մեջ կարգավորում է գլյուկոզի կոնցենտրացիան։
Բջիջները միմյանց հետ փոխազդեցության մեջ են մտնում միջբջջային նյութով փոխադրվող ազդանշանային սպիտակուցների միջոցով։ Այս սպիտակուցներին են պատկանում, օրինակ՝ ցիտոկինները և աճի գործոնները։
Ցիտոկինները պեպտիդային ազդանշանային մոլեկուլներ են, որոնք կարգավորում են այլ բջիջների հետ փոխհարաբերությունը, որոշում նրանց կյանքի տևողությունը, խթանում կամ ճնշում աճը, մասնագիտացումը, ֆունկցիոնալ ակտիվությունը և ապոպտոզը, ապահովում՝ իմունային, ներզատական և նյարդային համակարգերի համակարգված գործունեությունը։ Ցիտոկինների օրինակ է ուռուցի ներկրոզի գործոնը, որը օրգանիզմի բջիջներին է փոխանցում է բորբոքման ազդակները[74]։
Տրանսպորտային ֆունկցիա
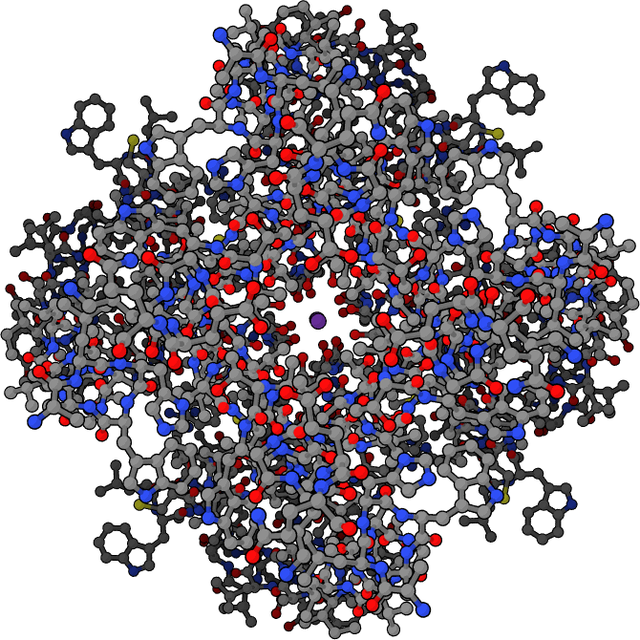
Մանր մոլեկուլների տեղափոխմանը մասնակցող լուծելի սպիտակուցները, պետք է սուբստրատի հետ ունենան մեծ աֆինություն, երբ սուբստրատի կոնցենտրացիան մեծ է, հեշտությամբ ազատվի, երբ սուբստրատի կոնցենտրացիան ցածր է։ Տրանսպորտային սպիտակուցների օրինակ է հեմոգլոբինը և հեմոգլոբինային մյուս սպիտակուցները, որը թթվածինը թոքերից տեղափոխում է հյուսվածքներ և ածխաթթու գազը՝ հյուսվածքներից թոքեր[75]։
Որոշ թաղանթային սպիտակուցներ մասնակցում են թաղանթի միջով փոքր մոլեկուլների տեղափոխմանը՝ փոխելով թաղանթի թափանցելիությունը։ Թաղանթի լիպիդները անջրաթափանց են (հիդրոֆոբ), որը կանխարգելում է բևեռային մոլեկուլների և լիցքավորված իոնների դիֆուզիան։ Մեմբրանային տրանսպորտային սպիտակուցները դասակարգում են սպիտակուց անցուղիներ և սպիտակուց տեղափոխողներ։ Սպիտակուցային անցուղիները ունեն ջրով լցված անցքեր, որոնք թույլ են տալիս իոններին՝ իոնային անցուղիների կամ ջրի մոլեկուլներին՝ ակվապորին սպիտակուցների միջոցով, տեղափոխվել մեմբրանի ներսով։ Շատ իոնային անցուղիներ մասնագիտացած են միայն մեկ իոնի տեղափոխման համար, օրինակ՝ կալցիումային և նատրիումային անցուղիները հաճախ տարբերում են այս իրար նման իոնները և անցկացնում նրանցից միայն մեկը[76]։ Սպիտակուց տեղափոխողները ֆերմենտների պես միանում են իոնին կամ տեղափոխման ենթակա մոլեկուլին և ի տարբերություն անցուղիների տեղափոխումը կարող են իրականացնել ԱԵՖ-ի էներգիայի հաշվին։ ԱԵՖ սինթետազը, որն ԱԵՖ-ի սինթեզն իրականացնում է պրոտոնային գրադիենտի հաշվին, նույնպես կարող է դասվել թաղանթային սպիտակուցների թվին[77]։
Պահեստային ֆունկցիա
Այս սպիտակուցներից են օրինակ սերմնավոր բույսերի բջիջներում և կենդանիների ձվաբջիջներում որպես էներգիայի և կառուցվածքային նյութի պահեստ ծառայող սպիտակուցները (օրինակ՝ 7S և 11S գլոբուլիններ)[78]։ Շատ այլ սպիտակուցներ օրգանիզմում օգտագործվում են որպես ամինաթթուների աղբյուր, որոնք իրենց հերթին մետաբոլիզմը կարգավորող կենսաբանական ակտիվ միացությունների նախորդներն են։
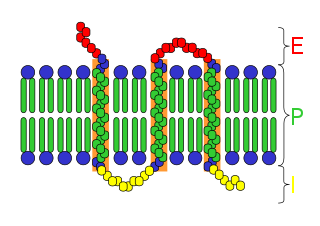
Ռեցեպտորային ֆունկցիա
Սպիտակուցային ռեցեպտորները կարող են գտնվել ինչպես ցիտոպլազմայում, այնպես էլ ներդրված լինել բջջաթաղանթի մեջ։ Մոլեկուլի մի մասը ընդունում է ազդանշանը, որը սովորաբար քիմիական միացություն է, հազվադեպ՝ լույս, մեխանիկական ազդեցություն և այլ ազդակներ։ Մոլեկուլի որոշակի հատվածի վրա տեղի ունեցած ազդեցության հետևանքով սպիտակուց ռեցեպտորը ենթարկվում է կոնֆորմացիոն փոփոխության։ Արդյունքում փոխվում է մոլեկուլի մյուս մասի կոնֆորմացիան, տեղի է ունենում ազդակի փոխանցումը դեպի բջջային մյուս բաղադրամասեր։ Գոյություն ունի ազդակի փոխանցման մի քանի մեխանիզմ։ Որոշ ռեցեպտորներ կատալիզում են որոշակի քիմիական ռեակցիա, մյուսները ծառայում են որպես իոնային անցուղիներ, ազդակի ազդեցությամբ փակվում կամ բացվում են, երրորդները յուրահատուկ կերպով միանում են ներբջջային միջնորդներին։ Մեմբրանային ռեցեպտորների մոլեկուլի այն մասը, որը միանում է ազդանշանային մոլեկուլին, գտնվում է բջջի մակերեսին, իսկ ազդակը փոխանցող դոմենը՝ ներսում[79]։
Շարժողական ֆունկցիա

Շարժողական սպիտակուցների մի ամբողջ խումբ ապահովում է օրգանիզմի շարժումը՝ մկանների կծկումը, այդ թվում լոկոմոցիան (միոզին), օրգանիզմում բջիջների շարժը (օրինակ՝ լեյկոցիտների ամեոբաձև շարժումը), թարթիչների և մտրակների շարժումը, ինչպես նաև ներբջջային ակտիվ ուղղորդված տրանսպորտը՝ կինեզին, դինեին։ Դինեինները և կինեզինները մոլեկուլի տեղափոխումն իրականացնում են միկրոխողովակների երկարությամբ՝ ԱԵՖ-ի հիդրոլիզի էներգիայի հաշվին։ Դինեինները տեղափոխում են մոլեկուլները և օրգանոիդները բջջի ծայրամասային հատվածներից դեպի ցենտրոսոմ, կինեզինները՝ հակառակ ուղղությամբ[80][81]։ Դինեինները ապահովում են նաև էուկարիոտների թարթիչների և մտրակների շարժումը։ Միոզինի ցիտոպլազմային ձևերը կարող են մասնակցել միկրոֆիլամենտներով մոլեկուլների և օրգանոիդների շարժին։
Սպիտակուցները նյութափոխանակության մեջ
Միկրօրգանիզմների և բույսերի մեծ մասն ընդունակ են սինթեզել 20 ստանդարտ ամինաթթուները և այլ լրացուցիչ՝ ոչ ստանդարտ, ինչպիսին օրինակ՝ ցինտրուլինն է։ Եթե ամինաթթուները կան արտաքին միջավայրում, նույնիսկ միկրօրգանիզմներն են պահպանում էներգիան՝ ամինաթթուները տեղափոխելով բջջի ներս և անջատելով կենսասինթետիկ ուղիները[82]։
Այն ամինաթթուները, որոնք կենդանիների օրգանիզմում չեն կարող սինթեզվել անվանվում են՝ անփոխարինելի ամինաթթուներ։ Կենսասինթեզի հիմնական ֆերմենտները, օրինակ՝ ասպարտատկինազը, որը կատալիզում է լիզինի, մեթիոնինի և թրեոնինի ձևավորման առաջին ռեակցիան, բացակայում են կենդանիների մոտ։
Կենդանիները հիմնականում ամինաթթուներն ստանում են սննդի սպիտակուցներից։ Սպիտակուցները քայքայվում են մարսողության ընթացքում, սպիտակուցները թթվային միջավայրում և պրոտեազների միջոցով բնափոխվում են։ Որոշ ամինաթթուներ օգտագործվում են սպիտակուցների սինթեզում, իսկ մնացածը գլյուկոնեոգենեզի ընթացքում վերածվում են գյուկոզի կամ օգտագործվում են Կրեբսի ցիկլում։ Որպես էներգիա սպիտակուների կիրառումը հատկապես կարևոր է քաղցի ժամանակ, երբ օրգանիզմի սեփական սպիտակուցները, հատկապես՝ մկանների սպիտակուցները ծառայում են էներգիայի աղբյուր[83]։ Ամինաթթուները նաև օրգանիզմի համար ազոտի աղբյուր են։
Սպիտակուցների սննդում օգտագործման որոշակի չափանիշ մարդու համար չկա։ Հաստ աղիքի միկրոֆլորայի կողմից սինթեզվում են այնպիսի ամինաթթուներ, որոնք հաշվի չեն առնվում սպիտակուցային նորմերի կազման մեջ։
Ուսումնասիրման մեթոդներ
Սպիտակուցների կառուցվածը և ֆունկցիաներն ուսումնասիրում են ինչպես in vitro՝ մաքրված պրեպարատների վրա, այնպես էլ in vivo՝ օրգանիզմի բնական միջավայրում։ Մաքուր սպիտակուցների ուսումնասիրումը կառավարելի պայմաններում կարևոր թ կինետիկ առանձնահատկությունների, ֆերմենտների կատալիտիկ ակտիվության և այլ ֆունկցիաների որոշման համար։In vivo ուսումնասիրությունը թույլ է տալիս պարզել, թե սպիտակուցը որտեղ է ակտիվ և ինչ ֆունկցիա է կատարում[84]։
Մոլեկուլային և բջջային կենսաբանություն

Մոլեկուլային կենսաբանության մեթոդներն օգտագործվում են բջջում սպիտակուցների սինթեզը և տեղադրությունը ուսումնասիրելու նպատակով։ Լայնորեն կիրառվում է սպիտակուցների տեղագրությունը, որը հիմնված է բջջում քիմերային սպիտակուցների սինթեզի վրա, քիմերային սպիտակուցը կազմված է ուսումնասիրման ենթակա սպիտակուցից միացած այլ սպիտակուցի, օրինակ՝ կանաչ ֆլուրիսցենտ սպիտակուցի հետ (GFP)[85]: Այս սպիտակուցի տեղադրությունը կարելի է տեսնել ֆլոուրիսցենտ մանրադիտակի օգնությամբ[86]։ Բացի այդ, սպիտակուցների տեղադրությունը կարելի է որոշել նաև նրանց միացող հակամարմինների միջոցով, որոնք իրենց հերթին կրում են ֆլոուրիսցենտ նշում։ Հաճախ ուսումնասիրվող սպիտակուցի հետ պատկերում են նաև օրգանոիդների սպիտակուցները, որը թույլ է տալիս ավելի ճշգրիտ որոշել սպիտակուցի տեղադրությունը բջջում[87]։
Իմունոքիմիական մեթոդներում կիրառվում են ֆերմենտների հետ կոնյուգացվող հակամարմիններ, որի արդյունքը բերում է ռեակցիայի գունավորմանը, ինչը հնարավոր է դառնում քանակապես որոշել։ Ավելի հազվադեպ օգտագործվում է բջջային ֆրակցիաների սպիտակուցների ուլտրացենտրիֆուգման մեթոդը՝ սախարոզի կամ ցեզիումի քլորիդի հետ[88][89]։
Դասական մեթոդներից է նաև իմունոէլեկտրոնային միկրոսկոպիան, որը սկզբունքորեն նման է իմունոֆլոուրիսցենտ միկրոսկոպիային, այն տարբերությամբ, որ օգտագործվում է էլեկտրոնային մանրադիտակ։ Ուսումնասիրման ենթակա նմուշը պատրաստվում է էլեկտրոնային մանրադիտակով ուսումնասիրման, մշակվում հակամարմիններով, որոնք իրենց հերթին միացած են էլեկտրոնային-դիմացկուն նյութի, որպես կանոն՝ ոսկու հետ[90]։
Սայտ-ուղղորդված մուտագենեզի միջոցով հետազոտողները կարող են որոշել սպիտակուցի ամինաթթվային հաջորդականությունը, արդյունքում՝ նրա տարածական կառուցվածքը, տեղադրությունը բջջում և ակտիվության կարգավորումը։ Այս մեթոդի և փՌՆԹ-երի միջոցով[91] հնարավոր է նաև սպիտակուց մտցնել սինթետիկ ամինաթթուներ և ստանալ նոր հատկություններով սպիտակուցներ[92]։
Կենսաքիմիա

Սպիտակուցի in vitro անալիզի համար, սպիտակուցը պետք է մաքրված լինի բջջային բաղադրամասերից։ Այս գործընթացը սովորաբար սկսվում է բջջի քայքայումով և այսպես կոչված բջջային էքստրակտի ստացումով։ Ապա ցենտրիֆուգման և ուլտրացենտրիֆուգման մեթոդներով այս էքստրակտը բաժանվում է ֆրակցիաների, որոնք պարունակում են՝ լուծված սպիտակուցները, մեմբրանային լիպիդները և սպիտակուցները, բջջի օրգանոիդները և նուկլեինաթթուները։
Աղայնացման մեթոդով սպիտակուցների նստեցումը կիրառվում է սպիտակուցային խառնուրդների բաժանման համար, նաև թույլ է տալիս խտացնել սպիտակուցները։ Սեդիմենտացիոն անալիզը (ցենտրիֆուգացումը) թույլ է տալիս ըստ սվեդբերգներով (S) չափվող սեդիմենցիայի հաստատունի արժեքի շերտավորել սպիտակուցային խառնուրդները[93]։ Անհրաժեշտ մոլեկուլային զանվածին, լիցքին, աֆինությանը համապատասխանող սպիտակուցները առանձնացնելու համար հետագայում խառնուրդը բաժանվում է քրոմատոգրաֆիայով[94][95]։ Բացի այդ, սպիտակուցները կարող են բաժանվել իրենց լիցքի հիման վրա՝ էլեկտրաֆոկուսավորման միջոցով[96]։
Սպիտակուցների մաքրման գործընթացը պարզեցնելու նպատակով, հաճախ օգտագործում է գենետիկական ինժեներիան, որը թույլ է տալիս ստեղծել սպիտակուցների ածանցյալներ։
«Նշագրերը» (մարկերները) կարճ ամինաթթվային հաջորդականություններ են, օրինակ՝ հիստիդինի 6 և ավելի մնացորդներից կազմված շղթաներ, որոնք ամրանում են սպիտակուցի ծայրերից մեկին։ Երբ համապատասխան նշագրված սպիտակուցը սինթեզած բջիջների էքստրակտը անցկացնում են նիկելի իոններ պարունակող քրմոատոգրաֆի միջով, հիստիդինը կապվում է նիկելի հետ և ամրանում քրոմատոգրաֆի սյունակին, իսկ լիզատի մյուս բաղադրամասերը առանց որևէ արգելքի անցնում են սյունակով։ Աֆինային քրոմատոգրաֆիայի միջոցով տարբեր սպիտակուցներ առանձնացնելու համար նախագծված են այլ նշագրեր նույնպես[97]։
Սպիտակուցի մաքրության աստիճանը կարելի է որոշել, երբ տարբեր տեսակի գել-էլեկտրոֆորեզների միջոցով հայտնի է սպիտակուցի մոլեկուլային զանգվածը և իզոէլեկտրական կետը, նաև՝ ֆերմենտային ակտիվության չափմամբ, եթե սպիտակուցը ֆերմենտ է։ Մաս սպետկրոմետրիան թույլ է տալիս նույնականացնել առանձնացված սպիտակուցը ըստ մոլեկուլային զանգվածի և հատվածի զանգվածով[98]։
Նմուշում սպիտակուցների քանակի որոշման համար, օգտագործվում են մի շարք մեթոդներ[99]
- բիուրետային մեթոդ
- միկրոբիուրետային մեթոդ
- Բրեդֆորդի մեթոդ
- Լոուրիի մեթոդ
- սպեկտրոֆոտոմետրիկ մեթոդ
Պրոտեոմիկա
Բջջի սպիտակուցների ընդհանրությունն կոչվում է պրոտեոմ, իսկ պրոտեոմի հետազոտությունը՝ պրոտեոմիկա՝ գենոմիկայի նմանությամբ։ Պրոտեոմիկայի հիմնական էքսպերիմենտալ մեթոդները ներառում են՝
- 2D-էլեկտրոֆորեզը, որը թույլ է տալիս առանձնացնել բազմաբաղադրիչ սպիտակուցային խառնուրդները[100],
- մաս-սպեկտրոմետրիա, որը թույլ է տալիս նույնականացնել սպիտակուցներն՝ ըստ նրանց կազմի մեջ մտնող մեծ թափանցելիություն ունեցող պեպտիդների մոլեկուլային զանգվածի[101];
- սպիտակուցային միկրոչիպեր, որոնք թույլ են տալիս միաժամանակ չափել մեծ քանակով սպիտակուցների պարունակությունը բջջում[102];
- խմորասնկային երկհիբրիդային սքրինինգ (անգլ.՝ Two-hybrid screening), որը թույլ է տալիս ուսումնասիրել սպիտակուց-սպիտակուցային փոխհարաբերությունները[103]
Կենսաբանորեն նշանակալի սպիտակուցների բոլոր փոխհարաբերությունների ամբողջությունն անվանում են ինտերակտ[104]։ Սպիտակուցների կառուցվածքի համակարգային ուսումնասիրությունը, որը ներկայացնում է երրորդային կառուցվածքի բոլոր հնարավոր տեսակները, անվանում են կառուցվածքային գենոմիկա[105]։
Կառուցվածքի կանխագուշակում և մոդելավորում

Սպիտակուցի տարածական կառուցվածքի կանխագուշակումը համակարգչային տեխնիկայի միջոցով (in silico) թույլ է տալիս կառուցել սպիտակուցների մոդելներ, որոնց կառուցվածքը դեռևս չի որոշվել փորձնականորեն[106]։ Ամենահաջող կանխագուշակման ձևը կոչվում է հոմոլոգ մոդելավորում և հիմնվում է գոյություն ունեցող կաղապարային կառույցի վրա, որը ամինաթթվային հաջորդականությամբ նման է մոդելավորվող սպիտակուցին[107]։ Սպիտակուցների տարածական կառուցվածքի կանխագուշակման մեթոդները լայնորեն կիրառվում են սպիտակուցների գենային ինժեներիայի զարգացման ուղղության մեջ․ մեթոդների միջոցով ստացվում են սպիտակուցի նոր երրորդային կառույցներ[108]։ Ավելի բարդ խնդիր է միջմոլեկուլային փոխհարաբերությունների և սպիտակուց-սպիտակուց փոխհարաբերությունների կանխագուշակումը[109]։
Ֆոլդինգը և միջմոլեկուլային փոխազդեցությունները կարող են մոդելավորվել մոլեկուլային մեխանիկայի և հատկապես մոլեկուլային դինամիկայի ու Մոնտե Կառլոյի մեթոդի միջոցով, որոնք ավելի ու ավելի շատ են կիրառում զուգահեռ և ցրված հաշվարկման առավելությունները (օրինակ՝ Folding@home նախագիծը[110])։ Փոքր α-պարույրավոր սպիտակուցների դոմենների ֆոլդինգը, ինչպիսին, օրինակ, վիլինն է[111] կամ ՄԻԱՎ-ի սպիտակուցներից մեկը[112], հաջողությամբ մոդելավորվել է in silico: Մոլեկուլային դինամիկան քվանտային մեխանիկայի հետ միավորող հիբրիդային մեթոդների օգնությամբ ուսումնասիրվել է տեսողական ռոդոպսին գունանյութի էլեկտրոնային վիճակը[113]։
Տես նաև
Նշումներ
- Քիմիական տեսակետից բոլոր սպիտակուցները պոլիպեպտիդներ են։ Սակայն կարճ, մինչև 30 ամինաթթվային մնացորդներ պարունակող պոլիպեպտիդները, հատկապես, երբ արհեստական են սինթեզվել, սպիտակուցներ չեն անվանվում
Ծանոթագրություններ
Գրականություն
Արտաքին հղումներ
Wikiwand - on
Seamless Wikipedia browsing. On steroids.