Loading AI tools
De Wikipédia, l'encyclopédie libre
Les métallocènes sont des complexes organométalliques de type sandwich ayant pour formule générale (η5-C5H5)2MII, souvent écrite M(C5H5)2, où MII est un élément métallique à l'état d'oxydation +2 entre deux ligands cyclopentadiényle (η5-C5H5) parallèles[1]. La notation « η5 » indique que l'atome de métal est lié par une liaison haptique aux cinq atomes de carbone de chaque cycle cyclopendadiényle. Ces derniers sont généralement abrégés « Cp », de sorte que les métallocènes s'écrivent fréquemment Cp2M. Le ferrocène Fe(C5H5)2 est le représentant typique de cette famille de composés, dont la découverte en 1951 constitue un jalon important de l'histoire de la chimie organométallique.

Au-delà de cette définition initiale restrictive sont également considérés comme métallocènes des composés sandwich dont les ligands cyclopentadiényle ne sont pas liés tous les deux à l'atome métallique par une liaison pentahapto η5 ou ne sont pas coplanaires, des polymères (en) de sandwiches métalliques de cyclopentadiényles, voire des composés « demi-sandwich » de cyclopentadiényle, également dits en tabouret de piano, et des dimères de tels composés[2]. Par extension, on assimile aux métallocènes les actinocènes (η8-C8H8)2AnIV, composés sandwich d'actinides à l'état d'oxydation +4 et de dianions cyclooctatétraénure [C8H8]2−, tels que l'uranocène (η8-C8H8)2U et le plutonocène (η8-C8H8)2Pu. On estime que plus de 80 % des complexes organométalliques connus sont des complexes métalliques de cyclopentadiényle[3].
Les métallocènes ont de nombreuses utilisations. Ils sont utilisés pour fabriquer des diodes électroluminescentes. Les dérivés de métallocènes tels que le dichlorure de titanocène Cp2TiCl2 sont utiles comme catalyseurs pour la polymérisation d'alcènes avec un rendement et une sélectivité élevés. Les dérivés cationiques de métallocènes du groupe 4 de type [Cp2ZrCH3]+ sont ainsi des catalyseurs Ziegler-Natta. En cancérologie, certains dérivés de métallocènes, tels que les dichlorures de titanocène, de niobocène, de molybdocène et de rhénocène présentent des propriétés cytostatiques. Par ailleurs, le ferrocène Cp2Fe et le MMT MeCpMn(CO)3 peuvent être utilisés pour augmenter l'indice d'octane des carburants (en remplacement du plomb tétraéthyle PbEt4) et pour améliorer leur combustion.
En 1973, le chimiste allemand Ernst Otto Fischer et le chimiste britannique Geoffrey Wilkinson reçurent le prix Nobel de chimie pour leurs travaux sur les composés organométalliques de type sandwich et l'élucidation de la liaison dans le ferrocène[4].
La plupart des métallocènes sont à base de métaux de transition. Le ferrocène (η5-C5H5)2Fe est ainsi le premier d'entre eux à avoir été caractérisé, en 1951[5], puis des métallocènes ont été produits avec une série d'autres métaux de transition, comme le nickelocène (η5-C5H5)2Ni[6], le cobaltocène (η5-C5H5)2Co[7], le chromocène (η5-C5H5)2Cr[8], le vanadocène (η5-C5H5)2V[9], le rhodocène (η5-C5H5)2Rh[10], le ruthénocène (η5-C5H5)2Ru[11], l'osmocène (η5-C5H5)2Os[12] ou encore le rhénocène (η5-C5H5)2Re[13]. Certains métallocènes sont à base de métaux alcalino-terreux, comme le magnésocène (η5-C5H5)2Mg[14], ou de métaux pauvres, comme le plombocène (η5-C5H5)2Pb[15]. Le béryllocène (η1-C5H5)(η5-C5H5)Be[16] se distingue par le glissement d'un ligand cyclopentadiényle par rapport à l'autre, avec une configuration qui tend vers (η3-C5H5)(η5-C5H5)Be en phase gazeuse[17].
Les cycles cyclopentadiényle ne sont pas parallèles dans le stannocène (η5-C5H5)2Sn[18], tandis que le manganocène [(η5-C5H5)2Mn]n est polymérique[19]. Certains, comme le zirconocène (η5-C5H5)2Zr[20], nécessitent des ligands stabilisateurs pour exister, donnant par exemple le dichlorure de zirconocène (η5-C5H5)2ZrCl2[21], le dichlorure de titanocène (η5-C5H5)2TiCl2[21] et le dichlorure d'hafnocène (η5-C5H5)2HfCl2[22], dans lesquels le métal, dans le groupe 4, est à l'état d'oxydation +4 ; d'autres dichlorures de métallocènes existent, tels que le dichlorure de vanadocène (η5-C5H5)2VCl2[21], le dichlorure de niobocène (η5-C5H5)2NbCl2[21] et le dichlorure de molybdocène (η5-C5H5)2MoCl2[23].
Les métallocènes de métaux de transition du groupe 4 sont trop déficients en électrons pour exister sans ligands additionnels conduisant à l'inclinaison des plans des cycles cyclopentadiényle à un angle d'environ 130° tout en augmentant le nombre d'électrons de valence[2]. Outre les dichlorures ci-dessus, dont des dérivés utilisés avec du méthylaluminoxane (MAO) donnent des catalyseurs de Kaminsky employés comme catalyseurs Ziegler-Natta, il existe également un certain nombre de réactifs utilisés en chimie organique formés de tels métallocènes portant divers types de ligands additionnels :
Il est possible de contraindre un titanocène ou un zirconocène dans une configuration coplanaire à l'aide de ligands pentaméthylcyclopentadiényle C5(CH3)5, stériquement encombrants :
La structure sandwich standard à ligands cyclopentadiényle coplanaires s'observe parmi les métallocènes de métaux de transition de la période 4 du tableau périodique entre le groupe 5 et le groupe 10 — hormis le manganocène Cp2Mn dans le groupe 7 — à savoir Cp2V, Cp2Cr, Cp2Fe, Cp2Co et Cp2Ni, ainsi que le long du groupe 8 avec Cp2Fe, Cp2Ru et Cp2Os et quelques exemples dans le groupe principal tels que Cp2Mg et Cp2Pb[2]. Les complexes η5, η5-Cp2M coplanaires peuvent être en conformation éclipsée ou en conformation décalée, avec une barrière de potentiel très faible entre les deux pour les cycles de cyclopentadiène non substitués ; l'énergie d'activation du ferrocène, du ruthénocène et de l'osmocène est ainsi comprise entre 8 et 21 kJ/mol[2].
Le fait de lier les ligands cyclopentadiényle par un pont d'un côté de l'atome métallique donne un ansa-métallocène, qui sont souvent des catalyseurs aux propriétés intéressantes. Les [n]métallocénophanes, caractérisés par un pont –(CH2)n−, sont des exemples de tels ansa-métallocènes, comme le [4]ferrocénophane (CH2)4Cp2Fe[24],[25]. Certains auteurs étendent également la désignation de métallocène à des complexes de bis(cyclooctatétraénure) (η8-C8H8)2MIV, où le métal M est à l'état d'oxydation +4, typiquement des actinocènes tels que l'uranocène (η8-C8H8)2U[26], le neptunocène (η8-C8H8)2Np[27], et le plutonocène (η8-C8H8)2Pu[27].

Le premier complexe cyclopentadiényle de métal alcalin, le cyclopentadiénure de potassium K(C5H5), a été préparé par Johannes Thiele en 1901, mais sa structure n'a pu être élucidée qu'en 1997[28]. Dans le cristal, les ions de potassium K+ et cyclopentadiénure Cp− forment une chaîne linéaire dans laquelle les atomes de potassium sont placés au centre des cycles Cp, qui sont inclinés les uns par rapport aux autres[28]. De telles structures ont été observées dans les cristaux de cyclopentadiénure de rubidium Rb(C5H5) et de césium Cs(C5H5). En revanche, le cyclopentadiénure de lithium Li(C5H5) et le cyclopentadiénure de sodium Na(C5H5) forment une chaîne linéaire idéale dans laquelle les cycles Cp sont parallèles[28]. Ainsi, l'angle des liaisons Cp–M–Cp vaut 180° pour LiCp et NaCp, puis 138° pour KCp, 132° RbCp et 130° pour CsCp[28].
Les deux cycles cyclopentadiényle coplanaires de l'anion lithocène Cp2Li− adoptent une conformation décalée, avec une liaison Li–Cp longue de 201 pm[29],[30],[31]. En raison des relations diagonales dans le tableau périodique, les complexes de Cp2Li− ont des propriétés semblables au magnésocène Cp2Mg. Les complexes organolithiens présentent des liaisons ayant une forte composante covalente, ce qui peut conduire à de fortes distorsions du carbanion. Cette composante covalente diminue fortement dans les homologues plus lourds, et le potassium est presque exclusivement ionique[32].

Des complexes de bis(cyclopentadiényle) ont été synthétisés pour tous les métaux alcalino-terreux[33]. Le béryllocène Cp2Be a été synthétisé pour la première fois en 1959 par Ernst Otto Fischer à partir de chlorure de béryllium BeCl2 et de cyclopentadiényle de métal alcalin[34]. Le magnésocène Cp2Mg a été synthétisé indépendamment par Ernst Otto Fischer et Geoffrey Wilkinson en 1954. Il peut être obtenu en dismutant du bromure de cyclopentadiénylmagnésium CpMgBr ou en faisant réagir du magnésium métallique avec du cyclopentadiène C5H6 à 500 °C. Les complexes bis(cyclopentadiényle) de calcium, de strontium et de baryum ont également été décrits pour la première fois en 1961 par Ernst Otto Fischer. Ils peuvent être obtenus en faisant réagir du calcium métallique ou du strontium avec du cyclopentadiène dans du THF ou du DMF, ou en faisant réagir les hydrures correspondants de calcium, de strontium et de baryum avec du cyclopentadiène[33]. La co-condensation du baryum métallique avec du cyclopentadiène à −196 °C donne un rendement presque quantitatif.
Parmi les métallocènes alcalino-terreux, seul le magnésocène présente la structure sandwich classique, avec une conformation décalée dans le cristal avec une distance Mg–Cp de 230 pm, mais présente une conformation éclipsée en phase gazeuse, avec une liaison Mg–Cp allongée. La géométrie moléculaire du beryllocène dépend de son état de condensation, avec à l'état solide une configuration sandwich (η1-C5H5)(η5-C5H5)Be dans laquelle l'un des cycles cyclopentadiényle a glissé par rapport à l'autre, avec une liaison Be–Cp d'environ 181 pm[35],[36], et à l'état gazeux l'un des cycles sensiblement plus éloigné du béryllium que l'autre (190 pm contre 147 pm), les deux cycles apparaissant liés η5 en raison d'une fluctuation des liaisons plus rapide[37]. La configuration η1, η5-Cp2Be s'explique par le fait que les orbitales du béryllocène ne peuvent être occupées que par un maximum de 8 électrons de valence.

Les terres rares ne forment généralement pas de complexes de type sandwich classiques. On obtient des complexes de formule générale Cp3M par réaction de cyclopentadiénure de sodium Na(C5H5) avec les halogénures correspondants. De tels composés ont ainsi été synthétisés pour toutes les terres rares[38]. Tous ces complexes de terres rares de type Cp3M ont des propriétés chimiques semblables. Ils sont insolubles dans l'éther de pétrole, le cyclohexane et le benzène, et légèrement solubles dans la pyridine, le THF, le diméthoxyéthane et le 1,4-dioxane. Ils se décomposent rapidement au contact de l'eau en hydroxydes métalliques et en cyclopentadiène, ainsi qu'au contact de l'air. Ils réagissent rapidement et quantitativement avec le chlorure de fer(II) dans le THF pour former du ferrocène. Les propriétés chimiques et physiques de ces complexes, comme la susceptibilité magnétique proche des ions correspondants, impliquent qu'il s'agit de composés ioniques.
Il existe cependant aussi des complexes de terres rares de type Cp2M. Les complexes bis(cyclopentadiényle)lanthanide(II) de samarium, d'europium et d'ytterbium sont connus depuis longtemps. Ils tendent à former des complexes de type Cp2(THF)2 avec les solvants tels que le THF. Des complexes Cp2Eu et Cp2Yb ont été obtenus en 1964 dans l'ammoniac liquide et purifiés par sublimation[39]. Il est également possible d'employer des ligands pentaméthylcyclopentadiényle (CH3)5C5, notés Cp*, pour obtenir des sandwiches de terres rares tels que Cp*2Sm, obtenu sans solvant en 1984[40]. La cristallographie aux rayons X a montré que Cp*2Sm et Cp*2Eu présentent une structure sandwich coudée avec un angle de 140°[41].

Tout comme les terres rares, les actinides ne forment pas de complexes de type sandwich classiques mais plutôt des complexes de formule générale Cp3An. Ces derniers, et leurs adduits Cp3An·THF ont été obtenus dans les années 1965-1974 par métathèse avec du cyclopentadiénure de sodium Na(C5H5) ou par transmétallation avec du béryllocène Cp2Be ou du magnésocène Cp2Mg[42]. Il est également possible d'obtenir ces composés par réduction de complexes d'halogénures tétravalents Cp3AnX, par exemple avec de l'amalgame de sodium Na(Hg) sur du chlorure de tris(cyclopentadiényle)uranium Cp3UCl :
Il existe un grand nombre de complexes de cyclopentadiényle des groupes 4 à 12. Seuls ceux du groupe 8 comptents 18 électrons et sont donc particulièrement stables. Ceux situés à gauche du groupe 8 dans le tableau périodique complètent les électrons manquants par l'acquisition de ligands supplémentaires ou par dimérisation ou oligomérisation, tandis que ceux situés à droite réduisent leur excès d'électrons par oxydation ou en réduisant le nombre de liaisons haptiques avec leurs ligands.
Sur la 4e période, les métallocènes du vanadium au nickel — Cp2V, Cp2Cr, Cp2Mn, Cp2Fe, Cp2Co et Cp2Ni — existent sous forme de composés isolables. Ils sont tous isomorphes et ont un point de fusion voisin de 173 °C[43]. Sur la 5e période, seuls les métallocènes du ruthénium et du rhodium — Cp2Ru et Cp2Rh — sont isolables, et seul celui d'osmium — Cp2Os — est isolable sur la 6e période.

Dans le prolongement des métaux de transition, des métallocènes de métaux pauvres du groupe 12 ont été obtenus à la fin des années 1970. Le zincocène Cp2Zn a été obtenu en 1969 par Ernst Otto Fischer, avec une structure chaînée dans laquelle les cycles cyclopentadiényle alternent avec les atomes de zinc, qui portent chacun un cycle cyclopentadiényle terminal supplémentaire[44]. Le cadmocène Cp2Cd a été décrit en 1969 par Jörg Lorberth, avec une structure vraisemblablement polymérique (en) en raison de son insolubilité dans les solvants apolaires et de sa température de décomposition supérieure à 250 °C[45]. Des monomères de dérivés de cadmocène avec une hapticité η1, η1 ou η1, η2 ont été obtenus à l'aide de ligands cyclopentadiényle encombrants à substituants isopropyle ou tert-butyle.
D'autres métallocènes de métaux pauvres ont été obtenus, comme le stannocène Cp2Sn et le plombocène Cp2Pb[15]. Des dérivés de dimétallocènes ont également été produits, comme le décaméthyldizincocène [(η5-C5(CH3)5)Zn]2[46], qui présente une liaison Zn–Zn.
En raison de leurs propriétés chimiques et de leur réactivité différentes, les métallocènes et dérivés de métallocènes ont des utilisations variées dans la recherche et dans leurs applications. Le magnésocène est par exemple utilisé en laboratoire pour le transfert de ligands cyclopentadiényle vers d'autres métaux[47].
Des métallocènes susceptibles d'être décomposés thermiquement ou photochimiquement sont utilisés comme source de vapeur métallique de grande pureté. Le magnésocène Mg(C5H5)2 peut être utilisé pour le revêtement de nanoparticules[48] et dans le procédé d'épitaxie par couche atomique (ALD), permettant par exemple de produire des diodes électroluminescentes (LED) vertes ou bleues[49]. Il est également utilisé comme dopant dans la production de semiconducteurs dopés p par dépôt chimique en phase vapeur (CVD)[50],[51]. Le baryocène Ba(C5H5)2 peut être utilisé par ALD pour déposer des couches minces de titanate de baryum BaTiO3 pour réaliser des résistances et des condensateurs[52]. Il est possible d'ajouter du ferrocène au gazole ou fioul pour favoriser la combinaison de l'oxygène et obtenir une meilleure combustion produisant moins de particules de suie[53].
L'application de loin la plus importante des métallocènes et de leurs dérivés est leur utilisation comme catalyseurs de polymérisation des alcènes pour la production de polyoléfines[54].
Les catalyseurs Ziegler-Natta sont utilisés pour polymériser des alcènes tels que l'éthylène CH2=CH2 ou le propylène CH2=CHCH3 à basse pression et température depuis les années 1950. Dans un mécanisme d'addition-insertion en plusieurs étapes, l'alcène est d'abord lié à un complexe organotitane puis incorporée dans la liaison titane–carbone. L'alcène suivant est ensuite lié au site de coordination qui est libéré dans le processus, et la réaction en chaîne se poursuit par l'incorporation de l'alcène dans la liaison titane–carbone. Les catalyseurs Ziegler-Natta classiques sont des catalyseurs mixtes constitués d'un composé organométallique du groupe 1, du groupe 2 ou groupe 13 (par exemple le triéthylaluminium) dans le groupe principal et d'un composé de métal de transition, principalement du groupe 4, du groupe 5 ou du groupe 6 (par exemple le tétrachlorure de titane) parmi les métaux de transition. Cependant, ils présentent l'inconvénient décisif d'être généralement utilisés comme catalyseurs hétérogènes sur un matériau support, car ils ne sont pas solubles dans les solvants organiques. Par conséquent, en plus des propriétés réelles du catalyseur, les propriétés du matériau de support, la vitesse de diffusion de l'alcène et d'autres réactions d'adsorption jouent également un rôle.
En 1980, Hansjörg Sinn et Walter Kaminsky ont décrit les réactions de polymérisation catalytique de mélanges de dihalogénures de métallocènes (type 1 ci-dessous) avec du méthylaluminoxane (MAO). Ces catalyseurs de Kaminsky permettent la polymérisation de mélanges d'éthylène, de propylène ou d'alcènes avec un rendement et une sélectivité très élevées[55]. Alors que les métallocènes ne montrent qu'une faible activité avec un cocatalyseur alkylaluminium conventionnel, la présence d'un excès de méthylaluminoxane augmente leur réactivité d'un facteur 10 000 ou plus, ce qui les rend cent fois plus actifs qu'un catalyseur Ziegler-Natta traditionnel. Les catalyseurs de Kaminsky sont également solubles dans les hydrocarbures et, contrairement aux catalyseurs Ziegler-Natta, peuvent donc être utilisés directement en solution[56]. Avec les catalyseurs Kaminsky à base de zirconocène, jusqu'à 100 tonnes d'éthylène par gramme de zirconium peuvent être polymérisées avec un temps d'insertion de l'ordre de 10−5 s[56].
Cinq ans plus tard, Walter Kaminsky et Hans-Herbert Brintzinger montrèrent qu'en utilisant des ansa-métallocènes de type 2 (ansa-métallocènes à symétrie C2), il est possible d'obtenir du polypropylène ayant un arrangement strictement isotactique. En augmentant la taille des résidus organiques sur les cycles cyclopentadiényle (comme dans le type 3) et/ou en faisant varier les atomes de pontage, l'activité et la sélectivité peuvent être spécifiquement modulées et la distribution de la masse moléculaire des polymères résultants peut être optimisée dans des limites étroites[54],[56].
Le magnésocène ainsi que le bis(cyclopentadiényl)calcium et le bis(cyclopentadiényl)strontium peuvent également être utilisés comme catalyseurs de polymérisation, par exemple pour le méthacrylate de méthyle (MMA)[50].
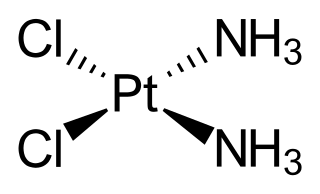
De nombreux dérivés de métallocènes des premiers métaux de transition n'ont pas une structure sandwich classique mais présentent un angle Cp–M–Cp d'environ 130° car ils peuvent coordonner jusqu'à trois ligands supplémentaires. En conséquence, l'atome métallique central est plus facilement accessible et plus réactif, ce qui peut également se traduire notamment par une plus grand bioactivité. Les dichlorures de titanocène Cp2TiCl2, de molybdocène Cp2MoCl2, de niobocène Cp2NbCl2, de vanadocène Cp2VCl2 et de rhénocène Cp2ReCl2 présentent un effet cytostatique[57]. En particulier, des études ont montré que les dérivés du dichlorure de titanocène (η5-C5H5)2TiCl2 ont un effet anticancéreux plus efficaces que le cisplatine [cis-(NH3)2PtCl2] avec une toxicité significativement moindre[58],[59],[60]. En outre, cette efficacité est également démontrée contre les cancers susceptibles de développer une résistance au cisplatine au cours du traitement, ce qui rend la poursuite du traitement plus difficile si des cellules cancéreuses réapparaissent[61]. D'autres études ont montré que les complexes cationiques de dichlorure de niobocène et de dichlorure de molybdocène sont encore plus efficaces que le dichlorure de titanocène[57]. Aucun métallocène n'a été approuvé comme traitement contre les cancers et les recherches continuent[62]. Les essais cliniques du métallocène oncologiquement le plus prometteur, le dichlorure de titanocène, se sont terminées en phase II. Aucun essai de phase III n'a été réalisée en raison de l'activité insuffisante.
Le ferrocène présente une grande stabilité structurelle, à la fois lorsqu'il est neutre et lorsqu'il est sous forme cationique de ferrocénium Fe(C5H5)2+, de sorte qu'il est parfaitement adapté à la mesure de potentiels d'oxydoréduction et pour intervenir dans des réactions d'oxydoréduction. En fixant un dérivé de ferrocène à une glucose oxydase sur une électrode, il est possible de mesurer le courant électrique en présence de glucose dans une solution physiologique par application d'un potentiel électrique. Il est ainsi possible de mesurer la glycémie d'un patient diabétique. La fixation sur un dérivé de ferrocène d'un groupe fonctionnel complexant des cations permet de moduler le comportement rédox d'un dérivé de ferrocène en présence de ces cations ; si ce groupe fonctionnel réagit spécifiquement à certains cations, il devient possible de développer un détecteur spécifique pour ces cations[63].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.