Maladie de Lyme
maladie infectieuse causée par des bactéries Borrelia, transmise par la morsure de tiques De Wikipédia, l'encyclopédie libre
La maladie de Lyme est une maladie vectorielle et une zoonose (maladie infectieuse touchant l'être humain et de nombreux animaux). La maladie de Lyme est nommée d'après les villes de Lyme et Old Lyme, deux villes des États-Unis, dans l'État du Connecticut où elle a été signalée pour la première fois en 1975 et identifiée en 1977. Transmise par morsure de tiques dures du genre Ixodes, c'est une maladie bactérienne, due à une borrélie (Borrelia burgdorferi, au sens strict, prédominante en Amérique du Nord).
Maladie de Lyme
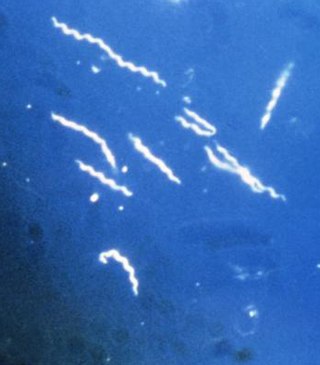
Borrelia burgdorferi, l'un des trois variants connus de la bactérie parasite qui cause la maladie de Lyme. Les borrelia ont une forme serpentine et spiralée caractéristique, d'où leur nom de spirochètes.
| Causes | Borrelia burgdorferi |
|---|---|
| Transmission | Transmission par les tiques (d), Ixodes pacificus et Ixodes scapularis |
| Incubation min | 1 j |
| Incubation max | 44 j |
| Symptômes | Érythème chronique migrant, fatigue, céphalée, arthralgie, myalgie, fasciculation, paresthésie, vertige, trouble du rythme cardiaque, douleur neuropathique chronique (d), fièvre, névrite, méningite, méningoencéphalite (en), myocardite, arthrite, encéphalomyélite (en) et cardiomyopathie hypertrophique |
| Médicament | Ceftriaxone, céfuroxime, amoxicilline, doxycycline et azithromycine |
|---|---|
| Spécialité | Infectiologie, dermatologie, neurologie et cardiologie |
| CIM-10 | A69.2 |
|---|---|
| CIM-9 | 088.81 |
| DiseasesDB | 1531 |
| MedlinePlus | 001319 |
| eMedicine |
330178 ped/1331neuro/521emerg/588 |
| MeSH | D008193 |
| Patient UK | Lyme-disease-pro |
L'expression borréliose de Lyme désigne souvent la « maladie de Lyme européenne », due à une plus grande diversité de borrélies (principalement Borrelia garinii, B. afzelii… ou B. burgdorferi au sens large). Maladie de Lyme et borréliose de Lyme sont souvent synonymes, dues alors à Borrelia burgdorferi au sens large. Les autres borrélioses sont dites fièvres récurrentes (cosmopolite transmise par poux ou régionales par tiques molles).
La maladie se manifeste initialement par une éruption cutanée (érythème migrant) centrée sur une morsure de tique. Non traitée, elle peut évoluer en trois stades de longue durée, caractérisés par une grande diversité car pouvant toucher plusieurs systèmes et organes. Elle se présente alors sous des formes plutôt cutanées, articulaires ou neurologiques, de façon aiguë ou chronique.
La maladie est en expansion, devenue la plus fréquente des maladies vectorielles transmises à l'humain dans l'hémisphère nord. Dans près de 90 % des cas, elle est traitée efficacement par une antibiothérapie de 2 à 4 semaines[1].
L'existence et la signification de formes non guéries par le traitement standard, ou l'attribution de pathologies chroniques à la maladie de Lyme, posent le problème de la « maladie chronique de Lyme ».
La complexité du diagnostic clinique, l'interprétation problématique des tests sérologiques, des lignes directrices contestées pour le diagnostic, le traitement et la gestion antibiotique de la maladie de Lyme chronique entretiennent une controverse sociétale dite Lyme War aux États-Unis ou Scandale de Lyme en France.
Histoire de la maladie
Résumé
Contexte

Les borrélioses existent depuis longtemps :
- d'après les restes d'ADN bactérien retrouvé dans son cadavre, le premier humain connu à avoir été infecté par Borrelia burgdorferi est Ötzi, il y a environ 5 300 ans[2],[3] ;
- l'histoire évolutive de B. burgdorferi en Amérique du Nord a été reconstituée, suggérant sa présence depuis au moins 60 000 ans, longtemps avant l’arrivée des humains dans les Amériques[4] ;
- plusieurs lignées très anciennes et largement distribuées (dont en Amérique du Nord) ont récemment trouvé les conditions d'un développement épidémique (Walter et al., 2017) ; leur diversité et large répartition réfute l’hypothèse d'une émergence liée à des modifications génétiques récentes (en 2019, des discussions sont en cours aux États-Unis pour savoir si la maladie de Lyme a été utilisée comme arme biologique[5],[6]) ; l’émergence de la maladie de Lyme résulte sans doute plus simplement de perturbations anthropiques des écosystèmes et du climat qui ont favorisé des pullulations de tiques et/ou de bactéries et un nombre croissant d'infections humaines[4] ;
- la maladie tire son nom de la ville de Lyme (Connecticut) où elle a été signalée en 1975 pour être identifiée comme consécutive à une morsure de tique en 1977[2],[7]. Mais la plupart de ses manifestations avaient déjà été décrites en Europe, dès la fin du XIXe siècle, mais de façon éparse[7].
Premières descriptions en Europe
- En 1883, un médecin allemand, Alfred Buchwald, décrit (à Breslau) une anomalie de la peau qui semble être ce qu'on nomme aujourd'hui l'acrodermatite chronique atrophiante, mais Buchwald ne l'a pas reliée à une morsure de tique, et ce symptôme ne sera pas présent à Lyme (où la borrélie dominante est différente de celles qu'on trouve en Eurasie) ;
- En 1909, Arvid Afzelius (dermatologue suédois) avait noté l'apparition d'une autre lésion cutanée en forme d'anneau, suivant parfois une morsure de tique Ixodes, et qu'il appelle érythème migrant[2]. En 1913, Bruce Lipschutz (dermatologue autrichien) l'appelle érythème chronique migrant.
- En 1922, les médecins français Garin et Bujadoux associent cette lésion dermatologique avec une atteinte plus générale de paralysie « plus ou moins grave, parfois mortelle, consécutive à la morsure de tiques » (Ixodes hexagonus)[2]. Les deux Français attribuent cette méningoradiculite lymphocytaire (associant parfois une méningite et une polynévrite) à un « virus » qu'il faudrait rechercher non dans le sang mais dans les tissus nerveux.
- En 1934, en Allemagne, l'érythème migrant est décrit en association avec des atteintes articulaires.
- En 1941, l'allemand Alfred Bannwarth (de) associe les atteintes articulaires avec une méningoradiculite de type lymphocytaire (syndrome de Bannwarth ensuite parfois renommé syndrome de Garin-Boujadoux-Bannwarth).
- En 1951, les effets bénéfiques de la pénicilline sur ces affections font penser à une origine bactérienne[7].
Redécouverte aux États-Unis
En 1969, le premier cas documenté d'érythème chronique migrant, survenu chez un chasseur en forêt, est publié aux États-Unis[7].
En 1975, deux mères de la ville de Lyme, ayant des enfants diagnostiqués comme victimes d'une forme d'arthrite rhumatoïde juvénile avaient observé que de nombreux autres enfants de la commune présentaient des problèmes similaires. Alertée, une équipe d'épidémiologistes de l'université Yale, dirigée par Allen Steere, met rapidement en évidence une situation atypique :
- la prévalence d'oligoarthrite était dans cette commune cent fois plus élevée que celle de l’arthrite rhumatoïde juvénile aux États-Unis ;
- les nouveaux cas étaient plus nombreux en été, et nettement répartis en foyers géographiques ;
- 25 % des patients présentaient une association avec un érythème chronique.
Allen Steere (en) nomme alors cette maladie « maladie ou arthrite de Lyme » du nom de la ville, en l'attribuant à une transmission par tique[7] dans un article publié en 1977[8].
De la tique à la bactérie

En 1977, la morsure de la tique Ixodes dammini (devenu Ixodes scapularis) est rapportée à un cas humain d'érythème chronique migrant.
En 1982, Willy Burgdorfer isole la bactérie spirochète responsable de la maladie dans le tube digestif de I. scapularis, dite « tique du cerf » en Amérique du Nord[2]. Après inoculation au lapin, il montre que ce spirochète peut provoquer un érythème migrant. Il observe aussi une forte réaction entre le sérum de malades et la bactérie. C'est en son honneur qu'on nommera en 1984 cette bactérie Borrelia burgdorferi[9]. À la même période, on détecte des spirochètes identiques ou proches en Europe (en Suisse), dans des tiques Ixodes ricinus[10].
La responsabilité de ce spirochète sera confirmée en l'isolant dans le sang, la peau et le liquide cérébrospinal de patients atteints de la maladie de Lyme.
En 1984, le dermatologue allemand Klaus Weber montre une augmentation d'anticorps de type IgG dans le sang de patients présentant une acrodermatite chronique atrophiante, établissant ainsi un premier rapport entre les manifestations précoces et tardives de la maladie[7].
Étiologie
Résumé
Contexte
Agents
Ce sont toujours des bactéries du genre Borrelia, classées parmi les spirochètes en raison de leur caractère serpentiforme et spiralé[11].
Borrelia burgdorferi sl (sensu lato) désigne un « complexe » d'une trentaine d'espèces, dont plusieurs sont pathogènes pour l'humain. Les trois principales étant : Borrelia burgdorferi ss (sensu stricto), B. garinii, B. afzelii. Au début du XXIe siècle, les méthodes de génétique moléculaire (typage moléculaire des bactéries) ont permis de détecter de nouvelles espèces pathogènes pour l'humain : comme B. spielmanii ou B. bavariensis en Eurasie, ou B. bissettii en Eurasie, Amérique, Australie[12].
On a aussi montré (en 2016) que certaines souches d'une même espèce de Borrélie sont plus pathogènes pour l'humain que d'autres[13].
Quelle que soit l'espèce de Borrélie en cause, l'atteinte initiale peut se manifester (parfois) par un érythème migrant ; sinon les évolutions diffèrent. Les associations ne sont pas absolues, mais préférentielles, expliquant en partie la prédominance géographique de certaines formes compliquées de la maladie[14].
- En Amérique du Nord, B. burgdorferi ss (sensu stricto) prédomine de façon quasi-exclusive, en provoquant surtout l'arthrite de Lyme et des douleurs de type rhumatismales (mais toujours sans acrodermatite).
- En Eurasie, B. burgdorferi ss est plus rare, alors que les B. burgdorferi sl (sensus lato) prédominent en ciblant aussi d'autres organes. En Europe les deux agents les plus présents sont Borrelia garinii qui provoque surtout des atteintes neurologiques ou « neuroborrélioses » et Borrelia afzelii, qui cause surtout des atteintes cutanées, notamment l'acrodermatite chronique atrophiante[14],[15]. Le type de bactérie peut varier dans l'espace et dans le temps mais, par exemple, une analyse des génospécies a été faite dans 710 tiques retirées de janvier à décembre 2009 de la peau de soldats allemands s'entrainant dans la zone de Seedorf (nord-ouest de l'Allemagne) : 84 % des borrelia étaient de l'espèce B. afzelii, 11 % étaient B. burgdorferi, 3 % étaient B. garinii et 3 % étaient B. spielmanii[16] (remarque : 99,2 % des tiques étaient de l'espèce I. ricinus, 0,7 % étaient I. hexagonus et 0,1 % H. concinna)[16].
Vecteurs
Tiques

Les vecteurs sont surtout des tiques du genre Ixodes[2]. Ces vecteurs majeurs ont en commun d'avoir un cycle de transmission à trois hôtes successifs[2], en forêt ou prairie humide, de 2 à 7 ans selon l'espèce et le climat.
En Amérique du Nord, le vecteur principal est Ixodes scapularis [=I. dammini], dans le nord-est et le Midwest. Tous les stades, surtout nymphes et adultes femelles peuvent mordre l'humain[2]. Ixodes pacificus, source de 5 % environ des cas déclarés aux États-Unis, se trouve plutôt dans l'Ouest. Son efficacité pathogène sur l'humain est moindre (seul le stade adulte semble mordre l'humain).
En Eurasie et surtout en Europe, le principal vecteur est Ixodes ricinus. Elle prédomine dans les régions boisées, en piquant l'humain à tous les stades (larves et nymphes au printemps, adultes à la fin de l'été).
En Eurasie tempérée et froide, surtout Asie et dans presque toute l'ex-URSS, le principal vecteur est Ixodes persulcatus.
Certains arthropodes hématophages tels que les taons, les moustiques… pourraient être des vecteurs potentiels de Lyme. Ce rôle éventuel de vecteur accessoire est en discussion.
Relations entre tiques et borrélies
La proportion de tiques infectées varie beaucoup selon le stade de développement, les espèces, les saisons et les régions : moins de 2 % des I. pacificus en Californie, jusqu'à 30 % de tiques contaminées en France, 60 % en Autriche[17], et 100 % à Long Island[18].
En France, une étude menée en 2021 par l'INRAE montre que 15 % des tiques qui mordent les êtres humains seraient porteuses de bactéries Borrelia bugdorferi sensu lato[19].
La bactérie se développe en deux stades : elle se multiplie d'abord dans l'intestin moyen de la larve, à ce stade, la bactérie est « non motile », c'est-à-dire incapable de se déplacer par ses propres moyens. Puis, dans une seconde phase, sous l'effet du repas de sang (d'un premier hôte petit rongeur), la bactérie devient motile et capable de pénétrer l'hémocœle de la tique, et de gagner les « glandes salivaires » de la nymphe ou de la tique adulte[20].
De là, elle passe dans la salive et est injectée chez les hôtes suivants (mammifère, oiseau, reptile…). Ceci explique pourquoi c'est généralement via la morsure d'une nymphe de tique, et non par morsure de larve, que la bactérie est transmise aux grands mammifères[21].
De façon exceptionnelle[12], la bactérie peut aussi diffuser vers les ovaires de la tique, ce qui donne lieu à une transmission transovarienne dite « verticale », la tique transmettant directement la bactérie à sa descendance. Ceci explique que, dans ces cas là, une larve de tique peut être infectante, avant même d'avoir effectué un repas sanguin[18].
En 2017, l'INRA a lancé un projet de sciences citoyennes pour une meilleure connaissance des vecteurs de la maladie de Lyme[22], en lien avec le plan national de lutte contre la maladie de Lyme[23]. Une application pour Smartphone permet notamment à chaque citoyen de signaler les morsures de tiques, et ceux-ci sont invités à transmettre les tiques aux laboratoires pour les analyser et ainsi mieux connaître la répartition des espèces de vecteurs et de borrélies.
Réservoirs

Le réservoir des borrelia est constitué par des petits rongeurs, hôtes principaux des tiques au stade de larves ou de nymphes. À ce stade initial, les larves et nymphes se nourrissent d'abord sur une même espèce de petit rongeurs. Au début de l'été, les nymphes infectées contaminent leur hôte, et à la fin de l'été l'hôte infecté contamine les larves. Les larves infectées muent, deviennent nymphes et le cycle recommence l'année suivante[24]. Ce cycle initial est essentiel pour le maintien des borrelia dans la nature.
En poursuivant leur développement (de la nymphe à l'adulte), les tiques contaminées transmettent la bactérie à d'autres hôtes (rongeurs, grands mammifères, oiseaux, parfois reptiles)[25]. À ce stade, les tiques se reproduisent et le cycle recommence. Cette partie du cycle est indispensable pour le maintien des tiques, mais pas pour les borrelia.
Les espèces qui jouent un rôle réel de réservoir peuvent varier selon les pays et régions. En Europe, plus de 300 espèces ont été ainsi identifiées : ce sont majoritairement les petits rongeurs, mais aussi les mammifères de taille moyenne (renard, lièvre…) ou de grande taille comme les cervidés, ou encore les oiseaux. Ces espèces-réservoirs sont celles d'animaux sauvages vivant en zone boisées, broussailles, prairies, humides et tempérées… en contact régulier et permanent avec l'habitat habituel des tiques. Les cycles européens paraissent plus complexes et plus variés qu'en Amérique.
En Amérique du Nord, contrairement à l'Europe, les espèces-réservoirs prédominantes se distinguent plus nettement. Par exemple, dans le nord-est et le Midwest : la souris à pattes blanches et le cerf de Virginie[26]. Les oiseaux migrateurs pourraient jouer un rôle dans l'expansion des tiques au Canada[24].
Des animaux domestiques peuvent aussi être infectés, en particulier les chiens, les moutons, bovins et chevaux[27], lesquels peuvent présenter des atteintes articulaires (chevaux)[28] ou rénales (chiens)[29] contrairement aux espèces sauvages à infections inapparentes.
L'humain qui s'insère dans ce cycle, en s'exposant aux tiques, est en fait un hôte accidentel terminal des tiques[14].
Co-infections
Une même tique peut injecter dans son hôte jusqu’à cinq agents pathogènes différents, ensembles ou de façon différée[30], la co-infection par plusieurs espèces de Borrelia chez les tiques semblant même être la règle plutôt que l'exception[31].
Ainsi des co-infections possibles, transmises par les tiques à l'humain sont :
- aux États-Unis, la tique Ixodes scapularis transmet souvent aussi Anaplasma phagocytophilum (agent de l'ehrlichiose humaine), et moins fréquemment Babesia microti (agent de la babésiose), Borrelia miyamotoi, Borrelia mayonii (agents de fièvres récurrentes à tiques)[32],[33] ;
- en Europe, la tique Ixodes Ricinus peut aussi transmettre Anaplasma phagocytophilum et Babesia microti agent de la babésiose, et aussi l'encéphalite à tique (due à un virus)[32],[33] ;
- en Asie, des co-infections sont également décrites[33].
Les agents connus autres que des Borrelia provoquent des symptômes généralement non spécifiques (maux de tête, douleurs articulaires et musculaires, fatigue…) et une fièvre plus importante que dans la maladie de Lyme[32].
L'impact sanitaire réel d'autres pathogènes potentiels qui constituerait un « pathobiome » des tiques est encore mal connu[2],[34]. Selon Johnson et al. (2014), les co-infections pourraient, au moins partiellement, expliquer la variabilité de la sévérité et des manifestations cliniques, parfois chroniques, observées dans l'expression de la maladie de Lyme[35].
Modalités de contamination
Résumé
Contexte
Morsures de tiques

Les humains se contaminent lors d'une rencontre avec les tiques vectrices (contaminées) qui se trouvent en particulier dans les milieux boisés humides avec sous-bois embroussaillés où elles sont actives toute l'année mais beaucoup moins lorsque les températures sont négatives, comme en hiver. Elles sont situées dans le tapis végétal à moins d'un mètre de hauteur.
Elles chassent « à l'affût » en détectant la présence d'un hôte à proximité grâce à des capteurs sensibles au CO2, à la chaleur et substances biochimiques (organe de Haller).
Une fois sur le corps de l'hôte, une tique recherche les zones chaudes et humides comme les plis du corps : chez l'humain, creux du coude ou du genou, aisselle, aine… Elle peut passer sous les vêtements et atteindre la peau où elle se fixe par son rostre pour faire son repas sanguin.
Ce repas sanguin dure de 3 à 5 jours. La transmission se fait au cours du repas, par passage de bactéries du tube digestif de la tique, à ses glandes salivaires. Salive et bactéries sont inoculées dans l'épiderme, et non directement dans un vaisseau sanguin. Cette progression ne débute qu'après la morsure de la tique, il faut plusieurs heures avant qu'elle ne soit contaminante. Aussi une tique retirée assez rapidement ne transmet pas de maladies[12].
Le risque de développer une maladie de Lyme après morsure de tique est de l'ordre de 1 à 5 %[36],[37]. Seul un tiers des patients atteints de maladie de Lyme a eu conscience ou se souvient d'une morsure de tique[38].
Autres
La transmission directe mère-enfant in utero est possible quand la mère est infectée durant la grossesse. La maladie n'a pas d'effet sur le fœtus, si la mère est traitée par antibiothérapie adaptée[39].
Les autres modes de transmission n'ont pas été démontrés : de personne à personne (par toucher, baiser, ou acte sexuel), par air, eau, aliments, allaitement maternel, transfusion sanguine[24],[39]…
Il n'existe pas de risques de contamination directe à partir d'un animal de compagnie infecté.
Le CDC américain recommande aux malades de Lyme ayant une infection active en cours d'antibiothérapie de ne pas donner leur sang, ceux qui ont terminé leur traitement pouvant être donneurs[40]. En France, l'attitude est similaire (report temporaire)[41].
Épidémiologie
Résumé
Contexte
Données actuelles

Prévalence
La maladie de Lyme existe sur tous les continents mais prédomine en zone tempérée de l'hémisphère nord, où elle est la première maladie vectorielle (y compris en Europe[42]). La maladie touche plus les jeunes enfants et les plus de 45 ans, avec un pic de fréquence correspondant à l'activité des tiques (début du printemps à la fin de l'automne). Les zones nordiques et d'altitude sont de plus en plus touchées, sans doute parce qu'elles se réchauffent.
Aux États-Unis, près de 30 000 cas sont signalés chaque année aux CDC, dont 95 % des cas dans 14 États du nord-est et du Midwest, mais des études estiment que le nombre de cas diagnostiqués serait de l'ordre de 300 000, avec la même distribution géographique[43]. La prévalence de la maladie augmente aussi au Canada[44], notamment démontrée par un suivi de sérologiques chez les chiens ; en 2019, on estimait qu'un tiers des cas environ sont signalés dans les régions canadienne d'émergence de la maladie[45].
En Europe, son incidence augmente selon un gradient sud-nord et ouest-est, généralement entre une latitude de 35° Nord et 60° Nord, et au-dessous d'une altitude de 1 300 m. Elle est estimée à 65 000 cas par an, répartis de façon hétérogène, avec un maximum en Slovénie et en Autriche avec plus de 100 cas pour 100 000 habitants[46].
En Belgique, de 2000 à 2016, en moyenne 200 à 300 personnes sont hospitalisées par an pour cette maladie ; près de 10 000 consultent un généraliste pour érythème migrant[47].
En Suisse, il y aurait 200 à 600 consultations par an pour de nouveaux cas de maladie de Lyme (estimation pour 2008-2018)[48].
En France, en 2020, le taux d’incidence annuel de la borréliose de Lyme était estimé à 91 cas pour 100 000 habitants (60 033 cas estimés), contre 76 cas pour 100 000 habitants (50 133 cas estimés) en 2019. Depuis 2009, il fluctue entre un minimum de 41 en 2011 et un maximum de 104 en 2018[49]. Cette incidence varie beaucoup selon les régions : la maladie semble exceptionnelle sur le pourtour méditerranéen (climat trop sec pour le vecteur)[14], alors que dans le Nord-Est (Alsace-Lorraine) et le Centre (Limousin) elle est beaucoup plus élevée (plus de cent cas pour cent mille habitants)[49].
Activités à risques
Les activités de promenade en forêt, camping, jardinage, activités naturalistes, chasse, travaux agricoles et surtout foresterie exposent à la maladie :
- sur 2 975 travailleurs agricoles et forestiers testés dans l'est de la France au début des années 2000, 14,1 % avaient déjà eu au moins un contact avec la borréliose de Lyme et 3,4 % avec le virus de l'encéphalite à tiques[50]. L'âge, la profession et le lieu de résidence influaient significative sur leur statut sérologique : 17,5 % des bûcherons étaient séropositifs[50]. La séroprévalence en Alsace (26,9 %) et en Lorraine (16,5 %) était significativement plus élevée que dans les autres régions ; de même la séroprévalence du virus de l'encéphalite à tiques était plus élevée en Alsace (5,5 %), mais les taux de séroprévalence pour ces deux infections variaient selon les zones forestières[50].
- Sur 310 forestiers belges (étude 2018), 21,6 % étaient séropositifs pour la maladie de Lyme. Ceux qui étaient le plus souvent en forêts ou ayant signalé plus de 100 morsures étaient les plus touchés. L'intensité des morsures et l'usage de mesures de protection ont diminué le taux de séroprévalence alors que la quantité d'ombre portée par les arbres au sol l'augmentait[51].
- Chez 181 gardes forestiers italiens de la région du Frioul-Vénétie Julienne (extrême nord-est de l'Italie), au début des années 2000 la prévalence sérologique de la borréliose de Lyme était de 23,2 % (à comparer à 0,6 % pour le virus de la méningoencéphalite à tiques, et à 0,6 % pour l'ehrlichiose)[52]. Le travail sur les contreforts et le jardinage dans le nord-est de la région et des antécédents multiples de morsures de tiques augmentaient le risque de maladie de Lyme[52]. Ces données plaident pour un facteur écopaysager (écoépidémiologique).
Remarque : les facteurs de risque étaient similaires pour une borréliose de Lyme diagnostiquée par un tests Western blot ou au vu des antécédents cliniques[52].
Synthèse épidémiologique

L'épidémiologie de la maladie de Lyme est celle d'une zoonose « à foyers naturels », c'est-à-dire dont la répartition est irrégulière avec des zones endémiques localisées, séparées par des zones plus ou moins indemnes (à l'échelle nationale — différences régionales — comme à l'échelle régionale — différences locales —, etc.).
Cette zonation fluctue dans le temps et dans l'espace, selon les conditions climatiques et écologiques, la saison, le nombre et le déplacement d'hôtes (oiseaux et gros mammifères notamment…) porteurs de tique et/ou de borrélies.
La progression de la maladie depuis les années 1970 résulte essentiellement d'une augmentation d'incidence et d'une extension des régions atteintes[53], et moindrement d'une amélioration du dépistage et de la surveillance[46],[18].
Facteurs d'émergence

L'augmentation de la prévalence de cette maladie peut résulter d'une évolution génétique des agents, des vecteurs et des hôtes, en rapport avec les modifications des écosystèmes.
Le réchauffement climatique[54] entraîne des températures minima plus élevées (nocturnes et hivernales) et des printemps plus précoces, ce qui retentit probablement sur la distribution locale des tiques, leur densité de population et leur taux de survie[46],[55].
À ce phénomène global, s'ajoutent les aménagements forestiers et agricoles : le drainage, la fragmentation forestière et des paysages, les coupes rases, le reboisement, etc. Ces activités humaines peuvent entraîner une perturbation de la dynamique des populations faunistiques et des équilibres sylvocynégétiques.
Ces processus réduisent la biodiversité, considérée comme élément stabilisateur[56]. Ils se manifestent par une augmentation de densité des vertébrés domestiques et sauvages (hôtes réservoirs compétents) avec un recul de leurs grands prédateurs.
Amérique du Nord

Par exemple, en Amérique, le cerf de Virginie et la souris à pattes blanches (hôtes principaux pour les tiques vectrices de Lyme) ont connu une augmentation rapide de densité.
Dans le nord-est, du XVIIe siècle au début du XIXe siècle, les colons ont défriché de vastes étendues de forêts pour leurs activités agricoles avec une quasi-disparition des cervidés et de leurs prédateurs. À la fin du XIXe siècle, la région s'industrialise et l'agriculture décline ; les terres abandonnées se reboisent, habitat favorable pour la multiplication du cerf de Virginie. Au cours du XXe siècle, cette reforestation s'accompagne d'un développement résidentiel périurbain en zone boisée. Les conditions sont alors réunies pour une plus grande proximité permanente souris-cerfs-tiques-humains[57].
Europe
En Europe, comme en Amérique du Nord, une présence humaine accrue en forêt ou en lisière de forêt (habitat périurbain, activités de chasse ou de loisir…) accroit la possibilité de contact entre la tique et l'humain ou ses animaux domestiques (chien, cheval…)[46].
Le contexte de guerre et de guerre civile pourrait aussi favoriser ce type de zoonoses ; ainsi en Serbie, peu après le début des guerres dites Guerres de Yougoslavie, on a constaté une forte augmentation des cas de borrélioses de Lyme[58].
La mondialisation, le commerce et le tourisme internationaux jouent également un rôle, par diffusion géographique d'hôtes et de parasites. Par exemple, en France, un nouvel animal de compagnie, l'écureuil de Corée ou tamia de Sibérie, relâché dans la nature par ses propriétaires, a été suspecté d'être un nouvel hôte réservoir, car il s'est rapidement adapté : une des plus grandes populations de tamias (entre dix et vingt mille individus) se trouve ainsi dans la forêt de Sénart[59].
Physiopathologie
Résumé
Contexte
Réactions immunitaires
Après inoculation, sauf en cas d'allergie à la salive de tique, il y a peu de réaction inflammatoire immédiate, car les borrélies peuvent modifier leurs antigènes de surface, Outer surface proteins ou Osp (A-F), et échapper aux premières défenses immunitaires. En l'absence de traitement, elles diffusent localement dans la peau à partir du site d'inoculation (érythème migrant).
Puis elles diffusent par voie sanguine vers les tissus articulaires, neurologiques et cardiaques. Chez le sujet immunocompétent, après plusieurs semaines ou mois, les réponses anticorps finissent généralement par contrôler l'infection disséminée, même en l'absence de traitement, et les symptômes s'estompent[24].
Chez les espèces-réservoirs de borrélies, comme la souris, les infections ne semblent pas pathogènes malgré la persistance à vie de la bactérie, suggérant que les systèmes immunitaires de certains hôtes sauvages ont coévolué avec la bactérie de façon à la « tolérer ».
L'humain n'est pas un hôte réservoir naturel ; son système immunitaire reste activé tant que la bactérie n'est pas éliminée (celle-ci pouvant persister longtemps dans des sites localisés dans divers tissus[24],[60]). Cette persistance et sa signification médicale dans divers tissus font l'objet de discussions. Non traitée, la bactérie a été mise en évidence des années après inoculation, notamment dans les lésions cutanées tardives (acrodermatite chronique atrophiante ou ACA)[12].
Des études de cas suggèrent que, même après un traitement antibiotique intense et de long terme, la bactérie peut durablement persister dans l'organisme, dans divers organe sous forme d'agrégats (de type biofilms) protégés du système immunitaire[60],[61]. Cette persistance est aussi observée dans le modèle animal (in vivo) où l'on retrouve une forme de B. burgdorferi survivante à un traitement antibiotique[62],.
Chez l'humain, une infection ne crée pas d'immunité protectrice, même si des anticorps restent présents[12].
Histoire naturelle de la maladie
Classiquement, la maladie évolue en trois phases, non obligatoires. Chaque phase peut être révélatrice ou s'intriquer avec une autre, avec des poussées ou des rémissions à chaque phase. Outre les variations selon les zones géographiques (Amérique et Eurasie), la maladie est aussi variable selon les patients (certains ne présentent que la phase primaire, d'autres la phase tertiaire)[26].
La phase primaire, ou précoce localisée, qui survient 3 à 30 jours après l'inoculation, est une phase cutanée, représentée par l'érythème migrant. Dans 20 à 30 % des cas, elle est absente ou passe inaperçue[63].
La phase secondaire, ou précoce disséminée, se manifeste dans les semaines ou mois après inoculation. Elle peut être révélatrice (apparaître en premier). Selon les cas (germe causal en rapport avec la zone géographique), les troubles peuvent être neurologiques, articulaires, cardiaques, ou cutanés.
Ces deux premières phases sont parfois regroupées en une seule phase dite précoce, surtout en Europe, car les troubles sont divers (plus grande variété de borrélies). La maladie de Lyme se présente comme un ensemble polymorphe (maladies apparemment différentes). Alors qu'en Amérique du Nord, la maladie de Lyme se présente plutôt sous une forme articulaire, unique ou prédominante.
La phase tertiaire se produit des mois ou des années après inoculation. Elle signe une infection persistante ou résurgente, elle peut être aussi révélatrice. Ces formes tardives sont reconnues lorsqu'elles forment des ensembles typiques et cohérents d'un point de vue clinique et biologique. Elles sont discutées ou controversées quand la clinique n'est pas caractéristique et la biologie non validée.
Formes cliniques
Résumé
Contexte

L'existence et l'importance de formes asymptomatiques est en discussion. Leur fréquence serait de l'ordre de 5 % de sujets séropositifs en zone d'endémie, et jusqu'à 20 % dans des populations à risques (travailleurs forestiers). Ces cas asymptomatiques indiqueraient un contact ancien avec la bactérie, ou une ancienne infection guérie.
Phase primaire


C'est une phase précoce et locale, réalisant l'érythème migrant caractéristique, mais non systématique. Elle correspond à une infection initiale cutanée, localisée autour du point de morsure.
Cette lésion apparaît de 3 à 30 jours après. Elle siège le plus souvent aux membres inférieurs ou à la partie inférieure du tronc ; plus rarement à la tête (petits enfants)[64].
Il s'agit d'un érythème annulaire avec une bordure active qui s'étend de façon centrifuge, tandis que le centre s'éclaircit avec petite tache rouge centrale (séquelle de la morsure de tique). Le diamètre initial de l'anneau est de quelques cm, puis jusqu'à 15 cm en moyenne, pouvant dépasser les 20 cm (un cas de 70 cm a été publié)[64].
Cet érythème migrant peut présenter quelques différences entre sa forme américaine et européenne.
Forme européenne

La lésion est unique, légèrement chaude, mais indolore, et sans prurit. En Europe, où la maladie est plus souvent due à B. afzelii ou B. garinii, l'inflammation est à ce stade généralement moins intense qu'en Amérique du Nord, et la croissance (migration) de l'érythème y est souvent plus lente.
Cet érythème migrant est habituellement isolé, sans fièvre, sans syndrome inflammatoire. Plus rarement, il peut exister des signes de dissémination précoce avec fièvre, douleurs, troubles neurologiques.
Forme américaine
Elle est souvent faite de lésions multiples. La partie centrale reste rouge ou foncée et devient plus indurée. Son bord externe reste également rouge, mais plus rarement, la portion de peau située entre le centre et le bord retrouve une couleur normale. Parfois une nécrose centrale, ou une vésicule apparaît à l'emplacement de la morsure, éventuellement avec prurit intense persistant, si la maladie n'a pas été soignée précocement.
Plus souvent qu'en Europe, il peut exister des signes de dissémination précoce avec fièvre, douleurs, troubles neurologiques[65].
Quand les aspects caractéristiques de ces deux formes sont présents, l'érythème migrant est pratiquement pathognomonique, et suffit à lui seul au diagnostic.
Cet érythème migrant disparaît spontanément en 4 à 6 semaines. Avec un traitement précoce, l'évolution est plus rapide : la lésion disparaît en moins d'une semaine, et la maladie n'évolue pas vers des formes plus compliquées.
Phase secondaire
Elle survient le plus souvent à partir de quelques semaines à quelques mois après l'inoculation, lorsque la lésion initiale est restée absente ou passée inaperçue, ou sans antibiothérapie adaptée.
Ce stade correspond à une dissémination bactérienne, suivie d'une focalisation sur des tissus particuliers.
Les manifestations sont dominées en Europe par des troubles neurologiques (« neuroborréliose ») et en Amérique par des troubles rhumatologiques (« arthrite de Lyme »). Plus rarement se rencontrent des troubles cardiaques, cutanés et oculaires.
Si la phase primaire est absente (phase secondaire révélatrice), le diagnostic peut être confirmé par l'association d'arguments cliniques, épidémiologiques et biologiques (à ce stade, l'infection active est habituellement détectable dans le liquide céphalorachidien et sur les tests sérologiques pertinents, mieux qu'en phase trois).
Neuroborréliose
L'incidence de ces neuroborrélioses (formes neurologiques de la maladie de Lyme) varie selon les pays et les régions. En Europe, on trouve plus de 15 % de neuroborréliose parmi les maladies de Lyme, alors qu'aux États-Unis, cette proportion ne dépasse pas les 8 %.
En Europe, elle varie aussi selon les régions, pour cent mille habitants : Danemark 0,5 cas, Suède 1 cas, Allemagne 3 cas, Alsace 10 cas[66].
Les formes les plus fréquentes (70 à 80 % des neuroborréliose) sont les méningoradiculites (polynévrite avec infection du liquide cérébrospinal). Elles apparaissent après 3 semaines à plus de 3 mois après la morsure de tique[67].
Il s'agit d'abord de troubles sensitifs, plus souvent que moteurs, de la zone de l'érythème migrant. Les douleurs sont sévères (brûlure, arrachement), souvent à recrudescence nocturne et provoquant l'insomnie. Ces douleurs n'ont pas toujours un trajet radiculaire strict. Il peut exister une atteinte associée des nerfs crâniens, se manifestant surtout par une paralysie faciale périphérique, bilatérale dans un tiers des cas.
La neuroborréliose est la cause la plus fréquente de paralysie faciale périphérique chez l'enfant[67].
Plus rarement, dans 0,5 à 8 % des cas, on peut trouver des méningites aiguës, des myélites aiguës, des encéphalites aiguës.
Dans ces manifestations neurologiques aiguës ou subaiguës, le diagnostic est fait par l'étude du liquide cérébrospinal (LCS). La ponction lombaire permet de confirmer une méningite lymphocytaire. Une sérologie du LCS est associée à la recherche d'une synthèse intrathécale d'anticorps spécifiques[67].
Chez l'enfant, en cas de paralysie faciale périphérique, une sérologie sanguine positive est considérée comme suffisante pour confirmer le diagnostic et prescrire une antibiothérapie[67].
Les radiculites hyperalgiques résistent aux antalgiques habituels. Elles peuvent disparaître spontanément en quelques semaines ou mois. Elles cèdent plus rapidement en quelques jours avec une antibiothérapie adaptée.
Arthrite de Lyme
Les manifestations articulaires ont été à l'origine de la redécouverte de la maladie aux États-Unis, où elles sont plus fréquentes (60 % des malades) qu'en Europe (10 à 15 %)[12]. Elle s'observe à tout âge, mais plus souvent chez l'enfant.
En Europe, elles sont précoces (quelques jours à quelques semaines après l'inoculation) et guérissent spontanément le plus souvent. En Amérique, elles sont plus tardives (6 mois en moyenne jusqu'à 2 ans), pour devenir plus souvent chroniques, réalisant le tableau de l'arthrite de Lyme. En Europe, les troubles articulaires sont classés en phase secondaire, alors qu'en Amérique, ils appartiennent à la phase tertiaire[68].
Dans sa forme la plus typique, l'arthrite de Lyme réalise une atteinte d'une seule grosse articulation (mono- ou oligoarthrite), avec douleurs et épanchement de liquide synovial, surtout au genou (moins souvent épaule, coude…). Cette atteinte est asymétrique, récidivante (avec poussées et rémissions), parfois permanente, et susceptible de durer plusieurs années en l'absence de traitement[68].
La plupart des patients guérissent par antibiothérapie adaptée, mais certains conservent une synovite post-infectieuse, réfractaire aux antibiotiques[68].
Autres manifestations
À l'exception d'une asthénie marquée, les troubles généraux sont rares. En particulier, il n'y a pas en général de fièvre dans une maladie de Lyme.


Dans moins de 5 % des cas, il peut exister des troubles cardiaques par bloc atrio-ventriculaire, se manifestant par des palpitations intermittentes ou des malaises. Ces derniers troubles sont spontanément régressifs et ne nécessitent que très rarement la mise en place d'un stimulateur cardiaque définitif[69]. Une péricardite d'évolution prolongée est possible. Une maladie de Lyme doit être recherchée systématiquement chez tout patient jeune ayant un bloc atrio-ventriculaire paroxystique inexpliqué[69].
Dans la même proportion, on peut trouver une manifestation dite lymphocytome borrélien. C'est un nodule rouge violacé, de 1 à 2 cm, qui siège le plus souvent au niveau de la face, du lobule de l'oreille, de l'aréole mammaire ou du scrotum.
Dans 1 % des cas, il existe des troubles ophtalmologiques divers : conjonctivite, sclérite, kératite, uvéite, etc.[12].
Phase tertiaire
La limite entre les formes secondaire et tertiaire est difficile à établir. Une forme secondaire se prolonge devenant tertiaire, ou des manifestations tertiaires apparaissent, apparemment primitives, des années après l'infection.
Des phénomènes auto immunitaires pourraient expliquer ces symptômes, mais la responsabilité directe de la bactérie au cours de ces manifestations tardives reste discutée[70],[71].
Il s'agit de formes chroniques : cutanées, articulaires ou neurologiques. Du point de vue clinique, elles ne sont guère spécifiques (elles peuvent aussi se rencontrer en dehors de la maladie de Lyme), à l'exception de l'acrodermatite chronique atrophiante.
Formes cutanées
L'acrodermatite chronique atrophiante, ou ACA, autrefois aussi nommée « maladie de Pick-Herxheimer », est liée à la maladie de Lyme de manière certaine : le germe a pu être isolé dans les biopsies de la lésion. C'est le symptôme le plus net de cette troisième phase, mais il n'est principalement observé qu'en Europe et pas chez tous les patients.
L'ACA commence avec un changement de couleur et de texture d'une surface de peau, habituellement sur une région exposées au soleil des membres supérieurs ou inférieurs. L'atrophie se traduit par des surfaces de peau qui deviennent très fines et transparentes, prenant une apparence rappelant un papier froissé de cigarette et une couleur rouge à violacée, avec parfois l'apparence de certains lichens plan. L'ACA d'abord localisée peut ensuite s'étendre peu à peu et parfois se bilatéraliser.
Formes rhumatologiques
Il s'agit d'une arthrite de Lyme (voir section phase secondaire) qui persiste et se prolonge en étant réfractaire à l'antibiothérapie.
Formes neurologiques
La « neuroborréliose tardive » regroupe plusieurs entités, dont l'encéphalite (atteinte cérébrale) et les polyneuropathies (atteinte des nerfs). Elles apparaissent au-delà de 6 mois après la morsure de tique.
L'encéphalite ou encéphalomyélite, chronique ou tardive, se manifeste par des troubles variés : troubles cognitifs, difficultés de concentration parfois associés un état de fatigue, douleurs, faiblesse musculaire, troubles moteurs… Le lien avec une maladie de Lyme est reconnu lorsqu'on retrouve une synthèse d'anticorps spécifiques dans le liquide cérébrospinal.
Une polyneuropathie se manifeste d'abord avec des pics de douleurs, parfois accompagnés d'engourdissements et picotements dans les mains ou les pieds. Elle est classiquement associée à l'acrodermatite atrophiante. Il peut s'agir aussi de douleurs radiculaires chroniques isolées se manifestant comme une sciatique.
Formes discutées ou controversées
Elles sont mal connues et difficiles à rattacher formellement à une borréliose[70].
Des manifestations dermatologiques (autres que le lymphocytome et l'acrodermatite) ont été décrites : morphée, sclérodermie, dermatomyosite… mais le lien avec une maladie de Lyme reste hypothétique et discuté.
Certains patients, après un traitement antibiotique bien conduit, présentent des troubles subjectifs chroniques (céphalées, fatigue, et douleurs articulaires) alors que la clinique et la biologie objectives sont en faveur de la guérison. On parle alors de « syndrome post-borréliose de Lyme » ou PLDS Post-Lyme Disease Syndrom[72]. À partir de là, et selon une continuité confuse, le terme de « maladie chronique de Lyme » est apparu. Non ou mal défini, il regroupe tout un ensemble de pathologies chroniques diverses, rapportées à une maladie de Lyme. Il s'agit de revendications, apparues aux États-Unis dans les années 1990, et portées tout autant par des patients soignés et traités, mais non guéris, que par des patients ni diagnostiqués, ni traités auparavant pour maladie de Lyme. Ce mouvement associatif entend défendre ce diagnostic et bénéficier de thérapies alternatives[73],[74].
Diagnostic
Résumé
Contexte
Diagnostic positif
L'examen clinique reste l'élément de base de la démarche diagnostique d'une maladie de Lyme, on recherche la notion de morsure de tique et d'érythème migrant, l'origine géographique et les activités du malade en évaluant le caractère plus ou moins caractéristique des lésions. Les différents examens s'organisent et s'interprètent en fonction de ces données cliniques[75]. En 2019, le diagnostic de confirmation le plus consensuel repose sur une sérologie à deux niveaux, pour chaque stade de l'infection, sauf en présence d'Erythema migrans (1er stade) qui fait considérer l'infection comme certaine.
Sérologie
Il existe des difficultés de diagnostic sérologiques en Europe du fait de la diversité des espèces pathogènes impliquées, comme celle des réactifs ; d'où l'absence d'une standardisation. Alors qu'aux États-Unis, la sérologie est plus facile à interpréter (critères standards du CDC), du fait de la présence d'une espèce pathogène très prédominante (B. Burdorgferi au sens strict)[76],[77]. Néanmoins, dans les années 2010, même aux États-Unis, « la variabilité inter-laboratoires était considérable et reste un problème dans les tests de maladie de Lyme »[78].
Lors de la phase primaire, le diagnostic est exclusivement clinique pour l'érythème migrant. À ce stade, la sérologie est inutile, la production d'anticorps étant encore insuffisante. De même les données biologiques, toujours à ce stade, sont habituellement normales. La présence d'un syndrome inflammatoire important doit faire évoquer un autre diagnostic[70].
Lors de la phase secondaire, les examens sérologiques (dosages d'anticorps) se discutent en fonction du contexte. Il existe deux méthodes couramment utilisées en pratique : ELISA et Western Blot. Le test ELISA est utilisé en première intention, s'il est positif ou douteux, il doit être confirmé par Western-Blot. L'administration de Stevia ou de Serrapeptase avant le test, par son effet anti biofilm, permet de relâcher des bactéries dans le système sanguin ce qui améliore la sensibilité de la détection[79].
Cette sérologie se pratique dans le sang (lymphocytome, atteinte cardiaque, arthrite…), dans le liquide articulaire (arthrite) ou dans le liquide cérébrospinal (neuroborréliose).
Une sérologie positive n'a de valeur pathologique que dans un contexte clinique évocateur. Inversement, une sérologie négative dans le même contexte incite à répéter ou poursuivre l'investigation.
PCR
La PCR vise à détecter la présence d'un fragment de génome d'une borrelia. C'est un examen optionnel, en deuxième intention, dans des cas douteux (contexte clinique et épidémiologique évocateur, mais sérologie négative). Il se fait sur des localisations particulières (prélèvement cutané, liquide cérébrospinal, liquide articulaire) selon le contexte.
La PCR est très spécifique, mais ne prouve pas une infection active, car l'ADN des borrélies peut persister après leur mort (élimination sous antibiotiques). Aussi aux États-Unis comme en Europe, la sérologie reste, en pratique courante, la seule méthode immédiatement disponible pour le diagnostic[80]. En 2019, « aucun test sérologique ne permet (…) de faire la différence entre une infection passée et une infection active. Le rôle de l’interniste est double : penser à une maladie de Lyme devant des symptômes focaux ou généraux mais aussi ne pas attribuer à tort à une maladie de Lyme des symptômes qui doivent faire ouvrir le champ des diagnostics différentiels »[81].
Une étude a montré que l'on peut détecter une infection active par analyse de l'ADN libre circulant, avec une sensibilité supérieure à la sérologie[82].
Diagnostic différentiel
À la phase primaire, lorsqu'il est atypique, l'érythème migrant peut être confondu avec un eczéma nummulaire, un érythème polymorphe, une dermatophytose, etc. et, dans le sud-est des États-Unis à un STARI (acronyme de Southern tick-associated rash illness)[83].
Lorsque l'érythème migrant est absent ou passé inaperçu, de nombreux diagnostics peuvent être évoqués à la phase secondaire : neurologiques (encéphalite ou myélite virale, Guillain-Barré, paralysie faciale a frigore, sclérose en plaques…), rhumatologiques (polyarthrite rhumatoïde, arthrite réactionnelle, arthrite juvénile…).
À la phase tardive, l'acrodermite chronique peut être confondue avec des troubles liés à une insuffisance veineuse, ou à des sclérodermies localisées. Les troubles généraux font discuter d'une fibromyalgie ou d'une fatigue chronique.
La différence peut être faite par la sérologie, et par le fait que les symptômes s'améliorent sous antibiothérapie.
La situation la plus complexe se présente lorsqu'un patient est étiqueté « malade chronique de Lyme » ou CLD Chronic Lyme Disease. Cette entité n'est pas reconnue par la communauté scientifique à cause d'une absence de définition de ces patients, et de l'incapacité de déterminer la présence de germes actifs persistant après traitement standard.
Diagnostic de Lyme chronique
L'existence d'un Lyme chronique n'est pas démontrée scientifiquement[84],[85].
Aux États-Unis, des diagnostics seraient effectués dans le cadre d'une « contre-culture » pseudoscientifique rassemblant des associations, des laboratoires de tests diagnostiques non validés, et des médecins autoproclamés spécialistes de l'affection ou « Lyme literate medical doctors » (LLMD), ayant des activités de lobbying auprès du Congrès américain et sur Internet[86].
Ces diagnostics de « maladie chronique de Lyme » se répartissent en quatre catégories[73] :
- La catégorie 1 est un diagnostic basé uniquement sur des symptômes non spécifiques (fatigue, douleurs chroniques, troubles cognitifs ou de l'humeur…) sans trouble biologique décelable. Ces troubles non spécifiques sont présents dans au moins 10 % de la population générale, sans rapport avec une répartition endémique de la maladie de Lyme.
- La catégorie 2 sont les patients ayant une autre maladie (qu'ils aient déjà ou pas, une histoire de maladie de Lyme non démontrée). Par exemple, des patients ont du mal à accepter le diagnostic de sclérose en plaques, et trouvent un médecin disposé à les traiter pour une maladie chronique de Lyme.
- La catégorie 3 n'a pas de troubles cliniques objectifs évoquant une maladie de Lyme, mais ils présentent des anticorps contre B. burgdoferi. Des médecins proposent un essai empirique d'antibiothérapie pour traiter leurs symptômes.
- La catégorie 4 sont les patients (diagnostiqués et traités Lyme) ayant des manifestations chroniques réalisant un « syndrome post-borréliose de Lyme » ou PLDS Post-Lyme Disease Syndrom[87]. Il s'agit de troubles subjectifs pouvant persister un an et plus après le traitement. Ces patients posent le problème plus général des états de fatigue et de douleurs chroniques[88].
Une étude récente (2019) a cherché à estimer le nombre de cas de forme chronique de la maladie aux États-Unis en 2016 et 2020. Ses résultats montrent une prévalence des formes chroniques « élevée et en augmentation » : sur la base des données disponibles, de 69 011 à 1 523 869 personnes en étaient victimes en 2016, et en 2020 la prévalence pourrait atteindre 1 944 189 cas[89].
Traitement
Résumé
Contexte
La prise en charge de la maladie de Lyme a fait l'objet de la publication de recommandations. Celles de l'« Infectious Diseases Society of America » (IDSA), l'« American Academy of Neurology » (AAN) et de l'« American College of Rheumatology » (ACR) datent de 2020[90].
Antibiothérapie
Principes de base
L'objectif du traitement antibiotique est de guérir les manifestations cliniques et d'éviter l'évolution vers des formes secondaires et tertiaires, ce qui s'obtient par l'éradication complète des Borrelia. On ne cherche pas à obtenir une sérologie négative[91].
En pratique, on utilise une cycline, et en deuxième intention ou dans des cas particuliers, une β-lactamine (céphalosporine).
En phase primaire (érythème migrant), l'amoxicilline ou la doxycycline doivent être prescrits durant 14 à 21 jours, au plus tôt : dans les 72 heures si possible pour un meilleur résultat.
En phase secondaire et tertiaire, pour les neuroborrélioses, les céphalosporines sont principalement utilisées, habituellement la ceftriaxone, pour une durée de 21 à 28 jours, au moins ; par voie veineuse périphérique en cas de méningoencéphalite.
Pour les formes tertiaires, des durées plus longues peuvent être proposées selon les cas[70].
En un ensemble de sociétés savantes françaises émet l'avis suivant[92] :
« Vu le continuum entre forme précoce localisée et borreliose disséminée et l'efficacité de la doxycycline pour traiter la neuroborréliose, la doxycycline est préférée comme première ligne de traitement de l'érythème migrans (durée 14 jours (j). Alternative : amoxicilline) et de la neuroborréliose (durée 14 j si traitement précoce, 21 j si tardif. Alternative : ceftriaxone). Le traitement des manifestations articulaires de la borréliose de Lyme est basé sur doxycycline, ceftriaxone ou amoxicilline pendant 28 j. Les patients présentant des symptômes persistants après traitement approprié ne doivent pas recevoir de traitement prolongé ou répété. Quelques patients se présentent avec des symptômes persistants et pléomorphiques après diagnostic documenté ou suspecté de borréliose. Une autre pathologie est diagnostiquée chez 80 % d'entre eux. »
Chez environ 15 % des patients, l'antibiothérapie peut provoquer une réaction de Jarisch-Herxheimer, liée à la lyse des bactéries, avec exacerbation des symptômes. Il s'agit d'une réaction transitoire sans gravité, qui disparaît en quelques heures[93], ou un à deux jours[83].
En 2021, des chercheurs américains ont fait part d'un traitement microbien potentiel recourant à l'hygromicine A pour traiter cette maladie. Cette découverte pourrait permettre également d'éradiquer la maladie dans l'environnement par l'apposition d'appâts dans des zones naturelles infectées[94].
Efficacité
Les infections traitées en phase primaire sont guéries par les antibiotiques recommandés. Si la phase primaire passe inaperçue, ou insuffisamment traitée, la maladie continue d'évoluer.
Environ 10 % des patients traités, et peut être plus chez ceux ayant une neuroborréliose, continuent d'avoir des troubles subjectifs (fatigue, douleurs musculaires, troubles cognitifs…). Ces troubles persistent plus de 6 mois après antibiothérapie préconisée, et jusqu'à plus de 10 ans, au moins de façon intermittente[95].
Même si la plupart des patients s'améliorent au fil des mois, cet état affecte durablement la qualité de vie. C'est le « syndrome post-borréliose de Lyme », ou PLDS Post-Lyme Disease Syndrom. Dans cette situation, les études contrôlées ne montrent pas de différence entre une antibiothérapie prolongée et un placebo[74],[88] ce qui indique que la bactérie ne peut pas être responsables des symptômes.
Traitements alternatifs
Plus ou moins reconnus
Si l'antibiothérapie prolongée n'est pas une solution pour ces états chroniques, de nouvelles stratégies de prise en charge doivent être mises en œuvre ; en sachant que près de 40 % des patients chroniques de « post-borréliose de Lyme » sont améliorés par un placebo[73]. Le malade « post-Lyme » rejoint alors les millions de personnes qui, dans le monde, souffrent de fatigue et douleurs chroniques d'origine indéterminée[88].
Ainsi, les troubles dépressifs sont à traiter selon les normes habituelles, et les douleurs persistantes selon une approche multidisciplinaire analogue à celle du traitement de la fibromyalgie. Il existe donc des combinaisons de médicaments (antalgiques, d'antidépresseurs…), de thérapies comportementales, kinésithérapie et acupuncture[96].
Des techniques d'origine neurochirurgicales, dites de neuromodulation par stimulation spinale, ont été développées pour traiter des syndromes complexes de douleurs chroniques ou des douleurs post-opératoires. Elles semblent pouvoir diminuer la douleur de patients atteints d'arthrite de Lyme chronique et résistante aux traitements classiques (médicaments, kinésithérapie)[97],[98].
Non reconnus ou non recommandés
De nombreux traitements alternatifs sont proposés sur le net[99]. Le problème central étant qu'ils prétendent soigner des symptômes d'une maladie alors que son existence n'est pas prouvée (les études citées dans le paragraphe précédent concluant même à son inexistence). Sans preuve d'efficacité -ce qui est logique puisque l'existence même de la maladie n'est pas validée- certains présentent un risque certain d'effet indésirable[100],[101].
- Antibiothérapie non préconisée, par exemple de très longue durée ; intermittente ; répétée (pour un même épisode de Lyme) ; pour des coinfections sans preuve.
- Médecine hyperbare.
- Thérapies « à radiation ou à énergie » (qui entrent dans le domaine des pseudosciences)
- Thérapies « nutritionnelles ».
- Chélation de métaux lourds.
- Pyrothérapie.
- Médicaments divers : immunoglobulines, hormones, venin d'abeille…
Phytothérapie
Des préparations phytothérapeutiques sont proposées ou distribuées par divers laboratoires.
Plusieurs plantes, dont la quinine du Ghana (Cryptolepis sanguinolenta) et la renouée du Japon (Polygonum cuspidatum) ont été étudiées et testées in vitro sur des cultures de Borrelia[102] avec des résultats encourageants qui demandent à être confirmés[103].
En France, le Tic Tox, est un mélange d'huiles essentielles et de propolis mis au point par Bernard Christophe (1949-2016), un pharmacien alsacien spécialisé en phyto-aromathérapie. Ce produit a été suspendu en 2012, en attendant sa mise en conformité avec la règlementation, par l'Agence nationale de sécurité du médicament et des produits de santé (AFSSAPS), qui a fait valoir notamment qu'il contient de la sauge officinale (potentiellement toxique selon les doses ingérées) et un terpène, la thuyone[104], outre une « absence d'autorisation de mise sur le marché[104],[105] » (AMM).
Prévention
Résumé
Contexte
Éviter l'exposition aux tiques
La prévention primaire (agir directement sur la cause : hôtes et vecteurs) est difficile, à cause de la diversité du réservoir animal. Agir sur l'un des facteurs d'émergence (voir section épidémiologie) est toujours discuté, car si l'on cerne à peu près ces facteurs, la façon dont ils réagissent entre eux est mal connue. Par exemple, aux États-Unis où la diversité des réservoirs semble moins grande, la réduction de la population des cervidés (cerfs de Virginie notamment), comme moyen de réduire la maladie humaine[106],[107],[108], fait débat[109].
Les mesures recommandées sont l'évitement d'une exposition aux tiques.
Forêts

- Porter en forêt des habits couvrants (chaussures fermées, pantalon long enfilé dans les chaussettes, chemise à col fermé et manches longues boutonnées aux poignets ; port de guêtres pour travailleurs forestiers et cueilleurs de champignons). Des habits de couleur claire permettent de mieux voir les tiques éventuelles. Proscrire les tongs et sandalettes, les shorts et les tee-shirts ;
- éviter les zones à très haut risque (taillis, sous-bois… surtout humides) en restant si possible au milieu des chemins ;
- limiter la manipulation du gibier pour les chasseurs ;
- l'utilisation de répulsifs en zone à risque est possible. Pour des raisons toxicologiques l'imprégnation vestimentaire par des insecticides était peu utilisée (nuisances et risques d'effets secondaires). Remarque : des vêtements professionnels[110] et des uniformes de combat enduits d'un polymère imprégné de perméthrine ont été mis au point (en coton, en matières synthétiques et mixtes[111]) ; ils diminuent de plus de 95 % le risque de morsures si le vêtement est correctement porté selon une étude allemande[112]. Cette protection dure au moins un an[113]. Une autre étude (2020) n'a pu prouver qu'une protection de 65 % la première année et de 50 % la deuxième année, sans effets immédiats détectés sur la santé des porteurs du vêtement[114]. Certaines espèces de tiques (ou stades de développement) se montrent plus rapidement sensibles à la perméthrine que d'autres[111]. Une étude en laboratoire (2019) a montré qu'après 16 jours d'usure et 16 cycles de lavage/séchage en machine 50 à 90 % de la perméthrine qui imbibait des chemises, pantalons et chaussettes traités en usine avait disparu des tissus (devenue source de pollution de l'eau, et rendant le vêtement significativement moins protecteur ; après 1 h de contact avec le tissu, 31 à 67 % des tiques présentaient encore un mouvement normal, au lieu de fuir le tissu ou d'y rester immobilisées)[115]. Par contre les chaussures traitées, portées mais non lavées, sont restées aussi toxiques pour les tiques qu'originellement[115].
- s'inspecter attentivement après les promenades ou le travail en forêt ; en particulier les aisselles, le nombril, les organes génitaux, les plis du genou, sans oublier chez les enfants la tête et le cuir chevelu.
Jardins
Une étude de sciences participatives lancée l’été 2017 en France par l'Inra, basée sur une application (« Signalement Tiques ») permettant de cartographier les lieux où ont eu lieu les morsures de tiques vient de montrer que — contre toute attente — si 53 % des cas concernent la forêt, 27 % des morsures déclarées volontairement ont eu lieu dans des jardins de maisons privés, et « seulement 10 % dans des prairies ». Les déclarants sont invités à photographier la tique et à l’envoyer par courrier aux chercheurs (54 envois par jour en moyenne en ). Un biais probable joue en la faveur des déclarations sur l’humain et le public des répondants n'est sans doute pas représentatif de toute la population. Pour 1 254 signalements de morsures sur les animaux, 4 198 l’ont été chez l’humain. Les morsures concernent d’abord des personnes de 20 à 40 ans (30 % des cas), et de 40 à 60 ans (26 %). Ce taux chute à 17 % chez les 5 à 20 ans. Suivent les personnes de plus de 60 ans (15 % des cas), et les enfants de moins de 5 ans (12 % des cas). Pour les animaux, les déclarations concernent surtout les chiens (45 % des cas) et chats (44 %) et moindrement les chevaux et le bétail (6 et 5 % des cas)[116].
Parmi les mesures parfois préconisées :
- entretenir ses jardins, notamment faucher les hautes herbes dans les zones fréquentées et détruire ou faire enlever les feuilles mortes[117] ;
- l'abondance des tiques pourrait être réduite dans certaines zones (parcs et jardins péri-forestiers…) par une zone-tampon dépourvue de litière de feuilles mortes (par exemple garnie de mulch ou de gravier entre la lisière forestière et les zones de jeu d'enfant, de pique-nique, etc.) et par des mesures interdisant l'intrusion d'animaux tels que sangliers ou cervidés[118],[119]), tout en favorisant les prédateurs naturels des tiques : dans les zones rurales, les poules, qui s'en nourrissent, semblent limiter leurs populations[120].
Animaux domestiques
- Munir les animaux de compagnie de collier anti-tiques, les inspecter régulièrement, surtout au retour d'une promenade en forêt et les débarrasser des tiques. On peut vaporiser sur les chiens des insecticides adaptés[121] ;
- Les chats sont extrêmement sensibles aux produits chimiques. Il ne faut pas appliquer sur eux d'insecticide ni de répulsif sans l'avis d'un vétérinaire[121] ;
- Un modèle prédictif de risque a été créé pour les chiens en combinant des facteurs climatiques, géographiques et sociétaux, avec des résultats de tests sérologiques. Ce modèle pourrait être utile pour aider les vétérinaires à évaluer le risque pour les chiens, et peut-être indirectement l'humain[122].
Ces précautions ne sont pas toujours suffisantes et n'ont pas une efficacité démontrée à 100 %, car les nymphes de tique sont à la limite de la visibilité (1 à 2 mm) et leur morsure est indolore. De plus, les animaux de compagnie peuvent ramener des tiques à la maison, d'où une contamination croisée avec l'être humain.
Soins en cas de morsure de tique
La contamination nécessite un temps long de présence de la tique sur la peau. Si le risque débute dès la première heure, il est proportionnel au temps de contact, avec un maximum entre 48 et 72 heures (le repas sanguin de la tique durant de 2 à 5 jours).

Si la tique est retirée de la peau dans les 36 premières heures après qu'elle s'y est fixée, les risques de contamination sont réputés faibles ; inférieurs à 1 %, car les borrelia ne sont à ce moment pas encore dans les glandes salivaires de la tique mais dans son tube digestif. Pour infecter l'hôte, elles doivent encore migrer du tube digestif aux glandes salivaires, ce qui peut demander 2 à 3 jours, cette durée pouvant être raccourcie en Europe.
Retrait de la tique
Les méthodes folkloriques, qui utilisent une goutte de divers produits visant à endormir, étouffer ou détacher la tique (éther, benzine, essence, gazoil, huile de table, vernis à ongle, chaleur par cigarette allumée…) n'agissent pas assez vite ou risquent de faire régurgiter la tique. Il ne s'agit pas d'attendre, la tique doit donc être retirée le plus rapidement possible, sans la manipuler[123],[124].
Divers modèles de pinces spéciales ou de sortes de petits pieds de biche qui permettent d'extraire les tiques en les tournant doucement, sont vendus en pharmacie (avec un modèle plus petit pour les larves et nymphes). Il ne faut pas tirer, mais tourner doucement comme pour dévisser[125] (le sens de rotation n'est pas important), on peut extraire sans peine la tique, du moins si elle n'est pas ancrée depuis trop longtemps. Ce geste évite le risque de laisser le rostre ou la tête et son « cément » fichés dans la peau, ce qui peut provoquer une infection, voire un abcès.
À défaut de tire-tique, on peut utiliser une pince fine à épiler, pour tirer la tique sans la tordre ou l'écraser[123],[124].
Traitement de la plaie
Après le retrait de la tique (et non avant, pas de produit sur une tique attachée), la plaie doit être soigneusement désinfectée (alcool modifié ou antiseptique à base de chlorhexidine sauf allergie) et surveillée. À ce stade, l'antibiothérapie prophylactique n'est pas recommandée pour une piqûre simple de tique, en raison de la faible probabilité de contamination. Celle-ci peut se discuter dans certains cas particuliers (femme enceinte, personne immunodéprimée…) ou encore, en zone hyperendémique, lorsque la tique est retirée tard et gorgée de sang[70].
Il en est de même aux États-Unis où, après morsure de tique, l'antibiothérapie prophylactique n'est pas généralement recommandée par les CDC. Les exceptions concernent les zones hyperendémiques où toute personne mordue de plus de 8 ans peut recevoir une dose unique de 200 mg de doxycycline dans les 72 h après le retrait de la tique. Pour cela, toutes les conditions suivantes doivent être réunies : pas de contre-indication à la doxycycline, tique I. scapularis identifiée, tique gorgée de sang avec un temps estimé supérieur à 36 h d'attachement[126].
Après morsure de tique, une surveillance de la plaie est nécessaire et suffisante. Dans les jours ou semaines qui suivent, il est impératif de consulter un médecin pour antibiothérapie adaptée, si une tache apparaît et grandit progressivement (érythème migrant). Il en est de même en cas d'apparition d'un état fébrile ou grippal (plus souvent en Amérique qu'en Europe).
Vaccin
Il n'existe plus en 2023 de vaccin humain disponible contre la maladie de Lyme.
Des vaccins vétérinaires existent, dont pour le chien, soit basés sur la bactérie entière tuée, soit sur des sous-unités (protéines de surface OspA ou OspC)[127].
Premier vaccin
Un vaccin (recombinant[128]), le Lymerix de Smith-Kline-Beecham, a été commercialisé aux États-Unis de (après approbation par la FDA) à [129]. Il ciblait une des protéines de surface les plus communes de B. Burgorferi, Osp A. Il a été recommandé pour les personnes à risques en zone d'endémie, et 1,4 million de doses ont été distribuées[129]. Les études ont montré que son efficacité était de l'ordre de 70 à 80 % sans effets secondaires significatifs, mais des incertitudes sur son effet protecteur à long terme impliquaient que des rappels annuels pouvaient être nécessaires[129].
En 1999, des rumeurs associent le vaccin à des arthrites auto-immunes, et conduisent à des poursuites judiciaires, une action collective est ainsi menée par 121 plaignants[129]. Les études effectuées par le CDC et la FDA ne confirment pas de relations de causalité, en estimant que les avantages du vaccin l'emportent sur les risques[129]. Le vaccin reste donc à disposition du public, mais les ventes s'effondrent en raison de la couverture médiatique des procès en cours et des polémiques sur le risque théorique d'auto-immunité[129].
En 2002, le fabricant retire de lui-même son vaccin du marché, pour des raisons économiques[129]. En 2003, un accord est conclu avec les plaignants : ils cessent toute poursuite judiciaire en échange d'un million de dollars servant à rembourser les frais d'avocats et de justice[129].
Recherches en cours
Les recherches vaccinales cherchent à cibler les protéines de surface les plus constantes de la bactérie[127],[130]. Un vaccin de ce type pour l'Europe et les États-Unis est en préparation[131].
Selon Stanley Plotkin, le vaccin idéal contre la maladie de Lyme doit avoir au moins 80 % d'efficacité sur deux ans, des deux côtés de l'Atlantique, être bien toléré, ne pas comporter de déterminant antigénique à risque théorique, et être utilisable chez l'enfant. Il doit aussi être accepté par le public ; pour éviter les fautes de communication commises lors de l'affaire du Lymerix, un nouveau vaccin devra répondre à une demande concertée des acteurs de santé publique, et du public afin qu'il existe un marché pour ce vaccin[131],[128].
Une autre stratégie est de casser le cycle de vie de la bactérie par un vaccin (ou des vaccins) ciblant les réservoirs animaux et/ou les vecteurs (tiques)[132] :
- la vaccination orale d'un réservoir animal comme la souris Peromyscus leucopus est envisagée en Amérique du Nord, sur le modèle de la vaccination orale des renards contre la rage, qui s'est montré très efficace ;
- d'autres recherches ciblent le vecteur, et plus précisément des composants de la salive de tique. Ce qui, théoriquement, aurait l'avantage de protéger contre l'ensemble des maladies transmises par les tiques[127].
Le vaccin VLA15 développé par Valneva SE et Pfizer entre en essai clinique de phase III (avec un dosage de 180 mg et 3 injections)[133]. Il couvre six sérotypes présents en Amérique du Nord et en Europe et cible la protéine de surface externe A (OspA) de la bactérie[134]. Sa mise sur le marché est attendue en 2026-2027[135].
Coûts économiques de la maladie
Résumé
Contexte
À la fin des années 2010, encore peu d'études avaient porté sur le fardeau économique de cette maladie[136] et ces études sont difficilement comparables en raison des « différences dans la méthodologie scientifique, la structure des soins de santé et les systèmes de sécurité sociale » entre pays[137]. Elles sont limitées en précision par le fait que les patients chroniques finissent par oublier ce qu'ils ont dépensé 5 à 20 ans plus tôt, mais elles montrent toutefois que les maladies transmises par les tiques (maladie de Lyme notamment) ont un coût annuel qui s'élève à plusieurs dizaines de millions d'euros par an pour de nombreux pays (y compris de petits pays comme la Belgique)[137].
En Europe, le coût sociétal de cette borréliose a été évalué pour la Suède[138], les Pays-Bas[139] et l'Allemagne[140] puis la Belgique[137].
Les Pays-Bas comptent parmi les pays les plus touchés, mais à titre d'exemple, ce coût était estimé à 20 millions d’euros/an pour ce pays[139] et à 80 millions d’euros/an pour l’Allemagne[141] vers le milieu des années 2010.
Et selon les études publiées entre 2000 et 2022, 23,1 à 48,2 % des coûts totaux sont des coûts non-médicaux et indirects (notamment liés à une perte de production due à l'absentéisme au travail) et les couts en soins de santé non remboursables pourraient être sous-estimés, car non décrits dans les bases de données administratives[137].
Aux Pays-Bas on a montré que vers 2010, les coûts individuels et sociaux liés à la maladie de Lyme variaient très considérablement selon la sévérité de l'infection ; allant de 53 €/personne/an pour le traitement d'une simple morsure de tique, à 122 € en cas d'érythème migrant, à 5 666 €/personne/an en cas de forme disséminée et 5 697 €/personne/an en cas de symptômes aigus persistants[139].
Une étude belge (2022) est arrivée à une conclusion proche : coût de 193 € en moyenne (par patient et par an) en cas d'érythème migrant simple, mais de 5 148 € en moyenne, pour les patients touchés par une maladie de Lyme disséminée[142] ; les auteurs appelant à des recherches plus approfondies chez les victimes de séquelles, car l'échantillon de leur étude ne contenait que quelques cas de forme longue de la maladie, et les auteurs manquaient de données sur les dépenses personnelles et non-remboursables induites par la forme étendue ou chronique de la maladie[137]. Or, faute de consensus sur le traitement des formes longues ou chroniques, de nombreux patients sont en situation d'errance diagnostique et/ou médicale, avec une qualité de vie dégradée et d'importantes dépenses de santé (en grande partie non remboursées)[137].
Une nouvelle étude a donc été lancée (publiée en 2023), basée sur 187 patients dont le diagnostic a été confirmé, souffrant de séquelles (en moyenne depuis près de 10 ans). Elle a modélisé le coût des syndromes post-maladie de Lyme (SPML) pour la société (arrêt maladie, invalidités, chômage...) et pour le patient (coûts des soins en 2018). Ses conclusions sont que les coûts directs annuels moyens des SPML s'élevaient en Belgique, en 2018, à 4 618 € (IC à 95 % de 4 070 à 5 152 €), dont 49,5 % en dépenses directes[137].
Les coûts indirects annuels moyens seraient, eux, de 36 081 € (31 312 à 40 923 €)[137]. Pour la Belgique entière, ceci correspondrait respectivement à des coûts directs de 19,4 millions d'euros/an et à des coûts indirects de 151,5 millions d'euros/an. Les ateurs concluent que des conseils sur le diagnostic et le traitement adéquats du SPML font encore défaut[143], mais sont nécessaires, et soulignent que l'errance diagnostique persiste[137] : « la période moyenne élevée de 112,7 mois (± 9,4 ans) entre les premiers symptômes et la réception d'un diagnostic de Lyme dans notre population d'étude. Les médecins ne pensent pas toujours à la maladie de Lyme lorsque les patients présentent des symptômes légers à plus graves, notamment de la fatigue, des difficultés cognitives et des douleurs musculo-squelettiques. Un tel scénario peut conduire à un traitement non idéal et, conséquemment à des symptômes persistants[137]. ». On a aussi montré que « ces patients présentent un risque plus élevé de pauvreté »[144].
Aux États-Unis où on estime que malgré les actions d'information et de prévention, le nombre de cas de maladie de Lyme a pratiquement triplé de 1990 à 2019 (plus de 300 000 cas/an), les actions préventives et de gestion de la maladie sont freinées par des diagnostics inadéquats (avec une sous estimation du nombre de cas : 30 000 cas officiellement déclarés de maladies à tiques aux États-Unis par an, contre 300 000 probablement en réalité), notait le New England Journal of Medicine. En outre, le fabricant du seul vaccin disponible contre la maladie de Lyme l'a retiré au motif d'une baisse des ventes et de problèmes de responsabilité[145].
Concernant le genre : les femmes dépensent autant que les hommes en parcours de soin post-Lyme[137], mais elles sont plus nombreuses que les hommes à déclarer des formes longues de la maladie (ex : 67,7 % de tous les cas dans une étude prospective publiée en 2009 pour la Belgique)[146].
Moyens de recherches
En 2018, les NIH avaient dépensé 23 millions d'USD pour la seule maladie de Lyme en 2018, pour un total de 56 millions d'USD affecté à toutes les maladies transmises par les tiques. En 2019, après l'avis d'un groupe consultatif mandaté par le gouvernement des États-Unis (avis alarmant et concluant au besoin d'augmenter les actions et les moyens financiers de la recherche au sujet des maladies à tiques au niveau fédéral), les NIH ont produit un nouveau plan stratégique pour lutter contre ces maladies, et en , ils ont lancé un appel à propositions de prévention des maladies transmises par les tiques, doté de 6 millions de dollars d'ici 2020. De leur côté, selon la revue Science[réf. nécessaire], les scientifiques espèrent encore plus d'argent pour améliorer le diagnostic de la maladie, et les moyens de la soigner.
Controverse sociétale
Résumé
Contexte
Il s'agit de thèses et arguments développés par un courant alternatif, opposé aux recommandations officielles des sociétés savantes qui, elles, font consensus à leur niveau international et qui sont reprises par l'ensemble des autorités sanitaires en Amérique du Nord comme en Europe.
Le courant alternatif est apparu aux États-Unis, dans les années 1990, où des médecins se sont rassemblés dans une International Lyme and Associated Diseases Society (ILADS), appuyée par des associations de malades. Ce courant soutient que les recommandations officielles sont trop restrictives, que la maladie est sous-diagnostiquée et sous-traitée. Il cherche donc à promouvoir de nouvelles attitudes thérapeutiques auprès des pouvoirs publics, notamment par la reconnaissance d'une « maladie chronique de Lyme », et d'une antibiothérapie de très longue durée, parfois associée à des thérapies non conventionnelles[147].
Pour la majorité de la communauté médicale, le courant du « Lyme chronique » serait un ensemble de microbiologie, immunologie et pharmacologie « alternatives »[86], diffusés sur internet et d'autres médias, mêlés à des témoignages de patients. Ce courant représenterait 2 % des médecins dans le Connecticut, l'une des régions où l'endémie de Lyme est la plus forte[74] ; il s'agirait d'attitudes reposant sur des présomptions ou des convictions subjectives, et non sur des éléments scientifiques validés[75]. La forme chronique de la maladie s'exprimerait le plus souvent par des symptômes subjectifs, les divers tests (tests urinaires, comptage de lymphocytes CD 57, immunofluorescence pour mettre en évidence des formes L de Borrelia, etc.) auraient été mis au point par des « laboratoires spécialisés de Lyme » et ne seraient pas cliniquement validés ni agréés par la FDA.
En 2019, une revue des recommandations européennes et américaines concernant le diagnostic de la maladie de Lyme, montre que sur les directives de 16 sociétés savantes de 7 pays, une seule présente une discordance majeure (une société allemande, la Deutsche Borreliose-Gesellschaft, non reconnue comme société académique par les autorités allemandes). La conclusion est « Contrairement au débat animé qui a lieu sur Internet et dans les médias européens et américains, notre analyse montre que la majorité des recommandations scientifiques médicales avec un score qualitatif élevé s'accordent sur les méthodes diagnostiques cliniques de la maladie de Lyme »[148].
Hypothèses d'une « maladie chronique de Lyme »
Le terme de Lyme chronique (ou syndrome post-traitement) peut désigner les rechutes, les symptômes persistants après l'arrêt du traitement antibiotique ou des complications chroniques attribuées, de façon consensuelle, à la maladie de Lyme. Il peut aussi désigner des formes chroniques contestées par la majorité de la communauté médicale, ce qui prête à confusion.
La forme chronique de la maladie a fait l'objet de définitions, par exemple en Suisse en 2005 : « preuves cliniques et de laboratoire documentées d'une infection antérieure par B. burgdorferi, cycle complet d'antibiothérapie appropriée, symptômes incluant fatigue, arthralgie, myalgie, dysfonctionnement cognitif ou douleur radiculaire persistant pendant plus de 6 mois, association plausible en temps opportun entre l'infection documentée par B. burgdorferi et apparition des symptômes (c.-à-d. symptômes persistants ou récurrents ayant débuté dans les 6 mois suivant la fin d'une antibiothérapie recommandée pour la borréliose de Lyme précoce ou tardive) et exclusion des autres causes somatiques ou psychiatriques des symptômes »[149].
En France, en 2018, un rapport de la HAS propose de distinguer une entité appelée SPPT (Syndrome Persistant Polymorphe après possible morsure de tique) définie comme l'association de polyalgies (douleurs multiples), fatigue et troubles cognitifs durant plus de 6 mois[150].
De même, aux États-Unis en 2019, l'ILADS a défini la forme chronique de la maladie de Lyme comme « maladie multisystémique avec un large éventail de symptômes et/ou de signes qui sont présents de manière continue ou intermittente pendant au moins six mois ». Les symptômes persistants sont fatigue, douleurs, troubles du sommeil, cognitifs et neurologiques, à traiter par antibiothérapie prolongée. La forme chronique résulte « d'une infection active et continue par l'un des nombreux membres pathogènes du complexe Borrelia burgdorferi sensu lato (Bbsl). L'infection a des périodes de latence variables et les signes et symptômes peuvent augmenter, diminuer et migrer »[151].
Les thèses de l'ILADS
Pour l'ILADS, représentant le courant minoritaire alternatif, la maladie est ubiquitaire et répandue sous des formes ou des transmissions méconnues (par exemple sexuelle).
L'ILADS distingue la forme chronique non traitée, et précédemment traitée (avec dans ce dernier cas des manifestations de forme chronique persistant ou réapparaissant après le traitement et présentes en continu ou selon un schéma récidivant/rémittent sur une durée de six mois ou plus). Ces définitions ont été élaborées sur la base d'une « revue systématique de plus de 250 articles révisés par des pairs dans la littérature internationale »[151].
Le caractère chronique, d'abord silencieux, puis antibiorésistant de la maladie peut avoir plusieurs explications (compatibles entre elles) :
- des formes persistantes « kystiques » de la bactérie (pléomorphisme) : dès 1995, on détecte qu'en réaction à la pénicilline et à la doxycycline (mais pas à la ceftriaxone), la bactérie peut prendre des formes particulières pouvant permettre sa survie dans les tissus de certains patients « malgré une thérapie apparemment adéquate ». Ces formes persistantes pourraient selon les auteurs être source d'un « stimulus antigénique continu conduisant à des plaintes pour borréliose de Lyme chronique »[152].
- une forme-L (réversible) de la bactérie (pressentie en 1996[153] et confirmée en 2008[154]) ;
- une persistance dans un biofilm, démontrée en 2008[154].
En 2014, pour la très grande majorité des experts, représentés par l'IDSA, l'implication de ces 3 variants morphologiques dans une forme chronique de la maladie de Lyme n'était pas démontrée[155]. En 2015, l'IDSA met en doute le concept de « crypto-infections » (lié à des coinfections, quand la tique transmet plusieurs maladies), surtout quand des bactéries non connues pour être transmissibles par tiques, voire des pathogènes fantaisistes, sont évoqués[74]. En 2019, pour la quasi-totalité des sociétés savantes d'infectiologie d'Europe et d'Amérique du Nord, il n'existe pas d'arguments scientifiques permettant de définir une « maladie chronique de Lyme »[150],[148].
Selon le Professeur Lantos, membre du panel des recommandations de l’IDSA, de telles controverses persisteront « aussi longtemps que des patients continueront à souffrir de symptômes inexpliqués, affectant leur qualité de vie »[74].
« Lyme war » aux États-Unis
Une « guerre du Lyme » se déroule aux États-Unis à coups de procédures judiciaires et d'affrontements violents menés par des militants activistes et visant principalement l'IDSA (Infectious Diseases Society of America) accusée de ne pas reconnaitre la maladie chronique de Lyme et ses formes multiples telles que l'autisme, les morgellons, la sclérose en plaques, la maladie de Parkinson ou la maladie d'Alzheimer[156].
Ces militants sont souvent des patients atteints d'affections chroniques non indemnisées par les compagnies d'assurance pour les traitements de longue durée, et qui accusent donc les autorités officielles d'agir de façon non scientifique et non éthique par intérêt financier. En 2000, ces activistes ont pu convaincre le Congrès d'enquêter sur le CDC et le NIH, sans résultats[156].
Au Connecticut, une enquête sans précédent a eu lieu sur l'IDSA (Infectious Diseases Society of America), société savante accusée de violer la loi antitrust, au motif que ses recommandations étaient les seules à être reprises par les autorités sanitaires[73]. Un compromis temporaire est apparemment trouvé avec la publication, en 2011 (révisée en 2014), des recommandations de l'ILADS sur un site officiel, mais il s'agit en fait d'un site qui ne fait que recenser des recommandations sans les valider[157]. Les recommandations officielles américaines restent donc celles de l'IDSA publiées sur les sites du CDC ou du NIH.
Au Texas, en 2021, un juge fédéral a débouté un groupe de patients accusant l'IDSA de complot et de négationnisme de la maladie chronique de Lyme. Le juge a estimé que les recommandations de l'IDSA suivent l'état du savoir actuel, et que l'adhésion à ces recommandations est volontaire[158].
De l'autre côté, plusieurs médecins membres de l'ILADS (International Lyme And Associated Diseases Society) sont poursuivis et condamnés par action disciplinaire ou pénale pour manquements divers à l'éthique, fraudes commerciales, évasions fiscales, traitements illusoires ou dangereux[156].
Situation française
La définition, les limites et la valeur des moyens diagnostiques de la « maladie chronique de Lyme » restent discutés. Cette question est devenue un problème sociétal, par les polémiques qu'elle provoque. En France, elle entraînerait une double perte de confiance « pour les patients qui perdent confiance en leur médecin, pour les médecins qui perdent confiance en eux-mêmes » dans un climat de méfiance réciproque[159].
Associations de patients
Les principales associations sont Lyme sans frontières fondée en 2012, 700 adhérents en France et en Belgique en 2013, dont 90 % de malades ; et France Lyme créée en 2008, revendiquant 400 adhérents en 2014[160] et 2 700 adhérents au [161]. Il existe d'autres associations plus petites à vocation locale. Un rapport de la Haute Autorité de santé (HAS) de 2014 fait état que la majorité des dirigeants sont des femmes et appartiennent à la catégorie des cadres et professions intellectuelles supérieures[160].
Selon le rapport de 2014 de la HAS qui cite une sociologue, il existe un « face-à-face acrimonieux » entre la légitimité des associations et l’autorité de la science. Les premiers défendent leur savoir par expérience personnelle et intime, la seconde se fonde sur l'observation, et la déduction scientifique (médecine basée sur des faits). Toujours selon le rapport, ces associations sont plus proches de l'attitude des antivaccins que de celle des associations de lutte contre le VIH, du fait qu'elles « demeurent le plus souvent crispées sur leur ressentiment à l’encontre du corps médical et des experts. Et dès lors, le système d’action autour de la question de la borréliose de Lyme offre aujourd’hui le spectacle d’une légitimité sociale sans autorité »[162].
Si ces associations partagent certains traits avec celles militant contre la contamination par le VIH — orientation « communautariste » (on se replie sur une pathologie spécifique), ambivalence des rapports avec les pouvoirs publics entre collaboration et affrontement, légitimité de l’« expertise » des patients (la « légitimité incorporée du malade ») opposée à l’expertise des scientifiques et du corps médical, etc. — elles s’en distinguent par l'absence d’universalisme (au service de la santé publique dans un champ de risque donné), l’absence de professionnalisation de militants tendant à devenir des experts reconnus consultés par les pouvoirs publics, l’absence de capital social (densité des réseaux de relations avec les scientifiques, les médias et la politique)[162].
Le rapport note : « Loin de tout « délire », la contestation des associations est au contraire parfaitement rationnelle, ce qui n’empêche pas certains de leurs arguments d’être très faibles »[162] et « Aussi les militantes défendent-elles une notion essentialiste de la science — arcane reposant sur une expérience intime — afin d’en revendiquer le monopole du fait d’être les victimes de la maladie et, du moins veulent-elles le croire, les seules à ne pas cacher la vérité (car libres de tout conflit d’intérêt) »[163].
Débats en cours
Jusqu'en , la prise en charge en France se basait sur une conférence de consensus de 2006[164], établissant des protocoles officiels.
- En 2014, la Haute Autorité de santé (HAS) rappelle que « Au même titre que les autres acteurs, les associations doivent pouvoir librement s'exprimer. Elles doivent aussi être écoutées. S'il ne leur revient pas de dire la science ou de conduire les politiques, il leur revient par contre de faire entendre la voix des patients »[165]. Pour sauver le dialogue et la confiance nécessaire, la HAS fait de la borréliose de Lyme, non seulement un fait biomédical, mais aussi un fait de société. Elle propose une écoute plus ouverte des récits et discours des patients par le biais de recherches en sciences sociales[166].
- En 2015, l'opposition dépose en février un projet de loi relatif à cette maladie, rejeté, mais suivi de plusieurs questions sur la reconnaissance de la maladie.
- En 2016, Matthias Lacoste entame en juin une grève de la faim pour alerter les autorités de santé et pour un « droit de guérir »[167]. En juillet, plus de cent médecins français dont Christian Perronne (chef du service en infectiologie à l'hôpital de Garches) et des associations de patients (France Lyme, Lyme sans frontières, Lymp'act… regroupées dans la Fédération française contre les maladies vectorielles à tiques) se plaignent d'une situation qui ne tient pas compte de leur expérience et de leur vécu[168],[169],[170]. Un plan national de lutte contre la maladie de Lyme est présenté par Marisol Touraine, alors Ministre des affaires sociales et de la santé, en [171].
- En 2018 les critiques portent sur le test sérologique jugé pas assez fiable, et sur l'existence d'une forme chronique parfois non guérie par 3 semaines d’antibiothérapie »[172],[173] ; avec donc une sous-estimation du nombre des cas chroniques. La non-reconnaissance officielle de la forme chronique induirait des modalités de traitement parfois inadaptées.
Ces critiques sont rejetées par la SPILF (société de pathologie infectieuse de langue française) qui juge les recommandations de 2006 restent valables au vu des connaissances actuelles[174] ; de même pour l'Académie de Médecine[175]. Le , la HAS publie de nouvelles recommandations de prise en charge de la borréliose de Lyme. Elles confirment (en les précisant) les protocoles de diagnostic et de traitement déjà adoptés, mais comme aux États-Unis, elle distingue un « syndrome post-borréliose de Lyme » ou PLDS Post-Lyme Disease, la HAS distingue « la/le symptomatologie/syndrome persistant(e) polymorphe après possible morsure de tique » ou SPPT[176]. Cette dénomination de compromis (faute de consensus) doit améliorer la prise en charge des patients[176].
Le , l'Académie de médecine « exprime clairement sa profonde déception » devant ce texte[177]. Puis le , un ensemble de sociétés savantes et professionnelles refusent de cautionner cette dénomination de SPPT et d'en suivre les recommandations[178].
En (trois mois après la publication des recommandations de la HAS), Jérôme Salomon (directeur général de la Santé), toujours à la recherche d'un consensus, a donc demandé à Pierre Tattevin, président de la SPILF « d'élaborer de nouvelles recommandations pratiques pour la prévention, le diagnostic et le traitement de la borréliose de Lyme et autres maladies vectorielles à tiques… »[179]. De son côté, la HAS a expliqué qu'avant de publier ses recommandations, elle a tenté en vain de trouver un consensus avec la SPILF[179]. Elle a donc publié ces recommandations sans la signature de la SPILF, car convaincue qu'elles reflétaient l'état de l'art, mais en prévoyant deux réunions par an de réactualisation des recommandations au vu des avancées scientifiques[180], en espérant aboutir à des recommandations communes avec la SPILF qui en 2019 « considère toujours que les tests de dépistage sont efficaces » et qu'il n'existe pas de forme chronique de la maladie[179].
En 2019, le , le Sénat doit auditionner Jérôme Salomon et Dominique Le Guludec (présidente de la HAS)[179].
Le , le Bulletin épidémiologique hebdomadaire publie une étude montrant que dans une série de cas de diagnostic présumé de Lyme, le diagnostic a été confirmé dans moins de 10 % des cas, le traitement antibiotique présomptif échouant dans 80 % des cas, 80 % des patients ayant une autre maladie. Selon l'éditorialiste du bulletin, il existe un important sur-diagnostic et sur-traitement de la maladie de Lyme[181], tendance retrouvée à l'étranger. Ce qui pose un problème éthique de santé publique : dans la construction des recommandations de prise en charge, peut-on prendre en compte des modèles alternatifs en l’absence de faits probants ?[182].
En 2021, le professeur Eric Caumes, chef de service des maladies infectieuses de l'hôpital de la pitié Salpêtrière, publie le livre "Maladie de Lyme, réalité ou imposture", dans lequel il relate son expérience avec la maladie de Lyme et la maladie de Lyme chronique. Il explique que la maladie de Lyme se soigne aisément avec un traitement antibiotique, mais que la maladie de Lyme chronique n'est qu'un nom donné à une variété de troubles pour des personnes en errance médicale. Ces patients, mal diagnostiqués, le sont en partie sous l'influence des "Lyme doctors" et des associations de Lyme, et subissent des traitements inadaptés. Pour lui 90% des personnes consultants en pensant être atteintes par la maladie de Lyme, ne le sont pas[183].
Une arme biologique ?
Résumé
Contexte
Les borrelia, dont celles de la maladie de Lyme, ne sont pas classées comme agent potentiel de bioterrorisme[184],[185].
En 2004, un avocat de Long Island, Michael Carroll, sort un livre conspirationniste[186] intitulé Lab 257, où il affirme qu’Erich Traub, un scientifique nazi transfuge aux États-Unis, collaborant à Fort Detrick dans le cadre du programme Operation Paperclip, aurait travaillé sur la fièvre aphteuse et la manipulation de tiques, entre autres sur l'île de Plum Island à quelques kilomètres au large de la ville de Lyme, où des tiques se seraient échappées sur oiseaux migrateurs[187]. Michael Caroll reconnaît cependant ne pas avoir de preuve de ce qu'il avance[188].
En France, l'infectiologue controversé Christian Perronne reprend ces propos en 2016 en affirmant que l'explosion de la maladie de Lyme a été cachée par « l'armée américaine et les scientifiques sous sa coupe »[189], ce qui serait une théorie du complot[190].
En 2019, Kris Newby publie un livre intitulé Bitten, the secret history of Lyme Disease and biological weapons, où elle aurait interviewé Willy Burgdorfer celui qui, en 1982, a découvert l'agent de la maladie de Lyme, Borrelia burgdorferi[186]. Burgdorfer aurait raconté avoir travaillé sur des armes biologiques pour l'armée américaine durant la guerre froide. Il était chargé d'élever des puces, des tiques, des moustiques et autres arthropodes pour les infecter avec des agents pathogènes, et ce serait, selon Burgdorfer, l'une de ces expériences qui aurait mal tourné et provoqué l'épidémie de Lyme aux États-Unis[191]. Pour autant, aucun élément ne vient étayer cette thèse ni confirmer les propos attribués à Burgdorfer[192].
À la suite de ces publications, le représentant républicain du New Jersey Chris Smith a fait adopter un amendement visant à lancer une enquête sur ces accusations[193],[194], demande rejetée par le Sénat[195].
Quant au Plum Island animal disease center (PIADC), situé à 15 km de la ville de Lyme, il affirme sur son site internet n'avoir jamais mené de recherches sur la maladie de Lyme[194], ni aucune recherche classée secret défense[196].
Notes et références
Voir aussi
Wikiwand - on
Seamless Wikipedia browsing. On steroids.