Πυριδίνη
χημική ένωση From Wikipedia, the free encyclopedia
Η πυριδίνη[6] (αγγλικά pyridine) είναι βασική ετεροκυκλική αρωματική (δηλαδή ετεροαρωματική) οργανική ένωση, που περιέχει άνθρακα, υδρογόνο και άζωτο, με μοριακό τύπο C5H5N. Είναι δομικά συγγενική με το βενζόλιο, από το οποίο τυπικά μπορεί να προκύψει αν αντικατασταθεί μια μεθινομάδα (=CH−) του τελευταίου (δηλαδή του βενζολίου) από ένα άτομο αζώτου. Ο όρος «πυριδίνη» επεκτείνεται και σε «θυγατρικές» παράγωγες ενώσεις της, στις οποίες συμπεριλαμβάνονται πολλές σημαντικές ενώσεις, όπως οι αζίνες και οι βιταμίνες νιασίνη και πυριδοξίνη.
| Πυριδίνη | |||
|---|---|---|---|
 | |||
 | |||
 | |||
 | |||
 | |||
| Γενικά | |||
| Όνομα IUPAC | Πυριδίνη[1][2] | ||
| Άλλες ονομασίες | Αζίνη[3] Αζαβενζόλιο[4] | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C5H5N | ||
| Μοριακή μάζα | 79,10 amu | ||
| Συντομογραφίες | Py | ||
| Αριθμός CAS | 110-86-1 | ||
| SMILES | c1ccncc1 | ||
| InChI | 1S/C5H5N/c1-2-4-6-5-3-1/h1-5H | ||
| Αριθμός EINECS | 203-809-9 | ||
| Αριθμός UN | NH9L3PP67S | ||
| PubChem CID | 1049 | ||
| ChemSpider ID | 1020 | ||
| Δομή | |||
| Διπολική ροπή | 2,20 D | ||
| Μοριακή γεωμετρία | Επίπεδη εξαγωνική | ||
| Ισομέρεια | |||
| Ισομερή θέσης | >100 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | -41,6°C | ||
| Σημείο βρασμού | 115,2°C | ||
| Πυκνότητα | 981,9 kg/m³ | ||
| Διαλυτότητα στο νερό | Αναμείξιμη | ||
| Ιξώδες | 0,88 cP | ||
| Δείκτης διάθλασης , nD | 1,5093 | ||
| Τάση ατμών | 16 mmHg (20°C) | ||
| Εμφάνιση | Άχρωμο προς κιτρινωπό υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 5,25[5] | ||
| Ελάχιστη θερμοκρασία ανάφλεξης | 21°C | ||
| Επικινδυνότητα | |||
  | |||
| Εύφλεκτη (F) Βλαβερή (Xn) | |||
| Φράσεις κινδύνου | 20, 21, 22 34, 36, 38 | ||
| LD50 | 891 mg/kg (αρουραίοι, στοματική λήψη) | ||
| Κίνδυνοι κατά NFPA 704 | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Η πυριδίνη ανακαλύφθηκε το 1849, από τον Σκωτσέζο χημικό Τόμας Άντερσον (Thomas Anderson), ως ένα από τα συστατικά του οστελαίου. Δύο χρόνια αργότερα, ο Άντερσον απομόνωσε χημικά καθαρή πυριδίνη με κλασματική απόσταξη οστελαίου.
Η χημικά καθαρή πυριδίνη, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm,
είναι άχρωμο, εύφλεκτο, ασθενώς αλκαλικό υδατοδιαλυτό υγρό, με χαρακτηριστική δυσάρεστη οσμή ψαρίλας.
Η πυριδίνη χρησιμοποιείται ως πρόδρομη ένωση αγροχημικών και φαρμακευτικών προϊόντων, ενώ επίσης αποτελεί σημαντικό οργανικό διαλύτη αλλά και συνθετικό αντιδραστήριο. Η πυριδίνη προστίθεται στο οινόπνευμα, για να το καταστήσει μη πόσιμο (βλ. μετουσιωμένη αλκοόλη). Χρησιμοποιείται για την in vitro σύνθεση του DNA,[7] στη σύνθεση της σουλφαπυριδίνης, που είναι φάρμακο κατά βακτηριδιακών και ιογενών λοιμώξεων, των αντισταμινικών φαρμάκων τριπελενναμίνη και μεπυραμίνη, καθώς και σε υδατοδιαλυτά εντομοαπωθητικά, σε βακτηριοκτόνα, και σε ζιζανιοκτόνα. Ορισμένες χημικές ενώσεις, αν και δεν παράγονται από πυριδίνη, περιέχουν ωστόσο τη δομή του δακτυλίου της (αποτελώντας έτσι τυπικά «θυγατρικές» ενώσεις της). Περιλαμβάνουν βιταμίνες του συμπλέγματος Β, όπως νιασίνη και πυριδοξάλη, το αντιφυματικό φάρμακο ισονιαζίδη, τη νικοτίνη και άλλα αζωτούχα φυτικά προϊόντα.[8] Ιστορικά, η πυριδίνη παράγονταν από λιθανθρακόπισσα και ως παραπροϊόν της αεριοποίησης του άνθρακα. Ωστόσο, η αυξημένη ζήτηση για πυριδίνης, είχε ως αποτέλεσμα την ανάπτυξη πιο οικονομικών μεθόδων σύνθεσης, από ακεταλδεΰδη και αμμωνία, με περισσότερους από 20.000 τόνους της ετησίως να παράγονται σε όλο τον κόσμο.
Ονοματολογία
Η συστηματική ονομασία της πυριδίνης «αζίνη», σύμφωνα με το σύστημα Hantzsch–Widman, για την ονοματολογία ετεροκυκλικών ενώσεων. Ωστόσο η συστηματική αυτή ονομασία χρησιμοποιείται σπάνια, ενώ άλλωστε η εμπειρική της ονομασία «πυριδίνη» συνιστάται από την IUPAC.[9] Η αρίθμηση του δακτυλίου της, για την ονοματολογία παραγώγων της πυριδίνης, ξεκινά από το άτομο του αζώτου ως #1. Για τα παράγωγά της χρησιμοποιούνται επίσης ενίοτε τόσο η αρίθμηση με γράμματα του ελληνικού αλφαβήτου (α-γ), όσο και τα προθέματα ορθο- (o-), μετα- (μ-) και παρα- (π-), αντιστοίχως. Οι θέσεις 2-, α- και ο-, 3-, β- και μ-, καθώς και 4-, γ- και π-, είναι αντιστοίχως ταυτόσημες. Για την ονοματολογία των ριζών που προκύπτουν τυπικά από την πυριδίνη με αφαίρεση ενός ατόμου υδρογόνου από αυτήν (την πυριδίνη) ονομάζονται συστηματικά «πυριδινυλο-», με πρόταξη του αριθμό θέσης του ατόμου υδρογόνου που αφαιρέθηκε για να σχηματιστεί η εκάτοστε ρίζα, αλλά επίσης ενθαρρύνεται από την IUPAC και χρησιμοποιείται αντί για το συστηματικό όνομα της ρίζας η εμπειρική ονομασία «πυριδυλο-».[10] Τα κατιονικά παράγωγα της πυριδίνης, που σχηματίζονται με την προσθήκη μιας ηλεκτρονιόφιλης ομάδας στο άτομο του αζώτου, ονομάζονται «πυριδινιώνια». Μερικά παραδείγματα ονοματολογίας παραγώγων της πυριδίνης είναι τα ακόλουθα:
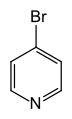
- 4-βρωμοπυριδίνη ή γ-βρωμοπυριδίνη ή π-βρωμοπυριδίνη
- 2,2΄-διπυριδίνη
- πυριδινο-2,6-δικαρβοξυλικό οξύ ή διπικολινικό οξύ
- Η γενική μορφή των κατιόντων πυριδινιωνίου
Ιστορία

Αναμφίβολα, οι αλχημιστές είχαν αναμφίβολα από παλιά παρασκευάσει ακάθαρτη (χημικά) πυριδίνη, με τη θέρμανση οστών ζώων και άλλων οργανικών υλών,[11], αλλά η παλαιότερη τεκμηριωμένη αναφορά πιστώνεται στον Σκωτσέζο χημικό Τόμας Άντερσον (Thomas Anderson).[12][13] Συγκεκριμένα, το 1849, ο Άντερσον μελέτησε το περιεχόμενο του ελαίου που λαμβάνεται μέσω υψηλής θερμοκρασίας θέρμανσης σε οστά ζώων. Μεταξύ άλλων ουσιών, που διαχωρίζονται από το έλαιο αυτό, είναι ένα άχρωμο υγρό με δυσάρεστη οσμή, από την οποία ο Άντερσον απμόνωσε χημικά καθαρή πυριδίνη. δύο χρόνια μετά από την αρχική του ανακάλυψη (δηλαδή το 1951). Περιέγραψε τη νέα (για τότε) ένωση, ως εξαιρετικά υδατοδιαλυτή, εύκολα διαλυτή σε πυκνά οξέα και άλατα, (ενίοτε) με τη βοήθεια κάποιας θέρμανσης, και μόνο ελαφρώς διαλυτή σε διάφορα έλαια.
Λόγω της ευφλεκτότητάς της, ο Άντερσον, ονόμασε τη (νέα για τότε) ένωση που ανακάλυψε «πυριδίνη», από την ελληνική λέξη «πῢρ» και το επίθεμα «ιδίνη», σύμφωνα με τη χημική ονοματολογία, όπως επίσης η τολουϊδίνη, για να υποδείξει ότι δομικά περιέχει ανθρακούχο δακτύλιο, με ένα άτομο αζώτου.[14]
Η χημική δομή της πυριδίνης αποσαφηνίστηκε δεκαετίες μετά την ανακάλυψη της ένωσης. Συγκεκριμένα, οι Βίλχελμ Κέρνερ (Wilhelm Körner, 1869)[15] και Τζέημς Ντιούαρ (James Dewar, 1871)[16][17] πρότειναν ότι, σε αντίστοιχη αναλογία ανάμεσα στην κινολίνη και το ναφθαλίνιο, η πυριδίνη προέρχεται τυπικά από το βενζόλιο, αντικαθιστώντας μια μεθνιυλομάδα (=CH-) με ένα άτομο αζώτου.[18][19] Η πρόταση των Κέρνερ και Ντιούαρ επιβεβαιώθηκε αργότερα, σε ένα πείραμα στον οποίο πυριδίνη ανάχθηκε σε πιπεριδίνη, με τη χρήση (στοιχειακού) νατρίου σε αιθανόλη. Το 1876, ο Ουίλιαμ Ράμσεϊ (William Ramsay) συνέθεσε πυριδίνη με συνδυασμό αιθινίου και υδροκυανίου σε ένα κλίβανο με σωλήνες ερυθροπυρομένου σιδήρου. Αυτή ήταν η πρώτη σύνθεση ετεροαρωματικής ένωσης.[20]
Οι τότε μέθοδοι παραγωγής πυριδίνης είχαν χαμηλή απόδοση, οπότε λόγω η αυξανόμενη ζήτηση της ένωσης ώθησε την έρευνα για πιο αποτελεσματικές παραγωγικές οδούς. Μια σημαντική ανακάλυψη, στον τομέα αυτό, έγινε το 1924, όταν ο ρώσος χημικός Αλεξέι Τσιτσιμπαμπίν (Чичибабин, Алексей Евгеньевич) εφεύρε μια (νέα για τότε) αντίδραση σύνθεσης πυριδίνης, που βασίζεται σε (σχετικά) φθηνά αντιδραστήρια.[21] Η μέθοδος αυτή, εξακολουθεί να χρησιμοποιείται για τη βιομηχανική παραγωγή της πυριδίνης (δείτε παρακάτω).
Φυσική παρουσία
Η «μητρική» πυριδίνη δεν είναι άφθονη στη φύση, εκτός από τα φύλλα και τις ρίζες της μπελαντόνας (Atropa belladonna)[22] και της (Althaea officinalis).[23] Δομικά, όμως, «θυγατρικά» παράγωγα της πυριδίνης αποτελούν μέρος (τουλάχιστον) βιομορίων, όπως τα νουκλεοτίδια και τα αλκαλοειδή.
Στην καθημερινή ζωή, ίχνη πυριδίνης αποτελούν συστατικά των πτητικών οργανικών ενώσεων που παράγονται κατά το ψήσιμο ή και την κονσερβοποίηση προϊόντων όπως για παράδειγμα το τηγανητό κοτόπουλο,[24] σουκιγιάκι,[25] ο καβουρδισμένος καφές,[26] τα πατατάκια,[27] και τηγανητό μπέικον.[28]. Ακόμη, ίχνη πυριδίνης μπορούν να βρεθούν στο τυρί Beaufort,[29] σε κολπικές εκκρίσεις,[30] στο μαύρο τσάι,[31] στο σάλιο των ανθρώπων που πάσχουν από ουλίτιδα,[32] και στο μέλι ηλίανθου.[33] Ο καπνός από καπνό[34][35] ή κάνναβη επίσης περιέχουν μικρές ποσότητες πυριδίνης.
Παραγωγή
Ιστορικά, πυριδίνη εξάγεται από τη λιθανθρακόπισσα ή λαμβάνεται ως παραπροϊόν της αεριοποίησης του άνθρακα. Οι μέθοδοι αυτές ήταν κοπιαστικές, χρονοβόρες και αναποτελεσματικές, αφού η λιθανθρακόπισσα περιέχει μόλις 1‰ πυριδίνη[36], ενώ η απομόνωση της ένωσης και ο καθαρισμός της συνεπάγεται περαιτέρω μείωση της παραγωγής. Σήμερα, πλέον, η περισσότερη πυριδίνη που χρησιμοποιείται παράγεται τεχνητά με τη χρήση διαφόρων μεθόδων, οι πιο σημαντικές από τις οποίες περιγράφονται παρακάτω:[37]
Σύνθεση Τσιτσιμπαμπίν
Η ανακάλυψη της μεθόδου αυτής από τον ρώσο χημικό Τσιτσιμπαμπίν το 1924 αναφέρθηκε παραπάνω στην ιστορία της ένωσης και είναι ακόμη σε χρήση από τη βιομχανία. Στη γενική της μορφή η μέθοδος μπορεί να περιγραφεί ως αντίδραση συμπύκνωσης αλδεϋδών, κετόνων και α,β-ακόρεστων καρβονυλικών ενώσεων, ή με οποιονδήποτε συνδυασμό των προηγούμενων, με αμμωνία ή διάφορα παράγωγα αυτής.[38] Ειδικότερα, η «μητρική» πυριδίνη παράγεται από μεθανάλη και αιθανάλη, που είναι σχετικά φθηνές και πολύ διαθέσιμες. Αρχικά, μεθανάλη και αιθανάλη υφίστανται συμπύκνωση Κνόεβανγκελ (Knoevenagel), δίνοντας ακρολεΐνη. Στη συνέχεια, παραγώμενη η ακρολεΐνη συμπυκνώνεται, μαζί με ένα ακόμη ισοδύναμο αιθανάλης, αλλά και αμμωνία, σχηματίζοντας αρχικά 1,4-διυδροπυριδίνη, που στη συνέχεια οξειδώνεται, με τη βοήθεια καταλύτη στερεάς κατάστασης, τελικά σε πυριδίνη. Η όλη διεργασία διεξάγεται στην αέρια φάση, στους 400-450 °C. Το παραγώμενο προϊόν αποτελείται από μείγμα πυριδίνης, πικολινών και λουτιδινών. Η σύνθεση του αναφερόμενου μείγματος εξαρτάται από τον καταλύτη που θα επιλεγεί, οπότε αυτό μπορεί να προσαρμοστεί στις ανάγκες του κατασκευαστή. Ο καταλύτης είναι συνήθως άλας μεταβατικών μετάλλων, όπως το διφθοριούχο κάδμιο (CdF2), το διφθοριούχο μαγγάνιο (MnF2), αλλά επίσης και άλατα του κοβαλτίου και του θάλλιου, ενώσεις μπορούν επίσης να χρησιμοποιηθούν. Η παραγώμενη πυριδίνη διαχωρίζεται από διάφορα υποπροϊόντα σε πολυβάθμια διαδικασία.[39]


Η πρακτική εφαρμογή της παραδοσιακής σύνθεσης πυριδίνης κατά Τσιτσιμπαντίν είναι περιορισμένη, εξαιτίας της σχετικά χαμηλής απόδοσης της μεθόδου, που τυπικά είναι γύρω στο 20%. Αυτή η σχετικά χαμηλή απόδοση, μαζί με την υψηλή συμπαραγωγή παραπαραγώγων, καθιστούν τη μέθοδο αυτή μη δημοφιιλή.[40]
Απαλκυλίωση αλκυλοπυριδίνης
Η «μητρική» πυριδίνη μπορεί να παραχθεί με απαλκυλίωση αλκυλιωμένων «θυγατρικών» πυριδών, που με τη σειρά τους παράγονται ως παραπροϊόντα σε συνθέσεις άλλων «θυγατρικών» πυριδινών. Η απαλκυλίωση πραγματοποιείται με οξείδωση από το οξυγόνο του ατμοσφαιρικού αέρα, με χρήση πεντοξειδίου του βαναδίου (V2O5) ως καταλύτη[41], ή με ατμό, με καταλύτη που έχει ως βάση το νικέλιο,[42][43] ή τέλος με υδρογόνο, με καταλύτη που έχει ως βάση τον άργυρο ή τον λευκόχρυσο.[44] Οι αποδόσεις αυτών των μεθόδων μπορούν να φθάσουν ως και 93%, ιδιαίτερα η μέθοδος ατμοαπαλκυλίωσης, με καταλύτη που έχει ως βάση το νικέλιο.[45]
όπου Py εδώ οποιοδήποτε πυριδινύλιο.
Σύνθεση Χαντς
Η πρώτη μεγάλης κλίμακας σύνθεση «θυγατρικών» πυριδινών περιγράφηκε το 1881 από τον Αρτουρ Ρούντολφ Χαντς (Arthur Rudolf Hantzsch).[46] Η σύνθεση πυριδίνης κατά Χαντς χρησιμοποιεί συνήθως μείγμα 2:1:1 από β-κετοξύ, όπως το ακετοξεικό οξύ, CH3COCH2COOH, μια αλδεΰδη, όπως τη μεθανάλη, και αμμωνία ή ένα αζωτούχο άλας, ως δότη αζώτου. Αρχικά λαμβάνεται κάποια «θυγατρική» διυδροπυριδίνη, η οποία στη συνέχεια οξειδώνεται στην αντίστοιχη «θυγατρική» πυριδίνη. Ο Εμίλ Κνόβεναγγελ (Emil Knövenagel) απέδειξε ότι με αυτήν τη διεργασία μπορούν να παραχθούν και ασύμμετρα υποκατεστημένα παράγωγα πυριδίνης.[47]

Κυκλοποίηση Μπόννεμανν

Ο συντριμερισμός δύο ισοδυνάμων αιθινίου και ενός ισοδυνάμου (κάποιου) νιτριλίου σε 2-αλκυλοπυριδίνη ονομάζεται κυκλοποίηση Μπόννεμανν (Bönnemann cyclization). Πρόκειται για παραλλαγή της σύνθεσης Ρέππε (Reppe synthesis) και μπορεί να ενεργοποιηθεί είτε με παροχή θερμότητας είτε παροχή φωτός. Η θερμική ενεργοποίηση απαιτεί υψηλές πιέσεις και θερμοκρασίες, ενώ η φωτοενεργοποιημένη κυκλοπροσθήκη γίνεται σε συνθήκες περιβάλλοντος, με τη χρήση CoCp2cod, όπου Cp: κυκλοπενταδιενυλο και cod: 1,5-κυκλοοκταδιένιο, ως καταλύτη, ενώ μπορεί να πραγατοποιηθεί ακόμη και μέσα στο νερό (ως διαλύτη)[48]. Αν χρησιμοποιηθεί αιθανονιτρίλιο (CH3CN) λαμβάνεται 2-πικολίνη. Αν απαιτείται η παραγωγή ειδικά της «μητρικής» πυριδίνης, μπορεί να ακολουθήσει απαλκυλίωση της 2-αλκυλοπυριδίνης (δείτε παραπάνω).
Σύνθεση Κρόνκε
Υπάρχει, ακόμη, η σύνθεση Κρόνκε (Kröhnke pyridine synthesis), που αποτελεί αρκετά γενική μέθοδο παραγωγής «θυγατρικών» πυριδινών, χρησιμοποιώνται «μητρική» πυριδίνη ως αντιδραστήριο, χωρίς να καταναλώνεται η ίδια τελικά. Σύμφωνα με τη μέθοδο αυτή, στην αρχή αντιδρά πυριδίνη μα α-βρωμοεστέρες, δίνοντας το αντίστοιχο άλας πυριδινιώνιου, στο οποίο η μεθυλενική ομάδα είναι πολύ όξινη. Το άλας αυτό δίνει προσθήκη τύπου Μάικελ (Michael-like addition) με α,β-ακόρεστες καρβονυλικές ενώσεις, παρουσία αιθανικού αμμωνίου, δίνοντας σχηματισμό πυριδινικού δακτυλίου που αντιστιοιχεί στη ζητούμενη «θυγατρική» πυριδίνη, καθώς αναγεννά την αρχική «μητρική» πυριδίνη, με τη μορφή βρωμιούχου πυριδινιώνιου (Py+Br-).[49]

Μετάθεση Κιαμίκιαν-Ντέννστετ
Σύμφωνα με τη μετάθεση Κιαμίκιαν-Ντέννστετ (Ciamician–Dennstedt rearrangement), γίνεται επέκταση δακτυλίου πυρρόλιου σε 3-χλωροπυριδίνη, μετά από επίδραση με διχλωρομεθυλένιο [:CCl2]:[50][51][52]

Σύνθεση Γκάττερμανν-Σκίτα
Σύμφωνα με τη σύνθεση Γκάττερμανν-Σκίτα (Gattermann–Skita synthesis)[53], χρησιμοποιείται κάποιο άλας μηλονικού εστέρα, που αντιδρά με διχλωρομεθυλαμίνη (CHCl2NH2):[54]

Σύνθεση Μπόγκερ
Μια άλλη μέθοδος είναι η σύνθεση Μπόγκερ (Boger pyridine):

Με συντριμερισμό ενώσεων με τριπλό δεσμό
Με μείγμα αιθινίου (HC≡CH) και υδροκυανίου (HCN), σε αναλογία 2:1 υπέρ του πρώτου, παρουσία διαλυτών ενώσεων του κοβαλτίου, όπως το κοβαλτιοκένιο [Co(C5H5)2], παράγεται πυριδίνη.[55] (Πρόκειται για παραλλαγή της μεθόδου Μπόννεμανν):
Με επίδραση εναμίνης σε β-δικαρβονυλική ένωση
Με επίδραση αιθεναμίνης (CH2=CHNH2) σε προπανοδιάλη (HCOCH2CHO), που αντιδρά με τη μορφή της ταυτομερούς της 3-υδροξυπροπενάλης (HOCH=CHCHO):
Με επίδραση 1,3-οξαζολίου σε αιθένιο και αφυδάτωση
Με επίδραση 1,3-οξαζολίου σε αιθένιο (CH2=CH2), παράγεται αρχικά 2,3-διυδροπυριδινόλη, που δίνει τελικά με αφυδάτωση πυριδίνη:[56]
Βιοσύνθεση
Αρκετές «θυγατρικές» πυριδίνες παίζουν σημαντικό ρόλο στα βιολογικά συστήματα. Ενώ η βιοσύνθεσή τους δεν είναι πλήρως κατανοητή, το νικοτινικό οξύ (βιταμίνη Β3) παρουσιάζεται σε ορισμένα βακτήρια, σε μύκητες, και σε θηλαστικά. Τα θηλαστικά συνθέτουν το νικοτινικό οξύ, μέσω της οξείδωσης του αμινοξέος τρυπτοφάνη, όπου το ενδιάμεσο προϊόν, ανιλίνη, δημιουργεί μια «θυγατρική» πυριδίνη, την κυνουρενίνη. Αντίθετα, τα βακτήρια Mycobacterium της φυματίωσης και Escherichia coli παράγουν νικοτινικό οξύ από τη συμπύκνωση της 3-φωσφογλυκεριναλδεΰδης και ασπαρτικού οξέος.[57]
Μοριακή δομή


Η πυριδίνη έχει ένα συζευγμένο σύστημα των έξι (6) π ηλεκτρονίων που είναι απεντοπισμένα πάνω από το επίπεδο του δακτυλίου της. Το μόριό της είναι επίπεδο και ακολουθεί τα κριτήρια Hückel για τα αρωματικά συστήματα. Ωστόσο, σε αντίθεση με το βενζόλιο, η πυκνότητα του ηλεκτρονιακού νέφους δεν είναι ομοιόμορφα κατανεμημένη πάνω από το δακτύλιο της πυριδίνης, λόγω της αυξημένης ηλεκτραρνητικότητας του ατόμου του αζώτου της, που παράγει αρνητική επαγωγική επίδραση πάνω στο δακτύλιο. Για το λόγο αυτό η πυριδίνη έχει διπολική ροπή που εξασθενεί την αρωματική σταθεροποίηση συντονισμού, σε σύγκριση πάντα με το βενζόλιο. Συγκεκριμένα, η πυριδίνη έχει ενέργεια συντονισμιού 117 kJ·mol-1, έναντι 150 kJ·mol-1 της αντίστοιχης του βενζολίου.[58] Ο σχετικά μικρότερος ηλεκτρονιακός απεντοπισμός στην πυριδίνη αντικατοπτρίζεται και στο μικρότερο μήκος δεσμού C–N, που είναι 137 pm, έναντι 139 pm του μήκους δεσμού C-C στο βενζόλιο. Και τα δυο μήκη δεσμών, ωστόσο, βρίσκονται μεταξύ των τιμών που αντιστοιχούν σε απλούς και διπλούς δεσμούς, φαινόμενο που είναι χαρακτηριστικό των αρωματικών ενώσεων. Όλα τα άτομα στο δακτύλιο της πυριδίνης βρίσκονται σε sp² υβριδισμό. Το άτομο του αζώτου εμπλέκεται στο αρωματικό σύστημα χρησιμοποιώντας το μη υβριδοποιημένο p τροχιακό του. Το μονήρες ζεύγος ηλεκτρονίων του ατόμου του αζώτου είναι υβριδοποιημένο σε sp² υβριδισμό, προβάλλοντας προς τα έξω από το δακτύλιο, στο ίδιο επίπεδο με τους εντοπισμένους σ-δεσμούς. Ως αποτέλεσμα αυτής της κατάστασης, το μονήρες ηλεκτρονιακό ζεύγος του ατόμου του αζώτου δεν συμβάλλει στο αρωματικό σύστημα (ευτυχώς, γιατί θα το καθιστούσε αντιαρωματικό), αλλά επηρεάζει τις χημικές ιδιότητες της πυριδίνης, γιατί εύκολα υποστηρίζει το σχηματισμό δεσμού μέσω ηλεκτρονιόφιλης επίδρασης. Ωστόσο, λόγω του διαχωρισμού του μονήρους ζεύγους από το αρωματικό σύστημα του δακτυλίου, το άτομο του αζώτουτ δεν μπορεί να συνεισφέρει θετικό μεσομεριακό αποτέλεσμα.


Πολλές ενώσεις που είναι ανάλογες της πυριδίνης είναι γνωστές, στα οποία το άτομο αζώτου της αντικαθίσταται από άτομα άλλων χημικών στοιχείων. Παραδείγματα:
- C αντί N: Βενζόλιο.
- P αντί N: Φωσφορίνη.
- As αντί N: Αρσαβενζόλιο.
- Sb αντί N: Στιμπαβενζόλιο.
- Bi αντί N: Βισμαβενζόλιο.

Η υποκατάσταση μιας μεθινομάδας της πυριδίνης με ένα δεύτερο άτομο αζώτου σχηματίζει μια από τις τρεις (3) ισομερείς διαζίνες, με μοριακό τύπο (C4H4N2) και ονομασίες: πυριδαζίνη (ή ο-διαζίνη), πυριμιδίνη (ή μ-διαζίνη) και πυραζίνη (ή π-διζίνη), αντίστοιχα.
Ιδιότητες
Φυσικές και φυσικοχημικές ιδιότητες

Η χημικά καθαρή πυριδίνη, στις κανονικές συνθήκες περιβάλλοντος, είναι άχρωμο υγρό, που υπό κανονική πίεση, βράζει στους 115,2°C και πήζει στους -41,6 °C. Η (κανονική) πυκνότητά του είναι 981,9 kg/m³, είναι κοντά σε αυτή του νερού. Έχει δείκτη διάθλασης 1,5093 σε μήκος κύματος 589 nm και σε θερμοκρασία 20 °C.[59] Η προσθήκη ως 40% mole νερού ταπηνώνει σταδιακά τη θερμοκρασία τήξης της από -41,6 °C σε -65,0 °C. Η μοριακή διπολική ροπή της είναι 2,2 Debyes.[60] Η πυριδίνη είναι διαμαγνητική και έχει διαμαγνητική ευαισθησία του -48,7·10-6 cm³·mol-1.[61] Η πρότυπη ενθαλπία σχηματισμού της είναι 100,2 kJ·mol-1 στην υγρή φάση[62] και 140,4 kJ·mol-1 στην αέρια φάση. Στους 25°C, η πυριδίνη έχει ιξώδες[63] 0,88 mPa/s και θερμική αγωγιμότητα 0,166 W·m-1·K-1.[64] Η ενθαλπία εξάτμισης είναι 35,09 kJ·mol-1, στη θερμοκρασία βρασμού της και υπό κανονική πίεση.[65] Η ενθαλπία τήξης της είναι 8,28 kJ·mol-1 στο σημείο τήξης της.[66]
Η πυριδίνη κρυσταλλώνεται στο ορθορομβικό κρυσταλλικό σύστημα, σε ομάδα χώρου Pna2, και με παραμέτρους πλέγματος a = 1752 pm, b = 897 pm., c = 1135 pm (στους 78 K), με 16 μονάδες τύπου ανά μονάδα κελιού, αλλά ο αριθμός των μορίων της ανά κελί είναι μόνο 4.[67] Η διαφορά αυτή σχετίζεται εν μέρει με τη (σχετικά) χαμηλότερη συμμετρία του μορίου πυριδίνης (C2v αντί D6h του βενζολίου). Ο τριυδρίτης της πυριδίνης (Py·3H2O) είναι, επίσης, γνωστός και κρυσταλλώνεται και αυτός στο ορθορομβικό κρυσταλλικό σύστημα, σε ομάδα χώρου Pna2, και με παραμέτρους πλέγματος a = 1244 pm, b = 1783 pm, c = 679 pm, με 8 μονάδες τύπου ανά μονάδα κελιού, (στους 223 K.[68]
Το κρίσιμο σημείο της πυριδίνης είναι: (κρίσιμη) πίεση 6,70 MPa, (κρίσιμη) θερμοκρασία 620 Κ και (κρίσιμος) όγκος 229 cm³·mol-1.[69] Στην περιοχή θερμοκρασιών 340-426 C η τάση ατμών της p μπορεί να περιγραφεί με την εξίσωση Αντουάν (Antoine equation):
- όπου Τ είναι η απόλυτη θερμοκρασία, A = 4,16272, B = 1.371,358 K και C = -58,496 Κ.[70]
Το οπτικό φάσμα απορρόφησης της πυριδίνης σε εξάνιο περιέχει τρεις ζώνες (απορρόφησης), κατά το μήκος κύματος των 195 nm (π → π* μετάβαση, μοριακή απορροφητικότητα ε = 7500 L·mol-1·cm-1), 251 nm (π → π* μετάβαση, ε = 2000 L·mol-1·cm-1) και 270 nm (n → π* μετάβαση, ε = 450 L·mol-1·cm-1).[71] Το φάσμα
πυρηνικού μαγνητικού συντονισμού (NMR) 1H της πυριδίνης περιέχει τρία σήματα, με το ολοκλήρωμα της σχετικής έντασης σε αναλογία 2:1:2, που αντιστοιχούν στα τρία χημικώς διακριτά πρωτόνια στο μόριό της. Αυτά τα σήματα προέρχονται από τα α-πρωτόνια (θέσεις 2 και 6, με χημική μετατόπιση 8,5 ppm), από το γ-πρωτόνιο (θέση 4, με χημική μετατόπιση 7,5 ppm) και από τα β-πρωτόνια (θέσεις 3 και 5,με χημική μετατόπιση 7,1 ppm). Το ολανθρακούχο ανάλογο της πυριδίνης, δηλαδή το βενζόλιο, έχει μόνο ένα σήμα πρωτονίων, με χημική μετατόπιση 7,27 ppm. Οι μεγαλύτερες χημικές μετατοπίσεις των α - και γ-πρωτονίων της πυριδίνης σε σύγκριση με το μοναδικό σήμα του βενζόλιου είναι αποτέλεσμα της χαμηλότερης ηλεκτρονιακής πυκνότητας στις α - και γ-θέσεις, στο μόριο της πυριδίνης, που μπορεί να προέρχεται από τις δομές αντήχησης. Η κατάσταση είναι κάπως παρόμοια και για τα φάσματα NMR 13C της πυριδίνης και τα αντίστοιχα του βενζόλιου. Το φάσμα NMR 13C πυριδίνης δείχνει μια τριπλέτα στα δ(α-Γ) = 150 ppm, δ(β-Γ) = 124 ppm και δ(γ-Γ) = 136 ppm, ενώ το βενζόλιο έχει μια ενιαία γραμμή στα 129 ppm. Όλες οι τιμές αυτές λήφθηκαν για χημικά καθαρές ενώσεις, ελεύθερες από προσμείξεις άλλων διαλυτών.[72] Ηπυριδίνη ταυτοποιείται συμβατικά με τις μεθόδους της αέριας χρωματογραφίας και της φασματομετρίας μαζών.[73]
Χημικές ιδιότητες
Η πυριδίνη είναι αναμείξιμη με το νερό και σχεδόν με όλους τους οργανικούς διαλύτες. Συμπεριφέρεται ως ασθενής βάση. Με το υδροχλωρικό οξύ σχηματίζει το χλωριούχο πυριδινώνιο, το κρυσταλλικό υδροχλωρικό της άλας, που έχει κανονική θερμοκρασία τήξης 145-147 °C.[74] Οι περισσότερες χημικές ιδιότητες της πυριδίνης είναι οι χαρακτηριστικές και αναμενόμενες για την κατηγορία των ετεροαρωματικών ενώσεων, στις οποίες η πυριδίνη ανήκει. Πιο συγκεκριμένα, σε οργανικές αντιδράσεις, η πυριδίνη συμπεριφέρεται τόσο ως τριτοταγής αμίνη, δίνοντας N-αλκυλίωση, N-ακυλίωση, καθώς και Ν-οξείδωση, όσο και ως αρωματική ένωση, που δίνει πυρηνόφιλες υποκαταστάσεις. Λόγω της παρουσίας του ηλεκτροαρνητικού ατόμου αζώτου στο δακτύλιό της, η πυριδίνη είναι σχετικά ανεπαρκής ηλεκτρονιακά. Γι' αυτό δίνει δυσκολότερα αντιδράσεις αρωματικής ηλεκτρονιόφιλης υποκατάστασης, σε σύγκριση με το βενζόλιο, που είναι χαρακτηριστικές για το βενζόλιο και πολλά από τα παράγωγά του. Η δυσκολία πραγματοποίησης αντιδράσεων αρωματικής ηλεκτρονιόφιλης υποκατάστασης αυξάνεται αν δεν εξουδετερώνονται τάχιστα τα παραγώμενα από την υποκατάσταση πρωτόνια, γιατί τότε σχηματίζεται πυριδινώνιο, που ενισχύει ακόμη περισσότερο την ηλεκτρονιακή ανεπάρκεια της ουδέτερης πυριδίνης. Ωστόσο, σε αντίθεση με το βενζόλιο και πολλά παράγωγά του, η πυριδίνη δίνει πυρηνόφιλη υποκατάσταση και μετάλλωση από το δακτύλιο, αντιδρώντας με ισχυρές οργανομεταλλικές βάσεις.
Η χημική δραστικότητα, λοιπόν, της πυριδίνης μπορεί να διακριθεί σε τρεις (3) ομάδες αντιδράσεων:
- Με ηλεκτρονιόφιλα, δίνει (έστω και δυσκολότερα από το βενζόλιο) αντιδράσεις αρωματικής ηλεκτρονιόφιλης υποκατάστασης, εκφράζοντας έτσι τις αρωματικές της ιδιότητες.
- Με πυρηνόφιλα, αντιδρά στις μετα- θέσεις, δηλαδή #2 και #4, συμπεριφερόμενη παρόμοια με τις ιμίνες και τις καρβονύλικές ενώσεις.
- Με πολλά οξέα κατά Λιούις αντιδρά με το άτομο αζώτου της, συμπεριφερόμενη παρόμοια με τις τριτοταγείς αμίνες. Επίσης, η ικανότητα της πυριδίνης να δίνει N-οξείδωση, σχηματίζοντας αμινοξείδια, είναι επίσης χαρακτηριστική ιδιότητα των τριτοταγών αμινών.[75]

Το άτομο αζώτου της πυριδίνης διαθέτει ένα μονήρες ζεύγος ηλεκτρονίων. Επειδή αυτό το μονήρες ζεύγος δεν συμμετέχει στο αρωματικό σύστημα, η πυριδίνη είναι βάση, έχοντας χημικές ιδιότητες παρόμοιες με αυτές των τριτοταγών αμινών. Η pKa του συζυγούς αξέος της πυριδίνης, δηλαδή του κατιόντος πυριδινιωνίου (PyH+), είναι 5,25. Όταν η πυριδίνη πρωτονιώνεται από την παρουσία ισχυρότερων από αυτήν οξέων, σχηματίζεται το κατιόν πυριδινιωνίου, που είναι αρωματικό πολυατομικό ιόν. Τα μήκη δεσμών και οι γωνίες δεσμών της πυριδίνης και του κατιόντος πυριδινιωνίου είναι σχεδόν ταυτόσημα.[76] Το κατιόν πυριδινιωνίου είναι ισοηλεκτρονιακό με το μόριο του βενζολίου. Το π-τολουοσουλφονικό πυριδινιώνιο [PyH(π-CH3C6H4SO3), Pyridinium P-TolueneSulfonate-PPTS] είναι ενδεικτικό άλας πυριδινιώνιου, που παράγεται με κατεργασία πυριδίνης με π-τολουολοσουλφονικό οξύ (π-CH3C6H4SO3H).
Η πυριδίνη μπορεί να λειτουγήσει ως βάση κατά Λιούις, δίνοντας το μονήρες ζεύγος ηλεκτρονίων της σε ένα οξύ κατά Λιούις, όπως το τριοξείδιο του θείου (SO3), σχηματίζοντας το αντίστοιχο σύμπλοκο.
Η ίδια η πυριδίνη είναι σχετικά αδύναμος συναρμοτής, σχηματίζοντας όμως σύμπλοκα με ιόντα μεταβατικών μετάλλων. Για παράδειγμα, σχηματίζει σύμπλοκα 1:1 με Ni2+ και με Cu2+, με logK1 τις τάξης των 1,9 και 2,6, αντίστοιχα.[77] Τα φάσματα υπερύθρου συμπλόκων πυριδίνης έχουν μελετηθεί.[78][79] Το 2-πινακολικό οξύ, που είναι υποκατεστημένη («θυγατρική») πυριδίνη, σχηματίζει ισχυρά σύμπλοκα, λόγω σχηματισμού χηλικών ενώσεων. Επίσης, η 2,2΄-διπυριδίνη και η 1,10-φαινανθρολίνη, που επίσης μπορούν να θεωρηθούν υποκατεστημένες («θυγατρικές») πυριδίνες, σχηματίζουν επίσης ισχυρά σύμπλοκα, όπως η φερροΐνη, που μπορεί να χρησιμοποιηθεί ως οξειδοαναγωγικός δείκτης στην ποσοτική ανάλυση του σιδήρου.[80]
Η συνακτική κατάσταση η6, όπως συμβαίνει σε αντίστοιχα σύμπλοκα του βενζολίου, παρατηρείται μόνο σε παράγωγα που μπλοκάρουν στερεοχημικά το αζωτούχο κέντρο της πυριδίνης.[81]
Αντιδράσεις
Πολλές αντιδράσεις που είναι χαρακτηριστικές για το βενζόλιο, τις δίνει και η πυριδίνη, αλλά με χαμηλότερη απόδοση ή και σε πιο περίπλοκες καταστάσεις. Λόγω της σχετικά μειωμένης ηλεκτρονιακής πυκνότητας στο αρωματικό της σύστημα,οι αρωματικές ηλεκτρονιόφιλες υποκατσστάσεις σχετικά καταστέλλονται για τη «μητρική» και τις «θυγατρικές» πυριδίνες, υπέρ της πυρηνόφιλης προσθήκηε, στο ηλεκτρονιακά πλουσιότερο άτομο του αζώτου. Η πυρηνόφιλη προσθήκη στο άτομο του αζώτου οδηγεί σε περαιτέρω απενεργοποίηση των αρωματικών ιδιοτήτων των πυριδινών και εμποδίζουν ακόμη περισσότερο τις αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις. Από την άλλη πλευρά, τόσο η ελεύθερη-ριζική, όσο και η πυρηνόφιλη υποκατἀσταση προκύπτει ευκολότερα στις πυριδίνες σε σύγκριση με το βενζόλιο.
Αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις
Σε πολλές αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις η πυριδίνη είτε δεν τις δίνει είτε τις δίνει μόνο εν μέρει. Ωστόσο, ο ετεροαρωματικός χαρακτήρας της ένωσης μπορεί να ενεργοποιηθεί, με την προσθήκη λειτουργικής ομάδας που περιέχει δότη ηλεκτρονίων. Οι συνηθισμένες αλκυλιώσεις και ακυλιώσεις κατά Friedel–Crafts, συνήθως αποτυγχάνουν στην πυριδίνη, γιατί τείνουν να οδηγήσουν μὀνο σε προσθήκη τους στο άτομο του αζώτου. Αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις (όταν συμβαίνουν) εμφανίζονται συνήθως στη #3- (μετα-) θέση, που είναι αντιστοιχεί στα σχετικά ηλεκτρονιακά πλουσιότερα άτομα άνθρακα του πυριδινικού δακτυλίου, οπότε είναι σχετικά πιο επιρρεπής σε μια αρωματική ηλεκτρονιόφιλη υποκατάσταση:




Οι αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις στην #2- (ορθο-) ή #4- (παρα-) θέσεις οδηγούν σε ενεργειακά δυσμενή σ- σύμπλοκα. Μπορούν, ωστόσο, να προωθηθούν κι αυτές, χρησιμοποιώντας πειραματικές τεχνικές, όπως η διεξαγωγή αρωματικής ηλεκτρονιόφιλης υποκατάστασεις όχι απευθείας στην πυριδίνη, αλλά σε N-οξυπυριδίνη, με επακόλουθη αποξυγόνωση του ατόμου του αζώτου. Η (προσωρινή έστω) προσθήκη οξυγόνου μειώνει την ηλεκτρονιακή πυκνότητα στο άτομο του αζώτου, ευνοώντας έτσι την αρωματική ηλεκτρονιόφιλη υποκατάσταση στα άτομα άνθρακα #2 και #4. Το άτομο του οξυγόνου μπορεί να αφαιρεθεί, στη συνέχεια, μέσω διαφόρων αντιδραστικών οδών, με συνηθέστερες τη χρήση ενώσεων του PIII ή του SII, οι οποίες εύκολα οξειδώνονται, εις βάρος του N. Η τριφαινυλοφωσφίνη (PPh3) χρησιμοποιείται συχνά ως τέτοιο αντιδραστήριο, που αφαιρεί το οξυγόνο από το άζωτο και οξειδώνεται η ίδια σε τριφαινυλοφωσφινοξείδιο (POPh3). Οι ακόλουθες παράγραφοι περιγράγουν παραδείγματα που εκπροσωπούν αρωματικές ηλεκτρονιόφιλες υποκαταστάσεις στην πυριδίνη:
Νίτρωση
Η άμεση νίτρωση της πυριδίνης απαιτεί σκληρές συνθήκες και έχει πολύ χαμηλές αποδόσεις. Η 3-νιτροπυριδίνη μπορεί να ληφθεί με την επίδραση στην πυριδίνη με πεντοξείδιο του αζώτου (N2O5), παρουσία μεταλλικού νατρίου.[82][83][84] Οι «θυγατρικές» πυριδίνες στις οποίες το άτομο του αζώτου περιβάλλεται στερεοχημικά, μπορεί να ληφθεί νίτρωσή τους με επίδραση τετραφθοριούχου νιτρώνιου (NO2BF4). Επίσης, η 3-νιτροπυριδίνη μπορεί να ληφθεί μέσω της σύνθεσης 2,6-διβρωμοπυριδίνης, νίτρωσης της τελευταίας και αφαίρεσης των ατόμων βρωμίου από την ενδιάμεσα σχηματιζόμενη 2,6-διβρωμο-3-νιτροπυριδίνη. [85][86]
Σουλφονυλίωση
Η απευθείας σουλφονυλίωση πυριδίνης είναι ακόμη πιο δύσκολα πραγματοποιήσιμη από την άμεση νίτρωση. Ωστόσο, το 3-πυριδινοσουλφονικό οξύ μπορεί να ληφθεί με αποδεκτή απόδοση με περίσσεια (πυκνού) θειικού οξέος θερμοκρασίας 320 °C σε βραστή πυριδίνη.[87] Η αντίδραση πυριδίνης με τριοξείδιο του θείου (SO3) διευκολύνεται με την (προσωρινή έστω) προσθήκη θείου στο άτομο του αζώτου, ειδικότερα δε με την παρουσία θειικού υδραργύρου (HgSO4), ως καταλύτη.[88]
Αλογόνωση
Σε αντίθεση τόσο με τη νίτρωση, όσο και με τη σουλφούρωση, η άμεση βρωμίωση και η άμεση χλωρίωση προχωρεί καλά. Με αντίδραση πυριδίνης με διβρώμιο (Br2) σε θεικό οξύ, στους 130 °C εύκολα παράγεται 3-βρωμοπυριδίνη. Η απόδοση είναι χαμηλότερη για την παραγωγή 3-χλωροπυριδίνης, κατά τη χλωρίωση πυριδίνης με διχλώριο (Cl2), παρουσία χλωριούχου αργιλίου (AlCl3), στους 00 °C. Και οι δυο 2-αλοπυριδίνες (2-βρωμοπυριδίνη και 2-χλωροπυριδίνη) μπορούν να παραχθούν και με άμεση επίδραση του αντίστοιχου αλογόνου σε πυριδίνη, παρουσία διχλωριοχου παλλαδίου (PdCl2), ως καταλύτη.[89]
Πυρηνόφιλες υποκαταστάσεις
Σε αντίθεση με το βενζόλιο, η πυριδίνη υποστηρίζει αποτελεσματικά διάφορες πυρηνόφιλες υποκαταστάσεις. Ο λόγος για αυτό το φαινόμενο είναι η σχετικά χαμηλότερη ηλεκτρονιακή πυκνότητα γύρω από τα άτομα άνθρακα του δακτυλίου της πυριδίνης. Οι αντιδράσεις αυτές περιλαμβάνουν υποκαταστάσεις με την αποβολή ανιόντος υδριδίου (H-), με τον ενδιάμεσο σχηματισμό διαμόρφωσης αρινίου (Ar-), και συνήθως οι υποκαταστάσεις αυτές συμβαίνουν στη #2 ή στη #4 θέση:[90]



Πολλές πυρηνόφιλες υποκαταστάσεις εμφανίζονται ευκολότερα όχι στη «μητρική» πυριδίνη, αλλά σε «θυγατρικές» πυριδίνες που περιέχουν βρώμιο, χλώριο, φθόριο ή σουλφυδριλική ομάδα, που στη συνέχεια γίνονται καλύτερες αποχωρούσες ομάδες, σε σύγκριση με το ανιόν υδριδίου. ΄Ετσι, το φθόριο είναι η καλύτερη από τις παραπάνω αναφερόμενες αποχωρούσα ομάδα για υποκατάσταση από οργανολιθιακές ενώσεις (RLi). Η πυρηνόφιλη επίδραση μπορεί να γίνει με αλκοξείδια (RO-), θειολικά άλατα (RS-), αμίνες (RNH2) και αμμωνία (NH3), υπό υψηλή πίεση.[91]
Σε γενικές γραμμές, το ανιόν υδριδίου είναι μια φτωχή αποχωρούσα ομάδα και τέτοιες υποκαταστάσεις παρουσιάζονται σε λίγες μόνο ετεροκυκλικές αντιδράσεις. Οι αντιδράσεις αυτές συμπεριλαμβάνουν την αντίδραση Τσιτσιμπαμπίν, που αποδίδει «θυγατρικές» 2-αμινοπυριδίνες. Σε αυτές τις αντιδράσεις χρησιμοποιείται νατραμίδιο (NaNH2) ως πυρηνόφιλο που αποδίδει 2-αμινοπυριδίνη. Το ανιόν υδριδίου που απελευθερώνεται από αυτήν την αντίδραση συνδυάζεται με ένα πρωτόνιο διαθέσιμο από την αμινομάδα, σχηματίζοντας έτσι μόριο διυδρογόνου.[92]
Ανάλογα με το βενζόλιο, οι πυρηνόφιλες υποκαταστάσεις σε πυριδίνη μπορούν να οδηγήσουν στον σχηματισμό των πυριδινίων (Py-), όπως τα ετεροαρίνια.
Για το σκοπό αυτό, οι «θυγατρικές» πυριδίνες μπορούν να εξουδετερωθούν, αφήνοντας ομάδες που αποτελούν ισχυρές βάσεις, όπως το τριτοταγές βουτοξείδιο του νατρίου (tBuONa) και το τριτοταγές βουτοξείδιο του καλίου (tBuOK). Η μετέπειτα προσθήκη πυρηνόφιλου στον ενδιάμεσα σχηματιζίμενο τριπλό δεσμό έχει χαμηλή επιλεκτικότητα, και το αποτέλεσμα είναι μείγμα των δύο πιθανών προσμίξεων.
Αντιδράσεις με ρίζες
Η πυριδίνη υποστηρίζει μια σειρά από αντιδράσεις ελευθέρων ριζών, που χρησιμοποιούνται στον διμερισμό της για παραγωγή διπυριδινών. Ο ριζικός διμερισμός της πυριδίνης πραγματοποιείται με στοιχειακό νάτριο ή με νικέλιο Raney, αποδίδοντας επιλεκτικά 4,4΄-διπυριδίνη,[93] ή 2,2'-διπυριδίνη,[94], που είναι σημαντικά πρόδρομα αντιδραστήρια για τη χημική βιομηχανία. Μια από τις επώνυμες αντιδράσεις που αφορούν τις ελεύθερες ρίζες είναι η αντίδραση Μινίσκι (Minisci reaction). Η τελευταία παράγει 2-τριτοταγες βουτυλοπυριδίνη, μετά από αντίδραση πυριδίνης με πιβαλικό οξύ [(CH3)3CCOOH], νιτρικό άργυρο (AgNO3) και αμμωνίου (NH4+) σε θειικό οξύ, με απόδοση 97%.[95]
Αντιδράσεις σχετικές με το άτομο αζώτου

Τα οξέα κατά Λιούις εύκολα προστίθενται στο άτομο αζώτου της πυριδίνης, σχηματίζοντας πυριδινιωνιακά άλατα. Η αντίδραση με αλκυλαλογονίδια οδηγεί σε αλκυλίωση του ατόμου του αζώτου. Αυτή η αντίδραση δημιουργεί θετικό φορτίο στο πυριδινικό δακτύλιιο, αυξάνοντας τη δραστικότητα της πρώην ουδέτερης πυριδίνης τόσο ως προς την οξείδωση, όσο και ως προς την αναγωγή. Η αντίδραση Ζίνκε (Zincke reaction) χρησιμοποιείται για την επιλεκτική εισαγωγή ριζών σε ενώσεις πυριδινιωνίου.
Αναγωγή με υδρογόνωση

Η αναγωγή της πυριδίνης στην κορεσμένη πιπεριδίνη επιτυγχάνεται μέσω της αντίδρασης της πυριδίνης με αέριο διυδρογόνο, παρουσία νικελίου Raney.[96] Αυτή η αντίδραση απελευθερώνει 193,8 kJ·mol-1 ενέργειας,[97] που είναι ελαφρώς μικρότερη από την αντίστοιχη ενέργεια υδρογόνωσης του βενζολίου (205.3 kJ·mol-1) σε κυκλοεξάνιο.
Μερικώς υδρογονωμένα παράγωγα που λαμβάνονται κάτω από ηπιότερες συνθήκες. Για παράδειγμα, η αναγωγή με λιθιοαργιλιοϋδρίδιολίθιο (LiAlH4) αποδίδει μείγμα 1,4-διυδροπυριδίνης, 1,2-διυδροπυριδινης, και 2,5-διυδροπυριδίνης.[98]
Η επιλεκτική σύνθεση της 1,4-διυδροπυριδίνης επιτυγχάνεται με την παρουσία οργανομεταλλικών συμπλόκων του μαγνησίου και ψευδάργυρου,[99] και η (Δ3,4)-τετραϋδροπυριδίνη λαμβάνεται μετά από ηλεκτροχημική αναγωγή της πυριδίνης.[100]
Εφαρμογές

Η πυριδίνη είναι μια σημαντική πρόδρομη ύλη για τη χημική βιομηχανία. Το 1989 η ετήσια παγκόσμια παραγωγή της ήταν 26.000 τόνοι, με τις 11 από τις 25 μεγαλύτερες μονάδες παραγωγής της να βρίσκονται στην Ευρώπη, από το 1999. Οι μεγαλύτεροι παραγωγοί πυριδίνης συμπεριλαμβάνουν τις εταιρείες Evonik Industries, Rütgers Chemicals, Imperial Chemical Industries, και Koei Chemical. Η παραγωγή πυριδίνης αυξήθηκε σημαντικά κατά τις αρχές της δεκαετίας του 2000, με ετήσια δυναμικότητα 30.000 τόνων, μόνο στην ηπειρωτική Κίνα.[101] Η αμερικανοκινεζική εταιρεία Vertellus είναι σήμερα ο παγκόσμιος ηγέτης σε παραγωγή πυριδίνης.[102]
Φυτοφάρμακα
Η κύρια εφαρμογή της πυριδίνης είναι ως πρόδρομη ένωση για τα ζιζανιοκτόνα παρακουάτ (paraquat) και ντικουάτ (diquat). Το πρώτο βήμα για τη σύνθεση του εντομοκτόνου χλωροπυρίφος (chlorpyrifos) αποτελείται από τη χλωρίωση της πυριδίνης, σε 3-χλωροπυριδίνη. Η πυριδίνη είναι επίσης η πρόδρομη ένωση για την παραγωγή της πυριθειόνης ( pyrithione), στην οποία βασίζονται μηκυτοκτόνα. Το κετυλπυριδίνιώνιο (cetylpyridinium) και το λαυρυλπυριδινιώνιο (laurylpyridinium), μπορούν να παραχθούν από την πυριδίνη με την παραπάνω αναφερόμενη αντίδραση Ζίνκε. Χρησιμοποιούνται ως αντισηπτικά στόματος σε προϊόντα οδοντιατρικής περίθαλψης.

Η πυριδίνη επιδράται εύκολα από αλκυλιωτικά μέσα, που μπορούν να δώσουν N-αλκυλοπυριδινιωνικά άλατα. Ένα παράδειγμα τέτοιου άλατος είναι το χλωριούχο κετυλπυριδινιώνιο.
Διαλύτης
Η πυριδίνη χρησιμοποιείται ως πολικός, βασικός, χαμηλής δραστικότητας διαλύτης, για παράδειγμα σε συμπυκνώσεις Κνόεβανγκελ, ενώ είναι ιδιαίτερα κατάλληλη για απαλογονώσεις, όπου δρα ως βάση για την αντίδραση απόσπασης υδραλογόνων (HX), με τα οποία η πυριδίνη σχηματίζει το αντίστοιχο άλας αλογονούχου πυριδινιώνιου (PyHX).

Σε εστεροποιήσεις και ακυλιώσεις, η πυριδίνη ενεργοποιεί το χρησιμοποιούμενο καρβοξυλικό οξύ, τα χρησιμοποιούμενα ακυλαλογονίδια ή τους χρησιμοποιούμενους ανυδρίτες οξέων. Ακόμη πιο ενεργές για τέτοιες αντιδράσεις είναι οι «θυγατρικές» πυριδίνες, 4-διμεθυλαμινοπυριδίνη (DiMethylAminoPyridine, DMAP) και 4-(1-πυρρολιδυνο)πυριδίνη. Η πυριδίνη χρησιμοποιήθηκε επίσης ως βάση σε αντιδράσεις συμπύκνωσης.[104]
Η πυριδίνη χρησιμοποιήθηκε, ακόμη, ως διαλύτης για την παραγωγή χρωστικών και καουτσούκ.[105] Χρησιμοποιήθηκε, ακόμη, σε βιομηχανίες κλωστοϋφαντουργίας, για τη βελτίωση της χωρητικότητας του δικτύου, σε βαμβάκι. Η πυριδίνη προσθέτεται, ακόμη, σε αιθανόλη, για να την καταστήσει ακατάλληλη για πόση. Προστέθηκε, ακόμη, σε χαμηλές δόσεις σε τρόφιμα, για να τους δώσει πικρή γεύση. Σε τέτοια χρήση έχει εγκριθεί από την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων. Το όριο ανίχνευσης για πυριδίνης σε διαλύματα είναι περίπου 1-3 mmol·L-1 (79-237 mg·L-1).[106] Ως βάση, η πυριδίνη μπορεί να χρησιμοποιηθεί ως αντιδραστήριο Καρλ Φίσχερ (Karl Fischer reagent), αλλά είναι συνήθως για τον σκοπό αυτό αντικαθίσταται με εναλλακτικές ενώσεις με λιγότερο δυσάρεστη οσμή, όπως το ιμιδαζόλιο.[107]
Πρόδρομος πιπεριδίνης
Η πιπεριδίνη είναι μια θεμελιώδης αζωτούχα ετεροκυκλική ένωση και σημαντική συνθετική δομική μονάδα. Οι πιπεριδίνες παράγονται με υδρογόνωση των αντίστοιχων πυριδινών με καταλύτες νικέλιο, κοβάλτιο ή ρουθήνιο, σε υψηλές θερμοκρασίες.[108]
Ειδικά αντιδραστήρια με βάση την πυριδίνη

Το χλωροχρωμικό πυριδινιώνιο {[PyH][CrO3Cl]} αναπτύχθηκε από τους Ελίας Τζέιμς Κόρεϊ (Elias James Corey) και Γουΐλλιαμ Σαγκς (William Suggs) το 1975 και χρησιμοποιήθηκε για να οξειδώνει πρωτοταγείς αλκοόλες (RCH2OH) σε αλδεΰδες (RCHO) και δευτεροταγείς αλκοόλες [R2CH(OH)] σε κετόνες (R2CO).[109] Παράγεται με προσθήκη πυριδίνης σε μεικτό διάλυμα χρωμικού οξέος (Η2CrO3) και πυκνού υδροχλωρικού οξέος (HCl).
Επειδή το χρωμυλοχλωρίδιο (CrO2Cl2) είναι καρκινογόνο, είναι υπό έρευνα εναλλακτικές αντιδραστικές οδοί, όπως η επεξεργασία του τριοξειδίου του χρωμίου (CrO3) με χλωριούχο πυριδινιώνιο (PyHCl).[110]
To αντιδραστήριο Κόρνφορθ (Cornforth reagent, δηλαδή διχρωμικό πυριδινιώνιο, Pyridinium DiChromate, PDC),[111] το χλωροχρωμικό πυριδινιώνιο (Pyridinium ChloroChromate, PCC), το αντιδραστήριο Κόλινς (Collins reagent, που είναι σύμπλοκο πυριδίνης-τριοξειδίου του χρωμίου και διχλωρομεθανίου, διαλυμένο σε πυριδίνη) είναι παρόμοιες ενώσεις του χρωμίου σε σύμπλοκα με πυριδίνη και χρησιμοποιούνται όμοια με το ίδιο το χρώμιο για αντιδράσεις οξςίδωσης, δηλαδή μετατροπής πρωτοταγών αλκοολών σε αλδεΰδες και δευτεροταγών αλκοολών σε κετόνες. Τα αντιδραστήρια Κόλλινς και Σάρρετ είναι τόσο δύσκολα και επικίνδυνα για την προετοιμασία, είναι υγροσκοπικά και μπορούν να διεγερθούν κατά τη διάρκεια της προετοιμασίας. Για το λόγο αυτό, η χρήση των PCC και PDC προτιμάται. Τα αντιδραστήρια αυτά ήταν αρκετά δημοφιλή κατά τις δεκαετίες του 1970 και του 1980, αλλά λόγω της τοξικότητάς τους και της κατάστασης επιβεβαιωμένων καρκινογόνων στην οποία βρίσκονται, σπάνια χρησιμοποιούνται σήμερα.[112]
Συναρμοτής και βάση κατά Lewis

Η «μητρική» πυριδίνη χρησιμοποιήθηκε ευρέως ως συναρμοτής στη χημεία συναρμογής, όπως και η «θυγατρική» της 2,2΄-διπυριδίνη (Dpy), που αποτελείται δομικά από δύο (2) μόρια «μητρικής» πυριδίνης που ενώνονται με έναν απλό δεσμό στη θέση #2 και των δύο. Ως συναρμοτής στη χημεία συναρμογής χρησιμοποιήθηκε, επίσης, και η «θυγατρική» τερπυριδίνη [δηλαδή (2,2΄),(6΄,2΄΄)-τριπυριδίνη, Terpy ή Tpy], που αποτελείται δομικά από τρία (3) μόρια «μητρικής» πυριδίνης που ενώνονται με δύο (2) απλούς δεσμούς ενωμένους μεταξύ τους.
Όταν ένα μόριο πυριδίνης γίνει συναρμοτής σε ένα μεταλλικό σύμπλοκο, μπορεί εύκολα να αντικατασταθεί στη συνέχεια από μια ισχυρότερη κατά Λιούις βάση. Αυτό το φαινόμενο αξιοποιείται στην κατάλυση αντιδράσεων πολυμερισμού[113][114] και στην κατάλυση αντιδράσεων υδρογόνωσης, χρησιμοποιώντας, για παράδειγμα, τον καταλύτη Κράμπτρι (Crabtree).[115] Ο συναρμοτής πυριδίνη αντικαθίσταται κατά τη διάρκεια της αντίδρασης και αποκαθίσταται μετά την ολοκλήρωσή της.
Τα χρήσιμα σύμπλοκα πυριδίνης συμπεριλαμβάνουν το πυριδινοβοράνιο (PyBH3, με θερμοκρασία τήξης 10-11 °C), που είναι ήπιο αναγωγικό μέσο, με βελτιωμένη σταθερότητα σε σύγκριση με το νατριοβοριοϋδρίδιο (NaBH4) σε πρωτικούς διαλύτες και βελτιωμένη διαλυτότητα σε απρωτικούς οργανικούς διαλύτες.
Άλλο αξιόλογο σύμπλοκο πυριδίνης είναι το πυριδινο-τριοξείδιο του θείου (PySO3, με θερμοκρασία τήξης 175 °C), αντιδραστήριο θείωσης που χρησιμοποιείται για τη μετατροπή αλκοολών σε θειικά άλατα, τα οποία με τη σειρά τους υποβάλλονται σε διάσπαση του δεσμού C-O, και στη συνέχεια αναγωγή με αντιδραστήρια υδριδίων.
Ασφάλεια
Η πυριδίνη έχει ελάχιστη θερμοκρασία ανάφλεξης μόλις 17 °C και, επομένως, είναι εξαιρετικά εύφλεκτη. Η θερμοκρασία αυτοανάφλεξης είναι 550 °C, και τα μείγματα των 1,7–10,6% κατ' όγκων ατμών πυριδίνης και αέρα είναι εκρηκτικά. Η θερμική τροποποίηση της πυριδίνης, ξεκινά πάνω από 490 °C, με αποτέλεσμα κυρίως 2,2-διπυριδίνη, ενώ σε μικρότερο βαθμό σχηματίζονται 2,3΄-διπυριδίνη, 2,4΄-διπυριδίνη, οξείδια του αζώτου (NOx) και μονοξείδιο του άνθρακα (CO).[116] H πυριδίνη διαλύεται εύκολα στο νερό και βλάπτει τόσο τα ζώα όσο και τα φυτά σε υδατικά οικοσυστήματα.[117] Η επιτρεπόμενη μέγιστη επιτρεπόμενη συγκέντρωση της πυριδίνης ήταν 15-30 ppm ή 15-30 mg·m-3 στον αέρα, στις περισσότερες χώρες, κατά τη δεκαετία του 1990, αλλά μειώθηκε σε 5 ppm, κατά τη δεκαετία του 2000.[118] Για σύγκριση, εσωτερικός αέρας μολυσμένος με καπνό του τσιγάρου μπορεί να περιέχει μέχρι και 16 μg·m-3 πυριδίνης, και ένα τσιγάρο περιέχει 21-32 µg.
Θέματα υγείας

Η πυριδίνη είναι επιβλαβής σε περίπτωση εισπνοής, κατάποσης ή απορρόφησης μέσω του δέρματος.[119] Επιδράσεις της οξείας δηλητηρίασης από πυριδίνη περιλαμβάνουν ζάλη, πονοκέφαλο, έλλειψη συντονισμού, ναυτία, σιελόρροια, και απώλεια της όρεξης. Μπορεί να εξελιχθεί σε κοιλιακό πόνο, πνευμονική συμφόρηση και απώλεια των αισθήσεων. Ένα άτομο πέθανε μετά από τυχαία κατάποση μισού φλιτζανιού πυριδίνης.[120] Η χαμηλότερη γνωστή θανατηφόρος δόση (LDLo) για την κατάποση πυριδίνης από άνθρωπο είναι 500 mg·kg-1. Σε υψηλές δόσεις, η πυριδίνη έχει ναρκωτική δράση και οι ατμοί της σε συγκεντρώσεις πάνω από 3600 ppm αποτελούν κίνδυνο για την υγεία. Η από του στόματος λήψη σε αρουραίους LD50 είναι 891 mg·kg-1. Η πυριδίνη είναι εύφλεκτη.
Αξιολογήσεις ως πιθανός καρκινογόνος παράγοντας έδειξαν ότι υπάρχουν ανεπαρκή στοιχεία για καρκινογένεση από πυριδίνη σε στους ανθρώπους, αν και υπάρχουν περιορισμένες ενδείξεις καρκινογόνων επιπτώσεων στα ζώα. Τα διαθέσιμα δεδομένα δείχνουν ότι η «...έκθεση σε πυριδίνη στο πόσιμο νερό οδήγησε σε μείωση της κινητικότητας του σπέρματος σε όλα τα επίπεδα δόσης σε ποντικούς και την αύξηση του κύκλου του οίστρου μήκος στο υψηλότερο επίπεδο δόσης σε αρουραίους...».[121]
Η πυριδίνη μπορεί, επίσης, να προκαλέσει μικρές νευροτοξικές, γονιδιοτοξικές, και κλαστογονικά αποτελέσματα. Η έκθεση σε πυριδίνη θα έπρεπε κανονικά να οδηγήσει σε εισπνοή και απορρόφηση μέσα στους πνεύμονες και στον γαστρεντερικό σωλήνα, όπου είτε παραμένει αμετάβλητη είτε μεταβολίζεται. Τα σημαντικότερα μεταβολικά προϊόντα της πυριδίνης είναι το υδροξείδιο του Ν-μεθυλοπυριδινιωνίου {[PyMe]OH}, που σχηματίζεται από N-μεθυλοτρανσφεράσες (όπως για παράδειγμα η N-μεθυλοτρασφεράση της πυριδίνης), αλλά επίσης σχηματίζονται οι ενώσεις Ν-οξο-2-υδροξυπυριδίνη, Ν-οξο-3-υδροξυπυριδίνη και Ν-οξο-4-υδροξυπυριδίνη, που δημιουργούνται από τη δράση των μονοοξυγονασών. Στον άνθρωπο, ειδικότερα, η πυριδίνη μεταβολίζεται μόνο σε υδροξείδιο του Ν-μεθυλοπυριδινιωνίου.[122] Η πυριδίνη αποικοδομείται άμεσα από βακτήρια σε αμμωνία και διοξείδιο του άνθρακα.[123] Η «μητρική» πυριδίνη αποικοδομείται ταχύτερα από «θυγατρικές», όπως οι πικολίνες, οι λουτιδίνες, οι χλωροπυριδίνες και οι αμινοπυριδίνες.[124]
Μια σειρά από αποικοδομητές πυριδίνης έχει αποδειχθεί ότι υπερπαράγουν ριβοφλαβίνη, παρουσία πυριδίνης.[125] Ιονίσιμες αζωτούχες ετεροκυκλικές ενώσεις, συμπεριλαμβανομένων της πυριδίνης, αλληλεπιδρούν με περιβαλλοντικές επιφάνειες (όπως εδάφη και ιζήματα), μέσω πολλαπλών pH και εξαρτώνται από μηχανισμούς, συμπεριλαμβανομένης της διαμέρισης σε οργανική ύλη εδάφους, ανταλλαγής κατιόντων, και επιφανειακής συμπλοκοποίησης.[126] Η προσρόφηση σε επιφάνειες μειώνει τη βιοδιαθεσιμότητα των πυριδινών για μικροβιακή και άλλων οργανισμών αποικοδόμηση, με αποτέλεσμα την επιβράδυνση των ρυθμών αποδόμησής της, και επομένως και των ρυμών μείωσης της οικοτοξικότητας.[127]
Μικρές ποσότητες πυριδίνης απελευθερώνονται στο περιβάλλον από ορισμένες βιομηχανικές διαδικασίες, όπως η παραγωγή χάλυβα,[128] η επεξεργασία του σχιστολιθικού πετρελαίου, η αεριοποίηση άνθρακα, η χρήση οπτάνθρακα και η χρήση φλογοβόλων. Η ατμόσφαιρα στις μονάδες επεξεργασίας σχιστολιθικού πετρελαίου μπορεί να περιέχει πυριδίνης συγκεντρώσεις έως και 13 μg·m-3,[129] ενώ επίπεδα 53 μg·m-3 μετρήθηκαν στα υπόγεια ύδατα, σε περιοχές βιομηχανικών μονάδων αεριοποίησης του άνθρακα.[130] Σύμφωνα με μια μελέτη από το Εθνικό Ινστιτούτο για την Επαγγελματική Ασφάλεια και την Υγεία (των ΗΠΑ), περίπου 43.000 Αμερικανοί εργάζονται σε χώρους που τους φέρνουν σε επαφή με πυριδίνη.[131]
Δείτε επίσης
- Ανιλίνη
- 2-μεθυλοπυριδίνη
- 3-μεθυλοπυριδίνη
- 4-μεθυλοπυριδίνη
- 2-αιθυλοπυριδίνη
- 3-αιθυλοπυριδίνη
- 2,3-λουτιδίνη
- 2,4-λουτιδίνη
- 2,5-λουτιδίνη
- 2,6-λουτιδίνη
- 3,4-λουτιδίνη
- 3,5-λουτιδίνη
- Βοραβενζόλιο
- Βενζόλιο
- Σιλαβενζόλιο
- Γερμαβενζόλιο
- Στανναβενζόλιο
- Φωσφορίνη
- Αρσαβενζόλιο
- Άλας πυρυλίου
- Πυριδαζίνη
- Πυραζίνη
- Πυριμιδίνη
- Τριαζίνες
- Τετραζίνες
- Πενταζίνη
- Εξαζίνη
Σημειώσεις και αναφορές
Wikiwand - on
Seamless Wikipedia browsing. On steroids.



![{\displaystyle \mathrm {2PyCH_{2}R+O_{2}{\xrightarrow[{\triangle }]{V_{2}O_{5}}}2PyH+2RCHO} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/62677e9ed6776042539397aeee38455afda70ca6)
![{\displaystyle \mathrm {2PyCH_{2}R+H_{2}O{\xrightarrow[{\triangle }]{Ni}}PyH+RCH_{2}OH} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/fa26a945d602155da8c0dd56312ee8e2392d04ca)
![{\displaystyle \mathrm {2PyR+H_{2}{\xrightarrow[{\triangle }]{Ag\ {\acute {\eta }}\ Pt}}PyH+RH} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/5d27a54675a8d5094b475c6ec8c72f47baaa85e4)
![{\displaystyle \mathrm {2HC\equiv CH+HCN{\xrightarrow[{Co(C_{5}H_{5})_{2}}]{\triangle }}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/2baf3a0095b25bc839bfcd29db8715e77e3cd8ba)







![{\displaystyle \mathrm {Py+HCl+CrO_{3}{\xrightarrow {}}[PyH][CrO_{3}Cl]} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/c942e91a509debc48e76d5c6d6090933fe40e03a)
![{\displaystyle \mathrm {PyHCl+CrO_{3}{\xrightarrow {}}[PyH][CrO_{3}Cl]} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/b93a395542b8e6b686ebb34f2c7a45f3387e53e9)