Οξυγόνο
χημικό στοιχείο με σύμβολο O και ατομικό αριθμό 8 From Wikipedia, the free encyclopedia
Το οξυγόνο (αγγλικά: oxygen) είναι το χημικό στοιχείο με χημικό σύμβολο O και ατομικό αριθμό 8. Είναι ένα μέλος των χαλκογόνων. Είναι, ακόμη, ένα πολύ δραστικό αμέταλλο χημικό στοιχείο και ένα οξειδωτικό μέσο που γρήγορα σχηματίζει χημικές ενώσεις, συγκεκριμένα οξείδια, με τα περισσότερα άλλα χημικά στοιχεία[2]. Κατά μάζα, το οξυγόνο είναι το 3ο σε αφθονία χημικό στοιχείο στο σύμπαν, δηλαδή αμέσως μετά το υδρογόνο και το ήλιο[3]. Δύο άτομα οξυγόνου ενώνονται για να σχηματίσουν «διοξυγόνο», δηλαδή μια διατομική αλλομορφή του στοιχειακού οξυγόνου, που όταν είναι χημικά καθαρό και υπό κανονικές συνθήκες, είναι ένα αέριο άχρωμο, άοσμο και άγευστο, με μοριακό τύπο O2.
| Οξυγόνο | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ιστορία | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταυτότητα του στοιχείου | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Όνομα, σύμβολο | Οξυγόνο (Ο) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικός αριθμός (Ζ) | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κατηγορία | αμέταλλα | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ομάδα, περίοδος, τομέας |
16 (VIA) ,2, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σχετική ατομική μάζα (Ar) |
15,9994(3) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτρονική διαμόρφωση |
1s2 2s2 2p4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός EINECS | 231-956-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Αριθμός CAS | 7782-44-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομικές ιδιότητες | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ατομική ακτίνα | 60 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ομοιοπολική ακτίνα | 66±2 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ακτίνα van der Waals | 152 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ηλεκτραρνητικότητα | 3,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κυριότεροι αριθμοί οξείδωσης |
-2, -1, 0, +1, +2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενέργειες ιονισμού | 1η:1.313,9 ΚJ/mol 2η:3.388,3 KJ/mol 3η:5.300,5 KJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φυσικά χαρακτηριστικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρυσταλλικό σύστημα | κυβικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο τήξης | -218,79 °C (-361.82 °F) (54,36 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Σημείο βρασμού | -182,95 °C (-297,31 °F) (90,20 K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κρίσιμο σημείο | -118,6 °C, 5,043 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Πυκνότητα | 0,0014290 g/cm3 (0 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία τήξης | 0,444 KJ/mol (O2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ενθαλπία εξάτμισης | 6,82 KJ/mol (O2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμοχωρητικότητα | 29,378 J/mol·K (O2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Μαγνητική συμπεριφορά | παραμαγνητικό | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ειδική θερμική αγωγιμότητα |
26,58×10-3 W/m·K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ταχύτητα του ήχου | 316 m/s (αέριο)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Επικινδυνότητα | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις κινδύνου | 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Φράσεις ασφαλείας | 17 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Κίνδυνοι κατά NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Η κατάσταση αναφοράς είναι η πρότυπη κατάσταση (25°C, 1 Atm) εκτός αν σημειώνεται διαφορετικά | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Για άλλες χρήσεις, δείτε: Οξυγόνο (αποσαφήνιση).
Πολλές μεγάλες κατηγορίες οργανικών μορίων σε ζωντανούς οργανισμούς, όπως πρωτεΐνες, νουκλεϊκά οξέα, υδατάνθρακες και λίπη, περιέχουν οξυγόνο, όπως επίσης συμβαίνει και με μεγάλης σημασίας ανόργανες ενώσεις (όπως για παράδειγμα το φωσφορικό οξύ) που αποτελούν συστατικά ζωικών εξωσκελετών, δοντιών και οστών. Άλλωστε, το μεγαλύτερο ποσοστό της μάζας των ζωντανών οργανισμών αποτελείται από οξυγόνο, ως κύριο μέρος της μάζας του νερού, που περιέχουν ως κυριότερο συστατικό τους οι μορφές ζωής. Για παράδειγμα, το ανθρώπινο σώμα αποτελείται κατά τα 2/3 της μάζας του από οξυγόνο. Το στοιχειακό οξυγόνο στη Γη παράγεται από κυανοβακτήρια, φύκη και φυτά, και χρησιμοποιείται από όλη τη σύνθετη ζωή του πλανήτη για την κυτταρική αναπνοή. Το οξυγόνο είναι τοξικό για τους υποχρεωτικά αναερόβιους οργανισμούς, που κυριαρχούσαν στη Γη κατά τα αρχικά στάδια της γέννησης και ανάπτυξης του φαινομένου της ζωής στον πλανήτη μας, πριν το στοιχειακό διοξυγόνο αρχίσει να συσσωρεύεται στην ατμόσφαιρα, δηλαδή περίπου πριν από 2,5 δισεκατομμύρια χρόνια πριν από σήμερα (δείτε το λήμμα μεγάλη οξυγονογένεση). Η ζωή είχε αρχίσει να εμφανίζεται στη Γη πριν από περίπου 1 δισεκατομμύρια χρόνια[4]. Το διατομικό αέριο οξυγόνο αποτελεί το 20,8% κατ' όγκο του ατμοσφαιρικού αέρα της Γης[5]. Το οξυγόνο είναι το πιο άφθονο χημικό στοιχείο κατά μάζα, κυρίως ως διοξείδιο του πυριτίου (SiO2), του φλοιού της Γης, αποτελώντας συνολικά σχεδόν το ήμισυ της μάζας του[6].
Το οξυγόνο αποτελεί σημαντικό τμήμα της ατμόσφαιρας της Γης και είναι απαραίτητο για τη διατήρηση του μεγαλύτερου μέρους της γήινης ζωής, καθώς χρησιμοποιείται από την αναπνοή. Ωστόσο, είναι πολύ δραστικό χημικά για να παραμείνει ως ελεύθερο στοιχείο στην ατμόσφαιρα του πλανήτη μας χωρίς τη συνεχή αναπλήρωσή του από τη φωτοσυνθετική δραστηριότητα ζωντανών οργανισμών (συγκεκριμένα των φυτών), που χρησιμοποιούν την ενέργεια του ηλιακού φωτός για να παράγουν στοιχειακό υγρό από το νερό. Μια άλλη αλλομορφή του οξυγόνου, το όζον (O3) απορροφά ισχυρά την UVB ακτινοβολία και συνεπώς το στρατοσφαιρικό στρώμα του όζοντος βοηθά την προστασία της βιόσφαιρας από την υπεριώδη ακτινοβολία, αλλά αντίθετα το τροποσφαιρικό όζον αποτελεί ρύπο κοντά στην επιφάνεια της Γης, αποτελώντας συστατικό της αιθαλομίχλης. Σε ακόμη μεγαλύτερα υψόμετρα από τη στρατόσφαιρα, η αλλομορφή του ατομικού οξυγόνου έχει σημαντική παρουσία και προκαλεί τη διάβρωση διαστημοπλοίων[7].
Το οξυγόνο ανακαλύφθηκε, ανεξάρτητα, από τους Καρλ Βίλχελμ Σέελε (αγγλικά: Carl Wilhelm Scheele), στην Ουψάλα το 1773, ή λίγο νωρίτερα, και τον Τζόζεφ Πρίστλυ (αγγλικά: Joseph Priestley), στο Γουίλτσαϊρ (Wiltshire) το 1774, αλλά ο δεύτερος δημοσίευσε πρώτος την εργασία του. Το όνομα «οξυγόνο» δόθηκε το 1777 από τον Λαβουαζιέ[8]. Τα πειράματα του τελευταίου διέλυσαν την τότε δημοφιλή θεωρία του φλογιστού για την καύση και τη διάβρωση. Η ονομασία «οξυγόνο» προήλθε από τις ελληνικές λέξεις «ὀξύ» + «γεννῶ», γιατί κατά την εποχή της ονοματοδοσίας του επικρατούσε η εσφαλμένη ιδέα ότι τα οξέα χρειάζονται οξυγόνο για να πραγματοποιήσουν τις χαρακτηριστικές τους αντιδράσεις διάβρωσης.
Το οξυγόνο παράγεται βιομηχανικά με κλασματική απόσταξη υγροποιημένου (ατμοσφαιρικού) αέρα, με τη χρήση ζεολίθων με κυκλική συμπίεση για τη συγκέντρωση οξυγόνου από τον αέρα, με ηλεκτρόλυση του νερού, και ενίοτε με άλλους τρόπους. Η χρήση στοιχειακού οξυγόνου περιλαμβάνει την παραγωγή χάλυβα, πλαστικών, υφασμάτων, επεξεργασία μετάλλων, προώθηση πυραύλων, οξυγονοθεραπεία, συστήματα υποστήριξης ζωής σε αεροσκάφη, υποβρύχια, διαστημόπλοια και δύτες.
Η εμπορική κατανάλωση οξυγόνου στις Η.Π.Α. υπερβαίνει τους 20 εκατομμύρια τόνους ετησίως. Ο εμπλουτισμός με οξυγόνο των υψικαμίνων στις χαλυβουργίες αντιπροσωπεύει τη μεγαλύτερη βιομηχανική χρήση του φυσικού αερίου. Μεγάλες ποσότητες χρησιμοποιούνται επίσης στην παρασκευή μίγματος αερίων κατά την παραγωγή αμμωνίας και μεθανόλης, καθώς και για οξυ-ακετυλενικές συγκολλήσεις.[9] Στα νοσοκομεία συχνά χρησιμοποιείται για την ενίσχυση της αναπνοής των ασθενών.
Το φυσικό οξυγόνο αποτελείται από τρία (3) σταθερά ισότοπα: το 16Ο (σε ποσοστό 99,762 %), το 17Ο και το 18O.
Ιστορία
Από τα αρχαία χρόνια μέχρι τον Μεσαίωνα
Ένα από τα πρώτα γνωστά πειράματα που έγινε για τη διερεύνηση της σχέσης ανάμεσα στην καύση και τον αέρα έχει αναφερθεί ότι έγινε κατά τον 3ο αιώνα π.Χ., από τον Έλληνα συγγραφέα και μηχανικό Φίλωνα (280 π.Χ. - 220 π.Χ.) από την πόλη του Βυζαντίου. Στο έργο του «Πνευματικά», ο Φίλων αναφέρει ότι αν ο λαιμός ενός αναποδογυρισμένου γυάλινου δοχείου που βρίσκεται πάνω από ένα αναμμένο κερί περιτριγυριστεί με νερό, το αποτέλεσμα θα είναι η άνοδος κάποιας ποσότητας νερού μέσα στον λαιμό του δοχείου, δηλαδή πάνω από τη στάθμη του νερού, που θα περίμενε κανείς από την αρχή «των συγκοινωνούντων δοχείων».[10] Ο Φίλων θεώρησε, εσφαλμένα όμως, ότι μέρος του αέρα που εγκλωβίστηκε στο δοχείο μετατράπηκε σε φωτιά και έτσι μπόρεσε να διαφύγει από τους πόρους του γυαλιού.
Ο μελετητής Ανατολικών Πολιτισμών Χάινριχ Κλάπροτ[Σημ. 1] αναφέρει ότι τον 8ο αιώνα ο Κινέζος συγγραφέας Μάο-Κόα (Mao-Khóa) σε χειρόγραφό του[Σημ. 2] έγραψε πως η ατμόσφαιρα αποτελείται από δύο συστατικά: το Γιανγκ (Yang) ή "πλήρης αέρας" (άζωτο) και το Γιν (Yin) ή "ατελής αέρας" (οξυγόνο). Το Γιν έχει την τάση να ενώνεται με πολλά μέταλλα, θειάφι και άνθρακα αλλά όχι με τον χρυσό. Σύμφωνα με τον Κινέζο συγγραφέα, το οξυγόνο θα μπορούσε να παρασκευαστεί με θέρμανση νιτρικού καλίου (KNO3) και μερικών ορυκτών όπως ο πυρολουσίτης. Άλλωστε, ο ίδιος αναγνώρισε επίσης ότι το οξυγόνο ήταν ένα από τα συστατικά του νερού.[11]
Αρκετούς αιώνες αργότερα, ο Ιταλός Λεονάρντο ντα Βίντσι (Leonardo di ser Piero da Vinci, 1452 – 1519) βασίστηκε στο έργο του Φίλωνα και παρατήρησε ότι πράγματι μέρος του αέρα καταναλώθηκε κατά την καύση.[12]
Ο φυσικός φιλόσοφος Ρόμπερτ Χουκ (Robert Hooke, 1635 – 1703) στο βιβλίο του "Micrografia" που εκδόθηκε το 1665, δίνει μια πλήρη θεωρία για την καύση. Αναφέρει ότι ο αέρας περιέχει ένα συστατικό (το οξυγόνο) που υπάρχει σε στερεά μορφή στο νιτρικό κάλιο, και ένα άλλο αδρανές συστατικό σε μεγαλύτερη ποσότητα (το άζωτο).[11]
Στα τέλη του 17ου αιώνα ο Ρόμπερτ Μπόιλ (Robert Boyle, 1627 – 1691) απέδειξε την αναγκαιότητα του αέρα για την καύση. Ο Άγγλος χημικός Τζον Μέιγιου (John Mayow, 1641 – 1679 τελειοποίησε το έργο του προηγούμενου αποδεικνύοντας ότι η καύση χρειάζεται μόνο ένα μέρος του αέρα[13] ο οποίος περιέχει ένα συστατικό που το ονόμασε "Spiritus nitro-aereus" (οξυγόνο).[11] Με ένα του πείραμα βρήκε ότι τοποθετώντας ένα ποντίκι ή ένα αναμμένο κερί σε ένα αεροστεγώς κλειστό κουτί προκαλείται το ίδιο φαινόμενο, δηλαδή η άνοδος της στάθμης του νερού και η αντικατάσταση περίπου του 1/5 του αέρα κατ' όγκο πριν πεθάνει το ποντίκι ή σβήσει το κερί. Από αυτό συμπέρανε ότι το ίδιο τμήμα του αέρα καταναλώνεται από τη ζωή και την καύση.[14] Ο Μάγιου παρατήρησε ακόμη ότι το αντιμόνιο αυξάνει το βάρος του όταν θερμαίνεται και καταναλώνει αντίστοιχο τμήμα του αέρα.[13] Επίσης διατύπωσε την άποψη ότι οι πνεύμονες ξεχωρίζουν το τμήμα του αέρα που υποστηρίζει τη ζωή, την καύση και την οξείδωση μετάλλων από τον υπόλοιπο αέρα και το διοχετεύουν στο υπόλοιπο σώμα μέσω της κυκλοφορίας του αίματος.[13] Υπολογισμοί και σημειώσεις από αυτά τα πειράματα δημοσιεύθηκαν το 1668 στα έργα του Tractatus duo και "De respiratione".[14]
Η Θεωρία του «Φλογιστού»

Η θεωρία του «φλογιστού» (από την αρχαία ελληνική λέξη «φλογιστόν», δηλ. φλεγόμενο, από τη «φλοξ», δηλ. φλόγα) άρχισε το 1667 από τον Γερμανό φυσιοδίφη και αλχημιστή Γιόχαν Γιοακίμ Μπέχερ (Johann Joachim Becher, 1635 – 1682), ως μια επιστημονική θεωρία που θεωρούσε την ύπαρξη ενός επιπλέον στοιχείου, σε σχέση με τα τέσσερα κλασσικά στοιχεία των Ελλήνων και ονομάστηκε «Φλογιστόν» υπονοώντας σαφώς ότι επρόκειτο για ένα παρόμοιο στοιχείο με τη «Φωτιά», που περιέχονταν στα εύφλεκτα σώματα και απελευθερώνονταν κατά τη διάρκεια της καύσης. Με παρόμοιο τρόπο «εξηγούσε» και το σκούριασμα (οξείδωση) των διαφόρων μετάλλων. Συγκεκριμένα, το 1667 ο Μπέχερ δημοσίευσε το σύγγραμμά του Physical Education (δηλ. Φυσική Εκπαίδευση), στο οποίο για πρώτη φορά ανέφερε τη θεωρία του φλογιστού. Θεωρητικά, οι αλχημιστές θεωρούσαν πως υπάρχουν τέσσερα στοιχεία: η φωτιά, το νερό, ο αέρας και η γη. Στο βιβλίο του, ο Μπέχερ, αφαίρεσε τη φωτιά και τον αέρα από το κλασσικό μοντέλο των τεσσάρων στοιχείων και τα αντικατέστησε με τρεις μορφές της γης, που τις ονόμασε terra lapidea, terra fluida, και terra pinguis.[15][16] Η terra pinguis ήταν το στοιχείο που περιείχε τις ελαιώδεις, θειώδεις και άλλες εύφλεκτες ιδιότητες.[17] Ο Μπέχερ πίστευε ότι η terra pinguis ήταν ο βασικός παράγοντας της καύσης που εκλύεται όταν ένα εύφλεκτο υλικό καίγεται.[15] Το 1703 ο Γκέοργκ Στάαλ (Georg Ernst Stahl, 1659 – 1734) ), καθηγητής της Ιατρικής και της Χημείας του Πανεπιστημίου του Halle, πρότεινε μια παραλλαγή της θεωρίας αυτής, στην οποία ονόμαζε με τον όρο «φλόγιστρο» την terra pinguis του Μπέχερ. Τελικά, επικράτησε ο όρος «φλογιστό», πιθανότατα εξαιτίας της μεγαλύτερης επιρροής του καθηγητή.[18]

Σύμφωνα με τη θεωρία αυτή, όλα τα εύφλεκτα υλικά περιέχουν φλογιστό, ένα υλικό χωρίς χρώμα, οσμή, γεύση ή μάζα που απελευθερώνεται κατά την καύση. Αφού καεί το «αποφλογιστικό» (πλέον) υλικό, μεταπίπτει στην «αληθινή» του μορφή, τη σκουριά.
Έτσι, «φλογιστικά» είναι τα εύφλεκτα υλικά που περιέχουν φλογιστόν πριν την καύση και «αποφλογιστικά» τα υπολείμματα, μετά την καύση: «...γενικά, τα υλικά που καίγονται στον αέρα λέγεται ότι είναι πλούσια σε φλογιστόν· το γεγονός ότι η καύση σε κλειστό χώρο σύντομα παύει, πάρθηκε ως ένδειξη ότι ο αέρας (του κλειστού χώρου) είχε (περιορισμένη) χωρητικότητα απορρόφησης ποσότητας του Φλογιστού. Όταν ο αέρας γίνει πλήρως Φλογιστικός, δεν μπορεί πλέον να υποστηρίξει την καύση κανενός υλικού, ούτε κάποιο θερμαινόμενο μέταλλο σκουριάζει, ούτε ο φλογιστικός (πλέον) αέρας υποστηρίζει τη ζωή, γιατί και σ' αυτό το θέμα, ο ρόλος του αναπνεόμενου αέρα είναι η απομάκρυνση του φλογιστού από το ζωντανό σώμα.».[19]
Ο Σκωτσέζος γιατρός, χημικός και βοτανολόγος Ντάνιελ Ράδερφορντ (Daniel Rutherford, 1749–1819), όταν ανακάλυψε το άζωτο το 1772, χρησιμοποίησε εν μέρει τη θεωρία του φλογιστού για να εξηγήσει τα συμπεράσματά του. Τα αέρια κατάλοιπα που μένουν μετά την καύση, δηλαδή στην πραγματικότητα (κυρίως) άζωτο και διοξείδιο του άνθρακα (CO2), πολλές φορές αναφερόταν ως «φλογιστικός αέρας», που είναι πλήρως κορεσμένος με φλογιστό. Μάλιστα όταν το οξυγόνο πρωτοανακαλύφθηκε, υπήρχε η σκέψη ότι είναι ο «αποφλογιστικός αέρας», που είναι ικανός να ενωθεί με περισσότερο φλογιστό και έτσι να υποστηρίξει την καύση περισσότερο από τον κοινό αέρα.[20]
Η ανακάλυψη του οξυγόνου

Το οξυγόνο ανακαλύφθηκε στην Ουψάλα της Σουηδίας για πρώτη φορά από τον Σουηδό φαρμακοποιό και χημικό Καρλ Βίλχελμ Σέελε (Carl Wilhelm Scheele, 1742 – 1786) ο οποίος είχε παραγάγει αέριο οξυγόνο με θέρμανση οξειδίου του υδραργύρου και διάφορα νιτρικά άλατα περίπου το 1772.[12] Ο Σέελε ονόμασε το αέριο «φωτιά του αέρα», επειδή ήταν η μόνη ουσία που υποστήριζε την καύση και έγραψε ένα κείμενο της ανακάλυψής του σε μιά χειρόγραφη εργασία με τίτλο Treatise on Air and Fire, την οποία έστειλε στον εκδότη του το 1775. Ωστόσο, το κείμενο δε δημοσιεύθηκε μέχρι το 1777.[21]

Εν τω μεταξύ, την 1η Αυγούστου 1774, σε ένα πείραμα που πραγματοποίησε στο Ουίλτσιρ της νοτιο-δυτικής Αγγλίας ο κληρικός Τζόζεφ Πρίστλυ (Joseph Priestley, 1733-1804) παρατήρησε ένα έντονο, σαν του ήλιου, φως σε οξείδιο του υδραργύρου (HgO) μέσα σε ένα γυάλινο σωλήνα, το οποίο απελευθέρωσε ένα αέριο που το ονόμασε «αποφλογιστικό αέρα».[12] Πρόσεξε ότι τα κεριά καίγονται εντονότερα στο αέριο και ότι ένα ποντίκι γινόταν ζωηρότερο και ζούσε περισσότερο όταν το ανέπνεε. Όταν το εισέπνευσε και ο ίδιος διαπίστωσε μια ευεξία. Δημοσίευσε τις ανακαλύψεις του το 1775 σε μια εργασία με τίτλο "An Account of Further Discoveries in Air" που περιέχονταν στον δεύτερο τόμο του βιβλίου του με τίτλο "Experiments and Observations on Different Kinds of Air".[22] Επειδή δημοσίευσε τα ευρήματά του πρώτα, ο Πρίστλυ συχνά θεωρείται ότι έχει προτεραιότητα στην ανακάλυψη του οξυγόνου.
Ο διακεκριμένος Γάλλος χημικός Αντουάν Λαβουαζιέ (Antoine-Laurent de Lavoisier, 1743 - 1794)[Σημ. 3] αργότερα ισχυρίστηκε ότι είχε ανακαλύψει ανεξάρτητα τη νέα ουσία. Ωστόσο, ο Πρίστλυ επισκέφθηκε τον Λαβουαζιέ, τον Οκτώβριο του 1774 και του είπε για το πείραμα του και τον τρόπο με τον οποίο απελευθέρωσε το νέο είδος αερίου. Ο Σέελε έστειλε επίσης μια επιστολή στον Λαβουαζιέ στις 30 Σεπτεμβρίου 1774 στην οποία περιέγραφε τη δική του ανακάλυψη, αλλά ο Λαβουαζιέ ισχυρίστηκε ότι δεν έλαβε ποτέ αυτή την επιστολή αντίγραφο της οποίας βρέθηκε στα υπάρχοντα του Σέελε μετά τον θάνατό του.[21]
Η συνεισφορά του Λαβουαζιέ

Η αναμφισβήτητη συμβολή του Λαβουαζιέ ήταν η διεξαγωγή των πρώτων ποσοτικών πειραμάτων οξείδωσης και η πρώτη σωστή εξήγηση για το πώς λειτουργεί η καύση.[12] Ο Λαβουαζιέ συνήθιζε να πραγματοποιεί παρόμοια πειράματα το 1774, στην προσπάθειά του να αποδείξει ότι η Θεωρία του Φλογιστού ήταν λανθασμένη και ότι η ουσία που είχαν ανακαλύψει οι Σέλε και Πρίστλυ ήταν ένα νέο χημικό στοιχείο. Σε ένα πείραμα, παρατήρησε ότι δεν υπήρχε συνολική αύξηση του βάρους, όταν ο κασσίτερος και ο αέρας θερμαίνονται σε κλειστό δοχείο.[12] Πρόσεξε επίσης ότι ο αέρας έμπαινε ορμητικά μέσα όταν άνοιξε το δοχείο, πράγμα που σήμαινε ότι μέρος του αέρα μέσα στο δοχείο είχε καταναλωθεί. Σημείωσε επίσης ότι το βάρος του κασσιτέρου είχε αυξηθεί και ότι η αύξηση αυτή ήταν η ίδια με το βάρος του αέρα που μπήκε στο δοχείο. Αυτό και άλλα πειράματα καύσης καταγράφηκαν στο βιβλίο του "Sur la combustion en général", που δημοσιεύθηκε το 1777. Στο βιβλίο αυτό, ο Λαβουαζιέ, απέδειξε ότι ο αέρας είναι ένα μίγμα δύο αερίων: του "ζωτικού αέρα", ο οποίος είναι απαραίτητος για την καύση και την αναπνοή, και του "αζώτου", (από την ελληνική λέξη "ἄζωτον"="άψυχο"), το οποίο δεν είναι απαραίτητο.[12]
Ο Λαβουαζιέ μετονόμασε τον ζωτικό αέρα σε "oxygène" το 1777 από τις ελληνικές λέξεις "ὀξύς" (oxys) και "-γενής" (-genēs) επειδή νόμιζε λανθασμένα ότι το οξυγόνο ήταν συστατικό όλων των οξέων. Όπως σημείωσε ο Χάμφρυ Ντέιβι το 1812, οι χημικοί γρήγορα διαπίστωσαν ότι ο Λαβουαζιέ έκανε λάθος σε αυτή την παρατήρησή του για τα οξέα αλλά ήταν πλέον αργά διότι το όνομα είχε ήδη δοθεί.
Από τον Μεσαίωνα ως τον 21ο αιώνα
Στην αρχική ατομική θεωρία του Τζον Ντάλτον (John Dalton, 1766 – 1844)), υπήρχε η υπόθεση ότι όλα τα στοιχεία ήταν μονοατομικά και ότι τα άτομα στις ενώσεις είχαν μεταξύ τους την απλούστερη ατομική αναλογία. Για παράδειγμα ο Ντάλτον πίστευε ότι ο χημικός τύπος του νερού ήταν ΗΟ, με την ατομική μάζα του οξυγόνου να είναι 8πλάσια από αυτήν του υδρογόνου, σε αντίθεση με τη σημερινή τιμή που είναι περίπου 16.[23] Το 1805 ο Γκαι-Λυσάκ (Joseph Louis Gay-Lussac 1778 – 1850) και ο Αλεξάντερ φον Χούμπολτ (Friedrich Wilhelm Heinrich Alexander Freiherr von Humboldt, 1769 – 1859) έδειξαν ότι το νερό αποτελείται από δύο όγκους υδρογόνου και έναν όγκο οξυγόνου. Το 1811 ο Αβογκάντρο (Lorenzo Romano Amedeo Carlo DeMarkus Avogadro di Quaregna e di Cerreto, 1776 – 1856) βρήκε τη σωστή σύσταση του νερού, βασιζόμενος σ' αυτόν που αποκαλούμε σήμερα "Υπόθεση Αβογκάντρο" και στην παραδοχή της ύπαρξης διατομικών μορίων των στοιχείων.

Κατά τη διάρκεια του 19ου αιώνα το οξυγόνο παραγόταν σε μικρές ποσότητες από την αποσύνθεση του χλωρικού καλίου και χρησιμοποιούνταν κυρίως στην καύση του άνθρακα και περιστασιακά για ιατρικούς σκοπούς. το 1840, ανακαλύφθηκε το όζον που ήταν η πρώτη αλλοτροπική μορφή στοιχείου που αναγνωρίστηκε, από τον Γερμανό Κρίστιαν Σένμπαϊν (Christian Friedrich Schönbein, 1799 – 1868 ) οποίος το πρότεινε ως μια ξεχωριστή χημική ουσία. Ο χημικός τύπος του όζοντος όμως διευκρινίστηκε το 1865 από τον Ελβετό Ζακ-Λουί Σορέ (Jacques-Louis Soret, 1827 – 1890) και επιβεβαιώθηκε από τον Σένμπαϊν το 1867.
Μέχρι τα τέλη όμως του 19ου αιώνα οι επιστήμονες συνειδητοποίησαν ότι ο αέρας θα μπορούσε να υγροποιηθεί, και τα συστατικά του να απομονωθούν, με τη συμπίεση και την ψύξη του.
Το 1877 στη Γενεύη ο Ελβετός χημικός και φυσικός Ραούλ Πιέρ Πικτέ (Raoul-Pierre Pictet, 1846 – 1929) χρησιμοποιώντας μια μέθοδο καταιονισμού, εξάτμισε υγρό διοξείδιο του θείου, προκειμένου να υγροποιήσει διοξείδιο του άνθρακα, το οποίο με τη σειρά του εξατμίστηκε για να ψύξει αέριο οξυγόνο αρκετά ώστε αυτό να υγροποιηθεί. Στις 22 Δεκεμβρίου 1877 έστειλε ένα τηλεγράφημα στη Γαλλική Ακαδημία Επιστημών στο Παρίσι, ανακοινώνοντας την ανακάλυψη του υγρού οξυγόνου. Μόλις δύο ημέρες αργότερα, ο Γάλλος φυσικός Λουί-Πωλ Καϊγετέ (Louis-Paul Cailletet, 1832 - 1913) ανακοίνωσε τη δική του μέθοδο υγροποίησης μοριακού οξυγόνου.[24] Και στις δυο περιπτώσεις είχαν παραχθεί μόνο λίγες σταγόνες υγρού χωρίς πρακτική σημασία. Υγροποιημένο οξυγόνο σε σταθερή κατάσταση παρασκευάστηκε για πρώτη φορά στις 29 Μαρτίου 1883 από τους Πολωνούς επιστήμονες Ζίγκμουντ Βρομπλέφσκι (Zygmunt Wróblewski, 1845 - 1888) και Κάρολ Ολζέφσκι (Karol Olszewski, 1846 – 1915).[25]
Το 1891 ο Σκωτσέζος χημικός Τζέιμς Ντιούαρ (James Dewar) παρήγαγε αρκετό υγρό οξυγόνο για μελέτες.[21] Η πρώτη εμπορικά βιώσιμη διαδικασία για την παραγωγή υγρού οξυγόνου αναπτύχθηκε ανεξάρτητα το 1895 από τoν Γερμανό μηχανικό Καρλ φον Λίντε (Carl von Linde, 1842 - 1934) και τον Βρετανό μηχανικό Γουίλιαμ Χάμπσον (William Hampson, 1854 - 1926). Και οι δύο ερευνητές μείωσαν τη θερμοκρασία του αέρα έως ότου υγροποιήθηκε και μετά διαχώρισαν με απόσταξη τα αέρια συστατικά απομακρύνοντας ένα κάθε φορά.[26] Αργότερα, το 1901, η πραγματοποίηση οξυγονοκόλλησης επιτεύχθηκε για πρώτη φορά από την καύση ενός μείγματος ακετυλενίου και συμπιεσμένου O2. Αυτή η μέθοδος συγκόλλησης και κοπής μετάλλων έγινε αργότερα πολύ συνηθισμένη.[26]
Το 1923 ο Αμερικανός επιστήμονας Ρόμπερτ Γκοντάρ ανέπτυξε για πρώτη φορά κινητήρα πυραύλου ο οποίος μάλιστα χρησιμοποιούσε ως καύσιμο μείγμα βενζίνης και υγρού οξυγόνου. Ο Γκοντάρ εκτόξευσε επιτυχώς ένα μικρό πύραυλο υγρών καυσίμων σε απόσταση 56 μέτρων με ταχύτητα 97 χιλιόμετρα ανά ώρα στις 16 Μαρτίου 1926 στη Μασαχουσέτη.[26]
Μετά τον Β΄ Παγκόσμιο Πόλεμο αναπτύχθηκαν νέες τεχνολογίες διαχωρισμού των συστατικών του αέρα και κατά συνέπεια νέες τεχνικές παραγωγής οξυγόνου. Ο όγκος παραγωγής και τα επίπεδα καθαρότητας αυξήθηκαν, ενώ το κόστος μειώθηκε. Το 1991, πάνω από 13,4 δις κυβικά μέτρα οξυγόνου παράχθηκαν στις Η.Π.Α. καθιστώντας το Ο2 το δεύτερο σε παραγωγή βιομηχανικό αέριο.[27]
Φυσική παρουσία
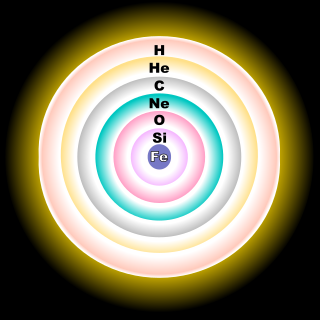
Το οξυγόνο είναι το πιο άφθονο κατά μάζα χημικό στοιχείο στη βιόσφαιρα, στην ατμόσφαιρα, στην υδρόσφαιρα και στη λιθόσφαιρα της Γης. Είναι, ακόμη, το 3ο πιο άφθονο χημικό στοιχείο στο Σύμπαν, μετά από το υδρογόνο (H) και το ήλιο (He)[3]. Περίπου το 0,9% της μάζας του Ήλιου είναι οξυγόνο[5]. Το οξυγόνο αποτελεί το 49,2% κατά μάζα του φλοιού της Γης[6] και κύριο ποσοστό κατά μάζα (88,8%) των ωκεανών του πλανήτη μας[5]. Το οξυγόνο είναι το δεύτερο πιο άφθονο αέριο της ατμόσφαιρας της Γης, καταλαμβάνοντας το 20,8% κατ' όγκο και το 23,1% κατά μάζα, 1015 τόνοι οξυγόνου συνολικά[5][28][29]. Η Γη είναι ασυνήθιστη ανάμεσα στους υπόλοιπους πλανήτες του ηλιακού συστήματος έχοντας μια τόσο μεγάλη συγκέντρωση οξυγόνου κατ' όγκο. Η Αφροδίτη έχει πολύ μικρότερη συγκέντρωση οξυγόνου.
Ωστόσο, το οξυγόνο που περιβάλλει αυτούς τους άλλους πλανήτες παράγεται μόνο από την ακτινόλυση, από την υπεριώδη ακτινοβολία, οξυγονούχων μορίων, όπως το διοξείδιο του άνθρακα (CO2).
Η ασυνήθιστα υψηλή συγκέντρωση αερίου οξυγόνου στη Γη είναι το αποτέλεσμα του κύκλου του οξυγόνου. Αυτός ο βιογεωχημικός κύκλος περιγράφει την κίνηση του οξυγόνου διαμέσου και μεταξύ των τριών (3) κύριων δεξαμενών οξυγόνου στη Γη, δηλαδή της ατμόσφαιρας, της βιόσφαιρας και της λιθόσφαιρας. Ο κύριος παράγοντας καθοδήγησης του οξυγόνου στη Γη είναι η φωτοσύνθεση, που είναι υπεύθυνη για τη σύνθεση της σύγχρονης ατμόσφαιρας του πλανήτη. Η φωτοσύνθεση απελευθερώνει οξυγόνο στην ατμόσφαιρα, ενώ η αναπνοή και η διάσπαση αφαιρούν οξυγόνο από την ατμόσφαιρα. Στη σημερινή ισορροπία, η ετήσια παραγωγή και η κατανάλωση οξυγόνου έχουν τον ίδιο ρυθμό, που αντιστοιχεί στο 1/2000 του συνολικού οξυγόνου της ατμόσφαιρας.
Το ελεύθερο (στοιχειακό) οξυγόνο υπάρχει ακόμη σε διάλυση στα παγκόσμια υδάτινα σώματα. Η αυξημένη διαλυτότητα του οξυγόνου σε χαμηλότερες θερμοκρασίες εχει σημαντικές επιπτώσεις στην ωκεάνια ζωή, καθώς οι πολικοί ωκεανοί υποστηρίζουν πολύ μεγαλύτερη πυκνότητα ζωής, εξαιτίας του μεγαλύτερου ποσοστού διαλυμένου οξυγόνου σε αυτούς[30].
Όταν το νερό ρυπαίνεται με φυτικά λιπάσματα, όπως τα νιτρικά ή τα φωσφορικά, μπορεί να υποστηρίξει την υπερβολική ανάπτυξη φυκών, μια διεργασία που ονομάζεται ευτροφισμός, με αποτέλεσμα η αποσύνθεση αυτών των οργανισμών και άλλων βιοδιασπώμενων υλικών να μειώνει τη συγκέντρωση του οξυγόνου στα υδάτινα οικοσυστήματα. Οι επιστήμονες μπορούν να αξιοποιήσουν αυτό το φαινόμενο, μετρώντας ως ποιοτική παράμετρο του νερού το βιοχημικά απαιτούμενο οξυγόνο (Biochemical Oxygen Demand, BOD), δηλαδή το οξυγόνο που απαιτείται για να αποκατασταθεί η κανονική συγκέντρωση του οξυγόνου στο νερό[31].


Βιομηχανική παραγωγή

Δυο (2) είναι οι κύριες μέθοδοι που αντιπροσωπεύουν την παραγωγή περίπου 100 εκατομμυρίων τόνων οξυγόνου ετησίως, με απομόνωση από τον ατμοσφαιρικό αέρα, για βιομηχανικές εφαρμογές[21]. Η πιο συνηθισμένη μέθοδος είναι η κλασματική απόσταξη υγροποιημένου αέρα στα διάφορα συστατικά του, με το άζωτο να αποστάζεται πρώτο, ενώ το οξυγόνο παραμένει υγρό[21].
Η άλλη κύρια μέθοδος παραγωγής οξυγόνου περιλαμβάνει ένα ρεύμα καθαρού και ξηρού αέρα μέσα από ένα ζεύγος ταυτόσημων μοριακών φίλτρων ζεολίθων, που απορροφούν άζωτο και αφήνουν ένα αέριο μείγμα που περιέχει 90 - 93% οξυγόνο[21], που αντλείται έξω από τον θάλαμο των ζεολίθων με αντιστροφή της ροής. Εν τω μεταξύ, οι κορεσμένοι με άζωτο ζεόλιθοι, απελευθερώνουν το αέριο, με εφαρμογή μειωμένης πίεσης και έτσι είναι έτοιμοι για ένα νέο γύρο διέλευσης αέρα - απορρόφησης αζώτου - αποθήκευσης οξυγόνου - απελευθέρωσης αζώτου. Έτσι εξασφαλίζεται μια συνεχής (σχεδόν) παροχή οξυγόνου. Αυτή η διεργασία είναι γνωστή ως απορρόφηση με εναλλαγή της πίεσης, ενώ είναι διαθέσιμη και η απορρόφηση με εναλλαγή κενού. Η παραγωγή οξυγόνου με τέτοιες μη κρυογονικές μεθόδους αυξάνεται[32].
Αέριο οξυγόνο μπορεί επίσης να παραχθεί και με ηλεκτρόλυση του νερού σε μοριακό οξυγόνο και μοριακό υδρογόνο. Πρέπει να χρησιμοποιηθεί συνεχές ηλεκτρικό ρεύμα. Αν χρησιμοποιηθεί εναλλασσόμενο ηλεκτρικό ρεύμα και τα δυο αέρια παράγονται και στα δυο ηλεκτρόδια στην εκρηκτική αναλογία 2:1. Αντίθετα από τη δημοφιλή πεποίθηση, η αναλογία 2: 1 παρατηρείται στην ηλεκτρόλυση συνεχούς ηλεκτρικού ρεύματος του οξινισμένου ύδατος, αλλά δεν αποδεικνύει ότι εμπειρικός τύπος του νερού είναι H2O, παρά μόνο αν πληρούνται ορισμένες παραδοχές που γίνονται για τους μοριακούς τύπους του υδρογόνου και του οξυγόνου. Μια παρόμοια μέθοδος είναι η ηλεκτροκαταλυτική παραγωγή οξυγόνου από οξείδια και οξοξέα. Χημικοί καταλύτες επίσης μπορούν να χρησιμοποιηθούν, όπως στις χημικές γεννήτριες οξυγόνου ή τα κεριά οξυγόνου, που χρησιμοποιούνται ως μέρη του εξοπλισμού υποστήριξης ζωής σε υποβρύχια, και είναι επίσης κανονικός εξοπλισμός για τις εμπορικές αερογραμμές για έκτακτες περιπτώσεις αποσυμπίεσης. Μια άλλη τεχνολογία διαχωρισμού του αέρα περιλαμβάνει τη διέλευση ατμοσφαιρικού αέρα διαμέσου κεραμικών μεμβρανών που περιέχουν διοξείδιο του ζιρκονίου (ZrO2), με τη χρήση υψηλής πίεσης ή ηλεκτρικού ρεύματος, για την παραγωγή σχεδόν καθαρού οξυγόνου[31].
Σε μεγάλες ποσότητες, η τιμή του υγροποιημένου οξυγόνου το 2001 ήταν περίπου 210$/τόνο[33]. Εφόσον το κύριο κόστος της παραγωγής του είναι το ενεργειακό κόστος της υγροποίσης του αέρα, το κόστος παραγωγής οξυγόνου αυξομειώνεται με τη μεταβολή του κόστους της ενέργειας.
Αποθήκευση
Οι μέθοδοι αποθήκευσης οξυγόνου περιλαμβάνουν υψηλής πίεσης δεξαμενές αερίου οξυγόνου, κρυογενικές δεξαμενές υγρού οξυγόνου και κάποιες οξυγονούχες χημικές ενώσεις. Για λόγους οικονομίας, το οξυγόνο μεταφέρεται χύμα ως υγρό σε ειδικά διαμορφωμένα δεξαμενόπλοια, εφόσον 1 λίτρο υγροποιημένου οξυγόνου αντιστοιχεί με 840 λίτρα αερίου οξυγόνου, υπό κανονική ατμοσφαιρική πίεση (1 atm) στους 20°C [21]. Τέτοια δεξαμενόπλοια χρησιμοποιήθηκαν για την επαναγέμιση δεξαμενών υγροποιημένου οξυγόνου, που βρίσκονται έξω από νοσοκομεία και άλλα ιδρύματα που χρειάζονται μεγάλες ποσότητες καθαρού οξυγόνου. Το υγροποιημένο οξυγόνο περνά, έπειτα, διαμέσου εναλλακτών θερμότητας που εξαερώνουν το υγροποιημένο οξυγόνο πριν αυτό μπει στα κυρίως κτίρια. Το οξυγόνο επίσης αποθηκεύεται και μεταφέρεται σε μικρότερους κυλίνδρους που περιέχουν συμπιεσμένο οξυγόνο, μια μορφή χρήσιμη για ορισμένες φορητές ιατρικές και μεταλλουργικές εφαρμογές[21].
Χαρακτηριστικά
Ιδιότητες και μοριακή δομή

Στις κανονικές συνθήκες περιβάλλοντος, το χημικά καθαρό οξυγόνο είναι άχρωμο και άοσμο αέριο με μοριακό τύπο O2, δηλαδή είναι διοξυγόνο. Στο μόριο αυτού του διοξυγόνου, τα δυο άτομα οξυγόνου ενώνονται χημικά μεταξύ τους. Ο δεσμός μπορεί να περιγραφεί με διάφορους τρόπους σε θεωρητικό επίπεδο, αλλά λογικά και απλά περιγράφεται ως ομοιοπολικός διπλός δεσμός που προέρχεται από ένα (1) σ δεσμό, από τη μεταξύ τους επικάλυψη των 2p τροχιακών κατά μήκος του μοριακού άξονα, και ένα (1) συνολικά π δεσμό, από την επικάλυψη των δυο άλλων σετ 2p τροχιακών γύρω από τον μοριακό άξονα. Τα δύο (2) ζεύγη από πρώην 2s ηλεκτρόνια των δυο ατόμων καταλαμβάνουν πλήρως τα σ και τα σ* μοριακά τροχιακά, ενώ τα υπόλοιπα τέσσερα (4) ζεύγη πρώην 2p ηλεκτρονίων καταλαμβάνουν πλήρως τα π μοριακά τροχιακά[34]. Η συνολική τάξη αυτού του δεσμού των δυο ατόμων είναι 2 (= 1-1+1+1). Γι' αυτό συχνά περιγράφεται ως διπλός δεσμός.
Εναλλακτικά, το μόριο του οξυγόνου έχει περιγραφεί έχοντας ηλεκτρονιακή δομή τριπλής κατάστασης. Αυτή περιγράφηκε για πρώτη φορά κατά τη δεκαετία του 1960 από τον Λάινους Πόλινγκ (Linus Carl Pauling), ως συνδυασμός ενός (1) δεσμού σ των δύο (2) ηλεκτρονίων και δύο (2) π δεσμών των τριών (3) ηλεκτρονίων[35]. Το (δι)οξυγόνο τριπλής κατάστασης, όπως λέγεται, που δεν πρέπει να συγχέεται με το όζον (δηλαδή το τριοξυγόνο O3), αποτελεί τη βασική κατάσταση του διοξυγόνου[36]. Η δομή αυτή περιλαμβάνει δυο (2) μονήρη ηλεκτρόνια που ημικαταλαμβάνουν από ένα τα δύο (2) π*, που είναι αντιδεσμικά τροχιακά, με αποτέλεσμα να αποδυναμώνεται ο συνολικός δεσμός. Η συνολική τάξη του δεσμού είναι και πάλι 2 (= 1+1+1-0,5-0,5).
Έτσι, ο δεσμός στο διοξυγόνο τριπλής κατάστασης είναι ασθενέστερος από τον δεσμό του διαζώτου, που δεν περιλαμβάνει αυτά τα δυο ηλεκτρόνια στα π* τροχιακά[36].

Στο διοξυγόνο τριπλής κατάστασης, τα μόρια είναι παραμαγνητικά. Αυτό σημαίνει ότι το οξυγόνο αυτό επηρεάζεται από την παρουσία ισχυρού μαγνητικού πεδίου, γιατί οι μαγνητικές ροπές των παράλληλων spin των δύο (2) μονήρων ηλεκτρονίων κάθε μορίου του (οξυγόνου τριπλής κατάστασης) αλληλεπιδρούν με το πεδίο. Αυτό είναι φανερό σε υγροποιημένο οξυγόνο, που φαίνεται (σε σχετική επίδειξη) να συγκεντρωνεται, παρά τη βαρύτητα, ανάμεσα στους πόλους ενός ισχυρού ηλεκτρομαγνήτη[37][38].
Η ονομασία διοξυγόνο απλής κατάστασης δόθηκε σε αρκετά υψηλότερης ενέργειας χημικά είδη μοριακού διοξυγόνου, στα οποία όλα τα ηλεκτρόνια βρίσκονται σε μονήρη ζεύγη, και τα spin τους είναι αντιπαράλληλα. Έτσι, το διοξυγόνο απλής κατάστασης είναι πιο δραστικό έναντι οργανικών μορίων σε σύγκριση με το κοινό διοξυγόνο τριπλής κατάστασης. Στη φύση, το διοξυγόνο απλής κατάστασης σχηματίζεται συχνά από το νερό κατά τη διάρκεια της φωτοσύνθεσης, χρησιμοποιώντας ενέργεια από το ηλιακό φως[39]. Παράγεται, επίσης, στην τροπόσφαιρα, με φωτόλυση του όζοντος χρησιμοποιώντας χαμηλού μήκους κύματος (ηλιακό) φως[40], καθώς και από το (ανθρώπινο και ζωικό) ανοσοποιητικό σύστημα ως πηγή ενεργού οξυγόνου (με μικροβιοκτόνα δράση)[41]. Τα καροτενοειδή σε φωτοσυνθετικούς οργανισμούς, αλλά πιθανώς επίσης και σε ζώα (ή ανθρώπους) στα οποία είναι παρόντα, παίζουν μεγάλο ρόλο απορροφώντας ενέργεια από το (παραγόμενο από την υπεριώδη ακτινοβολία) διοξυγόνο απλής κατάστασης, και μετατρέποντάς το έτσι στο (λιγότερο δραστικό) διοξυγόνο τριπλής κατάστασης, προστατεύοντας έτσι τους ιστούς από πιθανές βλάβες (που θα προκαλούσε το πολύ δραστικό διοξυγόνο απλής κατάστασης)[42].
Αλλότροπα

Η συνηθισμένη αλλομορφή του οξυγόνου στη Γη είναι το διοξυγόνο (O2). Το μόριό του έχει μήκος δεσμού 121 pm και η ενέργεια δεσμού του είναι 498 kJ/mole[43]. Αυτή η αλλομορφή χρησιμοποιείται από σύνθετες μορφές ζωής, όπως τα ζώα, στην κυτταρική αναπνοή (δείτε την ενότητα «Βιολογία», παρακάτω) και σε αυτήν την αλλομορφή αποτελεί το δεύτερο αέριο της ατμόσφαιρας του πλανήτη μας (δείτε την ενότητα «Φυσική παρουσία», παραπάνω).
Άλλη αξιοσημείωτη αλλομορφή του οξυγόνου είναι το όζον (τριοξυγόνο, O3). Αυτό είναι μια πολύ δραστική αλλομορφή του οξυγόνου, που προκαλεί βλάβες στον πνευμονικό ιστό (αν εισπνευθεί)[44]. Το όζον παράγεται στην ανώτερη ατμόσφαιρα (του πλανήτη μας), όπου το διοξυγόνο ενώνεται με ατομικό οξυγόνο, που με τη σειρά του παράγεται με ακτινόλυση διοξυγόνου από την υπεριώδη ακτινοβολία (του Ήλιου)[8]. Εφόσον το όζον απορροφά ισχυρά στην περιοχή της υπεριώδους του φάσματος, το (στρατοσφαιρικό) στρώμα του όζοντος λειτουργεί ως προστατευτική ασπίδα (για κάθε γνωστή μορφή ζωής) του πλανήτη μας[8]. Ωστόσο, όταν βρίσκεται κοντά στην επιφάνεια του πλανήτη μας, παραγώμενο ως παραπροϊόν της εξάτμισης των αυτοκινήτων, αποτελεί ρύπο[44].

Το μετασταθές τετραοξυγόνο (O4), που ανακαλύφθηκε το 2001[45][46], υποτέθηκε ότι υπάρχει σε μία από τις έξι (6) φάσεις του στερεοποιημένου οξυγόνου. Όμως, το 2006 αποδείχθηκε ότι στη συγκεκριμένη φάση, που παράγεται με συμπίεση διοξυγόνου υπό πίεση 2 - 20 GPa, στην πράξη σχηματίζεται (μοριακό) συγκρότημα που αντιστοιχεί στο ρομβοεδρικό οκταοξυγόνο (O8)[47]. Η τελευταία αλλομορφή (το οκταοξυγόνο) αποτελεί εν δυνάμει πολύ ισχυρότερο οξειδωτικό, σε σύγκριση με το διοξυγόνο, αλλά και με το όζον, οπότε ίσως στο μέλλον να χρησιμοποιηθεί ως προωθητικό πυραύλων[45][46]. Μια μεταλλική φάση (αλλομορφή) οξυγόνου ανακαλύφθηκε το 1990, σχηματίζεται όταν στερεοποιημένο οξυγόνο συμπιέζεται υπό πίεση πάνω από 96 GPa[48] και αποδείχθηκε το 1998 ότι σε πολύ χαμηλές θερμοκρασίες γίνεται υπεραγώγιμη[49].



Βιολογία
Το οξυγόνο είναι ένα από τα 27 απαραίτητα χημικά στοιχεία για τη ζωή. Μαζί με τον άνθρακα, το υδρογόνο και το άζωτο αποτελούν, σε ποσοστό, το 96% (κατά βάρος) των ζωντανών οργανισμών. Το διοξείδιο του άνθρακα σε συνδυασμό με το νερό και ενέργεια από το (ηλιακό) φως παράγουν οξυγόνο και γλυκόζη. Αυτή η βιολογική λειτουργία ονομάζεται φωτοσύνθεση και είναι η βασική διαδικασία στην ανακύκλωση του οξυγόνου στη φύση.
Το οξυγόνο είναι επίσης παρόν στο νερό, ουσία απαραίτητη για όλες τις μορφές ζωής. Οι περισσότεροι ζωντανοί οργανισμοί χρησιμοποιούν το οξυγόνο της ατμόσφαιρας για να επιτελέσουν τη λειτουργία της κυτταρικής αναπνοής, χάρη στην οποία οι οργανισμοί παίρνουν ενέργεια διασπώντας τις τροφές.
Σε αντίθεση με το διατομικό οξυγόνο (Ο2), το τριατομικό οξυγόνο (όζον, Ο3) είναι τοξικό για τους οργανισμούς σε περίπτωση εισπνοής. Ωστόσο, το στρώμα του όζοντος στην ανώτερη ατμόσφαιρα (οζονόσφαιρα) είναι πολύ σημαντικό για τη διατήρηση της ζωής, καθώς προστατεύει τους οργανισμούς απορροφώντας μεγάλο μέρος της επιβλαβούς υπεριώδους ακτινοβολίας που περιέχεται στην ηλιακή ακτινοβολία.[50]
Σημειώσεις
- Γιος του Γερμανού χημικού Μάρτιν Χάινριχ Κλάπροτ (Martin Heinrich Klaproth, 1743 – 1817) που ανακάλυψε το ουράνιο και το ζιρκόνιο
- Μετέπειτα συγγραφείς αμφισβητούν τη γνησιότητα του χειρογράφου
- Ο Λαβουαζιέ θεωρείται ο πατέρας της σύγχρονης Χημείας και αυτός που ουσιαστικά τη διαχώρισε από την αλχημεία
Παραπομπές
Πηγές
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.


