Αμμωνία
χημική ένωση αζώτου και υδρογόνου, με χημικό τύπο NH3 From Wikipedia, the free encyclopedia
Η αμμωνία[1] (αγγλικά: ammonia) είναι ανόργανη δυαδική χημική ένωση που περιέχει άζωτο και υδρογόνο, με μοριακό τύπο NH3. Η χημικά καθαρή αμμωνία, στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι άχρωμο αέριο, με χαρακτηριστική αποπνικτική οσμή. Είναι το απλούστερο αζάνιο. Η αμμωνία (άμεσα ή έμμεσα) συνεισφέρει σημαντικά στις θρεπτικές ανάγκες των γήινων οργανισμών, εξυπηρετώντας ως πρόδρομη ένωση για τροφές και λιπάσματα. Επίσης, η αμμωνία αποτελεί δομικό συστατικό για τη σύνθεση πολλών φαρμακευτικών, αλλά και πολλών εμπορικών καθαριστικών προϊόντων. Παρά την ευρύτατη χρήση της, η ίδια η αμμωνία είναι καυστική και βλαβερή.
| Αμμωνία | |||
|---|---|---|---|
 | |||
 | |||
 | |||
| Γενικά | |||
| Όνομα IUPAC | Αζάνιο | ||
| Άλλες ονομασίες | Αμμωνία Αζίδιο του υδρογόνου | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | NH3 | ||
| Μοριακή μάζα | 17,031amu | ||
| Αριθμός CAS | 7664-41-7 | ||
| SMILES | N | ||
| InChI | 1/H3N/h1H3 | ||
| Αριθμός EINECS | 231-635-3 | ||
| Αριθμός RTECS | BO0875000 | ||
| Αριθμός UN | 1005 (άνυδρη) 2672 (διαλύματα) 2073 3318 | ||
| PubChem CID | 222 | ||
| ChemSpider ID | 217 | ||
| Δομή | |||
| Διπολική ροπή | 1,46 D | ||
| Μήκος δεσμού | 101,2 pm | ||
| Είδος δεσμού | πολωμένος ομοιοπολικός τύπου σ (1s-2sp³) | ||
| Γωνία δεσμού | 106,7˚ | ||
| Μοριακή γεωμετρία | τριγωνική πυραμιδική | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −77,73 °C | ||
| Σημείο βρασμού | −33,34 °C | ||
| Κρίσιμη θερμοκρασία | 132,3 °C | ||
| Κρίσιμη πίεση | 11,300 MPa | ||
| Πυκνότητα | 817 kg/m³ (-80 °C, διαφανές στερεό) 860 kg/m³ (Σ.Ζ, 1,015 bar) 681,9 kg/m³ (-33,3 °C, υγρό) 0,789 kg/m³ (Κ.Σ.) 0,73 kg/m³ (15 °C) | ||
| Διαλυτότητα στο νερό | 47% w/w (0˚C) 31% w/w (25˚C) 18% w/w (50˚C) | ||
| Ιξώδες | 0,276 cP (−40 °C) | ||
| Δείκτης διάθλασης , nD | 1,3327 | ||
| Εμφάνιση | Άχρωμο αέριο | ||
| Χημικές ιδιότητες | |||
| pKa | 9,25 () 38 () | ||
| Σημείο αυτανάφλεξης | 651 °C | ||
| Επικινδυνότητα | |||
| Τοξική (T) Διαβρωτική (C) Βλαβερή για το Περιβάλλον (N) | |||
| Φράσεις κινδύνου | 10, 23, 34, 50 | ||
| Φράσεις ασφαλείας | (1/2), 9, 16, 26 36/37/39, 45, 61 | ||
| Κίνδυνοι κατά NFPA 704 | |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Ταξινομήθηκε στις εξαιρετικά βλαβερές ουσίες στις ΗΠΑ (και όχι μόνο) και γι' αυτό οι εγκαταστάσεις που παράγουν, αποθηκεύουν ή χρησιμοποιούν αμμωνία σε σημαντικές ποσότητες υπόκεινται (νομικά) σε αυστηρώς απαιτούμενες προδιαγραφές ασφαλείας.[2]
Η παγκόσμια βιομηχανική παραγωγή αμμωνίας το 2014 ήταν 176.300.000 τόνοι.[3] δηλαδή είχε μια αύξηση της τάξης του 16% σε σχέση με το 2006, κατά το οποίο η παγκόσμια βιομηχανική παραγωγή αμμωνίας ήταν 152.000.000 τόνοι.[4]
Η (χημικά καθαρή) αμμωνία συχνά αποκαλείται «άνυδρη αμμωνία». Ο όρος δίνει έμφαση στην απουσία νερού από το υλικό. Η άνυδρη, λοιπόν, αμμωνία βράζει στους -33,34 °C (υπό πίεση 1 atm) οπότε όταν είναι υγρό πρέπει να αποθηκευθεί κάτω από υψηλή πίεση ή και σε ψύξη σε (αρκετά) χαμηλή θερμοκρασία. Σε αντιδιαστολή, το υδατικό διάλυμά της, που συχνά παριστάνεται με τον τύπο NH4OH, ο οποίος είναι ισοδύναμος με τον τύπο NH3 (aq), και αποκαλείται «οικιακή αμμωνία». Ένα τυπικό εμπορικό προϊόν «πυκνής αμμωνίας» αντιστοιχεί σε περίπου 30% (άνυδρη) αμμωνία (κατά μάζα)[5].
Ουσίες που περιέχουν αμμωνία ή και κάποια παρόμοια χημικά είδη (συνήθως το κατιόν του αμμωνίου, NH4+) συχνά αποκαλούνται με τη χρήση του επιθέτου «αμμωνιακός».
Επίσης το συστηματικό όνομα «αζάνιο», επεκτείνεται τόσο στην ομώνυμη ομόλογη σειρά, όσο και ευρύτερα ακόμη, δηλαδή και σε μια σειρά «θυγατρικών» αζωτούχων ανόργανων και οργανικών ενώσεων, που συμπεριλαμβάνουν και τις αμίνες.
Φυσική παρουσία
Η αμμωνία βρίσκεται σε ιχνοποσότητες στην ατμόσφαιρα. Προέρχεται από την αποσύνθεση αζωτούχας ζωικής και φυτικής ύλης. Η αμμωνία και τα αμμωνιακά άλατα βρίσκονται επίσης, σε μικρές ποσότητες στο νερό της βροχής, όπου το χλωριούχο αμμώνιο (NH4Cl) και το θειικό αμμώνιο [(NH4)2SO4] προέρχεται από ηφαιστειακές εκλύσεις. Κρύσταλλοι όξινου ανθρακικού αμμωνίου [NH4(HCO3)] βρίσκονται στο ψευδοορυκτό γουανό, σε περιοχές της Παταγωνίας, προερχόμενο από την αποσύνθεση των περιττωμάτων θαλάσσιων πουλιών. Οι νεφροί χρησιμοποιούν αμμωνία για να εξουδετερώνουν τυχόν (τοπική) περίσσεια οξέων (ελέγχοντας έτσι το pH στο αίμα)[6]. Άλατα του αμμωνίου βρίσκονται και κατανέμονται μέσω του εύφορου εδάφους και του θαλάσσιου νερού.
Στο διάστημα
Η αμμωνία έχει βρεθεί επίσης και στο (υπόλοιπο εκτός της Γης) ηλιακό σύστημα, και πιο συγκεκριμένα στους πλανήτες Άρη, Δία, Κρόνο, Ουρανό και Ποσειδώνα, αλλά και στον πλανήτη-νάνο Πλούτωνα.
Πιο συγκεκριμένα, η αμμωνία έχει ανιχνευθεί στις ατμόσφαιρες των γιγαντιαίων πλανητών, που συμπεριλαμβάνουν τον Δία, στην ατμόσφαιρα του οποίου βρίσκεται αμμωνία ανάμεσα σε άλλα αέρια όπως το μεθάνιο, το υδρογόνο και το ήλιο. Εκτός από την ατμόσφαιρα και το εσωτερικό του Κρόνου μπορεί να περιέχει παγωμένους κρυστάλλους αμμωνίας[7]. Τέλος έχει βρεθεί και στους δύο φυσικούς δορυφόρους του Άρη, δηλαδή στον Δείμο και στον Φόβο.
Στο διαστρικό διάστημα
Η αμμωνία ανιχνεύθηκε για πρώτη φορά στο διαστρικό διάστημα το 1968, με βάση τις εκπομπές μικροκυμάτων από τη διεύθυνση του γαλακτικού πυρήνα[8]. Η αμμωνία ήταν η πρώτη πολυατομική ένωση που ανιχνεύθηκε στο διαστρικό διάστημα. Η ευαισθησία του μορίου της σε ένα μεγάλο εύρος διεγέρσεων και η (σχετική) ευκολία με την οποία αυτές μπορούν να παρατηρηθούν σε έναν αριθμό περιοχών, έχουν καταστήσει την αμμωνία μια από τις πιο σημαντικές ενώσεις για μελέτες στα μοριακά νεφελώματα[9]. Η σχετική ένταση των φασματικών γραμμών της αμμωνίας μπορεί να χρησιμοποιηθεί για τη μέτρηση της θερμοκρασίας του υλικού που εκπέμπει αυτές τις ακτινοβολίες. Τα ακόλουθα ισοτοπικά χημικά είδη ανιχνεύθηκαν: NH3, 15NH3, NH2D, NHD2, και ND3.
Η ανίχνευση της τριδευτεριούχας αμμωνίας θεωρήθηκε έκπληξη, εφόσον το δευτέριο είναι σχετικά σπάνιο. Μια εξήγηση που προτάθηκε είναι ότι οι συνθήκες χαμηλών θερμοκρασιών (που επικρατούν) εκεί επιτρέπουν στα μόρια αυτό να επιβιώνουν και να συσσωρεύονται[10].
Από την διαστρική της ανακάλυψη, η αμμωνία αποδείχθηκε ότι είναι ανεκτίμητο φασματοσκοπικό εργαλείο για τη μελέτη του διαστρικού ενδιάμεσου. Με ένα μεγάλο αριθμό μηκών κύματος εκπομπής, εξαιτίας του μεγάλου εύρους διεγέρσεων που επιτρέπει το μόριό της, η ανακάλυψη αμμωνίας έχει αναφερθεί σε εκατοντάδες επιστημονικά άρθρα.
Η μελέτη της διαστρικής αμμωνίας ήταν σημαντική σε έναν αριθμό περιοχών έρευνας τις λίγες τελευταίες δεκαετίες. Η πιο σημαντική από αυτές είναι η ανάδειξη της αμμωνίας ως «διαστρικού θερμομέτρου».
Διαστρικός μηχανισμός παραγωγής αμμωνίας
Η διαστρική (σχετική) αφθονία της αμμωνίας έχει μετρηθεί με σε μια ποικιλία περιβαλλόντων. Η αναλογία συγκεντρώσεων [NH3]/[H2] εκτιμήθηκε στο εύρος 10-7 (στα μικρά σκοτεινά νεφελώματα[11]) - 10-5 (στον πυκνό πυρήνα του συμπλέγματος νεφελωμάτων Ωρίωνα[12]). Παρόλο που συνολικά έχουν προταθεί 18 «παραγωγικές οδοί»[13], ο κύριος μηχανισμός σχηματισμού της διαστρικής αμμωνίας είναι η ακόλουθη χημική αντίδραση:
Η σταθερά ταχύτητας, k, αυτής της αντίδρασης εξαρτάται από τη θερμοκρασία του περιβάλλοντος. Στους 10 K (-263 °C) είναι k = 5,2·10-6[14]. Η σταθερά ταχύτητας της αντίδρασης υπολογίζεται από τον τύπο:
Για μια κύρια αντίδραση σχηματισμού, οι σταθερές είναι a = 1,05·10-6 και B = -0,47. Θεωρώντας συγκέντρωση αμμωνιοκατιόντων [NH4+] = 3·10-7 και συγκέντρωση ηλεκτρονίων [e-] = 10-7, που είναι τυπικές για τα μοριακά νεφελώματα, η ταχύτητα σχηματισμού αμμωνίας υπολογίζεται (με τα αναφερόμενα δεδομένα και τύπους) σε υ = 1,6·10-9 cm-3·s-1 σε μοριακά νεφελώματα με συνολική (μοριακή) πυκνότητα 105 cm-3[15].
Όλες οι άλλες προτεινόμενες αντιδράσεις σχηματισμού έχουν σταθερές ταχύτητας μικρότερες κατά 2 - 13 τάξεις μεγέθους, οπότε η συνεισφορά τους στην αφθονία της αμμωνίας είναι σχετικά ασήμαντες[16]. Ένα παράδειγμα αντίδρασης με μικρή συνεισφορά στον σχηματισμό της διαστρικής αμμωνίας είναι η ακόλουθη:
Αυτή η αντίδραση έχει σταθερά ταχύτητας αντίδρασης k = 2,2·10-15. Θεωρώντας την (μοριακή) πυκνότητα του υδρογόνου σε 105 cm-3 και την αναλογία [NH2•]/[Η2] = 10-7, η αντίδραση αυτή έχει ταχύτητα υ = 2,2·10-12 cm-3·s-1. Είναι δηλαδή σχεδόν 1.000 φορές (3 τάξεις μεγέθους) πιο αργή από την παραπάνω αναφερόμενη κύρια αντίδραση.
Μερικές άλλες πιθανές αντιδράσεις σχηματισμού διαστρικής αμμωνίας είναι οι ακόλουθες:
Διαστρικός μηχανισμός καταστροφής αμμωνίας
Υπάρχουν συνολικά 113 χημικές αντιδράσεις που προτάθηκαν ότι οδηγούν στην καταστροφή αμμωνίας στο διαστρικό διάστημα. Οι 39 από αυτές τοποθετούνται σε εκτεταμένους πίνακες χημείας μεταξύ χημικών ενώσεων άνθρακα, αζώτου και οξυγόνου[17]. Μια επανεξέταση των άρθρων που αναφέρονται στη διαστρική αμμωνία συγκεντρώνει τους ακόλουθους κύριους μηχανισμούς διάσπασης διαστρικής αμμωνίας[9]:
Οι σταθερές ταχύτητας των παραπάνω αντιδράσεων είναι 4,39·10-9[18] και 2,2·10-9[19], αντιστοίχως. Οι παραπάνω στοιχειομετρικές εξισώσεις έχουν ταχύτητες αντίδρασης 8,8·10-9 και 4,4·10-13, αντιστοίχως. Αυτοί οι υπολογισμοί θεωρήθηκαν με βάση τις παραπάνω αναφερόμενες σταθερές ταχύτητας, με αναλογίες συγκεντρώσεων [NH3]/[H2] = 10-5, [H3+]/[H2] = 2·10-5, [HCO+]/[H2] = 2·10-9, και συνολική (μοριακή) πυκνότητα 105 cm-3. Τα παραπάνω δεδομένα είναι τυπικά σε ψυχρά, πυκνά μοριακά νεφελώματα[20]. Καθαρά, ανάμεσα σε αυτές τις δυο κύριες χημικές αντιδράσεις καταστροφής, η πρώτη είναι η κυρίαρχη αντίδραση καταστροφής διαστρικής αμμωνίας, αφού είναι περίπου 10.000 φορές ταχύτερη από τη δεύτερη. Αυτό οφείλεται, ουσιαστικά, στη σχετικά μεγαλύτερη αφθονία των ιόντων H3+ σε σύγκριση με την αντίστοιχη αφθονία των ιόντων HCO+.
Ανιχνεύσεις μεμονωμένων ραδιοτηλεσκοπίων
Παρατηρήσεις της διαστρικής αμμωνίας με ραδιοκύματα από το ραδιοτηλεσκόπιο Έφελσμπεργκ (Effelsberg 100-m Radio Telescope) αποκάλυψαν ότι η γραμμή αμμωνίας διαχωρίστηκε σε δύο συνιστώσες: μια κορυφή φόντου και έναν άγνωστο πυρήνα. Ο φόντος αντιστοιχεί σε περιοχές που προηγουμένως ανιχνεύθηκε μονοξείδιο του άνθρακα[21]. Το (ραδιο)τηλεσκόπιο Χίλμπολτον (25 m Chilbolton telescope), στην Αγγλία, ανακάλυψε ραδιοϋπογραφές αμμωνίας σε περιοχές Η II, σε μέιζερς HNH2Ο και σε H-Η αντικείμενα, καθώς και σε άλλα αντικείμενα που σχετίζονται με τον σχηματισμό αστέρων. Η σύγκριση του πλάτους γραμμής εκπομπής δείχνει ότι οι ταραχώδεις ή συστηματικές ταχύτητες δεν αυξάνονται στους κεντρικούς πυρήνες των μοριακών νεφελωμάτων[22].
Η ακτινοβολία μικροκυμάτων από την αμμωνία ανιχνεύθηκε σε αρκετά γαλακτικά αντικείμενα, που περιλαμβάνουν το W3(OH), το Ωρίων Α, το W43, το W51 και πέντε (5) πηγές στο κέντρο του Γαλαξία. Ο υψηλός ρυθμός ανίχνευσης δείχνει ότι η αμμωνία είναι ένα συνηθισμένο μόριο στο διαστρικό ενδιάμεσο και ότι οι περιοχές υψηλής (μοριακής) πυκνότητας είναι συνηθισμένες στον Γαλαξία[23].
Συμβολομετρικές ανιχνεύσεις
Οι ανιχνεύσεις αμμωνίας με πολύ μεγάλη διάταξη (ραδιοτηλεσκοπίων) (Very Large Array, VLA) σε επτά (7) πηγές με υψηλής ταχύτητας κινήσεις αερίων αποκάλυψαν συγκεντρώσεις (αμμωνίας σε περιοχές μικρότερες) από 0,1 Παρσέκ στο L1551, στο S140 και στον Κηφέα Α. Τρεις (3) ξεχωριστές συγκεντρώσεις (αμμωνίας) ανιχνεύθηκαν στον Κηφέα Α, μια από τις οποίες έχει ένα πολύ επίμηκες σχήμα. Πρέπει να παίζουν σημαντικό ρόλο στη δημιουργία διπολικής εκροής στην περιοχή[24].
Εξωγαλακτική αμμωνία παρατηρήθηκε χρησιμοποιώντας VLA στο IC 342. (Σχετικά) θερμό αέριο με θερμοκρασίες πάνω από 70 K (-203° C), στο οποίο οι αναλογίες γραμμών υπερύθρου αμμωνίας και μονοξειδίου του άνθρακα εμφανίζονται στενά συσχετιζόμενες με τις πιο εσωτερικές περιοχές των (γαλαξιακών) κέντρων[25]. Αμμωνία επίσης παρατηρήθηκε με VLA σε ένα δείγμα τεσσάρων (4) γαλακτικών υπερσυμπυκνωμένων HII περιοχών: G9.62+0.19, G10.47+0.03, G29.96−0.02, και G31.41+0.31. Διαγνώσεις, με βάση τη θερμοκρασία και την πυκνότητα, συμπέραναν ότι τέτοιες συστάδες είναι πιθανό να αποτελούν περιοχές μαζικού σχηματισμού αστέρων σε μια πολύ πρώιμη φάση, πριν από την ανάπτυξη μιας υπερσυμπυκνωμένης HII περιοχής[26].
Ανιχνεύσεις υπερύθρου
Η απορρόφηση στα 2,98 μm, που οφείλεται στη στερεή αμμωνία, καταγράφηκε από διαστρικούς κόκκους στο Αντικείμενο Μπέκλιν-Νευγκαμπάουρ (interstellar grains in the Becklin-Neugebauer Object) και πιθανώς και στο NGC 2264-IR. Αυτές οι ανιχνεύσεις βοήθησαν να εξηγηθεί το φυσικό σχήμα των προηγουμένως φτωχά κατανοητών και σχετικών με την απορρόφηση από πάγο (φασματικές) γραμμές[27].
Το φάσμα από τον δίσκο του (πλανήτη) Δία παρατηρήθηκε από το Ιπτάμενο Αστεροσκοπείο Κάιπερ (Kuiper Airborne Observatory), καλύπτοντας φασματικό εύρος από 100 - 300 cm-1. Η ανάλυση του φάσματος δίνει πληροφορίες σε γενικές ιδιότητες αέριας και στερεοποιημένης αμμωνίας[28].
Ένα σύνολο από 149 περιοχές σκοτεινών νεφελωμάτων εξερευνήθηκαν για ενδείξεις «πυκνών κέντρων» (dense cores), χρησιμοποιώντας (J,K) = (1,1) ως περιστροφική γραμμή αναστροφής της αμμωνίας. Γενικά, τα κέντρα αυτά δεν είναι σφαιρικά, ως προς το σχήμα, έχοντας αναλογίες ακτίνων που κυμαίνονται από 1,4 - 4,4. Επίσης βρέθηκε ότι τα κέντρα που περιέχουν αστέρες έχουν ευρύτερες γραμμές από τα κέντρα που δεν περιέχουν αστέρες[29].
Η αμμωνία ανιχνεύθηκε στο Νεφέλωμα του Δράκοντα (Draco Nebula) και σε ένα (1) ή πιθανώς δύο (2) μοριακά νεφελώματα, που είναι σχετιζόμενα με υψηλού πλάτους γαλαξιακούς cirrus. Αυτό το εύρημα είναι σημαντικό επειδή πρέπει να αντιπροσωπεύει τις περιοχές «γέννησης» για τον Πληθυσμό I μεταλλικότητας τύπου B αστέρων στο γαλακτικό φωτοστέφανο που θα πρέπει να γεννούνται στον γαλαξιακό δίσκο[30].
Ιστορία
Οι Ρωμαίοι ονόμασαν sal ammoniacus (ελλ. μτφ.: «άλας αμμωνιακό») τα κοιτάσματα χλωριούχου αμμωνίου που συνέλεγαν κοντά στον Ναό του Άμμωνα, στην αρχαία Λιβύη, εξαιτίας της γειτνίασης των κοιτασμάτων αυτών με τον ναό[31]. (Αρκετά) άλατα του αμμωνίου είχαν γίνει γνωστά από τις πολύ πρώιμες εποχές. Έτσι, ο όρος hammoniacus sal εμφανίζεται σε γραπτά του Πλίνιου[32], παρόλο που (αυτός) ο γνωστός όρος δεν ήταν ταυτόσημος με τον πιο σύγχρονο όρο sal-ammoniac, που αναφέρεται ειδικά στο χλωριούχο αμμώνιο[33].
Με τη μορφή του sal-ammoniac (نشادر, nushadir), η αμμωνία ήταν σημαντική για τους Μουσουλμάνους αλχημιστές των αρχών του 8ου αιώνα. Η παλαιότερη (γνωστή) αναφορά έγινε από τον Πέρση χημικό και αλχημιστή Τζαμπίρ Ιμπν Χαγιάν (Jābir ibn Hayyān)[34], και στους Ευρωπαίους αλχημιστές από τον 13ο αιώνα (τουλάχιστον), αφού αναφέρθηκε από τον Αλβέρτο τον Μέγα (Albertus Magnus)[35]. Χρησιμοποιούνταν ακόμα από τους βαφείς του Μεσαίωνα με τη μορφή της ουρίας που έχει υποστεί ζύμωση, για την αλλαγή του χρώματος σε φυτικής προέλευσης βαφές. Τον 15ο αιώνα, ο Βασίλειος Βαλεντίνος (Basilius Valentinus) έδειξε ότι η αμμωνία μπορεί να ληφθεί με την επίδραση βάσης σε sal-ammoniac, δηλαδή σε χλωριούχο αμμώνιο. Αργότερα, όταν το sal-ammoniac λαμβανόταν με απόσταξη οπλών και κεράτων από βόδια, και εξουδετέρωση του έτσι παραγόμενου ανθρακικού αμμωνίου με υδροχλωρικό οξύ, η αμμωνία ονομάστηκε spirit of hartshorn (ελλ. κατά λέξη μτφ.: «πνεύμα της καρδιάς του κεράτου»)[35][36].
Η αέρια (άνυδρη) αμμωνία απομονώθηκε για πρώτη φορά το 1774 από τον Τζόζεφ Πρίστλεϊ (Joseph Priestley), που την ονόμασε alkaline air (ελλ. κατά λέξη μτφ.: «αλκαλικός αέρας»).[37] Το 1785, ο Κλωντ Λουί Μπερτολέ (Claude Louis Berthollet) εξακρίβωσε τη σύνθεση της αμμωνίας[35].
Πριν την αρχή του Α΄ Παγκοσμίου Πολέμου, η περισσότερη αμμωνία παράγονταν με ξηρή απόσταξη αζωτούχων φυτικών και ζωικών αποβλήτων, που συμπεριλάμβαναν κοπριά καμήλας, από τα οποία λαμβάνονταν νιτρώδες οξύ και νιτρώδη άλατα, τα οποία ανήγαγαν με χρήση υδρογόνου. Επιπρόσθετα παράγονταν με απόσταξη γαιάνθρακα, καθώς και με την αποσύνθεση αμμωνιακών αλάτων από υδροξείδια αλκαλίων (κυρίως από υδροξείδιο του νατρίου) ή και ασβεστόνερο (που περιέχει οξείδιο του ασβεστίου). Συνήθως, το άλας του αμμωνίου που χρησιμοποιούνταν ήταν το χλωριούχο αμμώνιο (sal-ammoniac, στα λατινικά)[38]:

Η διεργασία Χάμπερ-Μπος (Haber–Bosch process), για την παραγωγή αμμωνίας από το άζωτο του αέρα, αναπτύχθηκε το 1909 από τους Φριτς Χάμπερ (Fritz Haber) και Καρλ Μπος (Carl Bosch) και πατενταρίστηκε το 1910. Η πρώτη βιομηχανικής κλίμακας παραγωγή και χρήση αμμωνίας έγινε στη Γερμανία κατά τη διάρκεια του Α΄ Παγκοσμίου Πολέμου[39], επειδή οι Σύμμαχοι (Αντάντ) εφάρμοσαν εμπάργκο εναντίον της, απαγορεύοντας την εισαγωγή νιτρικού αμμωνίου από τη Χιλή. Η αμμωνία χρησιμοποιούνταν, με τη σειρά της, για την παραγωγή εκρηκτικών, για τις ανάγκες του πολέμου[40].
Πριν τη διαθεσιμότητα του (σχετικά) φθηνού φυσικού αερίου, το υδρογόνο που (επίσης) απαιτούσε η παραγωγή της αμμωνίας προέρχονταν από την ηλεκτρόλυση του νερού ή παράγονταν με τη χρήση της χλωραλκαλικής διεργασίας. Για ένα χρονικό διάστημα, η περισσότερη αμμωνία στην Ευρώπη παράγονταν κοντά στην υδροηλεκτρική μονάδα του Βέρμορκ (Vemork) της Νορβηγίας, με το υδρογόνο να παράγεται με ηλεκτρόλυση του νερού.
Ποιοτική ανίχνευση και ποσοτικός προσδιορισμός
Σε διάλυμα
Τόσο η ίδια η αμμωνία όσο και τα αμμωνιακά άλατα μπορούν γρήγορα να ανιχνευθούν, ακόμη και σε πολύ ελάχιστα ίχνη, με την προσθήκη του διαλύματος Νεσλέρ (Nessler's solution), που ουσιαστικά είναι διάλυμα τετραϊωδοϋδραργυριούχου καλίου [K2(HgI4)], το οποίο (σε περίπτωση θετικής δοκιμής) δίνει διακριτό κίτρινο χρωματισμό. Η ποσότητα της αμμωνίας σε αμμωνιακά άλατα μπορεί να εκτιμηθεί ποσοτικά με συναπόσταξη των αλάτων μαζί με υδροξείδιο του νατρίου (NaOH) ή με υδροξείδιο του καλίου (KOH). Η αποστάζουσα αμμωνία μπορεί να προσδιοριστεί ποσοτικά με απορρόφησή της από γνωστό (δηλαδή τιτλοδοτιμένο) όγκο (διαλύματος) θειικού οξέος (H2SO4). Τελικά, η περίσσεια του θειικού οξέος προσδιορίζεται ογκομετρικά. Εναλλακτικά, η αμμωνία μπορεί να απορροφηθεί από υδροχλωρικό οξύ (HCl) και στη συνέχεια το σχηματιζόμενο χλωριούχο αμμώνιο καθιζάνει (με την προσθήκη εξαχλωροχρυσιούχου οξέος, H2PtCl6) με τη μορφή (κίτρινου ιζήματος) εξαχλωρολευκοχρυσιούχου αμμωνίου [(ΝΗ4)2PtCl6], (που τελικά προσδιορίζεται σταθμικά.)
Παραγωγή
Βιομηχανία
Η αμμωνία, μαζί με το θειϊκό οξύ (H2SO4), είναι τα χημικά προϊόντα με τον μεγαλύτερο όγκο (παγκόσμιας) βιομηχανικής παραγωγής. Ο λόγος είναι ότι η αμμωνία είναι η πρόδρομη ύλη για την παραγωγή (μεταξύ άλλων) νιτρικού οξέος (HNO3), αμμωνιακών και νιτρικών λιπασμάτων, καθώς και ουρίας. Επίσης, η αμμωνία και τα άλατά της έχουν ποικίλες εφαρμογές σε διάφορες βιομηχανίες, όπως βαφών, φαρμάκων, εκρηκτικών, τροφίμων, κ.ά..
Υπάρχουν δεκάδες πολλών χημικών μονάδων παραγωγής αμμωνίας, παγκοσμίως. Η παραγωγή της καταναλώνει περισσότερο από το 1% της (παγκόσμιας) ανθρωπογενούς παραγόμενης ενέργειας. Η παραγωγή αμμωνίας αποτελεί ένα σημαντικό ποσοστό της κατανάλωσης του παγκόσμιου ενεργειακού κεφαλαίου[39]. Έρευνα αγοράς αναφέρει ότι η συνολική (παγκόσμια) παραγωγή αμμωνίας το 2012 ήταν 198 εκατομμύρια τόνοι και προβλέπεται ότι αυτή θα αυξηθεί κατά περίπου 35 εκατομμύρια τόνους έως το 2019[41]. Η Κίνα κατέχει το 28,4% της παγκόσμιας παραγωγής[42], ακολουθεί η Ινδία, με το 8,6% της παγκόσμιας παραγωγής[43], ακολουθεί η Ρωσία της παγκόσμιας παραγωγής[43], με το 8,4% της παγκόσμιας παραγωγής[43] και μετά οι ΗΠΑ, με το 8,2% της παγκόσμιας παραγωγής[43]. Περίπου το 80% ή και περισσότερο ποσοστό της παγκόσμια βιομηχανικά παραγόμενης αμμωνίας χρησιμοποιείται από τις βιομηχανίες παραγωγής αγροτικών λιπασμάτων[43].
Εκτός από τους ιστορικούς τρόπους παραγωγής της αμμωνίας, που περιγράφηκαν παραπάνω, στην ενότητα «Ιστορία», η σύνθεση αμμωνίας από υδρογόνο και άζωτο μπορεί επίσης να παράγει οικονομικά αμμωνία, χρησιμοποιώντας ως πηγή υδρογόνου το υδραέριο, δηλαδή αέριο μίγμα μονοξειδίου του άνθρακα και υδρογόνου. Εναλλακτικά, ως πηγή υδρογόνου χρησιμοποιήθηκε και η μέθοδος μετατόπισης υδραερίου, δηλαδή η αντίδραση μονοξειδίου του άνθρακα με υδρατμούς, που δίνει διοξείδιο του άνθρακα και υδρογόνο. Η διαβίβαση υδρατμών πάνω από ερυθροπυρωμένο κωκ[44], δίνει επίσης διοξείδιο του άνθρακα και υδρογόνο. Η απομάκρυνση του διοξειδίου του άνθρακα γίνεται με «έκπλυση» του αερίου μίγματος με νερό υπό πίεση 25 atm[45].
Οι σύγχρονες μονάδες παραγωγής αμμωνίας βασίζονται σε βιομηχανικής παραγωγής υδρογόνο που αντιδρά με ατμοσφαιρικό άζωτο:
Η μετατόπιση της χημικής ισορροπίας προς τα δεξιά, δηλαδή προς την παραγωγή της αμμωνίας, ευνοείται από την απομάκρυνση της παραγώμενης αμμωνίας, από την ελάττωση της θερμοκρασίας και από την αύξηση της πίεσης. Οι πιέσεις που χρησιμοποιούνται, ανάλογα με τη μέθοδο που εφαρμόζεται, κυμαίνονται από 100 μέχρι 1000 atm, ενώ οι θερμοκρασίες από 400 - 600 °C. Οι παράγοντες που καθορίζουν την απόδοση της αμμωνίας, είναι η πίεση, η θερμοκρασία, ο καταλύτης, ο αντιδραστήρας και η παροχή του αντιδρώντος μίγματος.
- Πίεση:
Η πίεση στον καταλυτικό αντιδραστήρα παραγωγής αμμωνίας κυμαίνεται, ανάλογα με την εφαρμοζόμενη μέθοδο, από 100 μέχρι 1.000 atm. Συνήθως όμως εφαρμόζονται πιέσεις της τάξης των 300 Αtm, κυρίως επειδή εξισορροπούνται έτσι η απόδοση μετατροπής, το κόστος των υλικών κατασκευής του αντιδραστήρα, η δυναμικότητα της μονάδας παραγωγής αλλά και ο χρόνος ζωής του καταλύτη. Η επιλογή της πίεσης που θα εφαρμοσθεί, θα πρέπει να γίνει με βάση:
- Τη φυσική κατάσταση του προϊόντος (υγρό ή αέριο). Όταν π.χ. είναι επιθυμητή η παραγωγή υγρής ΝΗ3, εφαρμόζονται υψηλότερες πιέσεις, απ’ότι στην περίπτωση της αέριας.
- Τη θερμοκρασία του νερού ψύξης. Όσο πιο χαμηλή είναι η θερμοκρασία του νερού ψύξης, τόσο μικρότερη πίεση απαιτείται για την παραγωγή.
- Την περιεκτικότητα του αερίου μίγματος σε αδρανή συστατικά. Μεγάλη περιεκτικότητα σε αδρανή συστατικά, σημαίνει μικρή συγκέντρωση των πρώτων υλών (υδρογόνου και αζώτου) και συνεπώς ανάγκη για μεγάλη συμπίεση του μίγματος.
- Θερμοκρασία:
Επειδή η σύνθεση της αμμωνίας είναι εξώθερμη αντίδραση, ευνοείται σε σχετικά χαμηλές θερμοκρασίες οι οποίες όμως έχουν το μειονέκτημα της μικρής ταχύτητας παραγωγής προϊόντος που είναι ανάλογη της αύξησης της θερμοκρασίας. Το πρόβλημα αυτό λύθηκε με την ανάπτυξη βελτιωμένων καταλυτών με βάση τα οξείδια του σιδήρου, όπως ο μαγνητίτης (Fe3O4) ή και απλά «ενεργοποιημένο» σίδηρο. Οι περισσότερες μέθοδοι παραγωγής αμμωνίας χρησιμοποιούν θερμοκρασίες 500 - 550 °C. Υπάρχουν όμως μέθοδοι που χρησιμοποιούν θερμοκρασίες 400 °C αλλά και 650 °C.
Η θερμοκρασία επίσης πρέπει να επιλεγεί έτσι ώστε να επιτευχθεί η μέγιστη δραστικότητα του καταλύτη στη χαμηλότερη δυνατή θερμοκρασία λειτουργίας του αντιδραστήρα. Ένας κρίσιμος παράγοντας στην περίπτωση αυτή είναι η ομαλοποίηση της θερμοκρασιακής κατανομής στα στρώματα του καταλύτη, δηλαδή το μην υπάρχει αισθητή διαφορά μεταξύ μέγιστης και ελάχιστης θερμοκρασίας των στρωμάτων και ελαχιστοποίηση της θερμοκρασιακής διαφοράς από στρώμα σε στρώμα στην κλίνη του καταλύτη. Η ρύθμιση των επιθυμητών θερμοκρασιών γίνεται με την τροφοδοσία νέων ποσοτήτων ψυχρού αερίου μίγματος Η2/Ν2 μέσα στον καταλυτικό αντιδραστήρα καθώς και με ανακυκλοφορία νερού μέσα από ελικοειδείς σωληνώσεις που υπάρχουν ανάμεσα στα στρώματα του καταλύτη.
Αυτή η διεργασία είναι γνωστή ως διεργασία Χάμπερ-Μπος[46]:
Το υδρογόνο που απαιτείται για την παραγωγή αμμωνίας με την παραπάνω μέθοδο μπορεί επίσης να παραχθεί και με (προς το παρόν) λιγότερο οικονομικές μεθόδους, όπως η ηλεκτρόλυση του νερού ή και άλλες μεθόδους που είναι προς το παρόν μη πρακτικές για βιομηχανικής κλίμακας παραγωγή. Αν και όταν υπάρχει διαθέσιμη (σχετικά) φθηνή ηλεκτρική ενέργεια, όπως από υδροηλεκτρικές μονάδες ή άλλες ανανεώσιμες πηγές ενέργειας, αυτή η μέθοδος παραγωγής υδρογόνου για την παραγωγή αμμωνίας είναι πάντα εν δυνάμει εφαρμόσιμη.
Μια πιο βιώσιμη εναλλακτική λύση, σε σύγκριση με τη σχετικά προς το παρόν ασύμφορη ηλεκτρόλυση, είναι η παραγωγή υδρογόνου από τη βιομάζα οργανικών αποβλήτων, όπως αυτά που παράγονται από τις βιομηχανίες τροφίμων, χρησιμοποιώντας τον καταλυτικό μετασχηματισμό της (βιομάζας). Αυτή η μέθοδος απελευθερώνει υδρογόνο από ανθρακούχες ενώσεις χρησιμοποιώντας μόλις το 10-20% της ενέργειας που θα απαιτούσε η ηλεκτρόλυση του νερού και μπορεί να οδηγήσει στην παραγωγή υδρογόνου από τα αστικά απόβλητα, ουσιαστικά με αρνητικό κόστος (συνυπολογίζοντας και το κόστος άλλων ειδών διαχείρισής τους). Ο καταλυτικός μετασχηματισμός μπορεί να γίνει με αποδοτικές μεθόδους, όπως η μέθοδος ψυχρού πλάσματος. Ο καταλυτικός μετασχηματισμός είναι δυνατό να πραγματοποιηθεί και με μικρές, ακόμη και κινητές μονάδες επεξεργασίας, έχοντας έτσι το πλεονέκτημα δυνατότητας χαμηλού κόστους βιομάζας ή (μικρών για άλλου είδους αξιοποίηση) κοιτασμάτων φυσικού αερίου. Η μετατροπή τέτοιων αποβλήτων απευθείας σε αμμωνία λύνει και το σημαντικό πρόβλημα της αποθήκευσης του υδρογόνου, που διαφορετικά απαιτεί ειδικούς χώρους αποθήκευσης και χρήση υψηλής πίεσης ή και κρυογονικές θερμοκρασίες ψύξης, καθώς το υδρογόνο μπορεί στη συνέχεια να απελευθερωθεί οικονομικά από την παραγόμενη αμμωνία (αν αυτό απαιτείται για άλλες εφαρμογές του). Είναι σαφώς πολύ ευκολότερο να αποθηκευθεί η αμμωνία, ακόμη και να φορτωθεί σε οχήματα, σε σχέση με την αποθήκευση του υδρογόνου, ενώ η αμμωνία είναι λιγότερο εύφλεκτη από τη βενζίνη ή το υγραέριο, που μπορούν να χρησιμοποιηθούν για άλλου είδους προσωρινή έμμεση αποθήκευση και μεταφορά του υδρογόνου.
Εργαστηριακές μέθοδοι
Στο εργαστήριο η αμμωνία μπορεί να παρασκευαστεί με τους εξής τρόπους:
- Με συνθέρμανση χλωριούχου αμμωνίου με υδροξείδιο ή οξείδιο του ασβεστίου (όλα τα αμμωνιακά άλατα, όταν αντιδρούν με βάσεις, παρέχουν αμμωνία).
- Μέθοδος Haber-Bosch
- Μέθοδος Claude
- Μέθοδος Casale
- Μέθοδος Fauser
- Διάσπαση νιτριδίων με νερό.
Δομή και ιδιότητες
Η χημικά καθαρή («άνυδρη») αμμωνία, στις κανονικές συνθήκες περιβάλλοντος, είναι άχρωμο αέριο με χαρακτηριστική αποπνικτική οσμή. Είναι ελαφρύτερη από τον αέρα, με σχετική πυκνότητα 0,589, σε σύγκριση με τη μέση πυκνότητα του ατμοσφαιρικού αέρα της Γης. Υγροποιείται εύκολα, χάρη του αρκετά ισχυρού φαινομένου των διαμοριακών δεσμών υδρογόνου της. Υπό κανονική πίεση, βράζει στους -33,3 °C και πήζει στους -77,7 °C, σχηματίζοντας λευκούς κρυστάλλους[47]. Αν χρειάζεται, η αμμωνία μπορεί να μετατραπεί σε άοσμα άλατα, όπως το όξινο ανθρακικό αμμώνιο [(NH4)HCO3] ή το οξικό αμμώνιο (CH3COONH4). Η αμμωνία έχει τη μεγαλύτερη ειδική θερμοχωρητικότητα από όλες τις γνωστές ουσίες.
Υγροποιημένη αμμωνία
Η υγροποιημένη αμμωνία διαθέτει ισχυρές ιονιστικές δυνάμεις που γίνονται φανερές από τον υψηλό δείκτη ε = 22, που διαθέτει. Ακόμη, η υγροποιημένη αμμωνία έχει υψηλή ενθαλπία εξάτμισης (23,35 kJ/mole, σε σύγκριση με την αντίστοιχη του νερού, που είναι 40,65 kJ/mole, του υγροποιημένου μεθανίου, που είναι 8,19 kJ/mole, και της υγροποιημένης φωσφίνης, που είναι 14,6 kJ/mole), οπότε μπορεί να χρησιμοποιηθεί σε εργαστήρια που βρίσκονται σε σκάφη χωρίς μόνωση, χωρίς επιπρόσθετη κατάψυξη.
Στερεή αμμωνία
Η κρυσταλλική συμμετρία της στερεάς αμμωνίας είναι κυβική, με σύμβολο Πίρσον (Pearson symbol) cP16, ομάδα διαστήματος (space group) P213 #198 και σταθερά κρυσταλλικού πλέγματος (lattice constant) 0,5125 nm[48].
Διαλύματα με αμμωνία
Η αμμωνία είναι αναμείξιμη με το νερό. Από ένα υδατικό της διάλυμα μπορεί να απομακρυνθεί με βρασμό. Τα υδατικά διαλύματα της αμμωνίας είναι βασικά. Το κορεσμένο σε αμμωνία υδατικό διάλυμα έχει πυκνότητα 0,880 g/cm³ και αυτό (δηλαδή το κορεσμένο υδατικό διάλυμα αμμωνίας) συχνά αναφέρεται ως «0,880 αμμωνία».
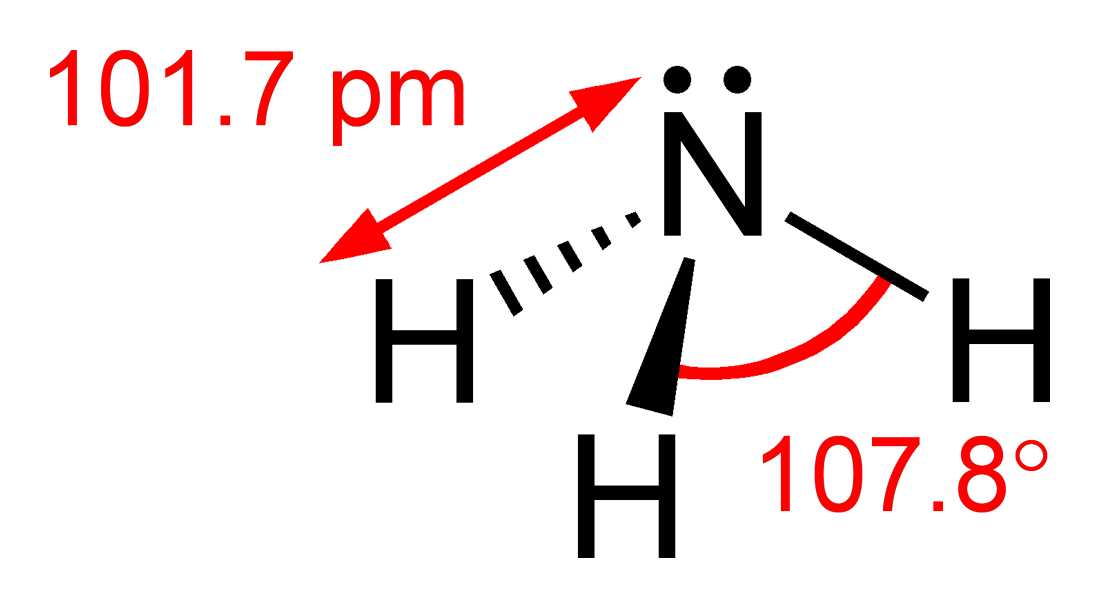
Δομή και ιδιότητες
Το μόριο της αμμωνίας έχει δομή τριγωνικής πυραμίδας, όπως προβλέπει η θεωρία σθένους - δεσμού (Valence shell electron pair repulsion theory, VSEPR theory) με πειραματικά επιβεβαιωμένη δεσμική γωνία 106,7°[49]. Το κεντρικό άτομο του αζώτου έχει πέντε (5) ηλεκτρόνια στην εξωτερική του στιβάδα, στα οποία προστίθενται άλλα τρία, ένα από κάθε άτομο υδρογόνου. Αυτό δίνει ένα σύνολο οκτώ ηλεκτρονίων (δομή ευγενούς αερίου, συγκεκριμένα αυτή του νέον, για το άζωτο), δηλαδή τέσσερα ζεύγη ηλεκτρονίων. Αν τα ζεύγη αυτά ήταν όλα ισότιμα, όπως στο μόριο του μεθανίου, θα τακτοποιούνταν σε τετραεδρική μοριακή δομή και θα είχαμε δεσμική γωνία 109,5°. Στην αμμωνία, όμως, μόνο τα τρία (3) ζεύγη που προέρχονται από σ δεσμούς N - Η είναι ισότιμα μεταξύ τους, ενώ το ένα (1) είναι μονήρες ζεύγος του ίδιου του ατόμου του αζώτου. Γι' αυτό και η πειραματικά μετρημένη δεσμική γωνία στο μόριο της αμμωνίας αποκλίνει από την τετραεδρική και είναι 106,7°[49]. Το μονήρες ζεύγος του ατόμου του αζώτου καθιστά την αμμωνία βάση, δηλαδή δέκτη πρωτονίων ή και δότη ζεύγους ηλεκτρονίων (βάση κατά Λιούις). Ακόμη, το μονήρες ζεύγος ηλεκτρονίων δίνει διπολική ροπή στο μόριο της αμμωνίας, κάνοντάς το πολικό. Αυτή η πολικότητα του μορίου της αμμωνίας, μαζί με την ικανότητά του να σχηματίζει δεσμούς υδρογόνου, τόσο με άλλα μόρια αμμωνίας, όσο και με μόρια νερού, καθιστούν την αμμωνία πολύ αναμείξιμη με το νερό. Η αμμωνία είναι μέτρια βασική. Ένα υδατικό διάλυμα αμμωνίας συγκέντρωσης 1 mole/lit έχει pH = 11,6. Αν προστεθεί σε αυτό αρκετό οξύ ώστε να γίνει το διάλυμα ουδέτερο (δηλαδή με pH = 7), το 99,4% των μορίων της αμμωνίας είναι πρωτονιομένα, σχηματίζοντας κατιόντα αμμωνίου (NH4+). Η θερμοκρασία και η αλατότητα του διαλύματος επίσης επηρεάζουν τη συγκέντρωση των NH4+. Το κατιόν αυτό έχει πλέον τετραεδρική δομή, όπως το ισοηλεκτρονικό του μόριο του μεθανίου.
Το μόριο της αμμωνίας πραγματοποιεί αναστροφή του ατόμου του αζώτου σε θερμοκρασία δωματίου, όπως κατ' αναλογία συμβαίνει με μια ανοικτή ομπρέλα υπό την επίδραση ισχυρού ανέμου. Το ενεργειακό εμπόδιο γι' αυτήν την αναστροφή είναι 24,7 kJ/mol, που αντιστοιχεί σε συχνότητα συντονισμού 23,79 GHz, που είναι αντίστοιχη με ακτινοβολία μικροκυμάτων με μήκος κύματος 1.260 cm. Η απορρόφηση αυτή ήταν (ιστορικά) η πρώτη απορρόφηση στο φάσμα των μικροκυμάτων που παρατηρήθηκε[50].
Αμφολυτικές ιδιότητες
Μια από τις πιο χαρακτηριστικές ιδιότητες της αμμωνίας είναι η βασικότητά της. Η αμμωνία θεωρείται ότι είναι «ασθενής βάση». Αντιδρά με οξέα και σχηματίζει άλατα. Παραδείγματα:
- Με το υδροχλωρικό οξύ (HCl) σχηματίζει χλωριούχο αμμώνιο (NH4Cl).
- Με το νιτρικό οξύ (HNO3) σχηματίζει νιτρικό αμμώνιο (NH4NO3).
- Με το θειικό οξύ (H2SO4), που είναι διπρωτικό οξύ, σχηματίζει αρχικά όξινο θειικό αμμώνιο [(NH4)HSO4], και τελικά, με περίσσεια αμμωνίας, θειικό αμμώνιο [(NH4)2SO4], κ.τ.λ..
Ωστόσο, για παράδειγμα, η τελείως ξηρή αμμωνία δεν αντιδρά με το τελείως ξηρό υδροχλώριο. Η παρουσία (τουλάχιστον) υγρασίας είναι απαραίτητη για αυτές τις αντιδράσεις[51]. Σε μια σχετικά συνηθισμένη επίδειξη, ανοίγονται φιάλες πυκνής αμμωνίας και πυκνού υδροχλωρικού οξέος, σε σχετικά μικρή απόσταση μεταξύ τους, οπότε σχηματίζονται κάπου ανάμεσα στα δοχεία «νέφη» χλωριούχου αμμωνίου, φαινομενικά από το τίποτε:
Τα άλατα που σχηματίζονται με αντίδραση αμμωνίας με οξέα είναι γνωστά ως «άλατα αμμωνίου» και περιέχουν το κατιόν αμμωνίου (NH4+).
Αν και η αμμωνία είναι γενικά γνωστή ως απλή βάση, μπορεί όμως επίσης να δράσει και ως εξαιρετικά ασθενές οξύ. Σε αυτήν την περίπτωση σχηματίζει «άλατα αμιδίου», που περιέχουν το ανιόν αμιδίου (NH2-). Αυτό συμβαίνει όταν αλκαλιμέταλλα αντιδρούν με υγροποιημένη αμμωνία. Για παράδειγμα, με λίθιο έχουμε την παραγωγή λιθιαμιδίου (LiNH2):
Διάσταση
Όπως και το νερό, η αμμωνία υφίσταται μοριακό αυτοϊονισμό, που ονομάζεται διάσταση, σχηματίζοντας το συζυγές της οξύ και τη συζυγή της βάση:
Υπό συνηθισμένες συνθήκες, η αντίστοιχη σταθερά ισορροπίας είναι K = [NH4+][NH2-] = 10-30.
Καύση
Η αμμωνία δεν καίγεται γρήγορα ούτε υφίσταται καύση, παρά μόνο στα στενά όρια μειγμάτων καυσίμου - αέρα του εύρους 15 - 25% στον αέρα. Η καύση της αμμωνίας παράγει διάζωτο και νερό και είναι εξώθερμη:
Η τυπική μεταβολή της ενθαλπίας της αμμωνίας ΔH°c, εκφρασμένη ανά γραμμομόριο αμμωνίας και με συμπύκνωση του σχηματιζόμενου νερού, είναι -382,81 kJ/mole. Το διάζωτο (N2) είναι θερμοδυναμικό προϊόν της καύσης, καθώς όλα τα οξείδια του αζώτου είναι ασταθή, διασπώμενα σε διάζωτο και διοξυγόνο (O2). Τα οξείδια του αζώτου μπορούν να σχηματιστούν ως κινητικά προϊόντα της καύσης, με την παρουσία κατάλληλων καταλυτών, αντίδραση με μεγάλη βιομηχανική σημασία για την παραγωγή νιτρικού οξέος:
Μια μεταγενέστερη αντίδραση οδηγεί στην παραγωγή διοξειδίου του αζώτου:
Η καύση της αμμωνίας στον ατμοσφαιρικό αέρα είναι πολύ δύσκολη απουσία καταλύτη, όπως πλέγμα λευκόχρυσου ή θερμού τριοξειδίου του χρωμίου (Cr2O3), γιατί η θερμοκρασία της φλόγας είναι συνήθως μικρότερη από τη θερμοκρασία ανάφλεξης σε μίγμα αμμωνίας - αέρα. Το εύρος αναφλεξιμότητας της αμμωνίας στον αέρα ανέρχεται σε 16–25%[52].[
Σχηματισμός άλλων ενώσεων από αμμωνία
Στην οργανική χημεία η αμμωνία μπορεί να δράσει ως πυρηνόφιλο αντιδραστήριο σε αντιδράσεις υποκατάστασης. Οι (οργανικές πρωτοταγείς) αμίνες μπορούν να σχηματιστούν με αντίδραση αμμωνίας με αλκυλαλογονίδια, παρ' όλο που η παραγώμενη αμινομάδα (-NH2) είναι επίσης πυρηνόφιλη και γι' αυτό συμπαράγονται δευτεροταγείς, τριτοταγείς αμίνες (μέχρι και τεταρτοταγή αμμωνιακά άλατα) ως παραπροϊόντα[53]:
Μια περίσσεια αμμωνίας βοηθάει να ελαχιστοποιηθεί η πολλαπλή υποκατάσταση και εξουδετερώνει το παραγώνο υδραλογόνο (σε αλογονούχο αμμώνιο, NH4X). Η μεθαναμίνη παράγεται βιομηχανικά με αντίδραση αμμωνίας με χλωρομεθάνιο:
Η επίδραση αμμωνίας σε 2-βρωμοπροπανικό οξύ παράγει αντίστοιχα ρακεμική αλανίνη, με απόδοση 70%:
Η αιθανολαμίνη παράγεται με αντίδραση 1,3-προσθήκης με διάνοιξη δακτυλίου σε οξιράνιο:
Η αντίδράση αυτή μερικές φορές αφήνεται να προχωρήσει παραπέρα (με επιπλέον ισοδύναμα οξιρανίου), παράγοντας διαιθανολαμίνη ή και τριαιθανολαμίνη:
Αμίδια (RCONH2) μπορούν να παραχθούν μετά από αντίδραση αμμωνίας με παράγωγα καρβοξυλικών οξέων. Τα ακυλοχλωρίδια (RCOCl) είναι τα πιο δραστικά (για τον σκοπό αυτό), αλλά απαιτούν περίσσεια αμμωνίας τουλάχιστον στο διπλάσιο, γιατί πρέπει να εξαυδετερώνεται παράλληλα το συμπαραγώμενο υδροχλώριο (γιατί αλλιώς υδρολύει τα παραγώμενα αμίδια):
Οι εστέρες (RCO2R, όπου τα δύο R όχι απαραίτητα ίδια) και οι ανυδρίτες οξέων [RCO(O)COR] μπορούν επίσης να αντιδράσουν με την αμμωνία και να σχηματίσουν τα αντίστοιχα αμίδια:
και
Τα αμμωνιακά άλατα των καρβοξυλικών οξέων (RCO2NH4) μπορούν να αφυδατωθούν σε αμίδια, εφόσον δεν συνυπάρχουν και άλλες ευαίσθητες χαρακτηριστικές ομάδες στο ίδιο μόριο. Για την αφυδάτωση αμμωνιακών αλάτων καρβοξυλικών οξέων απαιτούνται θερμοκρασίες της τάξης των 150–200 °C:
Το υδρογόνο της αμμωνίας μπορεί να αντικατασταθεί από μέταλλα, όπως το μαγνήσιο. Με την καύση μαγνησίου μέσα σε αέρια αμμωνία παράγεται αζωτούχο μαγνήσιο (Mg3N2):
Αν ρεύμα αέριας αμμωνίας περάσει πάνω από θερμαινόμενο μεταλλικό νάτριο ή μεταλλικό κάλιο τότε σχηματίζονται αντίστοιχα νατραμίδιο (NaNH2) και καλιαμίδιο (KNH2). [54]
και
Όπου είναι απαραίτητο στην ονοματολογία αντικατάστασης (παραγώγων της αμμαωνίας), η IUPAC προτείνει να προτιμάται να χρησιμοποιείται η ονομασία «αζάνιο» και όχι η ονομασία «αμμωνία». Έτσι, η χλωραμίνη (NH2Cl) θα έπρεπε να ονομάζεται «χλωραζάνιο», αλλά πάντως σίγουρα όχι «χλωραμμωνία». Η πεντασθενής αμμωνία (NH5) είναι γνωστή ως «λ5-αμίνη» ή ως «υδρίδιο του αμμωνίου» (δομικά μπορεί να παραστεί και ως NH4+← :H-). Αυτή η ένωση βρίσκεται με τη μορφή κρυσταλλικού στερεού που είναι σταθερό μόνο υπό υψηλή πίεση, ενώ ξαναδιασπάται σε συνηθισμένη αμμωνία και διυδρογόνο, μόλις η πίεση επανέρθει κοντά στην κανονική (1 atm). Το υδρίδιο του αμμωνίου ερευνήθηκε ως πιθανό καύσιμο πυραύλων στερεών καυσίμων το 1966.[55]
Εφαρμογές
Επειδή υγροποιείται εύκολα και έχει μεγάλη θερμότητα εξαέρωσης, χρησιμοποιήθηκε στα ψυγεία και για την παραγωγή πάγου. Αποτελεί δηλητήριο και μπορεί να προκαλέσει, όταν εισπνέεται, ακόμη και τον θάνατο.
Οι χρήσεις της αμμωνίας είναι πολλές. Υδατικό διάλυμα αμμωνίας χρησιμοποιείται σαν αντιδραστήριο στη Χημεία, στην Ιατρική και για επαλείψεις σε τσιμπήματα εντόμων (ιδιαίτερα των υμενοπτέρων). Ακόμη, χρησιμοποιήθηκε για εισπνοές, σε περιπτώσεις λιποθυμιών και μέθης, σαν αναλγητικό, αλλά και για τον καθαρισμό υφασμάτων, για την παρασκευή λιπασμάτων, σαν ψυκτικό σε ψυγεία και για παραγωγή πάγου. Επίσης για την παρασκευή νιτρικού οξέος και σόδας με την μέθοδο Solvay.
Παραπομπές και σημειώσεις
Wikiwand - on
Seamless Wikipedia browsing. On steroids.












![{\displaystyle \mathrm {N_{2}+3H_{2}{\xrightarrow[{100-1.000\;atm}]{400-650^{o}C\;Fe_{3}O_{4}\;{\acute {\eta }}\;|Fe|}}2NH_{3}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/c9f4ee390f9ef1f2c75b3461b01e3f335826eaca)






![{\displaystyle \mathrm {NH_{3}+RX{\xrightarrow {-HX}}RNH_{2}{\xrightarrow[{-HX}]{+RX}}R_{2}NH{\xrightarrow[{-HX}]{+RX}}R_{3}N{\xrightarrow {+RX}}[R_{4}N]^{+}X^{-}} }](http://wikimedia.org/api/rest_v1/media/math/render/svg/d1148988c14dc2010412ebb860c75b5ec4c60356)











