Τριοξείδιο του χρωμίου
χημική ένωση From Wikipedia, the free encyclopedia
Remove ads
Το τριοξείδιο του χρωμίου, γνωστό και ως οξείδιο του χρωμίου(VI) ή χρωμικός ανυδρίτης, είναι μια ανόργανη ένωση με τον χημικό τύπο CrO3. Είναι ο όξινος ανυδρίτης του χρωμικικού οξέος και μερικές φορές κυκλοφορεί στο εμπόριο με το ίδιο όνομα.[6] Αυτή η ένωση είναι ένα σκούρο βιολετί στερεό υπό άνυδρες συνθήκες και λαμπερό πορτοκαλί όταν είναι υγρό. Η ουσία διαλύεται στο νερό συνοδευόμενη από υδρόλυση Εκατομμύρια κιλά παράγονται ετησίως, κυρίως για ηλεκτρολυτική επιμετάλλωση.[7] Το τριοξείδιο του χρωμίου είναι ένα ισχυρό οξειδωτικό, μεταλλαξιογόνο και καρκινογόνο.[8]
Remove ads
Remove ads
Παραγωγή, δομή και κύριες αντιδράσεις
Το τριοξείδιο του χρωμίου παράγεται με επεξεργασία διχρωμικού νατρίου με θειικό οξύ[6]:
- H2SO4 + Na2Cr2O7 → 2 CrO3 + Na2SO4 + H2O
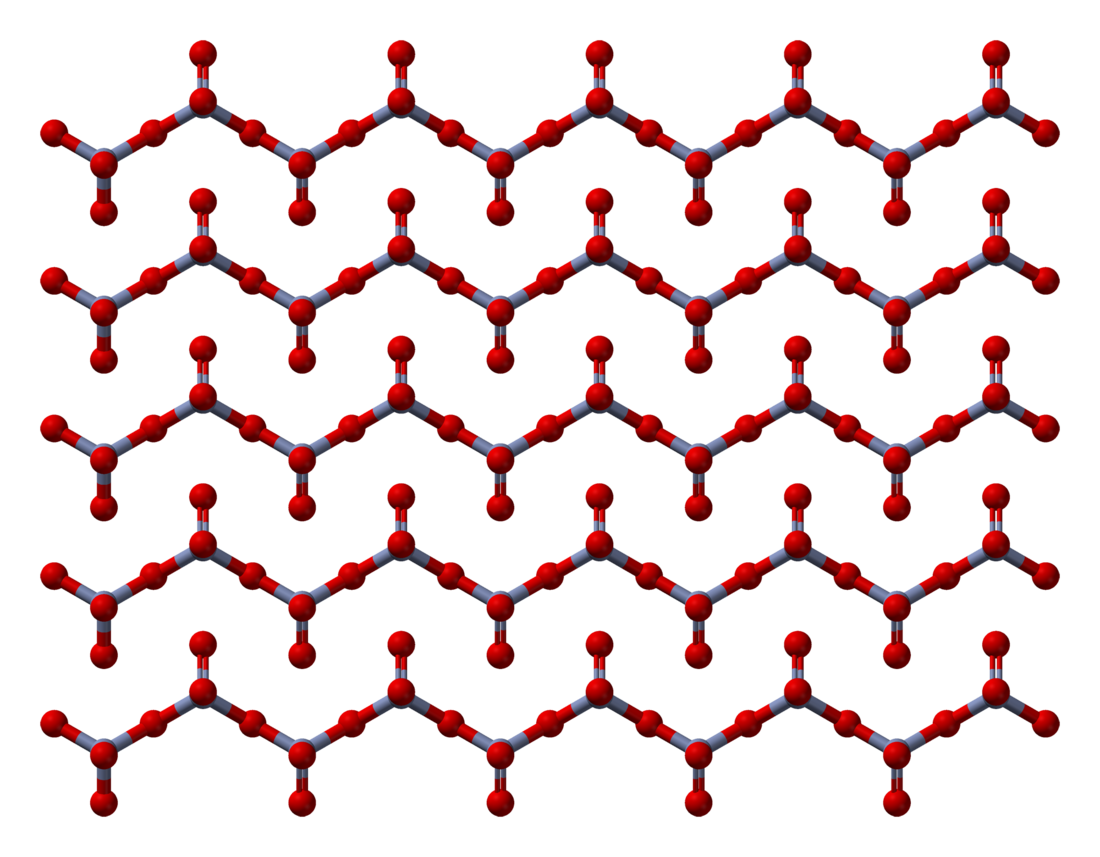
Περίπου 100.000 τόνοι παράγονται ετησίως από αυτήν ή παρόμοια οδό.[7] Το στερεό αποτελείται από αλυσίδες τετραεδρικά συντονισμένων ατόμων χρωμίου που μοιράζονται τις κορυφές. Επομένως, κάθε κέντρο χρωμίου μοιράζεται δύο κέντρα οξυγόνου με τους γείτονες. Δύο άτομα οξυγόνου δεν μοιράζονται, δίνοντας μια συνολική στοιχειομετρία 1:3.[9][10]

Η δομή του μονομερούς CrO3 έχει υπολογιστεί χρησιμοποιώντας τη συναρτησιακή θεωρία πυκνότητας και προβλέπεται να είναι πυραμιδική ομάδα σημείων C3v) αντί επίπεδη ομάδα σημείων D3h).[11]
Το τριοξείδιο του χρωμίου αποσυντίθεται πάνω από τους 197 °C, απελευθερώνοντας οξυγόνο και τελικά δίνοντας οξείδιο του χρωμίου(III) Cr2O3:
- 4 CrO3 → 2 Cr2O3 + 3 O2
Χρησιμοποιείται στην οργανική σύνθεση ως οξειδωτικό, συχνά ως διάλυμα σε οξικό οξύ,[9] ή ακετόνη στην περίπτωση της οξείδωσης Jones. Σε αυτές τις οξειδώσεις, το Cr(VI) μετατρέπει τις πρωτοταγείς αλκοόλες στα αντίστοιχα καρβοξυλικά οξέα και τις δευτεροταγείς αλκοόλες σε κετόνες. Οι αντιδράσεις φαίνονται παρακάτω:
- Πρωτογενείς αλκοόλες σε καρβοξυλικά οξέα
- 4 CrO3 + 3 RCH2OH + 12 H+ → 3 RCOOH + 4 Cr3+ + 9 H2O
- Δευτεροταγείς αλκοόλες σε κετόνες
- 2 CrO3 + 3 R2CHOH + 6 H+ → 3 R2C=O + 2 Cr3+ + 6 H2O
Remove ads
Εφαρμογές
Το τριοξείδιο του χρωμίου χρησιμοποιείται κυρίως στην επιχρωμίωση. Χρησιμοποιείται συνήθως με πρόσθετα που επηρεάζουν τη διαδικασία επιμετάλλωσης αλλά δεν αντιδρούν με το τριοξείδιο. Το τριοξείδιο αντιδρά με κάδμιο, ψευδάργυρο και άλλα μέταλλα για να δημιουργήσει παθητικοποιημένες χρωμικές ταινίες που αντιστέκονται στη διάβρωση. Χρησιμοποιείται επίσης στην παραγωγή συνθετικών ρουμπινιών. Το διάλυμα χρωμικού οξέος χρησιμοποιείται επίσης για την εφαρμογή τύπων ανοδικής επικάλυψης σε αλουμίνιο, οι οποίοι χρησιμοποιούνται κυρίως σε εφαρμογές αεροδιαστημικής. Στον Διεθνή Διαστημικό Σταθμό, χρησιμοποιείται για τον έλεγχο της ανάπτυξης βακτηρίων στη δεξαμενή αποθήκευσης λυμάτων. Ένα διάλυμα χρωμικού οξέος/φωσφορικού οξέος είναι επίσης ο προτιμώμενος παράγοντας απογύμνωσης ανοδικών επικαλύψεων όλων των τύπων.
Remove ads
Ασφάλεια
Το τριοξείδιο του χρωμίου είναι εξαιρετικά τοξικό, διαβρωτικό και καρκινογόνο.[12] Είναι το κύριο παράδειγμα του εξασθενούς χρωμίου, ενός περιβαλλοντικού κινδύνου.[13] Τα σχετικά παράγωγα χρωμίου (III) δεν είναι ιδιαίτερα επικίνδυνα. Έτσι, τα αναγωγικά σώματα χρησιμοποιούνται για την καταστροφή δειγμάτων χρωμίου(VI). Το τριοξείδιο του χρωμίου, ως ισχυρό οξειδωτικό, θα αναφλέξει οργανικά υλικά όπως αλκοόλες κατά την επαφή.
Εικόνες
- Συμπυκνωμένο διάλυμα διχρωμικού καλίου σε νερό.
- Προσθήκη θειικού οξέος στο διάλυμα.
- Κρυστάλλωση τριοξειδίου του χρωμίου από την αντίδραση.
- Αντίδραση μεταξύ τριοξειδίου του χρωμίου και αιθανόλης
Παραπομπές
Εξωτερικοί σύνδεσμοι
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads