Halogenalkany
skupina chemických sloučenin odvozených od alkanů obsahujících jeden nebo více halogenů From Wikipedia, the free encyclopedia
Halogenalkany nebo alkylhalogenidy jsou halogenderiváty odvozené od alkanů, mají obecný vzorec R-X. Mají mnoho různých využití, používají se například jako zpomalovače hoření, hasiva, chladiva, rozpouštědla a léčiva; některé halogenalkany jsou však také toxiny a jiné zase přispívají ke znečišťování životního prostředí, například chlorfluorované alkany poškozují ozonovou vrstvu a jsou také silnými skleníkovými plyny. Jodmethan však na rozdíl od ostatních chlorovaných, bromovaných a jodovaných alkanů nemá vliv na ozonovou vrstvu.
Většina halogenalkanů je umělého původu, některé však vznikají i přirozeně, většinou působením enzymů u bakterií, hub nebo mořských řas. Je známo více než 1600 halogenalkanů, nejčastější jsou bromalkany. Přirozeně se vyskytující halogenalkany patří nejčastěji mezi alkylbromidy. K přírodně vznikajícím organobromidům patří kromě methylbromidu také deriváty aromatických i různých nenasycených sloučenin, například indolů, terpenů, fenolů a acetogeninů.[1][2] V suchozemských rostlinách jsou alkylhalogenidy méně rozšířené než v mořských, ovšem i zde se vyskytuje například kyselina fluoroctová, sloužící jako toxin u nejméně 40 známých druhů rostlin. Jsou také popsány bakteriální enzymy dehalogenázy, které katalyzují odstraňování halogenů z organických substrátů.
Rozdělení
Podle počtu organických skupin navázaných na uhlíkový atom, na který je navázán halogen, se rozlišují primární (například chlorethan, CH3CH2Cl), sekundární (například 2-brompropan, CH3CHClCH3) a terciární (například 2-fluor-2-methylpropan) alkylhalogenidy.
Podle druhu halogenu se rozlišují fluoralkany (mají nejméně jeden fluor navázaný na alkylovou skupinu), chloralkany (obsahují chlor navázaný na alkylovou skupinu), bromalkany (na alkyl je připojený brom a alkyljodidy (na alkyl je napojen jod).
Vlastnosti
Alkylhalogenidy jsou většinou bezbarvé, bez zápachu a hydrofobní. Teploty tání chlor-, brom- a jodalkanů bývají vyšší než u příslušných alkanů a zvyšují se s molární hmotností halogenu, protože atomy halogenů způsobují polarizaci molekul, což zase způsobuje zesílení mezimolekulových interakcí od Londonových sil u alkanů po elektrostatické síly, které u polarizovaných molekul alkylhalogenidů převládají. Tetrajodmethan (CI4) je tak za standardních podmínek pevnou látkou, zatímco tetrachlormethan (CCl4) je kapalina. U fluoralkanů toto pravidlo kvůli nižší polarizovatelnosti vazby uhlík-fluor často neplatí, například teplota tání methanu (CH4) je -182,5 °C, zatímco tetrafluormethan (CF4) taje při -183,6 °C.
Jelikož obsahují méně vazeb C-H, tak jsou alkylhalogenidy méně hořlavé než odpovídající alkany, a některé se dokonce používají jako hasiva. Řada alkylhalogenidů patří mezi dobrá alkylační činidla, přičemž primární halogenalkany jsou účinnější než sekundární a lépe fungují také ty, které mají v molekulách halogeny s vyššími protonovými čísly. Schopnost chlorfluorovaných alkanů poškozovat ozonovou vrstvu vyplývá z nízké stability vazby C-Cl.
Výskyt
Z oceánů se ročně přirozenými procesy uvolní 1 až 2 miliony tun brommethanu.[3]
Názvosloví
Systematické názvy halogenalkanů podle Mezinárodní unie pro čistou a užitou chemii (IUPAC) se tvoří přidáním předpony před název příslušného alkanu, tato předpona se skládá z lokantu (čísla určujícího polohu substituentu na hlavním řetězci) a názvu příslušného halogenu; případně se před název přidává část určující počet jeho atomů. Například od ethanu je náhradou jednoho vodíku chlorem odvozen chlorethan, derivát methanu obsahující tři atomy bromu je tribrommethan a od propanu lze podle polohy atomu fluoru odvodit dva monofluorované deriváty - 1-fluorpropan a 2-fluorpropan. U některých halogenalkanů se také používají zažité triviální názvy, například trichlormethan bývá nazýván chloroform.
Výroba
Halogenalkany lze teoreticky vyrobit z libovolných organických látek. V průmyslu se prakticky využívá výroba z alkanů a alkenů.
Z alkanů
Podrobnější informace naleznete v článku Radikálová halogenace.
K výrobě alkylhalogenidů z alkanů se používá radikálová halogenace. Při této reakci dochází k odštěpení vodíku z molekuly alkanu a jeho náhradě atomem halogenu reakcí s dvouatomovou molekulou halogenu. Meziprodukty jsou zde radikály.
Tímto způsobem vznikají směsi mono- i polyhalogenovaných sloučenin se substituenty v různých polohách. Zastoupení jednotlivých produktů lze předvídat na základě vazebné energie a relativní stability průběžně vznikajících radikálů. Vliv má také reaktivita jednotlivých uhlíkových atomů.
Díky jejich rozdílným dipólovým momentům lze produkty od sebe oddělit destilací.
Z alkenů a alkynů
Při hydrohalogenaci, patřící mezi nukleofilní adice, reagují alkeny s halogenovodíky, jako jsou chlorovodík (HCl) a bromovodík (HBr) za vzniku monohalogenalkanu. Původní dvojná vazba je nahrazena dvěma jednoduchými vazbami, jednou na atom halogenu a druhou na atom vodíku pocházející z halogenovodíku. Přitom se uplatňuje Markovnikovovo pravidlo, podle kterého se halogen s větší pravděpodobností naváže na více substituovaný atom uhlíku. Reakce seč provádí za nepřítomnosti vody, jinak by jako vedlejší produkt vznikal halogenhydrin. Používají se bezvodá inertní rozpouštědla, jako například tetrachlormethan (CCl4) nebo se reakce provádí přímo v plynném skupenství. Podobně reagují i alkyny, u kterých se vytváří produkty s dvěma halogenovými substituenty na sousedních pozicích. Tyto dihalogenované sloučeniny se mohou tvořit i reakcí alkenů s halogeny, která u alkynů dává vzniknout tetrahalogenovaným sloučeninám. Reakce halogenů s nenasycenými alifatickými uhlovodíky se používají k důkazů halogenů, jelikož původní halogen je barevný a po navázání na uhlovodík dochází k odbarvení reakční směsi.
Z alkoholů
U alkoholů dochází k nukleofilní adici halogenovodíků za vzniku halogenalkanů. Terciární alkoholy reagují s kyselinou chlorovodíkovou přímo, přičemž se vytváří terciární chloralkany, ovšem u primárních a sekundárních alkoholů je potřeba ještě aktivátor, například chlorid zinečnatý. Tento postup se využívá při Lucasovu testu, který slouží k odlišení terciárních alkoholů od primárních a sekundárních.
Nejčastěji se alkylhalogenidy připravují z alkoholů reakcí s chloridem thionylu (SOCl2); tento postup je oblíbený díky tomu, že vedlejšími produkty jsou plyny. K podobným přeměnám se používají chlorid fosforečný (PCl5) a chlorid fosforitý (PCl3).
Alkoholy lze též přeměnit na bromalkany pomocí kyseliny bromovodíkové nebo bromidu fosforitého (PBr3).
Jodalkany se obvykle získávají pomocí červeného fosforu a jodu, které tvoří ekvivalent jodidu fosforitého, jenž je značně nestabilní. Další možností je Appelova reakce, při níž reaguje tetrahalogenderivát methanu s trifenylfosfinem, vedlejšími produkty jsou haloformy a trifenylfosfinoxid.
Rydonsovou reakcí
Alkoholy se při zahřívání s halogeny za přítomnosti trifenylfosfátu přeměňují a alkylhalogenidy.
Z karboxylových kyselin
Z karboxylových kyselin lze připravit halogenalkany reakcí Hunsdieckerových nebo Kochiovou reakcí.
Biosyntéza
V přírodě vzniká mnoho chloralkanů a bromalkanů působením enzymů chlorperoxidázy a bromperoxidázy.
Reakce
Halogenalkany reagují s nukleofily. Jejich molekuly jsou polární; atom uhlíku, na který je navázán halogen, je mírně elektronegativní, což vede ke snížené elektronové hustotě, v důsledku čehož je tento uhlík elektrofilní a proto dobře reaguje s nukleofily.
Substituce
Halogen v molekule alkylhalogenidu může být odstraněn a nahrazen jinou skupinou.
Příkladem dokládajícím nukleofilní vlastnosti halogenalkanů je hydrolýza. Polární vazba reaguje s hydroxidovým aniontem (OH−, jeho zdrojem nejčastěji bývá hydroxid sodný). Skupina OH− je díky svému zápornému náboji nukleofilní a dodává své přebytečné elektrony na uhlík, čímž se mezi nimi tvoří kovalentní vazba. Vazba C–X následně zanikne heterolytickým štěpením, které vede k uvolnění halogenidového iontu (X−). Po skončení reakce je na molekulu alkanu navázána hydroxylová skupina a produktem je tedy alkohol. Podobně lze reakcí s amoniakem připravit primární aminy.
Chlorované a bromované alkany snadno reagují s jodidovými ionty při Finkelsteinově reakci; takto získané jodalkany následně mohou snadno podstupovat další reakce. Jako katalyzátor se používá jodid sodný.
Halogenalkany reagují s iontovými nukleofily (například kyanidy, thiokyanatany a azidy), přičemž vznikají produkty s odpovídajícími substituenty. Využívají se při mnoha syntetických reakcích; kyanoalkany se hydrolýzou přeměňují na karboxylové kyseliny, nebo se redukují hydridem lithno-hlinitým na primární aminy. Azoalkany lze redukovat na primární aminy Staudingerovou reakcí nebo hydridem litho–hlinitým. Z alkylhalogenidů se také dají získat aminy Gabrielovou syntézou (reakcí s ftalimidem draselným) nebo Delépinovou reakcí (kdy se používá hexamethylentetramin) a následnou hydrolýzou.
Za přítomnosti zásady lze pomocí halogenalkanů alkylovat alkoholy na ethery, aminy na příslušné N-substituované deriváty a thioly na thioethery. Reakcí s Grignardovými činidly vznikají alkylové sloučeniny s delšími řetězci a hořečnaté soli.
Mechanismus
Substituce u halogenalkanů probíhá SN1 mechanismem. Nejpomalejším krokem této reakce je heterolýza vazby uhlík-halogen vedoucí k tvorbě karbokationtu a halogenidového aniontu. Poté se nukleofil naváže na karbokation a vznikne konečný produkt.
Při SN1 reakcích dochází k racemizaci chirálních molekul, protože karbokation může být atakován z obou stran. U terciárních alkylhalogenidů tento mechanismus převažuje, jelikož má karbokation díky stabilizaci kladného náboje alkylovými skupinami dodávajícími tři elektrony rovinnou trojúhelníkovou geometrii Rovněž převládá u substrátů, u kterých objemné substituenty zamezují SN2 mechanismu.
Eliminace
Podrobnější informace naleznete v článku Dehydrohalogenace.
Jednodušší než vytvoření molekuly, ve které bude halogen nahrazen jinou skupinou, je odštěpení halogenu společně se sousedním vodíkem, čímž vznikne alken. Příkladem může být reakce bromethanu s hydroxidem sodným v ethanolu, kdy dochází k odštěpení vodíkového kationtu hydroxidovým aniontem. Následně se odpojí i bromidový anion, čímž se vytvoří ethen, H2O a NaBr. Touto reakcí lze přeměnit monohalogenované alkany na alkeny a dihalogenované pomocí práškového zinku na alkyny. Reakcí geminálních alkyldihalogenidů se silnými zásadami vznikají karbeny.
Ostatní
Halogenalkany reagují radikálově s kovovým hořčíkem za vzniku Grignardových činidel a s lithiem za vzniku organolithných sloučenin. Za přítomnosti alkalických kovů může probíhat Wurtzova reakce, při níž se tvoří symetrické alkany. U halogenalkanů, obzvláště jodalkanů, také lze provést oxidační adicew, jejichž produkty jsou organokovové sloučeniny.
Použití
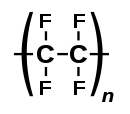
Chlorované a fluorované alkany mohou být polymerizovány. K nejvýznamnějším halogenovaným polymerům patří polyvinylchlorid (PVC) a polytetrafluorethylen (PTFE).
Kolem pětiny vyráběných léčiv obsahuje ve svých molekulách atomy fluoru, většina z nich patří mezi alkylfluoridy.[4] Příklady jsou 5-fluoruracil, flunitrazepam (Rohypnol), fluoxetin (Prozac), paroxetin (Paxil), ciprofloxacin (Cipro), meflochin a flukonazol. Fluorované ethery, například methoxyfluran, enfluran, isofluran, sevofluran a desfluran, se používají jako těkavá anestetitka.
Chlorfluorované uhlovodíky se používají jako chladiva, díky nízké toxicitě a vysokému skupenskému teplu výparu. Od 80. let 20. století se jejich používání omezuje, protože poškozují ozonovou vrstvu; od té doby jsou nahrazovány hydrofluorovanými uhlovodíky.
Některé nižší chloralkany, jako chloroform, dichlormethan a trichlorethan se používají jako rozpouštědla. Chlormethan slouží k výrobě chlorsilanů a silikonů. Chlordifluormethan se používá na výrobu polytetrafluorethylenu.
U bromalkanů se při jejich využívání ve větších množstvích projevuje toxicita. Jodalkany nejsou příliš využívané; ovšem například jodmethan se často používá v organické syntéze jako methylační činidlo.
Odkazy
Wikiwand - on
Seamless Wikipedia browsing. On steroids.