Lawrenci
element químic amb nombre atòmic 103 From Wikipedia, the free encyclopedia
El lawrenci és un element sintètic de la taula periòdica que pertany a la sèrie dels actinoides, el símbol del qual és el Lr i el seu nombre atòmic és 103. Fou sintetitzat per primera vegada el 1961 per un equip estatunidenc liderat per Albert Ghiorso de la Universitat de Califòrnia a Berkeley bombardejant nuclis de californi amb cations de bor accelerats en el ciclotró del Berkeley Radiation Laboratori. Fou nomenat en honor del físic estatunidenc Ernest Lawrence, inventor del ciclotró.[2][3] El 1965 investigadors soviètics també aconseguiren sintetitzar-lo bombardejant àtoms d'americi amb cations d'oxigen. Aquests isòtops i els que s'han observat posteriorment en cadenes de desintegració d'elements més massius són molt inestables. El lawrenci 266 té el període de semidesintegració més llarg, 11 h.[4] A causa d'aquesta inestabilitat no té cap aplicació, excepte les científiques. Tots els altres isòtops, excepte 260Lr, 261Lr, 262Lr, es desintegren amb una vida menor a un minut.
| Lawrenci | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
103Lr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspecte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Desconegut | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats generals | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, símbol, nombre | Lawrenci, Lr, 103 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Categoria d'elements | Actínids (de vegades és considerat com un metall de transició) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grup, període, bloc | n/d, 7, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pes atòmic estàndard | [262] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuració electrònica | [Rn] 7s2 5f14 7p1 2, 8, 18, 32, 32, 8, 3 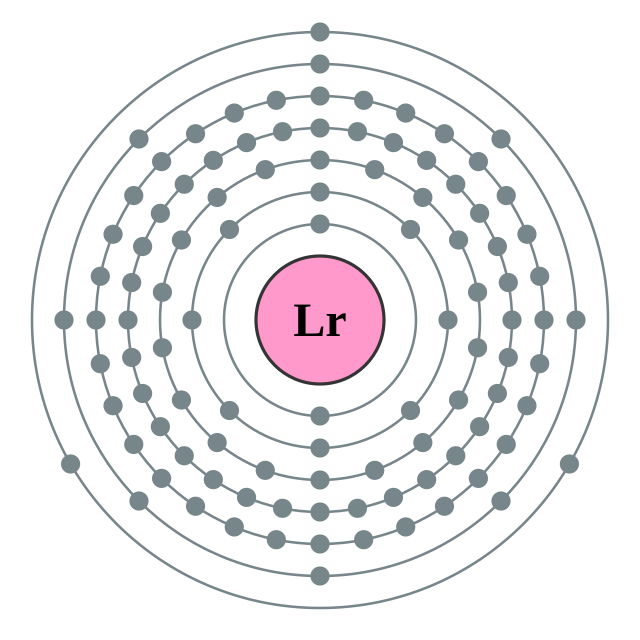 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats físiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase | Sòlid ((predit)) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punt de fusió | 1.900 K, 1.627 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propietats atòmiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estats d'oxidació | 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energies d'ionització | 1a: 443,8 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2a: 1.428,0 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3a: 2.219,1 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Miscel·lània | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristal·lina | Hexagonal compacta (predit)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre CAS | 22537-19-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isòtops més estables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Article principal: Isòtops del lawrenci | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Història
Descobriment

El lawrenci no és present a la natura i fou sintetitzat pels científics de la Universitat de Califòrnia a Berkeley Albert Ghiorso (1915-2010), el noruec Torbjørn Sikkeland (1923-2014), Almon E. Larsh (1939) i Robert M. Latimer (1934-1998) el 14 de febrer de 1961 al Berkeley Radiation Laboratory (ara anomenat Lawrence Berkeley National Laboratory). Bombardejaren a l'accelerador d'ions pesants HILAC (Heavy Ion Linear Accelerator) una barreja de 3 μg dels isòtops de més període de semidesintegració del californi (nombre atòmic Z = 98) amb isòtops de bor 10 i 11 (Z = 5) i obtingueren l'isòtop lawrenci 258[5] (inicialment determinaren que era el lawrenci 257).[6] Anomenaren el nou element en honor del físic estatunidenc Ernest O. Lawrence (1901-1958), que havia inventat el ciclotró i li assignaren el símbol Lw.[5] Les reaccions, amb el californi 252, foren:[7]

El símbol inicialment fou Lw, però el 1963 la Unió Internacional de Química Pura i Aplicada el canvià per Lr per adaptar-lo a la normativa aprovada. L'equip de científics soviètics format per E. D. Donets, V. A. Sxógolev i V. A. Ermakov, de l'Institut de Recerca Nuclear de Dubna, produí el 1965 l'isòtop lawrenci 256 (26 segons de període de semidesintegració)[8][6] segons la reacció:[7]
Altres experiments van demostrar la química actínida del nou element, per la qual cosa el 1970 va ser conegut com el darrer actínid.[9] El 1971 l'equip de física nuclear de la Universitat de Califòrnia a Berkeley va realitzar amb èxit tota una sèrie d'experiments dirigits al mesurament de les propietats de desintegració nuclear dels isòtops de lawrenci amb massa de 255 a 260.[2][10]
El 1992 el grup trans-fermi de la IUPAC —TWG per les sigles en anglès— va reconèixer oficialment els equips de física nuclear a Dubna i Berkeley com els codescobridors del lawrenci.[11]
Denominació

Ernest Orlando Lawrence
L'origen del nom, ratificat per l'American Chemical Society, és una referència al físic nuclear Ernest O. Lawrence de la Universitat de Califòrnia, que va inventar l'accelerador de partícules de ciclotró. Originalment, va ser utilitzat com a símbol Lw,[12] però finalment li va ser assignat el símbol Lr. L'agost de 1997, la Unió Internacional de Química Pura i Aplicada va ratificar el nom lawrenci i el símbol Lr durant una reunió a Ginebra.[11]
Propietats
El lawrenci es comporta més com els elements tripositius de la sèrie dels actinoides que com el nobeli, al qual segueix a la taula periòdica, predominantment dipositiu.[13]
Els experiments duts a terme el 1969 amb l'element van mostrar que reaccionava amb el clor per obtenir el que semblava ser clorur de lawrenci(III) . Estudis posteriors amb lawrenci 260 van confirmar la trivalència del lawrenci en comparar el temps d'elució amb el d'altres actinoides, cosa que va permetre determinar el radi iònic del catió (88,1 ± 0,1 pm) i la seva entalpia d'hidratació (−3.685 ±13 kJ/mol). Així es va deduir que la contracció actinoide al final de la sèrie era superior que l'anàloga contracció lantanoide, amb l'excepció del lawrenci a causa dels efectes relativistes.[6]
Tot i això, encara que l'estabilitat relativista dels electrons 7s preveia l'existència d'ions , els diferents experiments per reduir a o han resultat infructuosos. D'aquesta manera, la configuració electrònica del lawren-ci ha presentat certes controvèrsies perquè fins i tot molt recentment se li han assignat indistintament les configuracions 7s27p1 o 7s26d1. Tot i això, l'any 2015 es calculà experimentalment el seu primer potencial d'ionització, IP1 (4,96 eV a l'isòtop lawrenci 256). Aquest valor d'IP1 és significativament més baix que el del luteci i inferior al de tots els lantanoides i actinoides, de manera que es confirma la configuració de capa tancada 5f14 i 7s2 amb un electró addicional dèbilment enllaçat a l'orbital de valència. Els càlculs teòrics realitzats considerant els efectes relativistes concorden amb aquest valor i prediuen un valor del nivell 7s27p1/2 del Lr ~ 180 meV inferior que el del nivell 7s26d3/2, i semblen confirmar la primera com la configuració electrònica de l'element. Aquest fet ha suscitat diferents propostes per a la ubicació del lawrenci a la taula periòdica: bé al grup 3 al costat del Sc, Y i Lu, o bé al final del bloc f, amb dues sèries de quinze elements: La–Lu i Ac –Lr. Els estudis realitzats en models simples de monohidrurs i trihidrurs, monocarbonils o triclorurs apunten aquesta darrera possibilitat perquè suggereixen que no hi ha diferències químiques significatives entre el Lr i altres lantanoides. De fet, la IUPAC, a fi d'afrontar aquesta qüestió, creà un grup de treball l'any 2015 per establir una recomanació en l'elecció dels elements que han de conformar el grup 3.[6]
Nucleosíntesi
Fusió
- 205Tl(50Ti,xn)255-xLr (x=2?)
Aquesta reacció es va estudiar en una sèrie d'experiments el 1976 per Iuri Oganessian i el seu equip al Laboratori Fliórov de Reaccions Nuclears (LFRN). Es van proporcionar proves de la formació de 253Lr al canal de sortida 2n.
- 203Tl(50Ti,xn)253-xLr
Aquesta reacció es va estudiar en una sèrie d'experiments el 1976 per Iuri Oganessian i el seu equip al LFRN.
- 208Pb(48Ti,pxn)255-xLr (x=1?)
Aquesta reacció va ser reportada en 1984 per Yuri Oganessian a l'LFRN. L'equip va aconseguir detectar desintegracions de 246Cf, un producte descendent de 254Lr.
- 208Pb(45Sc,xn)253-xLr
Aquesta reacció també es va estudiar en una sèrie d'experiments el 1976 per Iuri Oganessian i el seu equip al LFRN. Els resultats no estan disponibles.
- 209Bi(48Ca,xn)257-xLr (x=2)
Aquesta reacció ha estat utilitzada per estudiar les propietats espectroscòpiques de 255Lr. L'equip del Grand Accélérateur National d'Ions Lourds va usar aquesta reacció el 2003 i l'equip de l'LFRN la va fer servir entre 2004 i 2006 per proveir més informació sobre l'esquema de desintegració de 255Lr. El treball va proporcionar evidència d'un nivell isomèric a 255Lr.
Fusió en calent
- 243Am(18O,xn)261-xLr (x=5)
Aquesta reacció es va estudiar per primera vegada el 1965 per l'equip de l'LFRN. Aquest va ser capaç de detectar activitat amb una desintegració característica de 45 segons, que van ser atribuïts a 256Lr o 257Lr. Treballs posteriors van suggerir una assignació a 256Lr. Altres estudis el 1968 van produir una activitat alfa de 8,35-8,60 MeV amb una vida mitjana de 35 segons. Aquesta activitat també va ser atribuïda inicialment a 256Lr o 257Lr i posteriorment només a 256Lr.
- 243Am(16O,xn)259-xLr (x=4)
Aquesta reacció es va estudiar el 1970 per l'equip de l'LFRN, que va aconseguir detectar una activitat alfa de 8,37 MeV, amb una vida mitjana de 22 segons. Aquest va ser atribuït a 255Lr.[10]
- 248Cm(15N,xn)263-xLr (x=3,4,5)
Aquesta reacció es va estudiar el 1971 per l'equip del LBNL en el seu estudi sobre els isòtops de lawrenci, que va poder atribuir activitats alfa des dels canals de sortida 3n a 5n, dels isòtops 260Lr, 259Lr i 258Lr.
- 248Cm(18O,pxn)265-xLr (x=3,4)
Aquesta reacció es va estudiar el 1988 al LBNL per avaluar la possibilitat de produir 262Lr i 261Lr sense haver de fer servir un blanc amb l'exòtic isòtop 254Es. També es va utilitzar per tractar de mesurar una branca en la captura d'electrons a 261mRf des del canal de sortida 5n.
Després de l'extracció del component Lr(III), es va poder mesurar la fissió espontània de 261Lr amb una vida mitjana de 44 minuts. La secció transversal de la producció va ser de 700 pb. Sobre aquesta base, un 14% de la branca de captura d'electrons es va calcular si aquest isòtop es va produir mitjançant el canal 5n, en lloc del canal p4n.
Un bombardeig d'energia més baix (93 MeV c.f. 97 MeV) es va fer servir per mesurar la producció de 262 al canal p3n. L'isòtop es va detectar amb èxit i es va mesurar un rendiment de 240 pb. El rendiment va ser més baix de l'esperat comparat amb el canal p4n. No obstant això, els resultats es van avaluar per indicar que el 261Lr probablement es va produir per un canal p3n i, per tant, es va suggerir un límit superior del 14% per a la branca de captura d'electrons de 261mRf.
- 246Cm(14N,xn)260-xLr (x=3?)
Aquesta reacció es va estudiar breument el 1958 al LBNL utilitzant un blanc enriquit de curi-244 (5 % 246Cm). Es va observar una activitat alfa aproximada a 9 MeV amb una vida mitjana d'uns 0,25 segons. Resultats posteriors van suggerir una assignació temptativa a 257Lr desde el canal 3n.
- 244Cm(14N,xn)258-xLr
Aquesta reacció es va estudiar breument el 1958 al LBNL utilitzant un blanc enriquit de 244Cm (5 % 246Cm). Es va observar una activitat alfa aproximada a 9 MeV amb una vida mitjana d'uns 0,25 segons. Resultats posteriors van suggerir una assignació temptativa a 257Lr des del canal 3n amb el component 246Cm. No es van reportar activitats associades amb la reacció amb el component 244Cm.
- 249Bk(18O,αxn)263-xLr (x=3)
Aquesta reacció es va estudiar breument el 1971 per l'equip del LBNL en el seu estudi sobre els isòtops de lawrenci, el qual va aconseguir detectar una activitat assignada a 260Lr.[10] La reacció es va repetir el 1988 per estudiar la química aquosa del lawrenci. Es van mesurar un total de 23 desintegracions alfa de 260Lr, amb una energia mitjana de 8,03 MeV i una vida mitjana de 2,7 minuts. La secció transversal calculada va ser de 8,7 nb.
- 252Cf(11B,xn)263-xLr (x=5,7??)
Aquesta reacció es va estudiar el 1961 a la Universitat de Califòrnia per Albert Ghiorso, en la qual es va fer servir un blanc de californi (52 % de 252Cf). Es van observar tres activitats alfa de 8,6, 8,4 i 8,2 MeV, amb vides mitjanes entre 8 i 15 segons, respectivament. L'activitat de 8,6 MeV va ser atribuïda temptativament a 257Lr.[12] Resultats posteriors van suggerir una reassignació a 258Lr, resultant del canal 5n. L'activitat de 8,4 MeV també va ser assignada a 257Lr. Resultats posteriors van suggerir una reassignació a 256Lr. Això és degut probablement del component de 33 % de 250Cf al blanc en comptes del canal 7n. L'activitat de 8,2 MeV va ser associada subseqüentment amb nobeli.
- 252Cf(10B,xn)262-xLr (x=4,6)
Aquesta reacció es va estudiar per primera vegada el 1961 a la Universitat de Califòrnia per Albert Ghiorso, utilitzant un blanc de californi (52% 252Cf). Es van observar tres activitats alfa de 8,6, 8,4 i 8,2 MeV, amb vides mitjanes entre 8 i 15 segons, respectivament. L'activitat de 8,6 MeV va ser atribuïda temptativament a 257Lr.[12] Resultats posteriors van suggerir una reassignació a 258Lr. L'activitat de 8,4 MeV també es va assignar a 257. Resultats posteriors van suggerir una reassignació a 256Lr. L'activitat de 8,2 MeV va ser associada subseqüentment amb nobeli.
- 250Cf(15N,αxn)260-xLr (x=3)
Aquesta reacció es va estudiar el 1971 al LBNL. Es va identificar una activitat alfa de 0,7 segons amb dues línies alfa en 8,87 i 8,82 MeV. Aquesta es va assignar a 257Lr.[10]
- 249Cf(11B,xn)260-xLr (x=4)
Aquesta reacció es va estudiar per primera vegada el 1970 al LBNL en un intent d'estudiar la química aquosa del lawrenci. Es va aconseguir mesurar una activitat Lr3+.[10] La reacció es va repetir el 1976 a Oak Ridge, i es va confirmar el temps de vida de 26 segons del 256Lr a través del mesurament de raigs X coincidents.
- 249Cf(12C,pxn)260-xLr (x=2)
Aquesta reacció es va estudiar el 1971 per l'equip del LBNL. Es va detectar una activitat atribuïda a 258Lr des del canal p2n.[10]
- 249Cf(15N,αxn)260-xLr (x=2,3)
Aquesta reacció es va estudiar el 1971 per l'equip del LBNL. Es va detectar una activitat atribuïda a 258Lr i 257Lr des dels canals α2n i α3n.[10] La reacció es va repetir el 1976 a Oak Ridge i es va confirmar la síntesi de 258Lr.
- 254Es + 22Ne – transferència
Aquesta reacció es va estudiar al LBNL. Es van detectar noves activitats de fissió espontània atribuïdes a 261Lr i 262Lr, resultants de la transferència des del nucli de 22Ne al blanc de 254Es. Així mateix, una activitat de fissió espontània de 5 ms de retard es va detectar en coincidència amb els raigs X de la capa K del nobel·li, i va ser assignada a 262No, resultant de la captura d'electrons de 262Lr.
Productes de desintegració
S'han identificat isòtops de lawrenci en la desintegració d'elements més feixucs. Les observacions fins a la data es resumeixen a la taula següent:
| Nuclid pare | Isòtop de lawrenci observat |
|---|---|
| 267Bh, 263Db | 259Lr |
| 278Uut, 274Rg, 270Mt, 266Bh, 262Db | 258Lr |
| 261Db | 257Lr |
| 272Rg, 268Mt, 264Bh, 260Db | 256Lr |
| 259Db | 255Lr |
| 266Mt, 262Bh, 258Db | 254Lr |
| 261Bh, 257Dbg,m | 253Lrg,m |
| 260Bh, 256Db | 252Lr |
Isòtops
S'han identificat 18 isòtops i isòmers nuclears del lawrenci que van des del de nombre màssic 251 al de nombre màssic 266. La majoria d'ells tenen períodes de semidesintegració molt curts, de l'ordre dels segons. Els que el tenen més llarg són (39 min), (≈ 4 h)[14] i (11 h).[14] Aquest darrer isòtop, el de període de semidesintegració més alt, fou observat el 2014 com a producte de la desintegració del dubni 270 per emissió d'una partícula alfa segons la reacció:[15]
La majoria apareixen en cadenes de desintegració d'isòtops d'elements de nombre atòmic superior i imparell, ja que ell el té imparell, a través d'un seguit de desintegracions α (a cada desintegració α es perden dos protons). Així, el lawrencii 263 apareix en la cadena de desintegració del tennes 291 (nombre atòmic 117), el lawrencii 264 en la del tennes 292, el lawrenci 265 en la del moscovi 289 (nombre atòmic 115), el lawrencii 266 en la del nihoni 286 (nombre atòmic 113), etc. Per exemple, en la cadena de desintegració del nihoni 286 apareix el lawrenci 266 després de sis desintegracions α:[16]
Isomeria nuclear
Un estudi sobre les propietats de desintegració del 257Db el 2001 per Hessberger i altres al GSI va proporcionar algunes dades sobre la desintegració del 253Lr. L'anàlisi de les dades va indicar la població de dos nivells isomèrics a 253Lr des de la desintegració dels isòmers corresponents a 257Db. A l'estat basal se li va assignar un espín i paritat de 7/2-, decaient per emissió d'una partícula alfa de 8794 KeV amb una vida mitjana de 0,57 segons. El nivell isomèric se li va assignar un espí i paritat d'1/2-, decaient per emissió d'una partícula alfa de 8722 KeV, amb una vida mitjana d'1,49 segons.[17]
Un treball recent a l'espectroscopia de 255Lr formada en la reacció 209Bi(48Ca,2n)255Lr va proporcionar proves d'un nivell isomèric.
Referències
Enllaços externs
Wikiwand - on
Seamless Wikipedia browsing. On steroids.













