substància química que conté carboni From Wikipedia, the free encyclopedia
Un compost orgànic és un compost químic que conté una cadena d'àtoms de carboni, enllaçats entre ells mitjançant enllaços covalents, i enllaçats a àtoms d'hidrogen, amb la possibilitat de formar enllaços amb altres elements químics dels no-metalls.

| Substància química | classe estructural d'entitats químiques |
|---|
Originàriament, parlar de composts orgànics era parlar dels composts produïts pels éssers vius. Però el 1828 el químic alemany Friedrich Wöhler anorreà la premissa bàsica del vitalisme científic quan sintetitzà la urea, present a l'orina dels mamífers, amb reactius inorgànics (escalfant cianat d'amoni).[1]

Arran de la caiguda en desús de la teoria de la força vital, l'àmbit d'estudi dels composts orgànics s'amplià també a les substàncies artificials, sintetitzades als laboratoris. Actualment, hi ha milions de composts orgànics coneguts.[2] El fet que hi hagi un nombre tan immens de combinacions a partir de només deu elements químics (carboni, hidrogen, oxigen, quatre halògens, nitrogen, sofre i fòsfor, principalment), a diferència del que ocorre en la química inorgànica, es basa, d'una banda, en la possibilitat que presenta l'àtom de carboni d'establir enllaços covalents amb altres àtoms de carboni per a formar cadenes i xarxes; i de l'altra, en l'existència de diversos grups funcionals, en els quals intervenen el carboni i els altres elements presents en els composts orgànics. Aquest fet condiciona una visió del compost orgànic en la qual hom pot considerar per separat l'estructura bàsica de carbonis i els grups funcionals ancorats sobre ella.[3]
El correcte coneixement de l'estructura dels composts orgànics neix amb la formulació de les teories estructurals del químic alemany Friederich A. Kekulé (1829-1896), del químic britànic Archibald S. Couper (1831-1892) i del químic rus Aleksandr M. Bútlerov (1828-1896), les quals donaren una visió fonamental de la natura de les cadenes de carbonis, i en particular la dels composts aromàtics. Posteriorment, la noció d'estereoquímica, derivada de les idees sobre la isomeria geomètrica i l'àtom de carboni asimètric, degut al químic neerlandès Jacobus H. van 't Hoff (1852-1911) i al químic francès Joseph A. Le Bel (1847-1930), la introducció del concepte d'enllaç covalent, amb el paper rellevant que aquest té en la química dels composts orgànics, i la formulació de les teories quàntiques de l'enllaç químic han proporcionat un coneixement gairebé perfecte del problema de l'estructura molecular dels composts orgànics.[3]
A conseqüència de la concepció original de la química orgànica, hi ha la tendència a agrupar els composts orgànics d'acord amb llur origen:
Hom ha emprat el criteri estructural per a delimitar els diferents composts orgànics. Així, hi ha:
D'altra banda, els distints grups funcionals confereixen als composts que els contenen propietats físiques i químiques molt relacionades, la qual cosa justifica una classificació dels composts orgànics segons aquest criteri. Així, hom sol parlar d'alcans, alquens, alquins, derivats halogenats, nitrils, alcohols, fenols, quinones, èters, aldehids, cetones, àcids carboxílics, èsters, anhídrids d'àcid, amines, amides, sulfones, etc.[4]


Els hidrocarburs són composts orgànics formats exclusivament per carboni i hidrogen. Els àtoms de carboni s'enllacen entre ells formant cadenes més o menys llargues, per mitjà d'enllaços covalents simples, dobles o triples, i les valències que resten lliures són saturades amb hidrogen.[5]
Hom distingeix els hidrocarburs acíclics, de cadena oberta, dels cíclics, de cadena tancada.
Els hidrocarburs són obtinguts principalment del gas natural (saturats de baixa massa molecular: metà, età, propà i butà), del petroli (parafines, aromàtics i alicíclics) i del quitrà de l'hulla (preferentment aromàtics: benzè, toluè, xilol, naftalè, antracè, etc.) i, en menys quantitat, de les ceres, resines i olis essencials d'origen vegetal.[5]


Els alcohols són composts orgànics caracteritzats per la presència d'almenys un grup funcional hidroxil, –OH, enllaçat amb enllaç covalent a un carboni que no és aromàtic ni és unit per un enllaç doble a un altre oxigen o a un sofre.[7]
El mot «alcohol» prové de l'àrab vulgar al-kuḥúl, i aquest de l'àrab clàssic kuḥl, ‘alcofoll’, a través del baix llatí dels alquimistes que l'empraven per designar una essència obtinguda per trituració o destil·lació, i que passà a denominar l'esperit de vi o etanol, el més conegut del grup.[7]

Amb la nomenclatura de la IUPAC els alcohols s'anomenen afegint al nom de l'hidrocarbur el sufix -ol, tot preservant la n etimològica (per exemples: propà → propanol, butà → butanol), i indicant la posició del grup hidroxil amb un localitzador numèric entre guions just davant del sufix, per exemple butan-2-ol, CH₃CH₂CH(OH)CH₃. Si la molècula conté un altre grup funcional, prioritari en nomenclatura, els alcohols s'anomenen emprant el prefix hidroxi-. Així el 3-hidroxibutanal, CH₃CH(OH)CH₂CHO, és un aldehid amb una funció hidroxil.[8] Sovint els alcohols encara es designen fent seguir el mot alcohol de l'adjectiu corresponent al grup R (per exemple el prop-2-enol també s'anomena alcohol al·lílic, CH₂=CHCH₂OH). Si el carboni unit a l'hidroxil és primari, secundari o terciari, els alcohols són anomenats també primaris, secundaris o terciaris. En cas que la molècula contengui dos, tres o més grups funcionals hidroxil, els alcohols s'anomenen, respectivament, diols (o glicols) com l'etan-1,2-diol o etilenglicol, triols com el propan-1,2,3-triol o glicerina i, en general, polialcohols.[9]
Les propietats físiques dels alcohols depenen de la llargària i ramificacions de la cadena de carbonis R. Si és curta són líquids miscibles amb l'aigua o molt solubles, d'olor característica i de sabor ardent i fortament associats (per formació d'enllaços per pont d'hidrogen), cosa que fa que llurs punts d'ebullició siguin elevats (metanol 65 °C, etanol 78,5 °C, propan-1-ol 97 °C, hexan-1-ol 156 °C) en comparació amb els hidrocarburs de la mateixa cadena i amb d'altres composts de polaritat semblant. La solubilitat en aigua disminueix ràpidament amb l'increment de la massa molecular. Si presenten diversos isòmers de posició, el punt d'ebullició tendeix a ser tant més baix (i el punt de fusió tant més alt) com més gran és la substitució al veïnatge del grup –OH. Els alcohols no absorbeixen en la radiació ultraviolada pròxima ni en la visible, però donen absorcions característiques en la zona de la radiació infraroiga. L'absorció principal té lloc a la regió de freqüències 3 650–3 590 cm-1. Quan hi ha enllaços per pont d'hidrogen la banda es desplaça cap a freqüències més baixes.[9]

Per la seva inestabilitat i reactivitat, els alcohols no es troben en el regne mineral, però sí que es troben en els éssers vius.[6] L'etanol i alguns dels seus homòlegs superiors es formen en la fermentació dels sucres i nombrosos olis essencials i resines contenen alcohols diversos. Deixant de banda els polialcohols (sorbitol, mannitol, xilitol, lactitol…), els àcids alcohols i els aminoalcohols (efedrina, esfingosina…), els alcohols bioquímicament més importants són la vitamina A, els alcohols grassos (tetradecan-1-ol, hexacosan-1-ol…) i, sobretot, els esterols (colesterol, ergosterol…).[9]
Pel fet de ser molt nombrosos, els alcohols tenen aplicacions molt diverses. Molts d'ells són utilitzats com a dissolvents o troben aplicació directa en nombroses indústries, per exemple, perfumeria, cosmètica, pintures, adhesius, indústria farmacèutica, etc. Llur principal ús és, tanmateix, la síntesi, especialment d'èsters, per a obtenir dissolvents, plastificants, detergents, medicaments, etc.[9]



Els èters són composts orgànics caracteritzades per la presència del grup funcional –O– unit a dos grups alquil, o bé, en els èters cíclics, formant part d'una cadena alifàtica tancada.[10]
El mot «èter» ve del grec αιθἠρ, aire lleuger, que indica que aquests composts són molt volàtils.[6]
Els èters (R–O–R') són geomètricament semblants a l'aigua i als alcohols. D'acord amb les normes de la IUPAC, els èters alifàtics s'anomenen emprant el grup alcoxi RO–, considerat com a substituent de la cadena més llarga que s'escriu al final, com ara metoxietà, CH₃-O-CH₂-CH₃ o etoxipropà, CH₃-CH₂-O-CH₂-CH₂-CH₃.[8]
Els punts de fusió i d'ebullició dels èters són comparables als dels hidrocarburs de massa molecular semblant. La majoria són immiscibles amb l'aigua, però els èters cíclics dioxà i tetrahidrofurà (THF), ho són en totes proporcions. Així la majoria són bons dissolvents dels composts orgànics, però dissolen molt poc els inorgànics, per la qual cosa són uns excel·lents dissolvents per als processos d'extracció. Els èters són indiferents a la majoria dels reactius químics. Atès que els derivats de l'oxigen divalent tenen parells d'electrons no compartits disponibles, actuen com a base de Lewis, per tant reaccionen en presència d'àcids. La reacció més important que experimenten és la ruptura de l'enllaç C–O. Els èters s'obtenen habitualment tractant alcohols amb haloalcans, reacció coneguda com a síntesi de Williamson. Els diols, en deshidratar-se, donen èters cíclics.[10]


Els aldehids són substàncies orgàniques caracteritzades per la presència del grup funcional carbonil, C=O, a un extrem d'una cadena de carbonis. La paraula «aldehid» deriva d'alcohol deshidratat.[11]
Amb la nomenclatura de la IUPAC els aldehids alifàtics RCHO s'anomenen afegint al nom de l'hidrocarbur RCH₃ el sufix -al, tot preservant la n etimològica (per exemple: metà → metnal, butà → butanal), i els aldehids amb el grup funcional directament fixat a un sistema cíclic, afegint el sufix -carbaldehid al nom d'aquest. Exemples: butanal, CH₃CH₂CH₂CHO, ciclopentacarbaldehid. Això no obstant, si la molècula conté un altre grup prioritari en nomenclatura, els aldehids es designen amb el prefix formil-. Exemple: àcid p-formilfenilacètic.[8]

Els aldehids bullen lleugerament a una temperatura més alta que els hidrocarburs, però molt per sota dels alcohols corresponents. Els més simples són solubles en aigua i tenen olors fortes i irritants; molts, de massa molecular elevada, tenen, en canvi, olors agradables. Tots són solubles en solvents orgànics. Des del punt de vista espectral, el carbonil dona lloc a una absorció intensa en l'ultraviolat llunyà i a una absorció feble en el pròxim, al voltant d'una longitud d'ona de 285 pm. Ambdues es desplacen cap a les grans llargades d'ona per conjugació amb sistemes insaturats. En l'infraroig els aldehids manifesten l'absorció característica del carbonil a unes freqüències de 1 660–1 740 cm-1.[12]

Els aldehids són composts neutres, reductors, de reactivitat intensa i variada. Donen alcohols primaris mitjançant hidrogenació catalítica o per reducció de Meerwein-Ponndorf-Verley, hidrocarburs per reducció de Clemmensen, i àcids carboxílics per oxidació (per aire, amb el reactiu de Fehling, amb solució argèntica amoniacal, etc.).[12]
A la natura els aldehids lliures són poc freqüents. Alguns són presents en diversos olis essencials (citral, citronel·lal, anisaldehid, vanil·lina, etc.); el benzaldehid és un constituent de molts glucòsids; i el gliceraldehid, l'etanal, el piruvaldehid, entre altres, són intermediaris importants en el metabolisme.[12]
Els mètodes industrials d'obtenció més importants són l'oxidació d'alcohols (per exemple: metanol → metanal); l'oxidació d'hidrocarburs (per exemple, del gas natural o de l'etè s'obté etanal) i la hidroformilació d'alquens (mètode oxo).[12] Industrialment tenen aplicació extensíssima el metanal i l'etanal. En menor grau són també importants, com a intermediaris de síntesi o per llurs aplicacions directes, el glioxal, l'isobutiraldehid, l'acroleïna, el crotonaldehid, el furfural i el benzaldehid, entre d'altres. Nombrosos aldehids són utilitzats en la preparació de perfums i essències sintètiques.[12]


Les cetones són composts orgànics amb el grup funcional C=O (carbonil) unit a dos grups alquil o, en les cetones cícliques, formant part d'una cadena alifàtica tancada.[13]
Amb les regles de la IUPAC, les cetones alifàtiques RR'CO són anomenades afegint al nom de l'hidrocarbur RR'CH₂ (en català, sovint seguit d'una n etimològica) el sufix -ona; davant del sufix s'hi posa un localitzador, si cal, que indica la posició del carbonil en la cadena. Per exemple: propanona, CH₃COCH₃, pentan-2-ona CH₃CH₂CH₂COCH₃. Quan conté altres grups funcionals prioritaris en nomenclatura, es designa amb el prefix ceto- (cetoàcid, cetoèster).[8]

Les cetones més simples, fins a uns dotze àtoms de carboni, són líquides. Les de massa molecular més baixa són solubles en aigua; totes ho són en solvents orgànics. Són destil·lables sense descomposició, i d'olor aromàtica. Les cetones tenen les propietats químiques generals del grup carbonil, exaltades o disminuïdes per les altres funcions presents en la molècula o per l'estructura d'aquesta.[13]

Els oxidants forts trenquen la cadena de carbonis de les cetones pels enllaços dels carbonis amb el grup carbonil, i donen àcids carboxílics diferents, segons si es fa la ruptura en un costat o l'altre del grup. Les cetones donenalcohols secundaris per hidrogenació catalítica o per reducció amb alcoholats d'alumini. Per reducció amb amalgames de sodi o magnesi produeixen 1,2-dialcohols, amb condensació de dues molècules. Amb la reducció de Clemmensen o amb la reducció de Wolff-Kishner les cetones es redueixen a hidrocarburs. Les amines primàries es condensen amb les cetones i donen les bases de Schiff. Comparades amb els aldehids, les cetones reaccionen poc per polimerització, encara que es condensin per elles mateixes en certes condicions.[13]
La propanona o acetona és la més coneguda i utilitzada de les cetones i la que dona nom al grup. Moltes cetones s'utilitzen com a solvents i com a primeres matèries en perfumeria. Algunes cetones inferiors, en particular l'acetona, s'originen sovint en la natura com a productes metabòlics anormals. Moltes cetones superiors formen part de productes odorants naturals, per exemple, dels olis eteris i dels greixos rancis.[6] Les cetones tenen propietats fisiològiques importants. Es troben en diversos sucres i en compostos d'ús medicinal, incloses les hormones esteroides naturals i sintètiques. Les molècules de l'agent antiinflamatori cortisona contenen tres grups cetònics.[14]


Els àcids carboxílics són composts orgànics que tenen en els extrems de la cadena de llur molècula un o diversos grups carboxil, –COOH, i que manifesten, per tant, les propietats àcides que aquest confereix.[15]
Segons quina és la natura del grup R, els àcids carboxílics es classifiquen en alifàtics, alicíclics (que poden ésser, uns i altres, saturats o insaturats), aromàtics i heterocíclics.[15]

D'acord amb les normes de la IUPAC, els àcids carboxílics s'anomenen fent seguir la paraula àcid d'un adjectiu format afegint al nom de l'hidrocarbur del mateix nombre de carbonis el sufix -oic, sense deixar-se la n etimològica (per exemple: pentà → àcid pentanoic), quan hi ha un sol carboxil, o -dioic, quan n'hi ha dos, com àcid butandioic. En alguns casos, no obstant això, resulta més pràctic considerar el grup carboxil com un substituent de la molècula RH. En aquest cas, o bé hom fa precedir el nom de RH de la paraula àcid i li afegeix el sufix -carboxílic (com, per exemple, àcid ciclopentan-carboxílic C₅H9COOH), o bé hom utilitza el prefix carboxi- (quan el carboxil no és el substituent principal). La IUPAC accepta, a més, que per a molts àcids carboxílics hom continuï utilitzant els noms comuns, tals com àcid fòrmic, àcid acètic, àcid butíric, àcid oxàlic, àcid acrílic, àcid benzoic, àcid cinàmic, etc.[8]
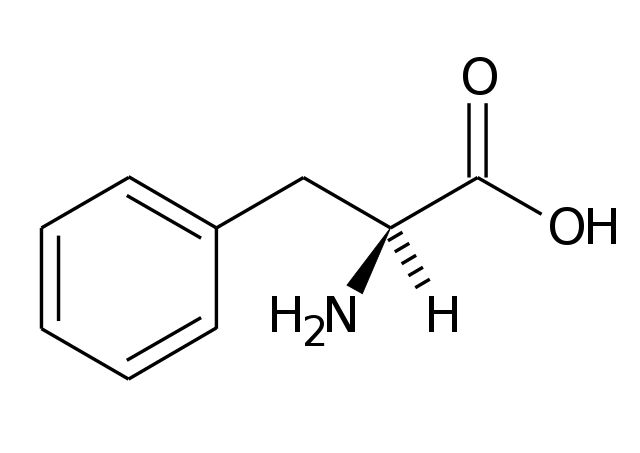
Les propietats físiques dels àcids carboxílics depenen de llur estructura i de llur massa molecular. Es fonen i bullen netament per damunt dels alcohols, amines, aldehids i cetones del mateix nombre de carbonis. Això té relació amb el fet que les seves molècules estan associades, formant dímers, a través dels carboxils. En sèrie alifàtica els primers termes són líquids destil·lables o arrossegables pel vapor d'aigua, i els àcids de nombre de carbonis parell es fonen sempre a més alta temperatura que llurs homòlegs immediats inferior i superior. En augmentar la massa molecular, la influència del grup carboxil sobre les propietats físiques tendeix a disminuir i així, per exemple, la solubilitat en aigua (total en els primers termes de la sèrie) decreix molt ràpidament. Això mateix passa amb l'olor.[15]
Els àcids carboxílics són en general àcids febles, amb valors pKa que, en general, varien entre 3 i 5, i la primera acidesa dels diàcids és molt més forta que la dels monoàcids, sobretot si els dos carboxils són pròxims. L'acidesa disminueix amb la massa molecular i augmenta amb la proximitat d'un doble enllaç al carboxil; els àcids aromàtics tendeixen també a ésser més forts que els alifàtics. La presència de substituents que atreuen electrons augmenta l'acidesa per efecte inductiu, i aquesta acció és particularment manifesta en el cas dels àcids carboxílics α-halogenats.[15]
Els àcids carboxílics donen sals alcalines solubles en aigua i són estables enfront dels oxidants i reductors. L'únic reductor que els ataca directament és l'hidrur d'alumini i de liti, que permet de transformar-los en alcohols. L'electròlisi de llurs sals alcalines RCOONa condueix als hidrocarburs R—R (reacció de Kolbe), i la fusió alcalina als hidrocarburs RH; la piròlisi de les sals alcalinotèrries dona en general cetones. Llurs sals d'argent reaccionen amb els halurs d'alquil donant cetones, i llurs sals sòdiques reaccionen amb els clorurs d'àcid donant anhídrids d'àcid. Per deshidratació de les sals amòniques són obtingudes amides. Per reacció dels àcids carboxílics amb el pentaclorur o amb l'oxiclorur de fòsfor són obtinguts clorurs d'àcid; per reacció amb els alcohols són obtinguts èsters, i per reacció de Schmidt són obtingudes amines. En fi, per acció del clor o del brom té lloc generalment una substitució progressiva dels hidrògens en α del carboxil (o de l'hidrogen d'un carboni terciari no gaire allunyat) i són obtinguts, doncs, àcids carboxílics halogenats.[15]
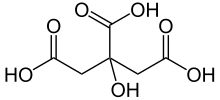
Àdhuc deixant de banda els aminoàcids que tenen una importància fonamental per ser els constituents de les proteïnes, els àcids carboxílics tenen una gran importància biològica. A l'estat lliure hom no els troba gaire sovint en els animals (per bé que hi ha àcid fòrmic en les formigues i en el verí de les abelles), però, en canvi, són molt abundants en els sucs cel·lulars de les plantes (àcids fòrmic, oxàlic, màlic, ascòrbic, tàrtric, cítric, etc.) i en nombroses resines d'origen vegetal (àcid abiètic, benzoic, cinàmic, etc.). Varis àcids carboxílics són productes de la fermentació (fermentació acètica de l'etanol, làctica dels glúcids, etc.). Les plantes els contenen també en abundància en forma de sals (en llurs sucs aquosos) i en forma d'èsters (en els olis essencials). Tanmateix és sobretot en forma d'èsters glicèrics (que constitueixen els greixos) que els àcids carboxílics són universalment presents en els éssers vius. Aquests àcids són anomenats àcids grassos.[4]


Els èsters són composts orgànics caracteritzades per la presència del grup funcional –COOR, és a dir, per la unió del grup acil amb un grup alquil.[16]
La paraula «èster», igual que «èter», ve del grec αιθἠρ, aire lleuger, que indica que aquests composts són molt volàtils (el metanoat de metil bull a 32 °C, l'acetat de metil a 57 °C, etc.).[6]

D'acord amb les normes de la IUPAC, els èsters són anomenats expressant primerament la part que prové de l'àcid carboxílic per un substantiu format afegint el sufix -oat (precedit d'una n etimològica) el nom de l'hidrocarbur del mateix nombre d'àtoms de carboni que l'àcid, i després el nom del radical de la part catiònica, com ara butanoat d'etil. Quan hom utilitza els noms trivials corrents dels adjectius característics dels àcids, com fòrmic, acètic, benzoic, etc., el substantiu que en deriva per designar la part aniònica és el format canviant el sufix -ic d'aquests adjectius pel sufix -at, com en el cas de l'acetat d'etil. Si hom no pot formar el nom de l'anió, acostuma a emprar perífrasis, com èster benzílic de la metionina.[8]

Per hidròlisi els èsters regeneren l'àcid i l'alcohol; això és important sobretot per als èsters naturals (ceres, olis i greixos; en el cas dels dos darrers, si la hidròlisi és bàsica hom obté els sabons).[16]
Els èsters de baixa massa molecular són molt emprats com a solvents (acetat de metil, d'etil i de butil). Els èsters d'àcids no saturats, com els dels àcids acrílic i metacrílic, es polimeritzen amb facilitat i donen matèries plàstiques d'un gran consum (acrilats, metacrilats).[6] També destaquen els èsters que formen part d'essències naturals i s'empren en la composició dels perfums sintètics: olor d'albercoc (butanoat d'etil i butanoat d'amil), de brandi i vi (heptanoat d'etil), de pera (acetat d'isoamil), de plàtan (acetat d'isoamil), de pinya (butanoat de butil), de raïm (metanoat d'etil i heptanoat d'etil), de rom (propanoat d'isobutil), de taronja (acetat d'octil), etc.[11]

Les amides són composts orgànics que deriven formalment de l'amoníac o d'una amina primària o secundària per substitució per radicals acil d'un hidrogen (amides primàries), de dos hidrògens (amides secundàries) o de tres hidrògens (amides terciàries). Les úniques importants són les amides primàries, en general dites simplement amides. Llur fórmula general és R-CONR'R", en la qual els radicals R, R', R" poden ésser hidrogen o un grup hidrocarbonat.[17] El mot «amida» ve del mot francès amide, format a partir del radical de ammoniaque i el sufix -ide, que indica la presència d'un àcid, provinent del mot acide.[18]
Les amides s'anomenen, amb les normes de la IUPAC, canviant en el nom de l'àcid carboxílic R-COOH el sufix -ic i -oic per -amida o la terminació carboxílic per carboxamida. Per excepció, l'amida de l'àcid oxàlic s'anomena oxamida.[8]


Exceptuant la formamida, les amides no substituïdes en el nitrogen són sòlides, i llurs punts de fusió i d'ebullició són superiors als dels àcids corresponents. En l'espectroscòpia infraroja absorbeixen a 3 500–3 400 cm–1 (vibració de tensió N–H) i a 1 690–1 680 cm–1 (banda I) i 1 640–1 630 cm–1 (banda II) (vibració de tensió C = O). Les amides són poc bàsiques, a causa de la important contribució de la forma ressonant B en la qual el nitrogen ja no suporta el parell d'electrons no compartits al qual són degudes les propietats bàsiques de les amines. A causa d'aquesta ressonància, la reactivitat del carbonil amídic enfront d'agents nucleòfils és menor que la dels carbonils dels àcids, èsters, etc.[17]
Les amides monomèriques són rares en la natura, amb poques excepcions, tals com la urea. Cal notar, però, que els constituents principals de la trama estructural de la matèria viva, els pèptids i les proteïnes, són poliamides, en les quals es manifesta la solidesa de l'enllaç amídic.[17]
Les amides es preparen principalment: per acilació de l'amoníac o d'amines primàries o secundàries per destil·lació lenta de sals amòniques d'àcids carboxílics i també per hidratació, en el medi àcid o bàsic, de nitrils. Les aplicacions de les amides són molt diverses. A més de llur utilització com a intermediaris de síntesi, moltes d'elles són emprades directament com a solvents, plastificants, estabilitzants, medicaments, etc. Imitant la natura, l'home sintetitza, a més, diversos polímers poliamídics, que són emprats per a la fabricació de fibres sintètiques (perló, niló) i en la indústria dels plàstics.[17]


Les amines són composts orgànics que deriven formalment de l'amoníac, NH₃, per substitució d'un o més àtoms d'hidrogen per grups alquil R. Les amines són primàries RNH₂, secundàries R¹R²NH o terciàries R¹R²R3N, segons que hi hagi un, dos o tres hidrògens substituïts.[19]
En la nomenclatura sistemàtica de la IUPAC, les amines primàries s'anomenen afegint el sufix -amina bé al nom del grup R, bé al nom del compost RH. Exemple: metilamina CH₃NH₂. Les amines secundàries i terciàries simètriques s'anomenen afegint els prefixos di- i tri-, i les no simètriques considerant-les productes de substitució de l'amina primària més complicada. Exemples: trietilamina (C₂H₅)₃N. Quan el grup -NH₂ no és el principal en la molècula, per a designar-lo és emprat el prefix amino-. Exemple: àcid p-aminobenzoic. Per a diverses amines importants, la IUPAC ha acceptat també noms trivials, tals com anilina, adenina, etc.[8]
Les amines primàries i secundàries poden formar enllaços per pont d'hidrogen i tenen, per tant, punts d'ebullició superiors als dels hidrocarburs de massa molecular similar. Per la mateixa raó, els termes més senzills de la sèrie són solubles en aigua. És característica de les amines primàries i secundàries llur absorció de radiació infraroiga de freqüència 3 500–3 300 cm–1, que correspon a la vibració de tensió de l'enllaç N–H. Les amines són composts bàsics a causa del parell d'electrons no compartits del nitrogen, que poden captar un protó. Les amines aromàtiques, com l'anilina, són molt menys bàsiques que les alifàtiques, a causa de la participació del parell electrònic no compartit en la ressonància del nucli aromàtic.[20]

Com a conseqüència de la seva basicitat, les amines donen amb els àcids inorgànics sals cristal·lines d'elevat punt de fusió i molt higroscòpiques. Les amines lliures s'oxiden fàcilment i donen òxids d'amina, cosa que les fa útils com a antioxidants. Les amines són preparades bé per reducció de composts nitrogenats de grau d'oxidació superior, tals com nitroderivats, nitrils, imines, amides i oximes, bé per alquilació de l'amoníac, reacció que malgrat donar mescles d'amines primàries, secundàries i terciàries té interès industrial, puix que els diversos productes poden ésser separats amb una adequada destil·lació fraccionada.[20]
Les amines participen de manera destacada en els sistemes bioquímics, estan àmpliament distribuïdes en la natura en forma d'aminoàcids, proteïnes, alcaloides i vitamines. Molts de derivats d'amines complexes tenen una activitat fisiològica pronunciada, per exemple la penicil·lina, LSD, el verí de la cicuta, la procaïna. S'empren per obtenir medicaments (sulfamides i anestèsics locals). La fibra sintètica niló s'obté a partir de dos components, un dels quals és una amina.[21]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.