compost orgànic que conté un oxigen connectat a dos fragments orgànics From Wikipedia, the free encyclopedia
Un èter és un compost orgànic on un àtom d'oxigen uneix dos grups alquil o aril, o que forma part d'una cadena alifàtica tancada. És un dels grups funcionals més típics en la química orgànica.
| Aquest article tracta sobre el grup funcional i la família de composts que en deriven. Vegeu-ne altres significats a «Èter (desambiguació)». |
| Substància química | classe estructural d'entitats químiques |
|---|---|
| Estructura química | |
 | |
Els èters de baixa massa molecular (com l'èter dietílic, l'oxolà o tetrahidrofuran i l'èter tert-butil metílic) s'empren com a dissolvents, ja que són líquids a temperatura ambient i poc reactius. Diferents èters halogenats (soflurà, desflurà,[1] sevoflurà,[2] metoxiflurà)[3] s'empren en anestèsia general per inhalació.

Algunes fonts atribueixen a Ramon Llull (1232–1316) el descobriment de l'èter etílic el 1275 en fer reaccionar oli de vidriol (àcid sulfúric) sobre l'esperit de vi (etanol) i que l'hauria anomenat oleum vitrioli dulce verum (veritable oli dolç de vidriol).[4] Tanmateix, les obres d'alquímia que se li atribueixen són apòcrifes i la síntesi de l'èter hauria estat descoberta per algun alquimista desconegut.[5][6] Paracels (1493–1541) cap al 1525 descobrí les seves propietats anestèsiques.[7] Tampoc es pot afirmar que la primera preparació descrita de l'èter fou la de l'alemany Valerius Cordus (1515–1544).[8][9] Cordus hauria conegut un procediment que comerciants portuguesos l'haurien recollit a l'Orient Mitjà. Realitzà la preparació el 1540 i fou publicada el 1548, després de la seva mort. Apareix també dins d'una ámplia obra pòstuma de recopilació dels seus treballs en la part titulada «De artificiosis extractionibus liber».[10] Però el producte obtingut i descrit, que anomenà oleum vitrioli dulce, té les propietats del sulfat de dietil i no pas de l'èter, que no hauria recollit.[11]
La primera descripció correcta de l'èter (no de la seva preparació) fou publicada el 1730 per l'alemany August Siegmund Frobenius (?–1741). Publicà un treball a la Philosophical Transactions que duu per títol «An Account of a Spiritus Vini Aethereus, together with several experiments tried therewith». Fou la primera vegada que el nom «èter» s'emprà en el camp de la química.[11] Prové del llatí aether, aethĕris, i aquest, del grec αἰθήρ, aithḗr, -éros 'cel; fluid molt subtil que omple l'espai enfora de l'atmosfera', derivat de aíthō 'cremar';[12] oposat a āēr, āĕris, i aquest del grec ἀήρ, aḗr, aéros,"l'aire inferior".[13]

Sembla que Frobenius volia amagar aquesta substància, potser ja coneguda per algunes persones, darrere d'un nou nom. Fa una descripció relativament precisa de les propietats físiques de l'èter. Destaca la seva extraordinària volatilitat i inflamabilitat, manca de característiques olioses i la seva solubilitat. Frobenius lloà l'èter com l'"instrument més noble, eficaç i útil de tota la Química i Farmàcia", ja que, juntament amb el seu col·lega Ambrose Godfrey-Hanckwitz (1660–1741) volia treure'n alguns beneficis venent èter als interessats. En conseqüència, es negaren a publicar cap informació sobre la seva síntesi. En un apèndix de l'article de Frobenius, escrit per Godfrey, diu que juntament amb Frobenius havia provat un procés descrit per Isaac Newton (1642–1727), el qual havia barrejat "un pes igual d'alcohol de vi i oli de vidriol" que, quan s'escalfaven junts i posteriorment es destil·laven, "donen dues begudes espirituoses fragants i volàtils que no es barrejaran entre si". Mitjançant aquest procés Newton obtingué èter i, com a segon "esperit", una barreja d'aigua i alcohol (potser amb una mica de sulfat de dietil). Això clarament demostra que sabia preparar l'èter. Aquesta sembla ser la primera descripció impresa de la preparació de l'èter. Mentre que Newton havia utilitzat pesos iguals d'alcohol i àcid sulfúric, Frobenius i Godfrey utilitzaren volums iguals (una manera menys preferible). El 1741, després de la mort de Frobenius i Godfrey, el seu procés fou publicat per Cromwell Mortimer en un document que havia estat dipositat a la Royal Society des de 1730.[11]
El químic francès Antoine François de Fourcroy (1755–1809) suggerí que l'èter es formava per l'eliminació d'aigua de l'etanol, cosa que el suís Nicolas-Théodore de Saussure (1767–1845) comprovà el 1807 i també ho confirmà el 1815 el francès Joseph-Louis Gay-Lussac (1778–1850). El farmacèutic francès Pierre-François-Guillaume Boullay (1777–1869) descobrí que una petita quantitat d'àcid sulfúric podia produir grans quantitats d'èter i aigua mitjançant un procés continu.[14] Aquesta observació indicava que l'àcid sulfúric no funcionava com a reactiu químic sinó, com proposaren l'alemany Eilhard Mitscherlich (1794–1863) i el suec Jöns Jacob Berzelius (1779–1848), com a catalitzador. Cap d'ells reconegué la formació d'hidrogen sulfat d'etil.[15]
L'anglès Alexander W. Williamson (1824–1904) intentava sintetitzar el butan-1-ol fent reaccionar la sal de potassi de l'etanol amb iodur d'etil. Però Williamson no aïllà un alcohol, sinó èter etílic. Descobrí per casualitat una manera totalment nova de preparar l'èter en condicions alcalines en contraposició a la reacció centenària de l'àcid sulfúric amb l'etanol.[16]
Al segle xix, l'èter dietílic fou la primera substància que s'emprà públicament per alleujar el temut dolor de la cirurgia.[17] El 1842, el metge estatunidenc Crawford W. Long (1815–1878) l'emprà per a l'anestèsia quirúrgica a la seva consulta privada a Jefferson, Geòrgia.[18] El 1846, el dentista William T. G. Morton (1819–1868)[19] va fer servir l'èter dietílic en la primera demostració pública amb èxit d'anestèsia quirúrgica, a l'Hospital General de Massachusetts.[20]
Avui dia, l'addicció al èter inhalat o ingerit com a substitut del consum de begudes alcohòliques és un fet poc comú.[21]
Els èters resulten de la substitució dels dos hidrògens de l’aigua i són geomètricament semblants a l’aigua i als alcohols . D’acord amb les normes de la IUPAC, els èters alifàtics són designats per mitjà del grup alcoxi , considerat com a substituent de la cadena més llarga , com ara metoxietà , 1-isopropoxipropà .[22] Hom també els pot designar per mitjà dels noms dels radicals i . Primer s'anteposa el nom «èter» als noms dels radicals que s'han d'ordenar per ordre alfabètic i posar el darrer en forma adjectivada. Per exemple: èter etil metílic , èter dietílic , èter etil vinílic .[23]
Hom anomena als èters simètrics o asimètrics, depenent de si els dos grups enllaçats amb l'oxigen són iguals o diferents. Els èters asimètrics també són anomenats èters mixts. L'etoxietà és un èter simètric, i el metoxietà és un èter asimètric.[24]

Els èters cíclics tenen l'oxigen com a part del seu anell; són composts heterocíclics. En cada cas, l'anell es numera començant a l'oxigen. Les regles de la IUPAC permeten que l'oxirà (sense substituents) s'anomeni òxid d'etilè o epoxietà, que l'oxolà s'anomeni tetrahidrofuran i que l'oxà s'anomeni tetrahidropiran.[23]
Moltes substàncies tenen més d’un enllaç èter. Dues, que sovint es fan servir com a dissolvents, són els dièters 1,2-dimetoxietà[25] i 1,4-dioxà.[26] També la diglima, un dissolvent d'ús comú, és un trièter.[27] Les molècules que contenen vàries funcions èter s'anomenen polièters.[24]
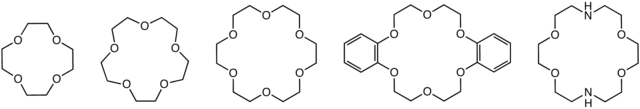
Els èters corona són un tipus de polièter cíclic que té capacitat per agafar ions metàl·lics i fer-los solubles en dissolvents orgànics.[28] Els èters corona foren obtinguts per primer cop pel químic estatunidenc Charles J. Pedersen (1904-1989) que treballava a l'empresa Du Pont de Nemours a Wilmington, Delaware, EUA, el 1967.[29] Per aquest descobriment rebé el Premi Nobel de Química el 1987. Fou Pedersen qui proposà en l'article de 1967 el nom de "composts corona" per aquests èters cíclics, ja que la seva estructura recorda la forma d'una corona. La nomenclatura de Pedersen indica el nombre d'àtoms i el nombre d'oxígens, davant i darrera, respectivament, del mot «corona», separats per guions. Per exemple: 12-corona-4, 15-corona-5.[24]
| Èter | Punt d'ebullició (℃) | Punt de fusió (℃) | Densitat a 25℃ (g cm-3) |
|---|---|---|---|
| Èter dietílic | 35 | –116 | 0,706 |
| Oxolà o THF | 65-67 | –108 | 0,889 |
| Èter tert-butil metílic | 55-56 | - | 0,74 |
| Dioxà | 100-102 | 10-12 | 1,034 |
| Èter dimetílic | 85 | –58 | 0,867 |
| Oxirà | 11 | –111 | 0,882 |
| PEG 200 | - | –50 | 1,124 (a 20℃) |
| 15-corona-5 | 93-96 (a 0,05 mmHg) | - | 1,113 (a 20℃) |
L'estructura dels èters lineals és angular, semblant a la de l'aigua o la dels alcohols. L'angle dels dos enllaços de l'oxigen val 105° a l'aigua; al metanol l'angle és de 108,5°; i a l'èter dimetílic 112°.[24]
Els seus punts de fusió i punt d'ebullició són comparables als dels hidrocarburs de massa molar semblant. Els homòlegs de quatre àtoms de carboni o menys són parcialment solubles en aigua, ja que tenen una polaritat baixa, i són miscibles amb els principals dissolvents apolars, com el cloroform i el benzè. Les propietats dels èters lineals difereixen una mica dels corresponents homòlegs cíclics, perquè són més solubles en aigua a causa de la major disponibilitat dels parells d'electrons no compartits per a formar enllaços intermoleculars mitjançant l'enllaç per pont d'hidrogen amb l'aigua. Així el dioxà i el THF són solubles en aigua en totes proporcions. Els homòlegs cíclics també tenen punts d'ebullició superiors, ja que tenen una estructura més ordenada, la qual cosa comporta una interacció intramolecular més gran per forces de van der Waals.[30]
Els èters són indiferents a la majoria dels reactius químics. Són bons dissolvents per a la majoria de les substàncies orgàniques, però dissolen molt poc els composts inorgànics. Per això els èters són uns excel·lents dissolvents d’ús comercial i de laboratori, en especial per als processos d’extracció. Atès que els derivats de l’oxigen divalent tenen parells d’electrons no compartits disponibles, actuaran com a base de Lewis. Generalment, els cations del tipus , formats per protonació d’un èter, no s’aïllen, però són freqüents en dissolució i com a intermediaris transitoris de reacció. Els èters són inerts enfront de les bases, però reaccionen en presència d’àcids. La reacció més important que experimenten és la ruptura de l'enllaç . Aquesta reacció de ruptura és catalitzada per àcids, normalment HI i, menys sovint, HBr o HCl, però en aquest cas són necessàries concentracions i temperatures més elevades. La reacció amb HI és el fonament del mètode de Zeisel per a determinar quantitativament el contingut en metoxils d’un compost.[22]
En medi àcid, dues molècules d'alcohol poden condensar-se amb eliminació d'una molècula d'aigua i formar el corresponent èter simètric. És un mètode molt emprats, però limitat als èters simètrics.[24]
En presència d'una base forta, un alcohol reacciona amb un agent alquilant (normalment un halur d'alquil) per a fornir èters diferentment substituïts.
Es pot condensar un alcohol i una olefina en presència de catalitzadors àcids. Aquesta reacció tengué una gran importància industrial abans de la prohibició de l'ús de l'èter tert-butil metílic (MTBE) per qüestions medioambientals.[31] Aquest èter se sintetitzava a partir de 2-metilpropè[32] i metanol i la seva addició, en petites quantitats, a la benzina permetia un augment de l'índex d'octà.[24]

Els èters més comuns són l'èter dietílic (conegut simplement com a èter), l'oxolà o tetrahidrofuran (THF),[33] i l'èter tert-butil metílic (MTBE). Tots aquests compostos s'usen com a dissolvents, però el MTBE s'emprà també com a additiu a les benzines sense plom. Són característics d'aquests tres èters el seu baix punt d'ebullició i la seva facilitat per a inflamar-se. Altres èters d'ús comú són el dioxà i dimetoxietà (DME),[34] que també es fan servir com a dissolvents. El fet que tinguin dos àtoms d'oxigen fa que tinguin un punt d'ebullició més alt, malgrat la seva baixa massa molecular.
Estructura dels principals èters emprats actualment en anestèsia per inhalació
C (negre), H (blanc), O (vermell), Cl (verd), F (groc verdós).Els èters també són importants en medicina i farmacologia, especialment per utilitzar-los com a anestèsics.[35] El primer que fou emprat fou l'èter etílic, conegut simplement com a èter, i que s'utilitzà per primera vegada com a anestèsic quirúrgic l'any 1842 als Estats Units pel metge Crawford W. Long (1815–1878). Com que l'èter dietílic és altament inflamable, s'ha substituït en gran part per èters halogenats menys inflamables, com l'isoflurà,[36] el desflurà,[37] el sevoflurà o el metoxiflurà,[38] que són administrats per inhalació.[39] També hom troba èters a anestèsics opioides, derivats de la morfina, com la codeïna[40] o l'oxicodona, entre d'altres.[41]

El polietilenglicol, PEG, és un èter polimèric la longitud de cadena del qual pot variar depenent de com s'ha preparat. La seva viscositat depèn de la longitud de la cadena polimèrica: com més llarg, més viscós. Els polietilenglicols (PEG) no són tòxics, generalment no són immunogènics i s'utilitzen freqüentment en moltes aplicacions biomèdiques, com ara la bioconjugació, el lliurament de fàrmacs, la funcionalització de la superfície i l'enginyeria de teixits.[42] La bioconjugació amb PEG és la conjugació covalent de dianes de fàrmacs com pèptids, proteïnes o oligonucleòtids amb PEG per a l'optimització de les propietats farmacocinètiques d'un determinat medicament. En farmacologia clínica, els PEG es poden utilitzar com a enllaçadors per a conjugats d'anticossos i fàrmacs[43] o com a recobriment superficial de nanopartícules lipídiques que facilitin el lliurament sistèmic de fàrmacs.[44] Els hidrogels PEG són xarxes de polímers tridimensionals inflades per l'aigua resistents a l'adhesió de proteïnes i a la biodegradació. Els hidrogels PEG es produeixen reticulant grups terminals PEG reactius i s'utilitzen en l'àmbit de la medicina regenerativa,[45] en procediments quirúrgics oftalmològics[46] o en neurocirurgia.[47]

Els polietilenglicols i els seus derivats es troben amb molta freqüència en preparats farmacèutics i cosmètics.[48] No són ingredients actius com a tals, sinó que s'utilitzen com a espessidors, emulgents, dissolvents, suavitzants i transportadors d'humitat. Poden ser la causa, ocasionalment, de reaccions anafilàctiques greus.[49] Els PEG s'utilitzen habitualment com a bases de crema cosmètica i es poden trobar en moltes formulacions.[50] S'ha demostrat que el PEG té propietats antimicrobianes i antiinflamatòries que són útils per tractar algunes malalties cutànies.[51]
L'oxirà o òxid d'etilè és l'èter cíclic més petit. És molt reactiu a causa de la tensió de l'anell de tres baules. S'empra com a reactiu en síntesi orgànica per a preparar compostos més complexos, o com a agent desinfectant gasós per esterilitzar material hospitalari en autoclaus.[52]
Els èters corona són polièters cíclics, usats en diverses línies d'investigació sobre vectors destinats al lliurament dirigit de medicaments.[53] Formen una subfamília d'èters molt important perquè tenen un gran capacitat de complexar diversos metalls selectivament, depenent de la grandària del cicle. Per exemple, l'èter 15-corona-5 es coordina especialment amb cations sodi(+1) ; l'èter 18-corona-6 amb cations potassi(+1) .[54]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.