热门问题
时间线
聊天
视角
锝
原子序數為43的化學元素 来自维基百科,自由的百科全书
Remove ads
在锝发现以前,德米特里·门捷列夫就已经预测了它的许多性质。在他的周期表中,门捷列夫把这种尚未发现的元素叫做“类锰”,符号为Em。1937年,锝成为第一个由人工合成而发现的元素。它的英文名来自希腊语τεχνητός,意为“人造”。
锝的短寿命同位素锝-99m具有γ放射性,广泛用于核医学。锝-99仅具有β放射性。商业上,锝的长寿命同位素是反应堆中铀-235裂变的副产物,可以从乏燃料中提取得到。锝的半衰期较短,因此1952年在寿命超过十亿年的红巨星中锝的发现证明恒星可以合成重元素。
Remove ads
历史
根据早期的元素周期律,许多研究者急于找到和命名第43号元素,其较低的原子序数似乎显示它应当比其他未知元素更容易发现。1828年,德国化学家哥特弗雷德·威尔海姆·奥桑(Gottfried Wilhelm Osann)相信他在铂矿里发现了43号元素,并命名为Polinium。但后来证明那只不过是不纯的铱。1846年,有人声称发现了元素ilmenium,但后来被证明是不纯的铌。1847年,有人说发现了新元素Pelopium,但也只是铌和钽的混合物。[6][7]
在门捷列夫的元素周期表中,元素钼(原子序为42)与钌(原子序为44)之间有一个空白。1871年,门捷列夫预言这个当时尚未发现的元素应当排在锰之下,因此与锰有相似的化学性质。门捷列夫把它叫做“类锰”。[8]
1877年,俄罗斯化学家谢尔盖·柯恩(Serge Kern)称在铂矿里发现了43号元素,并以英国化学家杭弗瑞·戴维(Sir Humphry Davy)的名字命名为Davyum,但最后发现它是铱、铑和铁的混合物。1896年发现的Lucium最后被确定为钇。1908年,日本化学家小川正孝在方钍石中发现了一种新元素,并称之为“日本素”(Nipponium)。2004年,日本有学者重新检验了小川正孝家族保留下来的方钍石样品。X-射线谱证明,该样品中不含43号元素,而是含有与其同族的75号元素铼。小川正孝可能是发现铼的第一人。[9]
1925年,德国化学家瓦尔特·诺达克、奥托·伯格和伊达·诺达克称他们发现了75号元素和43号元素,并将43号元素根据诺达克家族的发源地命名为Masurium。[10]他们用电子流轰击铌铁矿石,然后通过对X-射线波长的分析发现了新元素。[11]因该小组的发现无法重现,他们的发现没有受到广泛承认。[12][13]但直到1933年还有人把43号元素叫做Masurium。[14][15]1980年商务印书馆的《新华词典》中,将𨰾作为该元素Masurium的中文译名。至今,1925年诺达克等人是否真正发现了锝还存在争议。[15][16]
Remove ads
1936年12月,意大利巴勒莫大学的卡罗·佩里尔(Carlo Perrier)和埃米利奥·吉诺·塞戈瑞(Emilio Segrè)终于证实了43号元素的存在。[17]1936年中,塞戈瑞在美国先后访问了哥伦比亚大学和劳伦斯伯克利国家实验室。他向回旋加速器的发明者欧内斯特·劳伦斯要一些回旋加速器上带有放射性的废弃部件。于是劳伦斯寄给他了一些曾用做回旋加速器偏向板的钼箔。
塞戈瑞在同事佩里尔的协助下,用化学方法证明钼箔的放射性来源于一种原子序数为43的新元素。他们成功的分离出了锝的同位素锝-95m和锝-97。[18][19]巴勒莫大学当局希望他们把新元素以巴勒莫的拉丁文名称Panormus命名为“Panormium”。[18] 1947年,43号元素根据希腊语τεχνητός命名为锝,意为“人造”。[7][10]塞戈瑞再度访问美国。他和格伦·西奥多·西博格一起分离了锝的介稳态同位素锝-99m。现在这种同位素被广泛用于许多核医学诊断中。[20]
1952年,美国天文学者保罗·麦里尔在S-型红巨星的光谱中观察到了锝的发射谱线。[21]这些星体的年龄是锝最长寿同位素半衰期的几千倍。这意味着它们还在通过核反应产生锝。当时,恒星通过核合成产生重元素只是一个假说。此观测无疑给这一假说提供了证据。[19]近来,有观测表明重元素是在s-过程中通过中子俘获生成的。[22]
自发现以来,人们一直在搜索自然界中的锝。1962年,有人从比属刚果的沥青铀矿中分离出了锝-99。其含量极低,每公斤铀矿仅含有0.2纳克锝,[22]是铀-238自发裂变的产物。有证据表明,加蓬奥克洛天然核反应堆曾产生大量的锝-99,但在过去亿万年中已经几乎全部衰变为钌-99。[22]
性质
锝是一种银灰色放射性金属,外观与铂相似。粉状时呈灰色。纯金属锝的晶型为六方最密堆积。在原子发射光谱中,锝的特征谱线位于363.3、403.1、426.2、429.7和485.3纳米。[23]
金属锝具有顺磁性。在温度降到7.46 K时,纯金属锝的单晶成为二型超导体(type-II superconductor)。[b]在这个温度以下,锝具有很高的伦敦穿透深度,在所有金属中仅次于铌。[25]
在元素周期表中,锝处在第五周期和第七族,位于锰和铼之间。根据元素周期律,其化学性质应介于这两种元素之间。但锝比较不活泼,容易形成共价键,不易生成阳离子。这些性质上锝与锰不同,而更接近于铼。[26]锝常见的氧化数有+4、+5和+7。[27]金属锝能溶于王水、硝酸和浓硫酸,但不溶于盐酸。[28]
锝没有稳定的同位素,即所有同位素都具有放射性。在元素周期表中,锝是没有稳定同位素的元素中原子序最小的;下一个没有稳定同位素的元素是钷,其原子序数为61。[27]锝和钷是液滴模型的特例,而相邻元素(钼及钌)的稳定性也连带影响了锝的稳定性。根据马陶赫同量异位素规则,若两个在周期表上相邻的元素各有一个质量数彼此相等的同位素的话,其中一个必然会有放射性[29][30],而和锝相邻的钼与钌都有对β衰变稳定、且质量数位于照理来说锝的同位素会对β衰变稳定的质量范围内的同位素,因而造成锝没有稳定的同位素。
即使中子数为偶数,原子核中质子数为奇数的核素仍要比质子数为偶数的更不稳定。[31]因此对于原子序数(即质子数)为奇数的元素来说,一般其稳定同位素较少。而前述的锝和钷的原子序数皆为奇数,本身可能拥有的稳定同位素数量便少于相邻的偶数元素,再加上马陶赫同量异位素规则的影响,造成锝和钷可能拥有稳定同位素的质量数被相邻元素占去,因而成为原子序数小于83(铋)的元素中唯二没有稳定同位素的元素。
锝最稳定的同位素分别是锝-97(半衰期为421万年)、锝-98(半衰期为420万年)、锝-99(半衰期为21.11万年)。[1]除了上述同位素,锝还有34种同位素,质量数在86到122之间。[1]这些同位素的半衰期都不超过一个小时,锝-93(半衰期为2.73小时)、锝-94(4.88小时)、锝-95(20小时)和锝-96(4.3天)除外。[32]
比锝-98轻的锝同位素衰变时以电子俘获为主,产物是钼(原子序为42);[33]锝-98及更重的同位素衰变时则以β衰变为主,产物是钌(原子序为44)。唯一的例外是锝-100:它既可以俘获电子生成钼,也可以发生β衰变生成钌。[33][34]
锝还有很多亚稳态同位素,也称为核同质异能素。以锝-97m(97mTc;“m”代表“介稳态”)最为稳定,半衰期为91天。[32]锝-95m半衰期次之(61天)。锝-99m半衰期为6.01小时。它会释放出γ射线,转变成锝-99。[32]
锝-99是核反应堆中铀-235和钚-239裂变的主要产物之一,因此是最常见、最易得的锝同位素。一克锝-99每秒钟衰变6.2×108次(即0.62GBq/克)。[35]
Remove ads
化合物
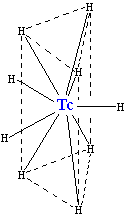
锝和氢气反应生成锝氢化物阴离子TcH2−
9,其晶体结构跟铼氢化物ReH2−
9类似。六个氢原子组成一个三棱柱,锝位于三棱柱的体心位置。另外三个氢原子位于通过中心锝原子并与上、下底面平行的平面上,和上、下底面的氢原子呈交错构象(gauche)。九个氢原子不等同,但是在电子结构上非常相似。锝在这个离子中的配位数是九。这是锝化合物的最高配位数。[36]
金属锝在潮湿空气中会渐渐失去光泽。[27]粉状锝在氧气中可以燃烧。现已制得两种锝的氧化物:TcO2和Tc2O7。锝可以被氧化成高锝酸离子TcO−
4。[35][27]
在400–450 °C,锝可以被氧化成浅黄色的七氧化二锝:
- 4 Tc + 7 O2 → 2 Tc2O7
此化合物的结构中心对称,共有两种不同的锝-氧键,键长分别为167 pm和184 pm。[37]
- Tc2O7 + 2 NaOH → 2 NaTcO4 + H2O
高锝酸可以通过Tc2O7和水或氧化性酸反应来制备。可用的酸包括硝酸、浓硫酸、王水和硝酸与盐酸的混酸。深红色的高锝酸是强酸,易吸水。和高锰酸(MnO−
4)不同,高锝酸是一种弱氧化剂。因为水溶性好,高锝酸盐是临床上常用的锝试剂和催化剂。[40]
高锝酸阴离子是正四面体结构:四个氧原子在四面体的四角,锝原子位于四面体的中心。在浓硫酸中,高锝酸会转化成八面体结构的异高锝酸(technetic(VII) acid)TcO3(OH)(H2O)2。[41]
锝有多种硫化物。锝可以和硫直接起反应生成TcS2。Tc2S7则是通过高锝酸与硫化氢的反应制备:
- 2 HTcO4 + 7 H2S → Tc2S7 + 8 H2O
在这个反应中锝(VII)被还原成四价,过量的硫生成双硫键。七硫化二锝是聚合物,结构为(Tc3(µ3–S)(S2)3S6)n,类似于钼的硫化物 Mo3(µ3–S)(S2)62–.[42]
- Tc2S7 → 2 TcS2 + 3 S

金属锝中如果有少量碳杂质,会使由部分锝由六方密堆积转变成为正交晶系结构。当含碳量超过15-17%时,转变趋于完全,生成立方晶系的碳化锝,化学式近似为Tc6C。其结构不会再随碳含量增加而变化。[45]
锝有几种已知的簇合物,包括Tc4、Tc6、Tc8和Tc13。[46][47]较稳定的Tc6和Tc8簇合物拥有棱柱型结构。垂直方向上的锝原子以三键相连接,水平方向的则以单键连接。每个锝原子有六个键,剩余价电子通过直立键同一个卤素原子,或者通过桥键与两个卤素原子相连接,比如氯和溴。[48]

锝可以形成众多的有机配合物。因为它们在核医学方面的重要性,对锝配合物的研究较为充分。羰基锝Tc2(CO)10为白色固体。[50]此化合物中,两个锝原子之间的化学键很弱,每个锝原子与五个羰基以八面体结构键合。锝-锝键键长为303 pm,[51][52]比金属锝中原子间距(272pm)长得多。和锝同族的锰和铼也可形成类似的羰基化合物。[53]
存象和生产

地壳中仅含有极微量天然锝,是铀矿自发裂变的产物。据估计,一公斤铀矿含有一纳克锝。[19][55][56]某些S型、M型和N型红巨星的吸收光谱中有锝的特征吸收。[28][57]这种红巨星被戏称为“锝星”(technetium stars)。[58]
每年大量的锝被人类从乏燃料中分离提取出来。反应堆中1克铀-235裂变可以产生27毫克锝-99,产额为6.1%。[35]如果以铀-233为燃料,锝-99产额为4.9%;如果以钚-239为燃料,锝-99产额为6.21%。[59]据估计,从1983年到1994年,人类反应堆中一共产生了78吨锝,是地球上锝最主要的来源。[60][61]其中只有一小部分用于商业用途。[c]
铀-235和钚-239的裂变都可以产生锝-99。因此,锝-99不但存在于核废料中,也存在于裂变核武器爆炸后产生的放射性落下灰中。在乏燃料贮存过程中,锝-99的放射性在104到106年之间将居主导地位。[60]据估算,1945年到1994年间大气层核试验一共向环境释放了250公斤锝。[60][63]截至1986年,人类核反应堆一共排放了1600公斤锝,主要是在乏燃料再处理过程中排放的;大部分进入海洋。随着再处理技术的发展,反应堆锝的排放逐渐减少。到2005年,最主要的排放源是英国谢拉斐尔德再处理厂(Sellafield Ltd)。据估计,1995年到1999年,该厂一共向爱尔兰海排放了900公斤锝。[61]2000年后,法律规定该厂每年只能排放140公斤锝。[64]该厂的排放导致某些海产品含有微量的锝。比如,英国坎布里亚郡西部捕获的欧洲龙虾和鱼含有1 Bq/公斤的锝。[65][66][d]
以铀或钚为燃料的核反应堆一直不停地产生介稳态核素锝-99m。但乏燃料都要经过数年冷却,到再处理的时候钼-99和锝-99m已经完全衰变了。经过钚铀提取(PUREX)之后的液料含有高浓度的锝(以TcO−
4形式存在),基本上全部是锝-99,锝-99m已经消失殆尽。[68]
绝大部分医用锝-99m是在反应堆里辐照高浓缩铀(铀-235含量超过20%)靶子,然后在再处理厂分离出钼-99,[69]最后在医院提取由钼-99衰变而生成的锝-99m。[70][71]在锝-99m制备机中,含有钼-99的钼酸(MoO2−
4)被吸附在酸性氧化铝上,装载到一个带有辐射防护屏的色谱柱中。这种机器又被称为“锝奶牛”,有时也叫做“钼奶牛”。钼-99半衰期为66小时,比较便于运输。用盐水(氯化钠水溶液)做淋洗剂,便可将含有锝-99m的高锝酸盐淋洗下来。
和从裂变产物中提取钼-99相比,通过辐照高浓缩铀的方法大大减化了化学分离的步骤。此法的缺点是需要高浓缩铀-235,会引起诸多的安全问题,比如核材料走私、核扩散等。[72][73]
世界上近三分之二的锝由两座反应堆提供:加拿大曹尔克河实验室的国家研究通用反应堆和荷兰核研究和咨询集团的帕滕反应堆。这两座反应堆建于1960年代,都已经接近退役期限。加拿大拟建的两座“多功能应用物理晶格实验”反应堆本来计划生产超过全世界总需求一倍的锝,但在2008年在试车成功后被封堆,整个计划取消。这给锝将来的供应前景带来了巨大的不确定性。[74]
2009年8月,曹尔克河实验室反应堆开始封堆维修,计划于2010年4月再次运行。2010年2月19日,帕滕反应堆开始了为期六个月的封堆维修。每年千百万人需要锝-99m,供应缺口迫使一些医生重新启用20年前的老技术。[75]令人稍感宽慰的是,波兰玛利亚研究反应堆宣布开发了一种制备锝-99m的新技术。[76]曹尔克河实验室反应堆于2010年8月重新启动.一个月后帕滕反应堆也再次运转。[77]锝-99m的供应危机暂时得以缓解。
锝-99的半衰期长,容易形成易溶于水的高锝酸盐(TcO−
4)。这些对于核废料的长期储存和处理以及减少排放不利。在再处理工厂中,许多提取和分离裂变产物的过程和工艺主要针对阳离子,比如铯-137和锶-90,类似高锝酸盐的放射性阴离子则畅通无阻。在现有的陆地埋藏方案中,最大的问题是水污染。高锝酸盐和碘离子(I−
)溶解性好,不易被土壤、岩石和矿物吸附,很有可能随水迁移。比较而言,钚、铀和铯更容易被土壤吸附。通过某些微生物活动,锝可以在一些环境富集,比如在湖底沉积物中。[78]因此,锝的环境化学是相当活跃的研究领域。[79]
还有一种处理方式是核嬗变。欧洲核子研究组织(CERN)已经证明锝-99的嬗变可行。用中子流轰击金属锝-99生成短寿命产物锝-100(半衰期为16秒),后者经过β衰变变成钌-100(稳定同位素)。这个方法对锝-99靶的纯度要求很高。如果靶中有微量锕系元素,比如镅或者锔,它们会在中子的轰击下裂变,生成具有高放射性的裂变产物。该方法还可能生成钌-106(半衰期为374天)。它的存在会延长分离钌-100之前所需要的冷却时间。[80]
从乏燃料中分离锝-99是个漫长过程。在再处理工艺中,它出现在铀和钚回收后的高放射性废液中。经过几年的冷却后,该废液的放射性下降到一定程度之后,锝-99可以用几种化学萃取方法回收,产生高纯度的金属锝。[81]
钼-98经中子活化后可生成钼-99,然后衰变成锝-99m。[82]其它锝同位素在裂变中产额较低,一般通过中子辐照前体同位素制备。比如,锝-97是用中子轰击钌-96生产。[83]
1971年,有人在医用回旋加速器用22兆电子伏特质子轰击钼-100(纯度>99.5%)靶子,通过反应100Mo(p,2n)99mTc制备锝-99m。[84]2010年代锝的短缺让人们重新审视此法。[75]使用加速器,还可以通过(n,2n)或(γ,n)反应从钼-100制备钼-99,进而得到锝-99m。[85][86][87]
应用
锝-99m半衰期较短(6.01小时),并释放出容易检测的软γ射线(140千电子伏特),因此在核医学上用于人体示踪剂。[19][35]截止2000年,含有锝-99m的常见放射性药物有31种,用于大脑、心肌、甲状腺、肺、肝、胆囊、肾、骨骼、血液等器官和肿瘤的造影和功能性研究。[88]
锝-99是一种纯β辐射源,释放出低能量β粒子。它的半衰期很长,所以辐射变化很缓慢。从放射性废物中提取的锝可以达到很高的化学纯度和同位素纯度。因此,锝-99是美国国家标准技术研究所(NIST)认证的标准β辐射源,用于仪器校准。[90]有人提议将锝-99用于光电器件和纳米级的核电池。[91]
同铼和钯类似,锝也可以作为催化剂。对某些反应,比如异丙醇脱氢反应,锝的催化活性比铼和钯高得多。但是,其放射性限制了它在催化上的应用。[92]
高锝酸钾在很低的浓度(55 ppm)就可以防止钢铁的锈蚀,甚至在250 °C仍有抗锈的能力。[93]因此,高锝酸盐可能可以用作钢铁的防锈剂。但是锝的放射性决定了锝防锈剂只能用于封闭体系。[94]铬酸盐CrO2−
4也能防锈,但其有效浓度是高锝酸钾的10倍。在一个实验中,一块碳钢被浸泡在高锝酸盐水溶液中20年仍没有锈蚀。[93]高锝酸盐防锈的机理尚不明确,但似乎是在钢铁表面形成了一层保护层。一种理论认为,高锝酸盐和钢铁的表面发生反应,生成了一薄层致密的二氧化锝,保护钢铁不受氧化。这个理论可以解释为什么铁粉能从水中吸附高锝酸离子。但当高锝酸离子浓度下降到某一最小浓度时,铁粉对该离子的吸附停止。高浓度干扰离子的存在也会抑制铁粉对高锝酸离子的吸附。[95]
如上所述,锝的放射性限制了它作为防锈剂的实际应用。有人提议把高锝酸盐用于沸水堆钢铁构件的腐蚀防护,但是此建议未获采用。[95]
锝的安全使用
在生物体内锝没有任何已知的功能。[28]锝的化学毒性似乎比较小。连续几个星期给小白鼠喂饲含有15微克/克锝的食物,其血液、体重、器官重量和进食量未观察到显著的变化。[96]锝的放射毒性取决于锝化合物组成、辐射类型和锝同位素的半衰期。[97]
使用所有锝同位素都必须谨慎。最大的健康风险是吸入带有锝同位素的灰尘,可以致肺癌。最常见的同位素锝-99释放出低能量β粒子,甚至无法贯穿实验室的玻璃器皿。因此和锝化合物接触时,手套箱基本没有必要,通风橱便可以很好的消除其危害。[98]
注释
参考资料
引用书目
参考书目
外部链接
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads



