Loading AI tools
元素週期表是依原子序數、核外電子排佈情況和化學性質的相似性來排列化學元素的表格。一如其名,元素週期表的排列展現元素性質的週期性趨勢。其中,週期表的橫行被稱作週期,縱列則被稱作族。一般而言,在同一週期內,金屬元素位於表的左端,非金屬位於右端;同族的元素則大多具有相似化學性質。週期表中有四個族具有單獨的別名,包括第1族(IA族)被稱為鹼金屬、第2族(IIA族)被稱為鹼土金屬、第17族(VIIA族)被稱為鹵素,以及第18族(VIIIA族)被稱為貴氣體。

元素週期表排列的週期性趨勢既可用於推演不同元素間性質的關係,也可用於預測未發現或新合成的元素的性質。週期表最早由俄羅斯化學家德米特里·門捷列夫在1869年發佈,主要用於表現當時已知的元素之間的週期性規律,但他也藉此基本成功預測當時尚未發現的、位於週期表空位中的元素的一部分性質。隨着新元素的發現和化學性質理論模型的健全,門捷列夫的思想也在不斷完善。現代的元素週期表不僅為分析化學反應提供有用的框架,也在其他化學領域乃至核物理學中得到廣泛應用。
自原子序數為1的元素(氫)至原子序數為118的元素(鿫,Oganesson)均已被發現或成功合成,並填滿週期表的前七個週期。[1][2]不過,在自然界中天然存在的僅有前94種元素,[a]且部分僅有痕量存在;95號及以後的元素都是在實驗室或核反應堆中合成得到的。[b][3]下一個合成的新元素將會開啟週期表的第八週期,因此大量工作都在往這方面努力,且已有理論指出可能的新元素。此外,世界各地的實驗室中也不斷有多種元素的新放射性同位素被合成出。
每種化學元素都對應一個獨有原子序數(通常記作Z),這個值即是原子核內的質子數量。[c]對大多數元素而言,同種元素的原子可以包含不同數目的中子,可互稱為同位素。例如,碳元素就有三種天然同位素,每種同位素原子都包含六個質子,但中子數量不同:絕大多數碳原子含有六個(碳-12),約1%含有七個(碳-13),極少數含有八個(碳-14)。元素週期表中對同位素不加區分。不少週期表會標出元素的原子量,但對於沒有穩定同位素的元素,則會標出半衰期最長的核種的相對原子質量,在這種情況下原子量會帶上括號。[4]
在標準的元素週期表中,元素按照原子序數遞增的順序排列。當一個新的電子殼層開始填入電子時,週期表就從下一行(即下一個週期)繼續開始排佈。縱列(族)是由原子的電子構型決定的。對於同一族中的元素,原子的某一亞層中的電子數量總是相同的。例如,氧和硒位於同一族,而它們的原子最外層的p軌態中都填入了4個電子。同族元素通常具有相似的化學性質,而在週期表的f區與d區的一部分中,整個區域的元素都有相似的化學性質。因而,如果已知與某個元素相鄰的其他元素的性質,這個元素的性質就不難猜測。[5]
截至2016年 (2016-Missing required parameter 1=month!)[update],元素週期表共有118種已確認存在的元素。其中原子序數為113、115、117、118的四種元素是最新發現的,國際純粹與應用化學聯合會(IUPAC)於2015年12月確認這些元素成功合成,並於2016年6月公佈了它們的英文名稱(同年11月確定為官方名稱),中國大陸於2017年5月公佈了其中文名。其名稱分別為鉨(寫如「釒尔」,英文名Nihonium,符號Nh)、鏌(英文名Moscovium,符號Mc)、鿬(寫如「石田」,英文名Tennessine,符號Ts)、鿫(「气」字頭下加「奧」,英文名Oganesson,符號Og)。[6][7][8][9]
前94號元素都天然存在,[a]其他的24種元素則有賴於人工合成。在94種天然元素中,83種能夠穩定存在(鉍、釷和鈾沒有穩定同位素,但有半衰期超過108年的同位素),另外11種只出現在這83種元素的衰變過程中。[3]砹(85號元素)和比鎄更重的元素(即99號以後的元素)尚未製備出宏觀數量級的純品,且鈁(87號)僅在極微量的狀態下,以光輻射的形式被觀察到過(數量僅有約30萬個原子)。[13]
週期表中的一個族指的是一個縱列(VIIIB族除外)。一般而言,與同週期、同分區的元素相比,同族元素往往具有更相似的性質,但是另一些性質與原子序數的相關性更明顯。依照現代原子結構量子力學的解釋,同族元素的價層電子通常具有相同的排佈方式,[14]因而一般具有一系列共同的化學性質,且隨着原子序數的遞增,元素的性質亦呈現出明顯有規律的變化。[15]不過在週期表的部分分區,如d區與f區,沿橫向排列的元素彼此間性質也很相似,甚至比同族元素的相似性更強。[16][17][18]
依照國際命名慣例,週期表中的族序號自左向右由1至18依次遞增。[19]此前常用的記法則是使用羅馬數字,並加標「A」或「B」表示主族(s區、p區)或副族(d區、f區)。每一族所對應的羅馬數字,正是現代使用的純數字記法的個位數。例如,第4族被記作IVB族,而第14族則是IVA族。此前歐洲通用的也是「羅馬數字+字母」這一體系,但不同的是,「A」用於表示前9列元素,「B」用於表示後9列元素。此外,第8、9、10族曾作為一整個跨三列的族(VIIIB族)而存在,但自1988年起,IUPAC已經放棄這種記法,並轉而改用一列一號的標號方式。[20]
部分族除了數字序號以外尚有其別名,不過有的別名很不常用。第3-10這8個族沒有別名,通常以族序號或族首元素指代(比如第3族也可稱作「鈧族」)。這些族沒有別名的一個原因是同族元素間的相似性較弱(相對於有別名的族而言)。[19]
通常情況下,同族元素自上而下,原子半徑遞增,電離能和電負性遞減。原子半徑的遞增是因為被填充的電子殼層越來越多,而價層電子離核越來越遠。電離能和電負性的下降亦是由於價電子與核的距離增加而導致的,因為離核越遠的電子所受的束縛越弱。[21]不過這一規則存在例外,例如第11族(I B族)的底端,電負性就反而增大。[22]

根據理化特性的不同,週期表中的元素可被分為金屬、類金屬和非金屬三類。金屬通常是具光澤的固體,電導率與熱導率較高。金屬元素彼此易形成合金,與非金屬元素之間則容易形成離子鹽類化合物(貴氣體除外)。大部分非金屬在通常狀況下則是氣體或有色固體,絕緣性較好。非金屬元素彼此間常以共價鍵結合形成化合物。金屬與非金屬間則是類金屬,具有介於二者之間的性質。[28]
金屬與非金屬可以進一步細分為多個子類。週期表中自左向右,這些子類的金屬性依次減弱,而非金屬性逐漸增強。金屬從相當活潑的鹼金屬開始逐漸向右擴展,依次經過活性較弱的鹼土金屬、內過渡金屬(鑭系與錒系元素)、典型過渡金屬,終止於物理化學活性都較弱的後過渡金屬(即貧金屬)。非金屬自左向右則依次為多原子非金屬、雙原子非金屬與單原子的貴氣體。多原子非金屬靠近類金屬區域,尚有殘餘的金屬特性,雙原子非金屬則具有典型的非金屬性,貴氣體更是幾近完全惰性。過渡金屬中還可細分出一些子類,如難熔金屬和貴金屬等較為知名的子類,[29]但在週期表中較少單獨標出。[30]
不過,僅僅依據性質的相似性來對元素分類尚有缺陷。每一個子類中,元素彼此間的性質實際上都有一定的差異,處在兩類邊界上的元素性質又較為相似,分野不夠明確。不過其它分類手段也會遇到類似的問題。[31]比方說鈹元素被歸類為鹼土金屬,但它具有貧金屬的特點,往往以共價形式參與化合,且能形成兩性氧化物。又例如,氡被歸為貴氣體,但能形成正離子,這是金屬元素的典型特性。除去理化性質以外,還有一些其它的分類標準,例如按宿主礦物分類(哥德施密特分類法(英語:Goldschmidt classification)),或按晶體結構分類。目前的分類方法最早可以上溯到1869年,當時希里斯(英語:Gustavus Detlef Hinrichs)為了對這些元素加以區分,曾建議在金屬、固態非金屬、氣態非金屬的區域之間加注邊界線。[32]


電中性原子的核外電子排佈情況隨原子序數的增長展現出一種不斷復現的規律(即所謂「週期」)。核外電子可以佔據不同的電子層(以數字標識),每個層又包含一系列亞層(以字母s、p、d、f、g等標識)。隨原子序數遞增,電子依照構造原理(即馬德隆規則,或稱能量遞增原理)逐步填入各電子層與亞層中,順序如左圖所示。以氖元素為例,其核外電子構型為1s2 2s2 2p6。其10個核外電子中,兩個最先填入第1層,而剩餘八個填入第二層。這其中,2個填入2s亞層,6個則填入2p亞層。在週期表中,一旦電子填入了一個此前從未填充過的新電子層,該元素就將作為一個新週期的起始元素而出現。目前這些起始元素包括氫和所有鹼金屬。[33][34]
由於元素性質基本由核外電子的排佈情況決定,因而元素的性質也隨原子序數增長而體現出某種週期性。典型的例子是原子半徑、電離能和電子親和能。實際上,元素週期律的提出和週期表的發明,就是基於對這些週期性規律的觀察和整理,因為彼時尚未出現與此相關的理論解釋。[33][34]

不同元素的原子半徑可以利用週期表加以預測和解釋。通常而言,沿週期方向,自左向右,原子半徑依次遞減,而沿着族的方向,自上而下,原子半徑逐漸增大。從上一個週期的貴氣體到下一週期的鹼金屬,原子半徑會突然增大。這些變化與其它的理化性質變化趨勢一樣,都可以用電子殼層填充理論解釋。它們也為量子力學理論提供了重要的支持。[35]
在鑭系元素中,4f亞層的價電子自左向右逐步增加,但它們對於同步增加的核電荷的遮蔽效果不良。因此,原子核對於鑭系元素外層電子的吸引力較強,導致鑭系元素的原子半徑偏小,即所謂的鑭系收縮。受此影響,鑭系後面的元素也有較小的原子半徑。[36]因此,鉿的原子半徑基本和鋯相同,鉭與鈮的半徑也相近,其後的元素依此類推。鑭系收縮的影響一直波及到鉑元素,此後才被惰性電子對效應(一種相對論效應)所掩蓋。[37]另外,和鑭系收縮類似,d區元素也存在着收縮效應,只不過強度更弱,它是d亞層電子對外側的p電子遮蔽不完全導致的。[36]

「第一電離能」是指從原子中移走一個電子所需要的能量,「第二電離能」是在此基礎上移走第二個電子所需的能量,依此類推。對於同一個原子,各級電離能隨着離子化程度的增加而增大,例如鎂的第一電離能是738 kJ/mol,第二電離能為1450 kJ/mol。粗略地講,這是因為越靠內的電子受到的靜電吸引作用越強,移走它所需要的能量因此也越大。一般地,越靠近週期表右端,電離能也相應地越大。[37]
當一個離子已經達到貴氣體電子排佈時,移走下一個電子的電離能將突然上升。仍以鎂元素為例,移走兩個3s電子後,鎂離子已經具有氖的電子排佈,在此基礎上移走下一個2p電子相當困難,因而第三電離能將明顯高於前兩級電離能,高達7730 kJ/mol。第三週期的其它元素中也可見這種現象。[37]

一個原子吸引共用電子對的能力稱作電負性。[38]原子的電負性與該原子的原子序數有關,同時也受價電子與核距離的影響。電負性越大,原子吸引電子(對)的能力越強。這個指標是萊納斯·鮑林於1932年提出的。[39]一般來說,在元素週期表中,自左向右,電負性依次遞增;自上而下,電負性依次遞減。因而,在電負性已知的元素中,靠近右上角的氟元素電負性最高,左下角的銫元素電負性最低[22][f]。
需要注意的是,上述規則有幾個例外。受d區收縮的影響(參見「原子半徑」一節),鎵和鍺的電負性分別高於它們上方的鋁和矽。第四週期過渡金屬的前幾個元素電負性上升得比較快,這是由3d電子對核電荷的遮蔽不完全,導致這幾個元素的原子半徑較小而引發的。[22]
元素的電負性會因為失去電子而增加。[40]這有時會造成很大的差別,例如+2氧化態的鉛的電負性為1.87,而+4氧化態的鉛則達到了2.33。[41]

原子的電子親和能是指向電中性的原子上加入一個電子,使之形成陰離子時釋放的能量。不同元素電子親和能的變化範圍較大,不過其中仍有跡可循。一般而言,非金屬的電子親和能高於金屬元素,其中氯元素的電子親和能最大。關於貴氣體的電子親和能尚無定論,因此其電子親和能可能是負的(儘管絕對值很小),也可能不是。[44]
大體上講,沿同一週期自左向右,電子親和能逐漸上升。由于越靠右端,原子的電子殼層填充得越滿,因而向其中加入一個電子後,陰離子的結構越接近穩定的閉殼層,電子親和能也相應地越高。[44]
沿同一族自上而下,電子親和能大體是逐漸下降的,因為新加入的電子離原子核越來越遠,受到的吸引越來越弱,因而釋放的能量也越來越少。不過實際上完全符合這個規律的只有第1族(I A族)——整個週期表約三分之一的元素不符合這個規律,即其電子親和能高於上方緊鄰的元素,這些例外多數情況下和d及f亞層的遮蔽效果不完全有關。[45]
橋接元素位於區與區之間。[50]這些族的元素,比如非金屬,具有臨近族元素的混合特徵。從化學性質上看,第3族元素、鈧、釔、鑭、錒都表現出了類似鹼土金屬[51](也即s區金屬[52][53])的性質,但同時也具有d區過渡金屬的物理性質。[54]位於f區末尾的镏在化學性質上的表現接近於鑭,但在物理性質上綜合了鑭與過渡金屬的特點。[55][56]作為镏類似物的鐒也可能會有類似的表現。[g]第11族裏的造幣金屬(銅、銀和金)在化學性質上的表現能等同於過渡金屬或主族金屬。[59]第12族裏的不定性金屬,如鋅、鎘、汞等有時被看作是d區到p區元素的橋接,它們表面上是d區元素,但幾乎不具有過渡金屬性質,而是更接近於相鄰第13族的p區元素。[60][61]第18族的惰性貴氣體橋接着最活潑的第17族鹵素元素與第1族的強鹼金屬。[50]
在整個週期表中,不屬於同一族的元素之間還有一些其它關係,例如對角相鄰的元素(例如鋰和鎂)之間的對角線關係。[62]當元素具有相同的價電子數時,在主族和過渡金屬之間,或早期錒系元素和早期過渡金屬之間也可以發現一些相似之處。因此鈾有點類似於6族元素中的鉻和鎢,[62]因為它們都有6個價電子。[63]
每個區塊的第一行往往表現出與其他行截然不同的屬性,因為每個區塊的第一個軌態(1s、2p、3d、4f、5g等)都比預期的要小得多。[64] 這種異常在s區塊中最強,在p區塊中中等,在d區塊和f區塊中不明顯。[62]除了s區塊以外,其它區塊的週期之間也存在奇偶差異,有時稱為次級週期性:偶數週期的元素具有較小的原子半徑並且更傾向於失去較少的電子,而奇數週期的元素(第一週期除外)則相反。因此,很多p區塊的性質是鋸齒狀的,而不是平滑的一條線。舉個例子,氮族元素中,奇數週期的磷和銻準備達到+5氧化態,而偶數週期的氮、砷和鉍則留在+3態。[62][65]

當原子核變得高度帶電時,就需要狹義相對論來衡量原子核對電子雲的影響。這些相對論效應導致重元素與其在元素週期表中的較輕同系物相比性質越來越不同。例如,相對論效應解釋了為什麼金是金色的,而汞在常溫下是液體。[66][67]預計這些影響將在第七期後期變得非常強烈,可能導致元素週期性的崩潰。[68]已知電子構型和化學性質的元素只到元素108(𨭆),因此最重元素的化學特性仍然是當前研究的主題。[69]
元素的許多其他物理性質也會按照週期律表現出週期性變化,如熔點、沸點、熔化熱、汽化熱、原子化能(英語:Atomisation energy)等。化合物也會出現類似的週期性變化,這可以通過比較氫化物、氧化物、硫化物、鹵化物等來觀察。[40]化學性質更難以定量描述,但同樣表現出其自身的週期性。例子元素及其化合物的酸性和鹼性的變化,化合物的穩定性和分離元素的方法。[35]週期性已非常廣泛地用於預測未知的新元素和新化合物的性質,並且是現代化學的核心。[70]

1789年,安托萬-洛朗·德·拉瓦節發表一個含33個化學元素的元素列表,並將它們分為氣體元素、金屬元素、非金屬元素和土元素。[71]在接下來的一個世紀,化學家們一直在尋找一個更準確的分類體系。1829年,約翰·沃爾夫岡·德貝萊納發現很多元素都可以根據他們的化學性質每三個分成一組。比如鋰、鈉、鉀三種元素就可以同時作為軟金屬和活潑金屬被分為一組。他還發現,若每組按原子量排序,第二個元素的原子量約等於第一個和第三個元素原子量之和的一半,這也被稱為德貝萊納三元素組定律(英語:Döbereiner's triads)。[72]德國化學家利奧波德·格梅林對這個理論進行研究,並在1843年證實10個三元素組、3個四元素組和1個五元素組的存在。讓-巴蒂斯特·杜馬在1857年發表文章,描述不同族金屬之間的關係。儘管很多化學家都發現元素組與組之間的關係,但他們都還沒有建立一個能涵蓋所有元素的完整體系。
1857年,德國化學家弗里德里希·奧古斯特·凱庫勒·馮·斯特拉多尼茨發現每個碳原子通常都會與四個原子相連,比如甲烷的結構為一個碳原子連着周圍的四個氫原子。[73]這個概念即是現在所稱的化合價:每個原子都與特定數目的原子相連。[74]
1862年,法國地質學家貝吉耶·德·尚古爾多阿(英語:Alexandre-Emile Béguyer de Chancourtois)發表一篇論文,當中包含一張被他稱作「地球物質螺旋」的圖表。這張圖表成為元素週期表的雛形,尚古爾多阿也因此成為第一個注意到元素週期性的人。他將元素按原子量螺旋排列在圓柱上,並發現性質相似的元素會週期性出現。他的圖表中除了化學元素,還包含一些離子和化合物。由於他的論文中使用很多地質學術語而不是化學術語,且發表時沒有附帶圖解,所以這篇論文直到門捷列夫的研究之後才得到關注。[75]
1864年,德國化學家尤利烏斯·洛塔爾·邁耶爾發表一張按化合價排列的元素表,共包含44個元素。這個表顯示有相似化學性質的元素,其化合價通常相同。[76]與此同時,英國化學家威廉·奧德林發表一個按原子量排序的元素排列,當中包含57個元素,指出元素在原子量上的週期性和他們通常的分組方式相符。[77]奧德林還提出一個關於週期律的想法,但並沒有繼續深究。[78]隨後,他在1870年提出按化合價分類元素。[79]

英國化學家約翰·紐蘭茲在1863至1866年發表一系列論文指出,當元素按照原子量排序時,擁有相似物理性質和化學性質的元素每隔七個元素出現一次。他把這個性質和音樂中的八度聯繫起來。[80][81]這個所謂的八音律(英語:Law of Octaves)遭到很多科學界同行的嘲諷,就連英國皇家化學會也拒絕發表他的論文。[82]儘管如此,紐蘭茲還是畫了元素表,並用它來預測尚未發現的元素,如鍺。[83]皇家化學會在五年後認可門捷列夫的發現時才承認紐蘭茲的重要發現。[84]
1867年,出生於丹麥的美籍化學家古斯塔夫·德特勒夫·辛里奇斯(英語:Gustavus Detlef Hinrichs)提出一個基於原子光譜、原子量和化學性質的螺旋週期體系。但當時的人們認為他的研究古怪、複雜、虛有其表,並沒有接受和承認這個理論。[85][86]

俄國化學家德米特里·門捷列夫和德國化學家尤利烏斯·洛塔爾·邁耶爾分別於1869年和1870年獨立出版他們的元素週期表。[87]門捷列夫的元素週期表是首次出版;而邁耶爾的是再版,是對1864年第一版的擴充。[88]他們都在週期表中將元素按原子量橫向或縱向排列,並在元素的化學性質開始出現重複時另起一行(列)。[89]
門捷列夫的週期表逐漸獲得廣泛的承認和接受,這源於他作出的兩個決定:其一,他在表中為未知元素留下空位[90](門捷列夫並不是第一個這樣做的化學家,但是他被認為是第一個用元素的週期性質預測未知元素的)。例如門捷列夫利用同族元素具有相似性質的特性,大膽提出未知元素的原子量、物理及化學性質等,[91]而這些元素都在隨後陸續被發現,如鎵和鍺;其二,他為了讓同族元素應具有相似性質這一特點,偶爾會刻意不跟從原子量的大小去安放元素,如碘這元素的原子量較碲為低而應在碲的前方,但碘與其他鹵素十分相似的性質讓門捷列夫刻意讓碘和碲的位置對調。[92]門捷列夫在1869年發表它的元素週期表時,雖說原子量的測量尚算精準,這些數據亦大大推動他的設計,但門捷列夫利用如元素的熱容量去比較,大膽修訂部份已發現元素的原子量,包括銦及鈰,並建議釷及鈾的原子量應增大一倍。這些後來被証實或擴充的預言令科學界廣泛承認及接受門捷列夫的週期表。[93]
在1911年盧瑟福發現原子核後,科學家發現元素的整數核電荷數與其在週期表的排名相同。1913年,亨利·莫塞萊在X射線光譜(英語:X-ray spectroscopy)實驗中證實這一發現,確定每個元素的核電荷數,並表明門捷列夫實質上是按核電荷數排序元素的。[94]原子的核電荷數等於其質子數,並決定每個元素的原子序數(Z),而原子序數可以確定一個基於整數的元素排序。莫塞萊就此預言,在鋁(Z=13)和金(Z=79)間的未知元素的原子序數應為43、61、72和75(這些元素之後都被發現)。原子序數成為確定化學元素的絕對標準,並給元素週期表的排序提供事實基礎。自此,元素週期表被用於在研究和製造新合成元素之前預測該元素的性質。[95]


1871年,門捷列夫出版新版元素週期表,把性質相似的元素排在同一縱列當中(此前版本以橫向排列),並且按照常見氧化態將幾組元素縱列標記I到VIII的編號。對於幾種他此前認為理應存在但尚未發現的元素,門捷列夫也詳細地給出了他預測的元素性質。[96]隨着科學家發現更多自然存在的元素,週期表中的空白也逐漸被填補。[97]例如元素鈁(之前被門捷列夫稱為銫下元素,eka-caesium)於1939年被法國科學家瑪格麗特·佩里發現,也是最後一個在自然界中發現的元素;[98]元素鈈於1940年合成生產,於1971年證實在自然界中微量存在。[99]
現時流行的[100]週期表佈局,也稱為通用形式或標準形式(如本文中多處所示),是由美國化學家霍勒斯·戴明(Horace Groves Deming)確定的。1923年,戴明發表簡短版本(門捷列夫式(頁面存檔備份,存於互聯網檔案館))和中等版本(18列(頁面存檔備份,存於互聯網檔案館))的週期表[101][h]。1928年,默克公司發佈戴明的中等版本的18列週期表的講義版,此版在美國的學校廣為流傳。到了1930年代,戴明的週期表已經出現在諸多化學手冊和百科全書中。薩金特-威爾奇科技公司(Sargent-Welch Scientific Company)也將此版本發行多年。[102][103][104]
隨着現代量子力學對原子內電子排佈理論的發展,科學家推論出表中每個週期(行)實際對應着電子層的電子填充。較大的原子有更多的電子亞層,因此後來的週期表需要更長的族表示元素。[105]

1945年,美國科學家格倫·西奧多·西博格提出有關於錒系元素的理論,就如鑭系元素一樣地填充f亞電子層。在這個構想之先,錒系元素被認為是對應填充第四行的d區殻層。西博格的同僚建議他不要發表這個頗為激進的理論,這或會毀掉他的前程。西博格認為自己並沒有甚麼事業生涯會遭受損害,便發表理論。這個理論後來被證實是正確的,他本人亦於1951年贏得諾貝爾化學獎,以表彰他對錒系元素合成的貢獻[106][107][i]。
儘管少量的超鈾元素會自然產生,[3]但是這類元素一開始是在實驗室中發現的,並極大地拓寬週期表的範圍。1939年,人類成功合成第一個超鈾元素:鎿。[108]由於許多超鈾元素非常不穩定且很快衰變,所以即使成功合成,探測和描述其性質就是很大的挑戰。此外,因為首個發現某元素的一方擁有對該元素的命名權,人們對某些新元素的發現順序存在爭議(英語:List of chemical elements naming controversies),需要第三方的獨立審查。[109]最新發現的一個元素是在2009年俄羅斯莫斯科州的杜布納,一個美俄聯合科學團隊聲明合成六個鿬(Tennessine, 117號元素)原子。鿬(117號元素)和鉨(113號元素)、鏌(115號元素)以及鿫(118號元素)是最新命名的四個元素,2016年11月28日,這四個新元素的命名都得到官方認可。[110]
為了慶祝元素週期表誕生150周年,聯合國將2019年設為「國際元素週期表年」,慶祝「科學史上最偉大的成就之一」。[111]
| 族→ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 電子層 | 0族電子數 | ||||||||||||||
| 週期↓ | I A | VIII A (0) | ||||||||||||||||||||||||||||||||
| 1 | 1 H 氫 1.008 |
II A | III A | IV A | V A | VI A | VII A | 2 He 氦 4.003 |
K |
2 | ||||||||||||||||||||||||
| 2 | 3 Li 鋰 6.941 |
4 Be 鈹 9.012 |
5 B 硼 10.81 |
6 C 碳 12.01 |
7 N 氮 14.01 |
8 O 氧 16.00 |
9 F 氟 19.00 |
10 Ne 氖 20.18 |
L K |
8 2 | ||||||||||||||||||||||||
| 3 | 11 Na 鈉 22.99 |
12 Mg 鎂 24.30 |
III B | IV B | V B | VI B | VII B | VIII B (VIII) 
|
I B | II B | 13 Al 鋁 26.98 |
14 Si 矽 28.09 |
15 P 磷 30.97 |
16 S 硫 32.04 |
17 Cl 氯 35.45 |
18 Ar 氬 39.95 |
M L K |
8 8 2 | ||||||||||||||||
| 4 | 19 K 鉀 39.10 |
20 Ca 鈣 40.08 |
21 Sc 鈧 44.96 |
22 Ti 鈦 47.87 |
23 V 釩 50.94 |
24 Cr 鉻 52.00 |
25 Mn 錳 54.94 |
26 Fe 鐵 55.84 |
27 Co 鈷 58.93 |
28 Ni 鎳 58.69 |
29 Cu 銅 63.55 |
30 Zn 鋅 65.38 |
31 Ga 鎵 69.72 |
32 Ge 鍺 72.63 |
33 As 砷 74.92 |
34 Se 硒 78.97 |
35 Br 溴 79.90 |
36 Kr 氪 83.80 |
N M L K |
8 18 8 2 | ||||||||||||||
| 5 | 37 Rb 銣 85.47 |
38 Sr 鍶 87.62 |
39 Y 釔 88.91 |
40 Zr 鋯 91.22 |
41 Nb 鈮 92.91 |
42 Mo 鉬 95.95 |
43 Tc 鍀 [97] |
44 Ru 釕 101.1 |
45 Rh 銠 102.9 |
46 Pd 鈀 106.4 |
47 Ag 銀 107.9 |
48 Cd 鎘 112.4 |
49 In 銦 114.8 |
50 Sn 錫 118.7 |
51 Sb 銻 121.8 |
52 Te 碲 127.6 |
53 I 碘 126.9 |
54 Xe 氙 131.3 |
O N M L K |
8 18 18 8 2 | ||||||||||||||
| 6 | 55 Cs 銫 132.9 |
56 Ba 鋇 137.3 |
57 La 鑭 138.9 |
58 Ce 鈰 140.1 |
59 Pr 鐠 140.9 |
60 Nd 釹 144.2 |
61 Pm 鉕 [145] |
62 Sm 釤 150.4 |
63 Eu 銪 152.0 |
64 Gd 釓 157.2 |
65 Tb 鋱 158.9 |
66 Dy 鏑 162.5 |
67 Ho 鈥 164.9 |
68 Er 鉺 167.3 |
69 Tm 銩 168.9 |
70 Yb 鐿 173.0 |
71 Lu 鑥 175.0 |
72 Hf 鉿 178.5 |
73 Ta 鉭 180.9 |
74 W 鎢 183.8 |
75 Re 錸 186.2 |
76 Os 鋨 190.2 |
77 Ir 銥 192.2 |
78 Pt 鉑 195.1 |
79 Au 金 197.0 |
80 Hg 汞 200.6 |
81 Tl 鉈 204.4 |
82 Pb 鉛 207.2 |
83 Bi 鉍 209.0 |
84 Po 釙 [209] |
85 At 砹 [210] |
86 Rn 氡 [222] |
P O N M L K |
8 18 32 18 8 2 |
| 7 | 87 Fr 鈁 [223] |
88 Ra 鐳 [226] |
89 Ac 錒 [227] |
90 Th 釷 232.0 |
91 Pa 鏷 231.0 |
92 U 鈾 238.0 |
93 Np 鎿 [237] |
94 Pu 鈈 [244] |
95 Am 鎇 [243] |
96 Cm 鋦 [247] |
97 Bk 錇 [247] |
98 Cf 鐦 [251] |
99 Es 鎄 [252] |
100 Fm 鐨 [257] |
101 Md 鍆 [258] |
102 No 鍩 [259] |
103 Lr 鐒 [266] |
104 Rf 鑪 [267] |
105 Db 𨧀 [268] |
106 Sg 𨭎 [267] |
107 Bh 𨨏 [270] |
108 Hs 𨭆 [271] |
109 Mt 䥑 [278] |
110 Ds 鐽 [281] |
111 Rg 錀 [282] |
112 Cn 鎶 [285] |
113 Nh 鉨 [286] |
114 Fl 鈇 [289] |
115 Mc 鏌 [290] |
116 Lv 鉝 [293] |
117 Ts 鿬 [294] |
118 Og 鿫 [294] |
Q P O N M L K |
8 18 32 32 18 8 2 |
現代週期表有時會將f區元素恢復到其自然位置(在s和d區元素之間),拓展為長式週期表(32列週期表)。與18列週期表不同的是,這樣的排列使得「遞增的原子序列不會間斷」,[113]f區元素和其他區元素的關係也會更加容易看出。[114]學者威廉·B·詹森(英語:William B. Jensen)擔心,學生們在使用現有的18列週期表時可能會將鑭系和錒系忽略掉,誤認為它們是不重要的元素,因此提倡使用32列週期表。[115]儘管有這些優點,長式週期表仍因其形狀過寬,[116]加之及化學家對(由西博格引入的)現有形式更熟悉[117]而未被廣泛使用。

包括圓形、螺旋、雙紐線、螺旋週期表等等。 本節所示的克魯克斯雙紐元素週期表包含以下相互關聯的元素:
| H | He | Li | Gl | B | C | N | O | F | Na | Mg | Al | Si | P | S |
| Cl | Ar | K | Ca | Sc | Ti | V | Cr | Mn·Fe·Ni·Co | Cu | Zn | Ga | Ge | As | Se |
| Br | Kr | Rb | Sr | Yt | Zr | Nb | Mo | Rh·Ru·Pd | Ag | Cd | In | Sn | Sb | Te |
| I | – | Cs | Ba | La | Ce | ( ) | ( ) | ( ) | ( ) | ( ) | ( ) | ( ) | ( ) | ( ) |
| ( ) | – | ( ) | ( ) | ( ) | ( ) | Ta | W | Ir·Pt·Os | ( ) | ( ) | ( ) | ( ) | ( ) | ( ) |
| – | – | – | – | – | Th | – | Ur | – | – | – | – | – | – | – |
錳與鐵、鎳和鈷的搭配後來出現在 1918 年現代馮·比肖夫斯基週期表,位於本文的非保密部分。
 |
 |
 |
元素週期律可以以多種方式呈現,經典的元素週期表只是其中一種。[122]
在1869年門捷列夫的週期表出現後的100年之中,人們出版了遠超700種週期表。[63][123]
除了數種矩形週期表外,也有不少種其他形狀結構的週期表,[j]如圓形、立方體、圓柱、建築物、螺旋形、雙扭線、[124]八角柱、金字塔錐形、球形、三角形等。這些不同版本的週期表常是為了彰顯或強調各種元素在傳統的元素週期表中不明顯的化學或物理性質而打造的。[122]

西奧多·本菲(英語:Theodor Benfey)在1960年製作的元素週期表是個廣泛傳播的螺旋形元素週期表。[126]表中的元素被安排成連續的螺旋狀,氫元素位於中央,而過渡元素、鑭系及錒系元素則位於圖中突出的「半島」部分。[127]
多數元素週期表是二維的,[3]而三維的元素週期表最早可追溯至1862年(較門捷列夫的二維週期表的1869年更早)。後來陸續出現的三維週期表有庫爾蒂納「週期表分類」(Courtines' Periodic Classification,1925年)、[128]瑞格理「分層系統」(Wringley's Lamina System,1949年)、[129] 保羅·安托萬-吉格爾(英語:Paul-Antoine Giguère)的「螺旋型週期表」(Periodic helix,1965年)[130]及「杜福爾樹狀週期表」(Dufour's Periodic Tree,1996年)。[131]甚至有人曾建立出「四維」的週期表,如蒂莫西·斯托(Timothy Stowe)的「物理學家的週期表」(Physicist's Periodic Table,1989年),[132]當中包含了三個空間維度和一個色彩維度。[133]
各式週期表可依照其更強調物理性質還是化學性質而進行歸類。[134]例如,雷那·崁漢(Rayner Canham)「不規矩」[135]的「無機化學家的元素週期表」(Inorganic Chemist's Periodic Table,2002年)着重元素的化學性質,[136]強調趨勢與規律,以及元素不尋常的化學關係與性質。強調物理性質的則有夏爾·讓內的「左階元素週期表」(Left-Step Periodic Table,1928年),其結構清楚顯示了電子填入電子層的順序和量子力學性質的緊密關係。[137]阿爾珀曾提出類似的電子亞層週期表的想法,[138]但被埃里克·塞利(英語:Eric Scerri)批評為「忽視了週期表展示物理及化學週期性的需求」。[139]而目前最常被使用,且最廣為人知的標準週期表則介於以上兩者之間,人們認為它在表達各種物理性質(如電導率和熱導率)的趨勢時更清楚,在闡釋如氧化數等可以簡單地以實驗室內常用的傳統方法推得的化學性質也簡單明了。[140]此週期表融合了其他週期表的各種特點,大小和形狀易於建構,對原子序及週期性的描述淺顯易懂,因而最為廣泛接受。[78][141]
| f1 | f2 | f3 | f4 | f5 | f6 | f7 | f8 | f9 | f10 | f11 | f12 | f13 | f14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | p1 | p2 | p3 | p4 | p5 | p6 | s1 | s2 | |
| 1s | H | He | ||||||||||||||||||||||||||||||
| 2s | Li | Be | ||||||||||||||||||||||||||||||
| 2p 3s | B | C | N | O | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4s | Al | Si | P | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3d 4p 5s | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | Rb | Sr | ||||||||||||||
| 4d 5p 6s | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | Cs | Ba | ||||||||||||||
| 4f 5d 6p 7s | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | Fr | Ra |
| 5f 6d 7p 8s | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | Uue | Ubn |
| f區 | d區 | p區 | s區 | |||||||||||||||||||||||||||||
如果單是按照氫和氦兩者的電子排佈來看,氫(電子排佈為 1s1)和氦(1s2)應分別置於鋰(1s22s1)和鈹(1s22s2)兩者之上。[26]相對於氫會較常使用這種排列方式,氦的位置卻甚少以此方式排列。原因可以追溯至1900年代:當貴氣體(惰性氣體)被首次發現時它們被稱為「第0族」,反映出當時並無發現這一族元素有任何化學反應。氦之所以會置於該族之上,是因為它確實具有此族元素的極端化學惰性。後來當這一族元素更名為「第18族」元素後,許多作者仍照舊把氦置於氖的上方,其中包括國際純化學和應用化學聯合會的週期表。[142]
氫的化學性質與第1族的鹼金屬並不相似,因此有時會把氫置於其他位置。其中一種常見的排列方式是將氫放在第17族之上[139] ,這個做法考量到了氫和其他的鹵素都傾向於處於1價的狀態,並且都具備強烈的非金屬性。有時候,氫會同時被放在第1族及第17族之上,以表示其性質分別與鹼金屬及鹵素相似之處。[143]另一個方案是將氫放在第14族之上,也就是碳的正上方,這麼做可以保持週期表中的電離能及電子親合能的遞增性,並且與電負性的趨勢也不致相差太遠,但是此方案的主要問題在於氫無法如其他第14族元素一般存在穩定的4價態。[144]最後,有些週期表將氫從各族中分開來獨立放置,因為氫與其他各族的常見性質都不完全相同。
而現時,除了依傳統把第1週期的另一個元素氦置於第18族之上以外,(如前文所指,因其的極端惰性與氖及氬十分相似[145]),有時候氦也會被獨立放置,[146]因為氦的表層軌態只有2個電子而其他貴氣體則有8個。此外依照現在的推測,氦會比氖更為活潑,這會打破第18族當中,越重的元素越活潑的趨勢(氖的電子排佈是[He]2s22p6,而氬的是[Ne]3s23p6,依此類推)。
因為歷史上鑭系元素在表中的位置一直無法確定,加上f區元素的範圍一向存在爭議。儘管鈧和釔一直都是第三族元素的前兩個,但接下來的兩個所屬元素仍有待商榷。一般認為它們是鑭和錒,但有時被認為是鑥和鐒。[147][k][l]有人聲稱這樣的爭議證明,「將週期系統分拆為明確劃分的區塊是錯誤的」。[149]第三種排列方式則將整組鑭系元素和錒系元素全部放入IIIB族。 [150]
已經有化學和物理論據提出來支持鑥和鐒要置於這兩個位置,[151][152]但大多數元素週期表製作者對此則抑或不置信,抑或不了解,[153]絕大部分活躍的化學家對此爭議毫不知情。[154]2015年12月,國際純化學和應用化學聯合會成立了一個項目,並建議那個位置要麼是鑭和錒,要麼是鑥和鐒。[155]
 鑭和錒在釔下面 |
鑭和錒通常被描述為剩餘的第3族元素。[156][m]研究指出這種佈局起源於20世紀40年代,其排列依據是元素的電子構型和區分電子的概念。銫、鋇和鑭的構型是[Xe]6s1、[Xe]6s2和[Xe]5d16s2。因此,鑭具有5d分化電子,這使其「在第3族中作為第6週期的d區的第一個成員」。[157]然後在第3族中可以看到一組一致的電子構型: 鈧 [Ar]3d14s2、釔 [Kr]4d15s2和鑭[Xe]5d16s2。還是在第六週期中,鐿的電子排佈是[Xe]4f135d16s2,而鑥為[Xe]4f145d16s2,「導致4f的電子分化,並且將鑥牢固地確定為第6週期的f-區塊的最後一個成員」。[157] 後來的電子能譜(英語:electron spectroscopy)研究發現,鐿的電子構型實際上是[Xe]4f146s2。這意味着鐿和鑥——後者為[Xe]4f145d16s2——都有14個f電子,對於鑥來說「導致d-而不是f-分化電子」,使其成為釔下第3族週期表位的鑭([Xe]5d16s2)的「同等有效候選者」。[157]鑭更適合劃分在這個位置,因為5d1電子首次在鑭中出現,而後才在鑥中第三次出現,也在釓中短暫地第二次出現。[158]
在化學行為方面,[159]以及第3族關於熔點,電負性和離子半徑等性質的趨勢,[160][161]鈧、釔、鑭和錒類似於它們的1-2族對應物。在該變體中,f區塊元素的最常見(三價)離子中的f電子的數量始終與它們在f區塊中的位置匹配。[162]例如,前三個f-區元素的三價離子的f-電子計數是Ce為1,Pr為2和Nd為3。[163]
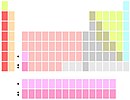 鑥和鐒在釔下面 |
在其他表格中,鑥與鐒是剩餘的第3族元素。[n]早期人們用化學方法分離鈧、釔和鑥,其理論依據是當時人們認為這些元素一起出現在所謂的「釔族」中,而鑭和錒一起出現在「鈰族」中。[157]因此,在20世紀20、30年代,一些化學家將鑥而不是鑭歸入第3族。[o]此外,20世紀50、60年代的一些物理學家將鑥的物理性質與鑭互相比較後,也認為這個位置應當屬於鑥。[157]由於鑭沒有f電子,因此一些學者反對將鑭定為f區的第一個元素。但是也有人認為,元素週期表其他的一些位置也有不合規律的排列方式,因此這個問題沒有意義——例如,釷儘管沒有f電子,但它還是f區的一部分。[164]至於鐒,其氣相原子電子構型在2015年被確認為[Rn]5f147s27p1。無論鐒是在位於f區還是d區中,都會造成週期表的元素異常排列問題。因為唯一可能適用的p區塊位置已被預留給了鉨,人們預測它的電子排佈是[Rn]5f146d107s27p1。[165][p]
在化學上,鈧,釔和鑥(可能也有鐒)表現得像1-2族金屬的三價形式。[167]另一方面,元素的熔點,電負性和離子半徑等性質下降的趨勢與4-8族相似。[157]在該變體中,f區原子的氣態形式中的f電子的數量通常與它們在f區中的位置相匹配。例如,前五個f區元素的f電子計數是La為0,Ce為1,Pr為3,Nd為4和Pm為5。[157]
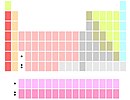 在釔下面的標記 |
一些學者將鑭系和錒系的所有30個元素都放在了釔下面的兩個位置(通常通過腳註標記)。這一排列方式強調了15種鑭系元素化學性質的相似性,規避了「具體把哪兩個元素放在釔下面」的問題,但會導致f區塊有15列寬(f區任意一行中只能有14個元素)。[q]
按照IUPAC的定義,過渡金屬(即過渡元素)是指其原子或陽離子含未充滿的d亞層的元素。 [168]此定義下,第3~11族的元素是過渡金屬,而第12族的鋅、鎘、汞和鎶不是。
部分化學家認為「d區元素」和「過渡金屬」是同義詞。按此定義,過渡金屬包括3~12列的所有元素。這時12族的元素就成了過渡金屬中的特例——他們的d電子通常並不參與成鍵。2007年,有報告稱在四氟化汞(HgF4)中,汞使用其d電子成鍵,部分人因而認為汞可被視為過渡元素。 [169] 也有人,如詹森,認為像HgF4這樣的化合物只能在極端條件下存在——實際上其存在性尚有爭議——因此汞在通常狀況下不能被合理地視為過渡元素。 [170]
還有部分化學家將第3族元素從過渡金屬的定義中排除出去,其理由是第3族元素所形成的陽離子的d亞層全是空的(而典型的過渡金屬則有部分填充),因此第3族沒有表現出過渡金屬特有的化學性質。[171]此時只有4~11族被視為過渡金屬。儘管3族元素的化學性質與典型的過渡金屬不盡相同,他們的物理性質卻較相似。(因其每個原子上有且僅有1個d電子)[54]
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 。[174]黑框標記的為172號元素的位置。 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
目前並不確定第八週期的元素是否會延續現有的週期律。西博格預計第八週期的元素會按現有規律,119號和120號兩個元素填充s區,接下來的18個元素填充g區,後面的30個元素填充現有的f區、d區和p區,第八週期在下一個貴氣體168號處結束。[175]後來,物理學家佩卡·皮克(英語:Pekka Pyykkö)等人建立了新理論,認為之後的元素不再滿足現有的構造原理。現在對172號內的元素的電子排佈有若干種互不相容的理論。不論如何,所有這些理論都預測下一個貴氣體元素並不是168號,而是172號。但所有這些多還只是推測,目前還沒有對123號後的元素的詳盡計算。[176]
現時人們還尚未確定元素數量的上限在哪裏。早在1911年,美國化學家艾略特·亞當斯(英語:Elliot Quincy Adams)就基於每個週期中元素的排佈給出了一個估計:原子質量在256以上(約相當於原子序數99~100)的元素無法存在。[177]後來有新的推測認為,元素週期表可能在穩定島後不久結束[178](所謂穩定島是指以126號元素Ubh為中心、被質子和中子滴線所限制的週期表和核種表擴展)。[179]其他關於週期表結束的預測包括: 128號(約翰·埃姆斯利)[3];137號(理查德·費曼)[180]; 146號(約根德拉·甘比爾,Yogendra Gambhir);[181]155號(艾伯特·卡贊,Albert Khazan)。[3][r]
... no interruptions in the sequence of increasing atomic numbers ...
|journal=被忽略 (幫助)K的參考文獻提供內容Click on 'Finding Aid' to go to full finding aid.
|journal=被忽略 (幫助)McGraw-Hill的參考文獻提供內容|article=被忽略 (幫助)It is high time that the idea of group 3 consisting of Sc, Y, La and Ac is abandoned
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.
