铁
原子序數為26的化學元素 来自维基百科,自由的百科全书
铁(英语:Iron),是一种化学元素,化学符号为Fe(源于拉丁语:Ferrum),原子序数为26,原子量为55.845 u,属于第一列过渡元素,位在周期表的第8族。依质量计,是在地球上占比最多的元素,为地球外核和内核的主要成分。它也是地壳中含量第四多的元素。
此条目需要补充更多来源。 (2023年1月2日) |
此条目可参照英语维基百科相应条目来扩充。 (2023年1月15日) |
地壳中的纯铁十分稀少,基本上只存在于陨石中。铁矿的蕴藏量相当丰富,但要提炼出可用的铁金属,需要可以达到1500 °C以上的窑或炉,比冶炼铜的温度还要高500 °C。仅在公元前2000年左右,人类开始在欧亚大陆导入这一制程,大约在公元前1200年,铁在某些地区开始取代铜合金,作为工具或武器,这个事件被认为是从青铜时代过渡为铁器时代,历史上的一些帝国由此技术的突破而诞生。由于其机械性能和低成本,铁合金(如钢、不锈钢和合金钢)是到目前为止仍是最常见的工业金属。
平滑的纯铁表面为如镜面般的银灰色,但生铁容易与氧和水反应,产生棕色或黑色的水合氧化铁,俗称铁锈。不同于其它金属的氧化物可以钝化金属,铁锈的体积大于原本的铁,容易剥落,露出新的表面并继续被锈蚀。虽然生铁容易反应,但电解产生的高纯铁有较好的抗腐蚀性。
一个成年人的身体含有约4公克(0.005%的体重)的铁,主要分布在血红素和肌红蛋白。这两种蛋白质在脊椎动物代谢中扮演极为重要的角色,前者负责在血液中运送氧气,而后者则承担起在肌肉中储藏氧气的责任。为了维持人体中铁的恒定及代谢,需要从饮食中摄取足量的铁。铁也是许多氧化还原酶的活性位置上的金属,其涉及细胞呼吸作用及植物和动物的氧化还原反应。[5]
在化学上,铁最常见的氧化态为二价铁离子和三价铁离子。铁具有其他过渡金属的特性,包括了其他第8族元素、钌和锇。铁可形成各种氧化态的化合物(-2到+7)。铁也可形成多种配合物,例如:二茂铁、草酸铁离子及普鲁士蓝,具有大量的工业、医学及研究应用。
物理性质
纯铁是有光泽、较软、有延展性的银白色金属,密度7.873 g/cm3,熔点为1535℃,沸点为3070℃。[6]它有很强的铁磁性,并有良好的可塑性和导热性。日常生活中的铁通常含有碳因而暴露在氧气中容易在遇到水的情况下发生电化学腐蚀,而纯度较高的铁则不易腐蚀[7]。

铁有四种已知的同素异形体,它们的名称通常表示为α、γ、δ和 ε。

前三种铁的同素异形体可以在常压下存在。当液态的铁冷却到1538 °C以下时,它会结晶成体心立方晶系的δ-铁。继续冷却到1394 °C时,它会变成面心立方晶系的γ-铁(奥氏体)。到了912 °C以下,铁又会变成体心立方晶系的α-铁。[8]
因为与地球和其它行星核心的理论相关,铁在非常高的压力和温度下的物理特性得到了广泛研究[9][10]。在约10 GPa和低温下,α-铁会转变成六方最密堆积结构的ε-铁。高温下的γ-铁也会转变成ε-铁,不过需要更高的压力。
有争议的实验证据称在50 GPa以上的压力和至少1500 K的温度下存在稳定的β相。它应该具有正交晶系或双六方最密堆积结构。[11](令人困惑的是,“β-铁”有时也用来指居里点以上,从铁磁性变为顺磁性的α-铁,但其晶体结构其实没有改变。)[12]
铁的熔点、沸点和原子化焓都低于早期的3d元素——钪到铬,显示3d电子对金属键的贡献随着原子核越来越大而被吸引而减少。[14]然而,锰的这些数据都低于铁,因为它具有半充满的3d亚电子层,因此d电子不容易离域。这个现象也出现在钌中,但没有出现在锇中。[8]
铁在低于50GPa的压力下的熔点已通过实验测量。对于更大的压力,截至2007年公布的数据仍然存在巨大的差异。[15]
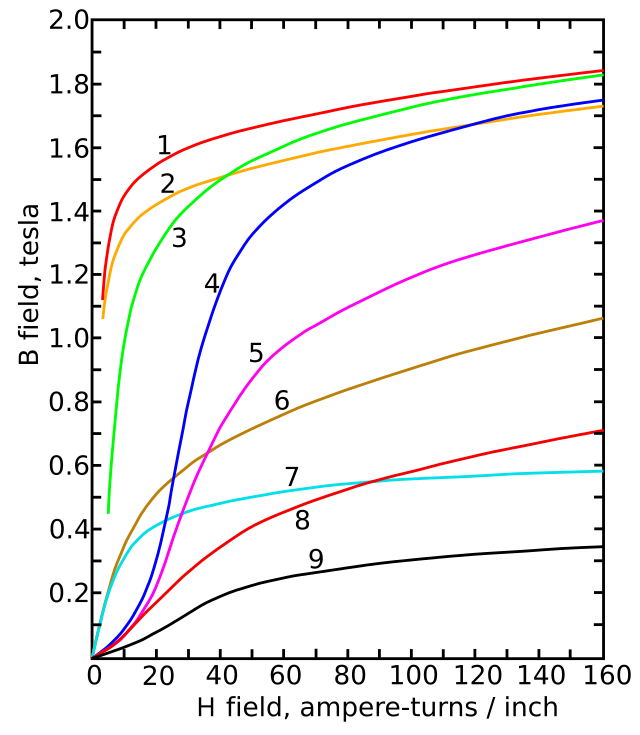
在居里点770 °C(1,420 °F;1,040 K)以下,α-铁会从顺磁性转变成铁磁性。铁原子有两个不成对电子,它们的自旋通常会和周围电子的自旋一样,产生磁场。[17]这两个电子的轨道dz2和dx2 − y2不指向晶格中的其它原子,因此不参与金属键。[12]
在没有外部磁场的情况下,铁原子会自发形成大小约10微米的磁畴。[18]磁畴中的原子的磁矩方向保持一致,但每个磁畴的磁矩方向都不一样,抵消了其它磁畴的磁场,所以大块铁的磁场几乎为零。[19]
外部磁场会使所有磁畴的磁矩指往一个方向,从而增强外部磁场。这可以用来改变物体的磁场,并在变压器、磁储存和电动机中得到应用。杂质和晶格缺陷可以使磁畴固定在那个方向,从而使铁制品移除外部磁场后仍有磁性,变成永久磁铁。[17]
铁有四种稳定同位素,分别是54Fe(丰度5.845%)、56Fe(91.754%)、57Fe(2.119%)和58Fe(0.282%)。铁除了这些稳定同位素以外还有24种人造同位素。稳定同位素中只有57Fe有自旋(−1⁄2)。54Fe理论上可以双电子捕获成54Cr,但该过程仍未被观察到,半衰期下限4.4×1020年。[20]
60Fe是有长半衰期(260万年)的绝种同位素。[21]它已经全部衰变成稳定的60Ni,所以已经不存在于地球。[22]过去关于铁同位素组成的大部分研究都集中在60Fe的核合成。质谱法的进步使我们可以检测和量化铁的稳定同位素比率的微小变化。[23]
对陨石Semarkona和Chervony Kut里的60Ni(60Fe的衰变产物)丰度和铁的稳定同位素的丰度研究表明太阳系形成时存在60Fe。在46亿年前小行星形成之后,60Fe和26Al的衰变产生的能量可能使它们重新熔化和分异。太阳系星体中的60Ni丰度可以使我们进一步了解太阳系的起源和早期历史。[24]
铁最常见的同位素56Fe因为是核合成最常见的终点,所以是核科学家感兴趣的对象。[25]因为56Ni(由14个α粒子聚变而成)可通过超新星的氦核作用 (见硅燃烧过程)合成,且再加一个α粒子产生60Zn的反应受光致蜕变抑制[26][27],所以56Ni是第三星族星核聚变的终点。半衰期六天的56Ni会被大量产生,但很快就会在超新星遗迹中先衰变成有放射性的56Co,再衰变成稳定的56Fe。这使得铁成为红巨星核心里最常见的元素,也是铁陨石和像地球这样的类地行星的核心中最常见的金属。[28]相较于其它原子量相近的元素,铁很常见。[28][29]它是宇宙中第六丰富的元素,也是最常见的耐火元素。[30]
虽然62Ni有比56Fe略高的结合能,但恒星的条件无法合成62Ni。超新星比起合成镍更倾向于合成铁,而且因为质子占比更大,使得56Fe的每个核子的平均质量低于62Ni。[31]比铁重的元素都需要超新星通过56Fe的r-过程合成。[28]
在遥远未来,如果质子不会衰变,那么量子隧穿效应会使比56Fe轻的原子核都聚变成56Fe,而比56Fe重的原子核则会通过自发裂变和α衰变衰变成56Fe。最终,所有恒星质量物体都会变成冰冷的铁球。[32]
分布

铁是地球上分布最广的金属之一,占了地壳质量的5%,位居第四,仅次于氧、硅和铝。[35]这些铁大多和各种元素化合,生成各种铁矿,其中主要的是赤铁矿(Fe2O3)、磁铁矿(Fe3O4)和菱铁矿(FeCO3)。铁也有硫化物矿物,它们在自然界中以火成岩磁黄铁矿和镍黄铁矿形式存在。[36][37]铁的硫化物和硅酸盐风化时容易分别转化成硫酸盐和碳酸氢盐,它们在水溶液中都会被氧化成三氧化二铁沉淀。[38]

条状铁层中存在大量的铁矿床,它们是在37亿年至18亿年前形成的。[39][40]
赭石等富含铁(III)氧化物或氢氧化物的材料自史前时代就被用作黄色、红色和棕色的颜料,也使岩石和粘土呈现出各种颜色。[41]铁化合物是许多历史建筑和雕塑中黄色颜料的成分。[42]火星表面著名的红色是富含氧化铁的表岩屑引起的。[43]
黄铁矿(FeS2)里虽然也有大量的铁,但因为其中的铁难以开采[44],所以黄铁矿大多用于生产硫酸。[45]铁是如此常见,以至于铁的开采通常只集中在铁含量非常高的矿石上。[46]
化学性质和化合物
铁是典型的过渡金属,可以形成多种氧化态,且有许多配合物和有机金属化合物。1950年代,铁化合物二茂铁的发现彻底改变了有机金属化学。[48]出于其丰度和在人类的技术进步中发挥的作用,铁可看作是所有过渡金属的原型。[49]
铁主要的氧化态为+2(二价铁、亚铁)和+3(三价铁)。铁也有更高的氧化态,如紫色的高铁酸钾(K2FeO4),其中铁的氧化态为+6。虽然有人声称合成出了含有+8氧化态的四氧化铁(FeO4),但该合成无法重现,而且计算表明含+8氧化态的铁的化合物不存在。[50]不过,含有+7氧化态铁的[FeO4]–已在4 K下通过红外光谱检测到。[4]铁(IV)是许多生物氧化反应的中间体。[51][52]在有机铁化合物中,铁的氧化态可以达到+1、0、−1甚至是−2。铁化合物的氧化态和成键性质可用穆斯堡尔谱评估。[53]铁也有很多混合价态化合物,它们同时含有铁(II)和铁(III),如四氧化三铁和普鲁士蓝(Fe
4(Fe[CN]
6)
3)。[52]普鲁士蓝是蓝图中蓝的来源。[54]
虽然在铁下方的8族元素钌和锇都可以达到+8氧化态,但铁不能。[12]钌在水溶液中仍有和铁类似的地方,但锇在水溶液中则以高氧化态含氧酸盐存在。[12]铁、钴和镍在室温下都有铁磁性,而且化学性质相似,因此它们有时合称为铁系元素。[49]
铁和大部分金属不同,它不会和汞形成汞齐,因此汞都是用铁烧杯交易的。[55]铁是8族元素中最活泼的元素。铁粉会自燃,易溶于稀酸中并产生Fe2+。不过,铁和浓硝酸和其它氧化性酸反应会产生氧化物钝化层,所以不会进一步反应。但仍然会和盐酸反应。[12]

| Fe2+ + 2 e− | ⇌ Fe | E0 = −0.447 V |
| Fe3+ + e− | ⇌ Fe2+ | E0 = +0.77 V |
| FeO2− 4 + 8 H+ + 3 e− |
⇌ Fe3+ + 4 H2O | E0 = +2.20 V |
红紫色的高铁酸根离子是强氧化剂,能在室温下把氨气氧化成氮气,在酸性或中性条件下甚至能氧化水:[56]
- 4 FeO2−
4 + 10 H
2O → 4 Fe3+
+ 20 OH−
+ 3 O2
Fe3+离子的阳离子化学较丰富,但其六水合离子[Fe(H
2O)
6]3+在pH大于0时极易水解:[57]
| [Fe(H 2O) 6]3+ |
⇌ [Fe(H 2O) 5(OH)]2+ + H+ |
K = 10−3.05 mol dm−3 |
| [Fe(H 2O) 5(OH)]2+ |
⇌ [Fe(H 2O) 4(OH) 2]+ + H+ |
K = 10−3.26 mol dm−3 |
| 2[Fe(H 2O) 6]3+ |
⇌ [Fe(H 2O) 4(OH)]4+ 2 + 2H+ + 2H 2O |
K = 10−2.91 mol dm−3 |
[Fe(H
2O)
6]3+在pH大于0时会变成上述的黄色水解产物,而继续升高pH至2–3时则会产生红棕色的水合氧化铁沉淀。Fe3+的水合离子都具有相当强烈的颜色,但[Fe(H
2O)
6]3+例外。[57]另一方面,淡绿色的[Fe(H
2O)
6]2+不会水解。把碳酸根加入溶液中并不会产生二氧化碳气体,而是产生白色的碳酸亚铁沉淀。在二氧化碳过量的情况下,反应会产生微溶的碳酸氢盐,但它在空气中会迅速被氧化成氧化铁,这也是许多溪流中棕色沉积物的来源。[58]
铁有多种氧化物,其中四氧化三铁(Fe3O4)和三氧化二铁(Fe2O3)较为常见。虽然氧化亚铁存在,但它在室温下不稳定。它们虽然有类似整比化合物的名字,但其实都是成分可变的非整比化合物。[59]铁最著名的硫化物是二硫化亚铁(FeS2),它在自然界中以黄铁矿和白铁矿形式存在。[52]FeS2里没有Fe4+,而是Fe2+和S2−
2离子形成的化合物。[59]另一种硫化物硫化亚铁则可以通过铁和硫直接反应而成。[60]铁溶于稀硫酸[61]或是二硫化亚铁的燃烧[62]都可以制备硫酸亚铁:
- Fe + H2SO4 → FeSO4 + H2
- 2 FeS2 + 7 O2 + 2 H2O → 2 FeSO4 + 2 H2SO4

- Fe + 2 HX → FeX2 + H2(X = F、Cl、Br、I)
铁可以和氟气、氯气或溴反应,生成对应的三卤化物,其中三氯化铁最常见。[56]
- 2 Fe + 3 X2 → 2 FeX3(X = F、Cl、Br)
因为Fe3+会氧化I−,所以碘化铁不能通过此法制备。[56]
- 2 I− + 2 Fe3+ → I2 + 2 Fe2+(E0 = +0.23 V)
碘化铁是不稳定的黑色固体,可由−20 °C时五羰基铁、碘和一氧化碳隔绝氧气和水,并在己烷和光照下反应而成。[56]碘化铁的某些配合物可由稳定存在。[63][64]


有机铁化合物是含有碳-铁键的化合物。有机铁化合物的一个例子是用作颜料的普鲁士蓝 Fe4[Fe(CN)6]3。普鲁士蓝可以由Fe2+和铁氰化钾或是Fe3+和亚铁氰化钾反应而成。[52]
五羰基铁 Fe(CO)5则是有机铁化合物的另一个例子,由铁原子和五个一氧化碳分子成键而成,可由铁和一氧化碳于150°C和175大气压下反应得到。[65]
- Fe + 5 CO → Fe(CO)5
五羰基铁的热分解会产生十二羰基三铁 Fe
3(CO)
12。四羰基铁酸二钠又称Collman试剂含有−2氧化态的铁,是有机化学试剂。二羰基环戊二烯基铁二聚物中的铁则含有罕见的+1氧化态。[66]
有机金属化学的一个里程碑是由Pauson和Kealy[67]及Miller等人[68]在1951年独立发现、不寻常稳定的夹心配合物二茂铁 Fe(C
5H
5)
2。次年,罗伯特·伯恩斯·伍德沃德和杰弗里·威尔金森[69]以及恩斯特·奥托·菲舍尔[70]也独立发现了它特别的结构。
历史
铁矿石是地壳主要组成成分之一,铁在自然界中分布极为广泛,但人类发现和利用铁却比黄金和铜要迟。首先是由于天然的单质状态的铁在地球上非常稀少,而且铁容易氧化生锈,加上铁的熔点(1812K)又比铜(1356K)高得多,使得铁比铜难于熔炼。
人类最早发现的铁是从天空落下来的陨石,陨石中含铁的百分比很高,是铁和镍、钴等金属的混合物,在融化铁矿石的方法尚未问世,人类无法大量获得生铁的时候,铁一直被视为一种带有神秘性的最珍贵的金属。
铁的发现和大规模使用,是人类发展史上的一个里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展。至今铁仍然是现代化学工业的基础,人类进步所必不可少的金属材料。

在格尔津发现了可追溯到公元前3500年,由陨铁做成的珠子。[74]这些珠子含镍7.5%,而地壳中的铁的镍杂质很少,表示它们是用陨石制造的。
当时人们认为陨铁来自天界,所以它们备受推崇,常被用来锻造武器和工具。[74]举个例子,在图坦卡蒙的陵墓中有一把由陨铁打造的匕首,其铁、钴和镍的比例与当地陨石相似。[75][76][77]埃及人使用的铁制品可追溯到公元前3000年至公元前2500年。[73]
1774年,安托万-洛朗·德·拉瓦锡通过金属铁和水蒸气生成氢气的反应演示能量守恒定律,这将化学从定性研究转变为定量研究。[79]
铁,化学符号Fe的来源是拉丁文名称Ferrum。
《说文解字》:“鐵,黑金也。从金,𢧤聲。銕,古文鐵,从夷。”
生产
单质铁的制备一般采用冶炼法。以赤铁矿(Fe2O3)和磁铁矿(Fe3O4)为原料,与焦炭和助溶剂在熔矿炉内反应,焦炭燃烧产生二氧化碳(CO2),二氧化碳与过量的焦炭接触就生成一氧化碳(CO),一氧化碳和矿石内的氧化铁作用就生成金属铁。
以上反应都是可逆反应,所产生的一氧化碳浓度越大越好,要使反应进行完全必须在800度以上进行。
在实验室里,少量纯铁可以通过用氢气还原纯氧化铁或氢氧化铁而成,或是由五羰基铁在250 °C下热分解而成。[38]它也可由氯化亚铁用铁阴极电解而成。[80]
用途
铁是用处最广泛的金属,占了全球金属生产量的90%。铁的低成本和高强度使它成为承受压力或传递力的首选材料,如机床、铁轨、汽车、船体、钢筋和建筑的承重框架。纯铁较软,因此铁通常会和其它金属混合,形成合金。[82]
生产氨的哈伯法和把一氧化碳转化成碳氢化合物的费托合成都需要铁催化剂。[83]铁粉的酸性溶液则是贝尚还原反应中把硝基苯还原成苯胺的还原剂。[84]铁催化剂在把生物质转化成燃料[85]、合成精细化学品[86][87]、燃料电池[88]以及危险化学品无害化[89][90][91][92]中发挥着至关重要的作用。
铝热剂(氧化铁和铝粉的混合物)可用于焊接铁轨。[93][94]三氯化铁用于水净化、污水处理、布料染色、动物饲料添加剂和印制电路板的蚀刻。[95]三氯化铁的乙醇溶液可以止金丝雀的血。[96]
硫酸亚铁可以生产其它铁化合物。它也用于还原水泥中的铬酸盐,对食物营养强化和治疗缺铁性贫血。硫酸铁则用于沉淀水池中的微小颗粒。氯化亚铁是絮凝剂,也是有机合成的还原剂。[95]
对生物的影响
生命需要铁。[5][97][98]可以固氮的固氮酶中含有铁硫簇。含铁蛋白质参与了氧气的运输和储存,[5]还参与了电子转移。[99]
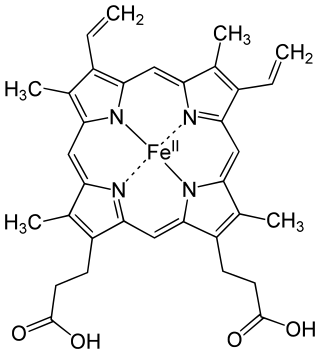
含铁蛋白质包括血红蛋白、细胞色素和过氧化氢酶。[5][100]成年人体内含约四克的铁,其中有四分之三以血红蛋白形式存在。虽然人每天只吸收了一毫克的铁,[99]但因为人体会回收血红蛋白中的铁[101],所以人体的铁含量一直保持恒定。
铁(II)的氧化或铁(III)的还原可能有助于微生物生长。[102]
富含铁的食物有红肉、牡蛎、豆类、家禽、鱼类、绿叶蔬菜、西琼脂、豆腐和糖蜜。[5]面包和谷物片有时也会特别加铁。[5][103]
铁膳食补充剂通常以延胡索酸亚铁或硫酸亚铁形式存在。[95]单质铁虽然吸收率只有硫酸亚铁的三分之一至三分之二,[104]但也常被加到谷物片和面粉中。和氨基酸螯合的铁的吸收率最高[105],因此也可作为铁补充剂。最便宜的氨基酸甘氨酸就常被用来生产甘氨酸铁补充剂。[106]
美国国家医学院在2001年发布了铁最新的估计平均需求和推荐膳食摄入量。[5]对14–18岁的女人来说,铁的估计平均需求是每天7.9毫克,到了19–50岁增加到8.1毫克,而绝经后则减少到5.0毫克。对于19岁和以上男人,他们的估计平均需求为每天6.0毫克。15–18岁的女人的铁推荐膳食摄入量为每天15.0毫克、19–50岁18.0毫克、超过50岁8.0毫克。19岁和以上的男人的铁推荐膳食摄入量都是每天8.0毫克。孕妇的铁推荐膳食摄入量是每天27毫克,而哺乳期妇女的则为每天9毫克。[5]1–3岁的儿童的铁推荐膳食摄入量为每天7毫克、4–8岁10毫克、9–13岁8毫克。出于安全原因,当证据充足时,美国国家医学院也会给营养素设定可耐受最高摄入量。铁的可耐受最高摄入量为每天45毫克。这些值都是参考膳食摄入量。[107]
缺铁是世界上最常见的营养不良。[5][110][111][112]如果缺少的铁没有通过饮食补充,就会导致潜伏性缺铁,之后会更进一步导致缺铁性贫血。[113]儿童、停经前期的女人和饮食不当的人最容易患此病。虽然大多数缺铁性贫血病例轻微,但如果不治疗,就会造成心跳加快或不规律、妊娠并发症以及婴儿和儿童生长迟缓等问题。[114]
参见
参考文献
参考书目
外部链接
延伸阅读
Wikiwand - on
Seamless Wikipedia browsing. On steroids.












