Loading AI tools
совокупность правил, согласно которым в живых клетках последовательность нуклеотидов переводится в последовательность аминокислот (бело Из Википедии, свободной энциклопедии
Генети́ческий код (англ. Genetic code) — совокупность правил, согласно которым в живых клетках последовательность кодонов (генов и мРНК) переводится в последовательность аминокислот (белков). Собственно перевод (трансляцию) осуществляет рибосома, которая соединяет аминокислоты в цепочку согласно инструкции, записанной в кодонах мРНК. Соответствующие аминокислоты доставляются в рибосому молекулами тРНК. Генетический код всех живых организмов Земли един (имеются лишь незначительные вариации), что свидетельствует о наличии общего предка.
Схема генетического кода
Правила генетического кода определяют, какой аминокислоте соответствует триплет (три подряд идущих нуклеотида) в мРНК. За редкими исключениями[1], каждому кодону соответствует только одна аминокислота. Конкретная аминокислота может кодироваться более чем одним кодоном, есть также кодоны, означающие начало и конец белка. Вариант генетического кода, который используется подавляющим большинством живых организмов, называют стандартным, или каноническим, генетическим кодом. Однако известно несколько десятков исключений из стандартного генетического кода, например, при трансляции в митохондриях используются несколько изменённые правила генетического кода.
Простейшим представлением генетического кода может служить таблица из 64 ячеек, в которой каждая ячейка соответствует одному из 64 возможных кодонов[2].

Попытки понять, каким образом последовательность ДНК кодирует аминокислотную последовательность белков, начали предприниматься почти сразу же после того, как в 1953 году была установлена структура ДНК (двойная спираль). Георгий Гамов предположил, что кодоны должны состоять из трёх нуклеотидов, чтобы кодонов хватило для всех 20 аминокислот (всего же возможно 64 различных кодона из трёх нуклеотидов: на каждую из трёх позиций можно поставить один из четырёх нуклеотидов)[3].
В 1961 году триплетность генетического кода удалось подтвердить экспериментально. В том же году Маршалл Ниренберг и его коллега Генрих Маттеи[англ.] использовали бесклеточную систему для трансляции in vitro. В качестве матрицы был взят олигонуклеотид, состоящий из остатков урацила (UUUU…). Пептид, синтезированный с него, содержал только аминокислоту фенилаланин[4]. Так впервые было установлено значение кодона: кодон UUU кодирует фенилаланин. Дальнейшие правила соответствия между кодонами и аминокислотами были установлены в лаборатории Северо Очоа. Было показано, что полиадениновая РНК (ААА…) транслируется в полилизиновый пептид[5], а на матрице полицитозиновой РНК (ССС…) синтезируется пептид, состоящий только из остатков пролина[6]. Значение остальных кодонов было установлено при помощи разнообразных сополимеров в ходе экспериментов, проведённых в лаборатории Хара Гобинда Кораны. Вскоре после этого Роберт Холли установил структуру молекулы тРНК, которая служит посредником при трансляции. В 1968 году Ниренберг, Корана и Холли были удостоены Нобелевской премии по физиологии и медицине[7].
После установления правил генетического кода многие учёные занялись его искусственными преобразованиями[англ.]. Так, начиная с 2001 года в генетический код были внедрены 40 аминокислот, которые в природе не входят в состав белков. Для каждой аминокислоты создавались свой кодон и соответствующая аминоацил-тРНК-синтетаза. Искусственное расширение генетического кода и создание белков с новыми аминокислотами могут помочь глубже изучить структуру белковых молекул, а также получить искусственные белки с заданными свойствами[8][9]. Х. Мураками и М. Сисидо смогли превратить некоторые кодоны из трёхнуклеотидных в четырёх- и пятинуклеотидные. Стивен Бреннер получил 65-й кодон, который был функционален in vivo[10].
В 2015 году у бактерии Escherichia coli удалось изменить значение всех кодонов UGG с триптофана на тиенопиррол-аланин, не встречающийся в природе[11]. В 2016 году был получен первый полусинтетический организм — бактерия, геном которой содержал два искусственных азотистых основания (X и Y), сохраняющихся при делении[12][13]. В 2017 году исследователи из Южной Кореи заявили о создании мыши с расширенным генетическим кодом, способной синтезировать белки с аминокислотами, не встречающимися в природе[14].
Выделяют следующие свойства генетического кода, также называемые принципами трансляции:
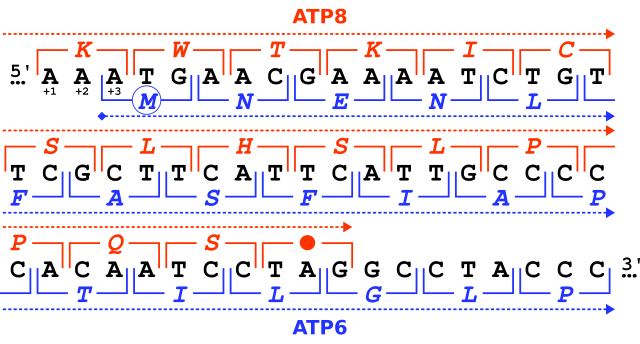
Гены кодируются в направлении 5'→3' нуклеотидной последовательности[15]. Рамка считывания определяется самым первым триплетом, с которого начинается трансляция. Последовательность неперекрывающихся кодонов, начинающуюся со старт-кодона и заканчивающуюся стоп-кодоном, называют открытой рамкой считывания. Например, последовательность 5'-AAATGAACG-3' (см. рис.) при чтении с первого нуклеотида разбивается на кодоны AAA, TGA и ACG. Если чтение начинается со второго нуклеотида, то ей соответствуют кодоны AAT и GAA. Наконец, при чтении с третьего нуклеотида используются кодоны ATG и AAC. Таким образом, любую последовательность можно прочесть в направлении 5' → 3' тремя разными способами (с тремя разными рамками считывания), причём в каждом случае последовательность белкового продукта будет отличаться из-за распознавания рибосомой разных кодонов. Если учесть, что ДНК имеет двуцепочечную структуру, то возможны 6 рамок считывания: три на одной цепи и три на другой[16]. Однако считывание генов с ДНК не является случайным. Все другие рамки считывания в пределах одного гена обычно содержат многочисленные стоп-кодоны, чтобы быстро остановить и уменьшить метаболическую стоимость неправильного синтеза[17].
Трансляция информации с последовательности мРНК в аминокислотную последовательность начинается с так называемого старт-кодона — как правило, AUG, причём у эукариот он читается как метионин, а у бактерий — как формилметионин. Одного старт-кодона недостаточно для запуска трансляции; для него необходимы факторы инициации трансляции, а также особые элементы в соседних последовательностях, например, последовательность Шайна — Дальгарно у бактерий. У некоторых организмов в роли старт-кодонов используются кодоны GUG, который в норме кодирует валин, и UUG, который в стандартном коде соответствует лейцину[18].
После инициационного кодона трансляция продолжается через последовательное считывание кодонов и присоединение аминокислот друг к другу рибосомой до достижения сигнала к прекращению трансляции — стоп-кодона. Существуют три стоп-кодона, каждый из которых имеет своё название: UAG (янтарь), UGA (опал) и UAA (охра). Стоп-кодоны также называют терминаторными. В клетках нет тРНК, соответствующих стоп-кодонам, поэтому, когда рибосома доходит до стоп-кодона, вместо тРНК с ним взаимодействуют факторы терминации трансляции, которые гидролизуют последнюю тРНК от аминокислотной цепочки, а затем заставляют рибосому диссоциировать[19]. У бактерий в терминации трансляции принимают участие три белковых фактора[англ.]: RF-1, RF-2 и RF-3: RF-1 узнаёт кодоны UAG и UAA, а RF-2 распознаёт UAA и UGA. Фактор RF-3 выполняет вспомогательную работу. Трёхмерная структура RF-1 и RF-2 напоминает формой и распределением заряда тРНК и, таким образом, представляет собой пример молекулярной мимикрии[англ.][20]. У эукариот фактор терминации трансляции eRF1 распознаёт все три стоп-кодона. Зависимая от рибосомы ГТФаза eRF3, которую рассматривают как второй фактор терминации трансляции эукариот, помогает eRF1 в высвобождении с рибосомы готового полипептида[21][22][23].
Распределение стоп-кодонов в геноме организма неслучайно и может быть связано с GC-составом генома[24][25]. Например, у штамма E. coli K-12 в геноме имеется 2705 кодонов TAA (63 %), 1257 TGA (29 %) и 326 TAG (8 %) при GC-составе 50,8 %[26]. Масштабное исследование геномов разных видов бактерий показало, что доля кодона TAA положительно коррелирует с GC-составом, а доля TGA — отрицательно. Частота самого редко используемого стоп-кодона, TAG, не связана с GC-составом[27]. Сила стоп-кодонов также неодинакова. Спонтанный обрыв трансляции чаще всего происходит на кодоне UGA, а на UAA — реже всего[23].
Помимо собственно стоп-кодона, важнейшее значение для терминации трансляции имеет его окружение. Наиболее велика роль нуклеотида, расположенного сразу за стоп-кодоном (+4). Вероятно, нуклеотид +4 и другие нуклеотиды, следующие за ним, влияют на терминацию трансляции, обеспечивая сайты связывания факторов терминации трансляции. По этой причине некоторые исследователи предлагают рассматривать четырёхнуклеотидный стоп-сигнал вместо трёхнуклеотидного стоп-кодона. Нуклеотиды, расположенные выше стоп-кодонов, также влияют на трансляцию. Например, для дрожжей было показано, что аденин, располагающийся на 2 позиции выше первого нуклеотида стоп-кодона, стимулирует обрыв трансляции на стоп-кодоне UAG (возможно, и на остальных кодонах)[23].
Иногда стоп-кодоны выступают в роли смысловых. Например, кодон UGA кодирует нестандартную аминокислоту селеноцистеин, если рядом с ним в транскрипте находится так называемый SECIS-элемент[28]. Стоп-кодон UAG может кодировать другую нестандартную аминокислоту — пирролизин. Иногда стоп-кодон распознаётся как смысловой при мутациях, затрагивающих тРНК. Наиболее часто это явление наблюдается у вирусов, но оно также описано у бактерий, дрожжей, дрозофилы и человека, у которых играет регуляторную роль[29][30].
В ходе репликации ДНК изредка возникают ошибки при синтезе дочерней цепи. Эти ошибки, называемые мутациями, могут повлиять на фенотип организма, особенно если они затрагивают кодирующую область гена. Ошибки происходят с частотой 1 на каждые 10—100 миллионов пар оснований (п. о.), так как ДНК-полимеразы могут эффективно исправлять свои ошибки[31][32].
Под точечными мутациями понимают единичные замены одного азотистого основания. Если новое основание относится к тому же классу, что и исходное (оба пурины или оба пиримидины), то мутацию относят к транзициям. Если происходит замена пурина на пиримидин или пиримидина на пурин, то говорят о трансверсиях. Транзиции встречаются чаще трансверсий[33]. Примерами точечных мутаций являются миссенс- и нонсенс-мутации. Они могут вызывать такие заболевания, как серповидноклеточная анемия и талассемия соответственно[34][35]. Клинически значимые миссенс-мутации приводят к замене аминокислотного остатка на остаток с другими физико-химическими свойствами, а нонсенс-мутации заключаются в появлении преждевременного стоп-кодона[16].
Мутации, при которых нарушается правильная рамка считывания из-за вставок и делеций (в совокупности они называются инделами[англ.]), содержащих некратное трём число нуклеотидов, называются мутациями сдвига рамки считывания. При этих мутациях белковый продукт получается совершенно иной, чем в диком типе. Как правило, при сдвигах рамки считывания появляются преждевременные стоп-кодоны, которые вызывают образование усечённых белков[36]. Поскольку эти мутации значительно нарушают функцию белка, они довольно редко закрепляются отбором: нередко отсутствие белка приводит к гибели организма ещё до рождения[37]. Мутации сдвига рамки считывания связаны с такими заболеваниями, как болезнь Тея — Сакса[38].
Хотя подавляющее число мутаций вредно или нейтрально[англ.], некоторые оказываются полезными[39]. Они могут давать организму лучшую приспособленность по сравнению с диким типом к определённым условиям окружающей среды или дают ему возможность размножаться быстрее особей дикого типа. В этом случае мутация будет постепенно распространяться в популяции в ходе нейтрального отбора[40]. Вирусы, геномы которых представлены РНК, мутируют очень быстро[41], что нередко приносит им пользу, потому что иммунная система, эффективно распознающая одни варианты вирусных антигенов, оказывается бессильна против слегка изменённых[42]. В больших популяциях организмов, размножающихся бесполым путём, например, E. coli, одновременно может происходить несколько полезных мутаций. Этот феномен получил название клональной интерференции[англ.] и вызывает конкуренцию между мутациями[43].

Способность разных кодонов кодировать одну аминокислоту называется вырожденностью кода. Впервые генетический код назвали вырожденным[англ.] Ниренберг и Бернфилд. Однако, несмотря на вырожденность, в генетическом коде полностью отсутствует двусмысленность. Например, кодоны GAA и GAG оба кодируют глутамат, но ни один из них не кодирует одновременно ещё какую-то аминокислоту. Кодоны, соответствующие одной аминокислоте, могут различаться по любым позициям, однако чаще всего две первые позиции у таких кодонов совпадают, а различается только последняя. Благодаря этому мутация, затронувшая третью позицию кодона, скорее всего, не скажется на белковом продукте[44].
Эта особенность может быть объяснена гипотезой неоднозначной пары оснований, предложенной Франсисом Криком. Согласно этой гипотезе, третий нуклеотид в кодоне ДНК может быть не полностью комплементарен антикодону тРНК для компенсации несоответствия числа типов тРНК числу кодонов[45][46].
Кодоны близких по физико-химическим свойствам аминокислот также нередко похожи, благодаря чему мутации не приводят к значительным нарушениям белковой структуры. Так, кодоны NUN (N — любой нуклеотид) обычно кодируют гидрофобные аминокислоты. NCN кодируют маленькие аминокислоты с умеренной гидрофобностью, а NAN кодируют гидрофильные аминокислоты среднего размера. Генетический код устроен настолько оптимально с точки зрения гидрофобности, что математический анализ при помощи сингулярного разложения 12 переменных (4 нуклеотида на 3 позиции) даёт значимую корреляцию (0,95) для предсказания гидрофобности аминокислоты по её кодону[47]. На восемь аминокислот мутации по третьим позициям не влияют вообще, а мутации по второй позиции, как правило, приводят к замене на аминокислоту с совершенно другими физико-химическими свойствами. Однако наибольшее влияние на белковый продукт имеют мутации по первым позициям. Так, мутации, приводящие к замене заряженной аминокислоты на аминокислоту с противоположным зарядом, могут затрагивать только первую позицию, а вторую — никогда. Такая замена заряда, вероятнее всего, окажет сильный эффект на структуру белка[48].
В таблице ниже представлен генетический код, общий для большинства про- и эукариот. В таблице приведены все 64 кодона и указаны соответствующие аминокислоты. Порядок оснований — от 5'- к 3'-концу мРНК. Приведены трёхбуквенные и однобуквенные обозначения аминокислот.
| неполярный | полярный | основный | кислотный | (стоп-кодон) |
| 1-е основание |
2-е основание | 3-е основание | |||||||
|---|---|---|---|---|---|---|---|---|---|
| U | C | A | G | ||||||
| U | UUU | (Phe/F) Фенилаланин | UCU | (Ser/S) Серин | UAU | (Tyr/Y) Тирозин | UGU | (Cys/C) Цистеин | U |
| UUC | UCC | UAC | UGC | C | |||||
| UUA | (Leu/L) Лейцин | UCA | UAA | Стоп (охра)[B] | UGA | Стоп (опал)[B] | A | ||
| UUG[A] | UCG | UAG | Стоп (янтарь)[B] | UGG | (Trp/W) Триптофан | G | |||
| C | CUU | CCU | (Pro/P) Пролин | CAU | (His/H) Гистидин | CGU | (Arg/R) Аргинин | U | |
| CUC | CCC | CAC | CGC | C | |||||
| CUA | CCA | CAA | (Gln/Q) Глутамин | CGA | A | ||||
| CUG[A] | CCG | CAG | CGG | G | |||||
| A | AUU | (Ile/I) Изолейцин | ACU | (Thr/T) Треонин | AAU | (Asn/N) Аспарагин | AGU | (Ser/S) Серин | U |
| AUC | ACC | AAC | AGC | C | |||||
| AUA | ACA | AAA | (Lys/K) Лизин | AGA | (Arg/R) Аргинин | A | |||
| AUG[A] | (Met/M) Метионин | ACG | AAG | AGG | G | ||||
| G | GUU | (Val/V) Валин | GCU | (Ala/A) Аланин | GAU | (Asp/D) Аспарагиновая кислота | GGU | (Gly/G) Глицин | U |
| GUC | GCC | GAC | GGC | C | |||||
| GUA | GCA | GAA | (Glu/E) Глутаминовая кислота | GGA | A | ||||
| GUG | GCG | GAG | GGG | G | |||||
| Ala/A | GCU, GCC, GCA, GCG | Leu/L | UUA, UUG, CUU, CUC, CUA, CUG |
|---|---|---|---|
| Arg/R | CGU, CGC, CGA, CGG, AGA, AGG | Lys/K | AAA, AAG |
| Asn/N | AAU, AAC | Met/M | AUG |
| Asp/D | GAU, GAC | Phe/F | UUU, UUC |
| Cys/C | UGU, UGC | Pro/P | CCU, CCC, CCA, CCG |
| Gln/Q | CAA, CAG | Ser/S | UCU, UCC, UCA, UCG, AGU, AGC |
| Glu/E | GAA, GAG | Thr/T | ACU, ACC, ACA, ACG |
| Gly/G | GGU, GGC, GGA, GGG | Trp/W | UGG |
| His/H | CAU, CAC | Tyr/Y | UAU, UAC |
| Ile/I | AUU, AUC, AUA | Val/V | GUU, GUC, GUA, GUG |
| START | AUG | STOP | UAG, UGA, UAA |
В некоторых белках нестандартные аминокислоты кодируются стоп-кодонами в зависимости от наличия особой сигнальной последовательности в мРНК. Например, стоп-кодон UGA может кодировать селеноцистеин, а UAG — пирролизин. Селеноцистеин и пирролизин рассматривают как 21-ю и 22-ю протеиногенную аминокислоту соответственно. В отличие от селеноцистеина, у пирролизина есть собственная аминоацил-тРНК-синтетаза[51]. Хотя обычно генетический код, используемый клетками одного организма, фиксирован, архея Acetohalobium arabaticum[англ.] может переключаться с 20-аминокислотного кода на 21-аминокислотный (включая пирролизин) при разных условиях роста[52].

Существование отклонений от стандартного генетического кода предсказывалось ещё в 1970-х[53]. Первое отклонение было описано в 1979 году в митохондриях человека[54]. Впоследствии было описано ещё несколько альтернативных генетических кодов, слегка отличающихся от стандартного, в том числе альтернативные митохондриальные коды[55].
Например, у бактерий рода Mycoplasma стоп-кодон UGA кодирует триптофан, а у дрожжей из так называемой «CTG-клады» (в том числе патогенного вида Candida albicans) кодон CUG кодирует серин, а не лейцин, как в стандартном генетическом коде[56][57][58]. Поскольку вирусы используют тот же генетический код, что и клетки-хозяева, отклонения от стандартного генетического кода могут нарушить размножение вирусов[59]. Впрочем, некоторые вирусы, например, вирусы рода Totivirus[англ.], используют тот же альтернативный генетический код, что и организм-хозяин[60].
У бактерий и архей GUG и UUG нередко выступают старт-кодонами[61]. Некоторые отклонения от стандартного генетического кода есть и в ядерном геноме человека: так, в 4 % мРНК фермента малатдегидрогеназы один из стоп-кодонов кодирует триптофан или аргинин[62]. Значение стоп-кодона зависит от его окружения[30]. Отклонения в генетическом коде организма можно обнаружить, если найти в его геноме очень консервативные гены и сравнить их кодоны с соответствующими аминокислотами гомологичных белков близкородственных организмов. По такому принципу работает программа FACIL, которая рассчитывает, с какой частотой каждый кодон соответствует той или иной аминокислоте, а также определяет поддержку стоп-кодона и представляет результат в виде логотипа (LOGO)[63]. Впрочем, несмотря на все перечисленные отличия, генетические коды, используемые всеми организмами, в общих чертах схожи[64].
В таблице ниже перечислены известные на данный момент нестандартные генетические коды[65][66]. Насчитывают 23 нестандартных генетических кода, причём наиболее частым отличием от стандартного генетического кода является превращение стоп-кодона UGA в смысловой, кодирующий триптофан[67].
| Код | Таблица трансляции |
ДНК-кодон | РНК-кодон | Трансляция с данным кодом |
Стандартная трансляция | Примечания | ||
|---|---|---|---|---|---|---|---|---|
| Стандартный[англ.] | 1 | Включает таблицу трансляции 8 (хлоропласты растений) | ||||||
| Митохондриальный код позвоночных | 2 | AGA | AGA | Ter (*) | Arg (R) | |||
| AGG | AGG | Ter (*) | Arg (R) | |||||
| ATA | AUA | Met (M) | Ile (I) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Митохондриальный генетический код дрожжей[англ.] | 3 | ATA | AUA | Met (M) | Ile (I) | |||
| CTT | CUU | Thr (T) | Leu (L) | |||||
| CTC | CUC | Thr (T) | Leu (L) | |||||
| CTA | CUA | Thr (T) | Leu (L) | |||||
| CTG | CUG | Thr (T) | Leu (L) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| CGA | CGA | absent | Arg (R) | |||||
| CGC | CGC | absent | Arg (R) | |||||
| Митохондриальный генетический код слизевиков, простейших, стрекающих и генетический код Mycoplasma и Spiroplasma[англ.] | 4 | TGA | UGA | Trp (W) | Ter (*) | Включает таблицу трансляции 7 (кинетопласт) | ||
| Митохондриальный код беспозвоночных[англ.] | 5 | AGA | AGA | Ser (S) | Arg (R) | |||
| AGG | AGG | Ser (S) | Arg (R) | |||||
| ATA | AUA | Met (M) | Ile (I) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Генетический код инфузорий, Dasycladacea и Hexamita[англ.] | 6 | TAA | UAA | Gln (Q) | Ter (*) | |||
| TAG | UAG | Gln (Q) | Ter (*) | |||||
| Митохондриальный генетический код иглокожих и плоских червей[англ.] | 9 | AAA | AAA | Asn (N) | Lys (K) | |||
| AGA | AGA | Ser (S) | Arg (R) | |||||
| AGG | AGG | Ser (S) | Arg (R) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Генетический код Euplotidae[англ.] | 10 | TGA | UGA | Cys (C) | Ter (*) | |||
| Генетический код бактерий, архей и пластид растений[англ.] | 11 | См. таблицу трансляции 1 | ||||||
| Альтернативный генетический код дрожжей[англ.] | 12 | CTG | CUG | Ser (S) | Leu (L) | |||
| Митохондриальный генетический код асцидий[англ.] | 13 | AGA | AGA | Gly (G) | Arg (R) | |||
| AGG | AGG | Gly (G) | Arg (R) | |||||
| ATA | AUA | Met (M) | Ile (I) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Альтернативный митохондриальный генетический код плоских червей[англ.] | 14 | AAA | AAA | Asn (N) | Lys (K) | |||
| AGA | AGA | Ser (S) | Arg (R) | |||||
| AGG | AGG | Ser (S) | Arg (R) | |||||
| TAA | UAA | Tyr (Y) | Ter (*) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Генетический код Blepharisma[англ.] | 15 | TAG | UAG | Gln (Q) | Ter (*) | |||
| Митохондриальный генетический код хлорофициевых[англ.] | 16 | TAG | UAG | Leu (L) | Ter (*) | |||
| Митохондриальный генетический код трематод[англ.] | 21 | TGA | UGA | Trp (W) | Ter (*) | |||
| ATA | AUA | Met (M) | Ile (I) | |||||
| AGA | AGA | Ser (S) | Arg (R) | |||||
| AGG | AGG | Ser (S) | Arg (R) | |||||
| AAA | AAA | Asn (N) | Lys (K) | |||||
| Митохондриальный генетический код Scenedesmus obliquus[англ.] | 22 | TCA | UCA | Ter (*) | Ser (S) | |||
| TAG | UAG | Leu (L) | Ter (*) | |||||
| Митохондриальный генетический код Thraustochytrium[англ.] | 23 | TTA | UUA | Ter (*) | Leu (L) | Сходна с таблицей трансляции 11. | ||
| Митохондриальный генетический код крыложаберных[англ.] | 24 | AGA | AGA | Ser (S) | Arg (R) | |||
| AGG | AGG | Lys (K) | Arg (R) | |||||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Генетический код возможных групп SR1 и Gracilibacteria[англ.] | 25 | TGA | UGA | Gly (G) | Ter (*) | |||
| Генетический код Pachysolen tannophilus[англ.] | 26 | CTG | CUG | Ala (A) | Leu (L) | |||
| Генетический код Karyorelictea[англ.] | 27 | TAA | UAA | Gln (Q) | Ter (*) | |||
| TAG | UAG | Gln (Q) | Ter (*) | |||||
| TGA | UGA | Ter (*) | или | Trp (W) | Ter (*) | |||
| Генетический код Condylostoma[англ.] | 28 | TAA | UAA | Ter (*) | или | Gln (Q) | Ter (*) | |
| TAG | UAG | Ter (*) | или | Gln (Q) | Ter (*) | |||
| TGA | UGA | Ter (*) | или | Trp (W) | Ter (*) | |||
| Генетический код Mesodinium[англ.] | 29 | TAA | UAA | Tyr (Y) | Ter (*) | |||
| TAG | UAG | Tyr (Y) | Ter (*) | |||||
| Генетический код Peritrichia[англ.] | 30 | TAA | UAA | Glu (E) | Ter (*) | |||
| TAG | UAG | Glu (E) | Ter (*) | |||||
| Генетический код Blastocrithidia[англ.] | 31 | TAA | UAA | Ter (*) | или | Gln (Q) | Ter (*) | |
| TAG | UAG | Ter (*) | или | Gln (Q) | Ter (*) | |||
| TGA | UGA | Trp (W) | Ter (*) | |||||
| Биохимические свойства аминокислот | неполярная | полярная | основная | кислая | Терминация: стоп-кодон |
В геномах многих организмов наблюдается так называемое предпочтение кодонов, то есть частота встречаемости всех синонимичных кодонов, соответствующих определённой аминокислоте, не равна и для одних кодонов выше, чем для других[68][69]. Эволюционные основы возникновения предпочтения кодонов неясны. Согласно одной гипотезе, реже встречаются те кодоны, которые наиболее часто мутируют. Другая гипотеза утверждает, что предпочтение кодонов регулируется естественным отбором в пользу тех, которые обеспечивают наибольшую эффективность и точность экспрессии генов[70][71]. Предпочтение кодонов в значительной мере связано с GC-составом генома, и в некоторых случаях по GC-составу можно даже предсказать частоту использования кодонов[72]. С функциональной точки зрения предпочтение кодонов связано с эффективностью и точностью трансляции и, следовательно, уровнем экспрессии гена[73][74].
В настоящее время наиболее общепринятой гипотезой о происхождении жизни на Земле является гипотеза мира РНК. Любая модель возникновения генетического кода использует гипотезу о передаче основных функций от РНК-ферментов (рибозимов) к белковым ферментам. Как и предполагает гипотеза мира РНК, тРНК появились раньше аминоацил-тРНК-синтетаз, поэтому эти ферменты не могли оказать влияние на свойства тРНК[75].
Генетический код последнего универсального общего предка (LUCA) был основан, вероятнее всего, на ДНК, а не РНК[76]. Генетический код состоял из трёхнуклеотидных кодонов, и всего было возможно 64 различных кодона. Поскольку для построения белков использовалось только 20 аминокислот, некоторые аминокислоты кодировались несколькими кодонами[77][78][79][80].
Если бы соответствие между кодонами и аминокислотами было случайным, в природе существовало бы 1,5 × 1084 генетических кодов[81]. Это число получилось в результате расчёта количества способов, которыми можно 21 предмет (20 кодонов, кодирующих аминокислоты, и один стоп-кодон) разложить в 64 корзины, так, чтобы каждый предмет был использован по крайней мере единожды[82]. Однако соответствия кодонов и аминокислот неслучайны[83]. Аминокислоты, которые имеют общий путь биосинтеза, как правило, имеют общую первую позицию кодонов. Этот факт может быть пережитком раннего, более простого генетического кода, который содержал меньше аминокислот, чем современный, и постепенно включил в свой состав все 20 аминокислот[84]. Кодоны аминокислот со схожими физико-химическими свойствами также, как правило, похожи, что смягчает последствия точечных мутаций и нарушений трансляции[85][86].
Поскольку генетический код неслучаен, правдоподобная гипотеза о его возникновении должна объяснять такие свойства стандартного генетического кода, как отсутствие кодонов для D-аминокислот, включение всего лишь 20 аминокислот из возможных 64, ограничение синонимичных замен третьей позицией кодонов, функционирование в качестве стоп-кодонов именно кодонов UAG, UGA и UAA[87]. Существуют три основные гипотезы происхождения генетического кода. Каждая из них представлена множеством моделей, многие модели гибридны[88].
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.