Tiol
Da Wikipédia, a enciclopédia livre
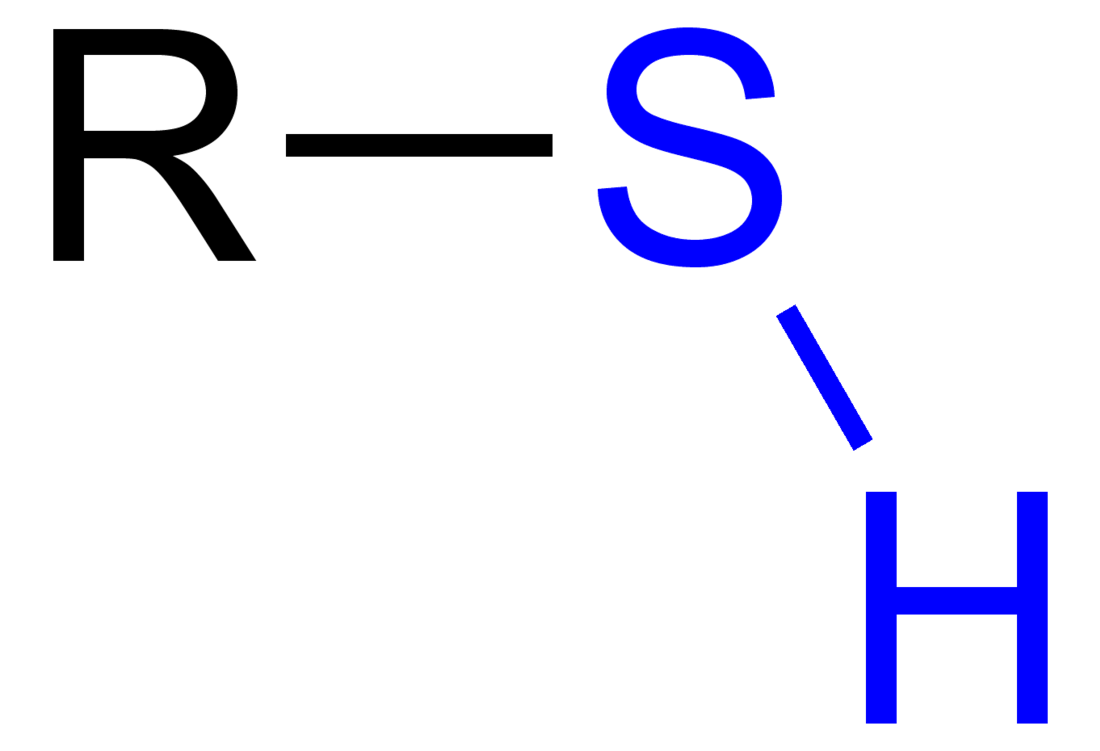
Em química orgânica, um tiol, plural tióis, é um composto organossulfurado que contém um grupo -SH, designado por grupo tiol, grupo mercaptano ou grupo sulfidrilo ou sufidrila,[1] ligado a um átomo de carbono (–C–SH ou R–SH, onde R representa um alcano, alceno, ou outro grupo de átomos contendo carbono). Tióis são os análogos do enxofre de álcoois (ou seja, o enxofre toma o lugar do oxigênio no grupo hidroxila de um álcool), e a palavra é uma amálgama de "tio" + "álcool," com a primeira palavra derivando do grego θεῖον ("thion") = "enxofre".) O nome de um tiol é precedido do nome do hidrocarboneto: ex. etanotiol (C2H5SH).

Muitos tióis tem como característica fortes odores que lembram o odor de alho. Por exemplo, o próprio cheiro característico do alho é produzido por etanotiol. Tióis são usados como odorantes para auxiliar na detecção de derivados gasosos de hidrocarbonetos, como gás natural (que na forma pura é inodoro), assim como ao gás liquefeito de petróleo (pois o propano e butano que predominantemente o compõe também são inodoros), vulgarmente, “gás de cozinha”, e o "cheiro de gás natural", assim como o popular “cheiro de gás” é devido ao cheiro do tiol usado como o odorante, proporcionando o odor desagradável característico quando há vazamentos.[2][3]
Ao contrário dos álcoois eles são ácidos, reagindo com bases e alguns metais, formando compostos semelhantes a sais, os chamados tiolatos, que são definidos como os derivados de um tiol em que um átomo de metal substitui o hidrogênio ligado ao enxôfre, similares aos alcóxidos: RSH → RS-M+. Tióis são frequentemente referidos como mercaptanos.[4][5] O termo mercaptano é derivado do latim mercurium captans (capturando mercúrio)[6] porque o grupo tiolato liga-se muito fortemente com os compostos de mercúrio.
Estrutura e ligação
Tióis e álcoois têm estrutura molecular semelhante. A principal diferença é o tamanho do calcogeneto, com o comprimento da ligação C-S sendo cerca de 180 picômetros. Os ângulos de C-S-H aproximam-se de 90 °. Nos líquidos ou sólidos fundidos, a ligação de hidrogênio entre grupos individuais tiol é fraca, sendo a principal força coesiva as interações de van der Waals entre os centros de enxofre divalentes altamente polarizáveis. Devido à menor diferença de eletronegatividade entre o enxofre e o hidrogênio em relação ao oxigênio e o hidrogênio, um vínculo S-H é menos polar do que o grupo hidroxilo. Tióis tem um menor momento de dipolo em relação ao álcool correspondente.
Nomenclatura
Existem várias formas usadas nos nomes dos alquil-tióis:
- O método preferido (usado pela IUPAC) é adicionar o sufixo -tiol ao nome do alcano. Este nome é praticamente idêntico à nomenclatura dos álcoois.[7][8][9][10][11] Exemplo: CH3SH é o metanotiol.
- Um método mais antigo parte do álcool e substitui álcool por mercaptano. Exemplo: CH3SH seria mercaptano metílico ou metilmercaptano, assim como CH3OH é o álcool metílico.
- Podem-se usar os prefixos mercapto ou sulfanil. Exemplos: ácido mercaptosuccínico (ácido tiomálico) e ácido 2-amino-3-metil-3-sulfanil-butanoico (Penicilamina).
Propriedades físicas
Resumir
Perspectiva
Odor
Muitos tióis tem odores fortes lembrando aquele do alho. Os odores de tióis são frequentemente fortes e repulsivos, particularmente para aqueles de baixo peso molecular. Os borrifos (‘’sprays’’) de cangambás consistem principalmente de compostos tióis de baixo peso molecular.[12][13] Estes compostos são detectáveis pelo olfato humano em concentrações de apenas 10 partes por bilhão.[14] O suor humano contém (R)/(S)-3-metil-3-sulfanil-hexan-1-ol (MSH), detectável a 2 partes por bilhão e tendo um odor frutal, similar a cebolo. Mulheres liberam significativamente mais MSH que homens[15] (Metiltio)metanotiol (MeSCH2SH; MTMT) é um tiol volátil fortemente odorífico, também detectável em níveis de partes por bilhão, encontrado na urina de camundongos machos. Lawrence C. Katz e colaboradores mostraram que MTMT funciona como um semioquímico, ativando certos neurônios sensitivos do olfato dos camundongos, atraindo suas fêmeas.[16] Cobre tem sido mostrado como requerido por um receptor olfativo específico dos camundongos, MOR244-3, o qual é altamente responsivo a MTMT assim como vários outros tióis e compostos relacionados.[17]
Tióis são também responsáveis por uma classe de falhas de vinho causadas por uma reação não intencional entre enxofre e o fermento, causando o odor "como de gambá" em cerveja que tenha sido exposta à luz ultravioleta.
Não são todos os tióis que tem odores desagradáveis. Por exemplo, furano-2-ilmetanotiol contribui para o aroma de café torrado enquanto o mercaptano da toronja, um tiol monoterpenoide, é responsável pelo pelo característico aroma da toronja. O efeito deste último composto está presente apenas em baixas concentrações. O mercaptano puro tem um odor desagradável. Cloretos de tionilo também tem um odor característico e podem ser facilmente reconhecidos quando os temos para identificar qual o grupo funcional está sendo utilizado na reação.
Distribuidores de gás natural e gás liquefeito de petróleo iniciaram adicionando tióis, originalmente etanotiol, aos seus produtos, os quais são naturalmente inodoros, após o grave incidente da explosão na New London School em New London, Texas, em 1937. A maioria dos gases odorantes utilizados atualmente contém misturas de mercaptanos e sulfetos, com o t-butil mercaptano como o principal constituinte de odor. Em situações onde tióis são usados na indústria, logística e comercialização de grande escala, tais como tanques de gás liquefeito de petróleo e sistemas de manipulação em grande escala produtos, um catalisador oxidante é usado para destruir o odor. Um catalisador de oxidação baseado em cobre neutraliza os tióis voláteis e transforma-os em produtos inertes.
Pontos de ebulição e solubilidade
Tióis mostram pequena associação por ligação de hidrogênio, com ambas moléculas de água e entre si. Assim, possuem pontos de ebulição mais baixos e são menos solúveis em água e outros solventes polares que álcoois de peso molecular similar. Tióis e tioéteres tem solubilidades características e pontos de ebulição similares.
Caracterização
Tióis voláteis são facilmente e quase infalivelmente detectados pelo seu odor característico. Analisadores específicos para enxofre para cromatógrafos a gás são úteis. Indicadores espectroscópicos são o sinal D2O-permutável SH no 1H espectro RMN (33S é RMN ativo mas os sinais de enxofre bivalente são muito amplos e de pouco utilidade[18]). A banda νSH aparece próximo de 2400 cm−1 no espectro I.V..[4] Em testes colorimétricos, tióis reagem com nitroprussiato.
Produção
Resumir
Perspectiva
Na indústria, metanotiol é sintetizado, principalmente, pela reação de sulfeto de hidrogênio com metanol:
:CH3OH + H2S → CH3SH + H2O
Tais reações são conduzidas na presença de catalisadores ácidos. A outra rota principal para tióis envolve a adição de sulfeto de hidrogênio a alquenos. Tais reações são usualmente conduzidas na presença de um catalisador ácido ou luz ultravioleta. O deslocamento de haletos, usando haletos orgânicos e sulfeto de hidrogênio adequados também tem sido utilizada.[19]
Métodos laboratoriais
Muitos métodos são úteis para a síntese de tióis na escala laboratorial. A reação direta de um haloalcano com hidrossulfeto de sódio é geralmente ineficiente em virtude da formação competitiva de tioéteres:
- CH3CH2Br + NaSH → CH3CH2SH + NaBr
- CH3CH2Br + CH3CH2SH → (CH3CH2)2S + HBr
Em vez disso, os halogenetos de alquila são convertidos para tióis através de uma S-alquilação de tioureia. Neste multipasso, em processo por batelada, num só recipiente, ocorre através da intermediação do sal isotiourônio, que é hidrolisado num passo separado:[20]
- CH3CH2Br + SC(NH2)2 → [CH3CH2SC(NH2)2]Br
- [CH3CH2SC(NH2)2]Br + NaOH → CH3CH2SH + OC(NH2)2 + NaBr
A rota por tioureia funciona bem com halogenetos primários, especialmente os ativados. Tióis secundários e terciários são preparados menos facilmente. Tióis secundários podem ser preparados a partir de cetonas por meio dos correspondentes ditiocetais.[21]
Compostos organolítios e reagentes de Grignard reagem com enxofre resultando em tiolatos, os quais são facilmente hidrolisados:[22]
- RLi + S → RSLi
- RSLi + HCl → RSH + LiCl
Fenóis podem ser convertidos aos tiofenóis via o rearranjo de seus dialquilltiocarbamatos de O-arila.[23]
Muitos tióis são preparados pela dealquilação redutiva de tioéteres, especialmente derivados benzila e tioacetais.[24]
Reações
Resumir
Perspectiva
Similarmente à química de álcoois, tióis formam tioéteres, tioacetais e tioésteres, os quais são análogos à éteres, acetais e ésteres. Tióis e álcoois são também muito diferentes em sua reatividade, com tióis sendo facilmente oxidados e tiolatos sendo nucleófilos altamente potentes.
Alquilação S
Tióis, ou mais particularmente suas bases conjugadas, são facilmente alquiladas resultando seus tioéteres:
- RSH + R'Br + base → RSR' + [Hbase]Br
Acidez
Relativamente aos álcoois, tióis são bastante ácidos. Butanotiol tem um pKa de 10.5 vs 15 para o butanol. Tiofenol tem um pKa de 6 vs 10 para o fenol. Disto resulta que tiolatos podem ser obtidos de tióis por tratamento com hidróxidos alcalinos.

Redox
Tióis, especialmente na presença de base, são facilmente oxidados por reagentes tais como o iodo ou o bromo resultando em um dissulfeto orgânico (R–S–S–R).
- 2 R–SH + Br2 → R–S–S–R + 2 HBr
Oxidação por reagentes mais enérgicos tais como o hipoclorito de sódio ou peróxido de hidrogênio resultam em ácidos sulfônicos (RSO3H).
- R–SH + 3H2O2 → RSO3H + 3H2O
Oxidação por oxigênio na presença de catálise heterogênea:[25]
- 2R–SH + 1/2O2 → RS–SR + H2O
Tióis participam em intercâmbio tiol-dissulfeto:
- RS–SR + 2 R'SH → 2 RSH + R'S–SR'
A reação é especialmente importante na natureza.
Complexação de íon metálico
Tiolatos, as bases conjugadas derivadas dos tióis, formam complexos fortes com muitos íons metálicos, especialmente aqueles classificados como "macios" (soft, dentro da teoria HSAB). O termo mercaptano é derivado do latim mercurium captans (capturando mercúrio)[6] porque o grupo tiolato liga-se fortemente com compostos de mercúrio. A estabilidade de tiolatos metálicos faz paralelo com a dos correspondentes sulfetos minerais.
Radicais tiil
- Para a química do radical SH, veja Sulfanilo
Radicais livres derivados dos mercaptanos, chamados tiil ou radical tiol ou ainda radical mercapto, são comumente citados para explicar reações em química orgânica e bioquímica. Eles tem a fórmula RS onde R é um substituinte orgânico tal como alquilo ou arilo.[5] Eles surgem ou podem ser produzidos por uma variedade de rotas, mas o principal método é a abstração do átomo de hidrogênio dos tióis. Outro método envolve homólise de dissulfetos orgânicos.[26] Em biologia radicais tiil são responsáveis pela formação dos ácidos deoxirribonuclêicos, construindo blocos para o DNA. Esta conversão é catalisada por ribonucleotídeo redutase (ver figura).[27] Intermediários tiil também são produzidos pela oxidação de glutationa, um antioxidante em biologia. Radicias tiil são também intermediários no processo de vulcanização. Por exemplo, a vulcanização do poliisopreno resulta quando radicais mercapto acoplam formando dissulfeto e reticulações de polissulfeto.

Importância biológica
Resumir
Perspectiva
Cisteína e cistina
Como um grupo funcional do aminoácido cisteína, o grupo tiol desempenha um papel muito importante da biologia. Quando os grupos tiol de dois resíduos cisteína (como em monômeris ou unidades constituintes) são trazidos perto um do outro no decurso de dobragem de proteína, uma reação de oxidação pode gerar uma unidade cistina com uma ligação dissulfeto (-SS-). Pontes de dissulfeto podem contribuir para uma estrutura terciária de proteína se as cisteínas são parte da mesma cadeia de peptídeo, ou contribuir para a estrutura quaternária de unidade multi-proteínas, formando ligações covalentes bastante fortes entre diferentes cadeias peptídicas. A manifestação física visível e trivial do equilíbrio cisteína-cistina é fornecido pelas tecnologias de alisamento de cabelo.
Grupos sulfidrila no sítio ativo de uma enzima podem formar ligações covalentes com o substrato da enzima, bem como contribuir para a atividade catalítica. Sítios ativos de resíduos de cisteína são a unidade funcional em cisteína proteases. Resíduos de cisteína podem também reagir com os íons de metais pesados (Zn2+, Cd2+, Pb2+, Hg2+, Ag+) por causa da alta afinidade entre o sulfeto "mole" e o metal "mole" (ver ácidos e bases "duros" e "macios"). Isto pode deformar e inativar a proteína, e é o mecanismo da intoxicação por metai pesados.
Cofatores
Muitos cofatores (moléculas auxiliares não baseadas em proteínas) apresentam em suas estruturas grupos tióis. O anabolismo e catabolismo de ácidos graxos e hidrocarbonetos de cadeia longa são conduzidos por uma estrutura que ancora a cadeia crescente através de um tioéster derivado do tiol, a coenzima A. A biossíntese do metano, o principal hidrocarboneto sobre a Terra, surge a partir da reação mediada pela coenzima M, ácido 2-mercaptoetil-sulfônico. Tiolatos, as bases conjugadas derivados dos tióis, formam fortes complexos com muitos íons metálicos, especialmente aqueles classificados como "moles". A estabilidade de tiolatos metálicos rivaliza com aquela dos sulfetos minerais correspondentes.
Exemplos de tióis
|
|
Referências
- Römpp CD 2006. Thieme, Stuttgart 2006, ISBN 3-13-143321-3.
- Sindigás (ed.). «Cheiro de gás». Consultado em 13 de dezembro de 2021
- Corpo de Bombeiros da Polícia Militar do Paraná (ed.). «Gás de cozinha ou GLP». Consultado em 13 de dezembro de 2021
- Patai, Saul “The chemistry of the thiol group” Saul Patai, Ed. Wiley, London, 1974. ISBN 0471669490.
- R. J. Cremlyn “An Introduction to Organosulfur Chemistry” John Wiley and Sons: Chichester (1996). ISBN 0 471 95512 4.
- Oxford American Dictionaries (Mac OS X Leopard).
- Alcohols, Phenols, Thiols, and Ethers - Thiol Nomenclature - ‘’’www.chem.latech.edu’’’ (em inglês)
- Dr. Carl C. Wamser; Organic Chemistry I ; Chapter 9 - Alcohols and Thiols - Thiol Nomenclature - ‘’’web.pdx.edu’’’ (em inglês)
- Thiols and Related Compounds - Thiols Rule C-511 - ‘’’www.acdlabs.com’’’ (em inglês)
- Richard Morrison, Charles H. Atwood, Joel A. Caughran; Survival guide for general, organic, and biochemistry: with math review; Cengage Learning, 2007. - ‘’’books.google.com.br‘’’ (em inglês)
- Wood W. F., Sollers B. G., Dragoo G. A., Dragoo J. W. (2002). «Volatile Components in Defensive Spray of the Hooded Skunk, Mephitis macroura». Journal of Chemical Ecology. 28 (9): 1865–70. PMID 12449512. doi:10.1023/A:1020573404341
- William F. Wood. «Chemistry of Skunk Spray». Dept. of Chemistry, Humboldt State University. Consultado em 2 de janeiro de 2008
- Aldrich, T.B. (1896). «A CHEMICAL STUDY OF THE SECRETION OF THE ANAL GLANDS OF MEPHITIS MEPHITIGA (COMMON SKUNK), WITH REMARKS ON THE PHYSIOLOGICAL PROPERTIES OF THIS SECRETION». J. Exp. Med. 1 (2): 323–340. PMC 2117909
 . PMID 19866801. doi:10.1084/jem.1.2.323
. PMID 19866801. doi:10.1084/jem.1.2.323 - Troccaz, Myriam; Borchard, Gerrit; Vuilleumier, Christine; Raviot-Derrien, Sophie; Niclass, Yvan; Beccucci, Sabine; Starkenmann, Christian (2009). «Gender-Specific Differences between the Concentrations of Nonvolatile (R)/(S)-3-Methyl-3-Sulfanylhexan-1-Ol and (R)/(S)-3-Hydroxy-3-Methyl-Hexanoic Acid Odor Precursors in Axillary Secretions.». Chem. Senses. 34: 203-210. doi:10.1093/chemse/bjn076
- Lin, DaYu; Zhang, Shaozhong; Block, Eric; Katz, Lawrence C. «Encoding social signals in the mouse main olfactory bulb». Nature. 2005 (434): 470-477. doi:10.1038/nature03414
- Duan, Xufang; Block, Eric; Li, Zhen; Connelly, Timothy; Zhang, Jian; Huang, Zhimin; Su, Xubo; Pan, Yi; Wu, Lifang; Chi, Qiuyi; Thomas, Siji; Zhang, Shaozhong; Ma, Minghong; Matsunami, Hiroaki; Chen, Guo-Qiang; Zhang, Hanyi. «Crucial role of copper in detection of metal-coordinating odorants». Proc. Natl. Acad. Sci. U.S.A. 2012 (109): 3492-3497. doi:10.1073/pnas.1111297109
- Sulfur-33 NMR - Solid-state sulfur NMR references - www.pascal-man.com (em inglês)
- John S Roberts, "Thiols", in Kirk-Othmer Encyclopedia of Chemical Technology, 1997 by John Wiley & Sons, Inc.
- Speziale, A. J. (1963). «Ethanedithiol». Org. Synth.; Coll. Vol., 4.
- S. R. Wilson, G. M. Georgiadis (1990). «Mecaptans from Thioketals: Cyclododecyl Mercaptan». Org. Synth.; Coll. Vol., 7.
- E. Jones and I. M. Moodie (1990). «2-Thiophenethiol». Org. Synth.; Coll. Vol., 6.
- Melvin S. Newman and Frederick W. Hetzel (1990). «Thiophenols from Phenols: 2-Naphthalenethiol». Org. Synth.; Coll. Vol., 6.
- Ernest L. Eliel, Joseph E. Lynch, Fumitaka Kume, and Stephen V. Frye (1993). «Chiral 1,3-oxathiane from (+)-Pulegone: Hexahydro-4,4,7-trimethyl-4H-1,3-benzoxathiin». Org. Synth.; Coll. Vol., 8
- Heterogeneous catalytic demercaptization of light hydrocarbon feedstock. A. G. Akhmadullina, B. V. Kizhaev, G. M. Nurgalieva, I. K. Khrushcheva and A. S. Shabaeva, et al. Chemistry and Technology of Fuels and Oils, 1993, Volume 29, Number 3, Pages 108–109
- Kathrin-Maria Roy “Thiols and Organic sulphides” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH Verlag, Weinheim. doi:10.1002/14356007.a26_767
- JoAnne Stubbe, Daniel G. Nocera, Cyril S. Yee, Michelle C. Y. Chang "Radical Initiation in the Class I Ribonucleotide Reductase: Long-Range Proton-Coupled Electron Transfer?" Chem. Rev., 2003, 103 (6), pp 2167–2202. doi:10.1021/cr020421u
Wikiwand - on
Seamless Wikipedia browsing. On steroids.