Loading AI tools
ウィキペディアから
小膠細胞(しょうこうさいぼう、英: Microglia)またはそのまま英語でミクログリアは、脳脊髄中に存在するグリア細胞の一種。中枢神経系における細胞の約 5%から20%を占めている[1]。Hortega細胞とも呼ばれる。他のグリア細胞は外胚葉由来であるのに対し、ミクログリアは中胚葉由来であり、造血幹細胞から分化する。
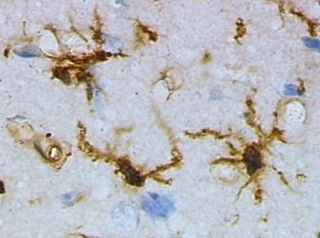
マクロファージ様の神経食現象を有し、神経組織が炎症や変性などの傷害を受けるとミクログリアが活性化し、病変の修復に関与する。Fc受容体・補体受容体・MHCの発現、IL-1の分泌を行い、中枢神経系の免疫細胞としての役割を有する可能性が示唆されている。
PET検査により神経炎症が確認された慢性疲労症候群(CFS)患者の頭部CT検査やMRI検査は、明らかな異常所見がなかったとの報告がある。保険診療で認められている検査では神経炎症を判別することは困難とされ、ミクログリアの活性化を評価できるPET検査が必要であることが示された[2]。
ヒトやマウスの脳内ミクログリアは、細胞分裂やアポトーシスにより生涯一定の数で維持され、生涯で数回は完全に入れ替わる[3]。
41の研究をメタ解析した結果、対照(762人)と比較し統合失調症患者(783人)は、死後脳ミクログリアの密度が有意に増加していた。アストロサイトおよびオリゴデンドロサイトの密度は有意差がなかった[4]。
アルコールはグリアの機能を変更することにより脳を損傷させる。対照的に、運動はグリアの可塑性と健康を促進させる。ラットをエタノールで強制飼養し、グリアに対するその後の運動の効果を検証した。対照ラットは運動により内前頭前野のミクログリア数が増加したが、エタノール過剰摂取ラットはミクログリア数が有意に少なかった[5]。
コロニー刺激因子1受容体(CSF1R)阻害剤であるPLX3397は、成体マウスの脳内ミクログリアを99%枯渇させる。そのマウスは行動や認知異常を示さなかった。阻害剤の投与中止から1週間以内に新しいミクログリアが完全に再増殖した。中枢神経系(CNS)のミクログリア再増殖は、ネスチン陽性細胞(神経幹細胞)の増殖を介し、ミクログリアに分化する[6]。
成体マウスへPLX3397を投与し長期間ミクログリアを枯渇させたところ、樹状突起スパインの密度が増加した。脳発達後もミクログリアがシナプス形成する証拠が示された[7]。
成体マウスへ4週間ドキシサイクリン40ppm[注 1][8]混餌投与した結果、ミクログリアの数が有意に激減し、樹状突起スパインの密度が有意に増加した[9]。
胎児期18日目から出生後1日目までマウスへミノサイクリン(45mg/kg, ip)を投与し、最終投与から8時間後に検査したところ、検査した脳組織の全領域で細胞死(アポトーシス)が10倍以上に増加していた。殆どの領域でミクログリアマーカー(IBA1)が増加していた。生後3-5日齢への投与においても類似の作用がみられた[10]。
青年期の雌性ラットへΔ9-THC(2.5 - 10mg/kg)やMDMA(10mg/kg, sc)の慢性投与はミクログリアマーカー(IBA1)の割合を減少させた。雄性ラットにおいては増加させた[11]。思春期に大麻を長期乱用すると脳の成熟が損なわれ神経発達障害の傾向になりやすいと示されているが、この関連の基礎をなす神経生物学的なメカニズムの大部分は不明であった。思春期の雌性ラットへΔ9-THC(2.5 - 10mg/kg)慢性投与で誘導される長期間の認知障害とミクログリア活性化の因果関係を示す証拠が提示された。ミクログリアの活性化を阻止することで青年期の短期記憶障害を有意に減弱させ、ミクログリア上のカンナビノイド2受容体(CB2R)の増加を防止できた[12]。多くの神経変性疾患はCB2Rの増加が見出されている[13]。大麻乱用と関連する有害作用にミクログリアおよびアストロサイトの変化が寄与し得ることを示唆する最近の前臨床的な証拠がある[14]。
神経食現象 (英語版) とは、壊死した神経細胞を除去する目的で細胞周囲および細胞内にグリア細胞が集合する現象。ウイルス感染や中毒などで認められる[15][16]。イソ-α酸はミクログリアを活性化させ、アルツハイマー病の原因物質とされるアミロイドβタンパク質の蓄積を抑え、脳内の炎症を抑制する[17][18]。
ミクログリアの活性化は炎症性サイトカインを放出し細胞傷害を惹起する。それは脳内の炎症であり、神経変性や中枢神経系の炎症応答を引き起こす[19]。重症の慢性疲労症候群(CFS)では、脳内ミクログリアの活性化による神経炎症が起こっていた[2]。神経因性疼痛の病態としてミクログリアの活性化が引き起こされる。
トレーサーとしてTSPOの放射性リガンドである[11C]DAA-1106を用いたPET検査の結果、喫煙者は非喫煙者よりも[11C]DAA-1106結合が全体的に少なく、ミクログリアの活性化が少ないことが示された。それは、非喫煙者と比較して喫煙者は炎症機能が損なわれていることを示す先行研究と一致していた[20]。TSPOの放射性リガンドである[11C]PBR28を用いたPET検査の結果、アルコール依存症の個体は脳内のミクログリア活性が低く、対照と比較して鈍い炎症応答を示した[21]。
ミクログリアはカンナビノイド1受容体(CB1R)とカンナビノイド2受容体(CB2R)を発現し[22]、CB2Rの刺激はミクログリアの活性化を抑制させる[23]。
一般的に神経保護とは、神経細胞の傷害や死滅を抑えることを指しており、髄鞘(ミエリン鞘)の形成を指してはいない。
マウスへTHC(5 or 20mg/kg, ip)を亜慢性投与すると小脳のミクログリアが活性化した。投与中止後5日目に小脳のCB1Rの発現が減少し、CB2Rの発現が増加していた。そのときミノサイクリン(40mg/kg, ip)を投与するとミクログリアの活性化が阻止され、CB2Rの発現が増強された。THCはミクログリア上のCB2Rアゴニストとして作用し、ミクログリアの活性化を抑制する可能性がある[24]。
ミノサイクリンの神経保護作用は、CB1Rアンタゴニスト(AM-251)やCB2Rアンタゴニスト(AM-630)によって阻止された。ミノサイクリンによるミクログリア活性化の抑制は、エンドカンナビノイドシステム(ECS)の関与が実証された[25][26][27]。
合成カンナビノイドである WIN 55,212-2・HU-210・JWH-133 はアミロイドβタンパク質によるミクログリアの活性化を抑制し神経毒性から保護する[28]。
ミクログリアは統合失調症や不安およびストレス関連障害などの精神障害に影響する。うつ病がミクログリア病であり得ることを示唆する根拠が示され、うつ病治療の標的はミクログリアに発現しているCB2Rと指し示された[29]。
インターフェロン(IFN-α)の副作用の一つであるうつ病の原因は、IFN-αが脳内のミクログリアを活性化し、海馬の神経新生を阻止するためとの報告がある[30][31]。HPVワクチン(ガーダシル)を注射したマウスの免疫組織化学分析では、海馬のCA1領域においてミクログリアの活性化が明らかとなった。それは、アジュバントのアルミニウムによるものと示唆された[32]。
IFN-α誘発性の抑うつは、ミクログリアの活性化を抑制する薬剤で改善できるかもしれない[30]。マウスの実験では、IFN-α誘発性の抑うつ行動がミノサイクリン処置で抑制された。ミノサイクリンはIFN-α誘発性うつ病患者の治療に有望な薬剤と示唆された[31]。ミクログリアの活性化を抑える薬剤は慢性疲労症候群(CFS)の特効薬として開発が始まっている[2]。
ミクログリアの活性化を促進させる可能性がある薬剤[34]。
潜在的にミクログリアの活性化を抑制させる薬剤[34]。
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.