Top Qs
Timeline
Obrolan
Perspektif
Germanium
unsur kimia dengan lambang Ge dan nomor atom 32 Dari Wikipedia, ensiklopedia bebas
Remove ads
Germanium adalah sebuah unsur kimia dengan lambang Ge dan nomor atom 32. Ia berkilau, keras tetapi rapuh, berwarna putih keabu-abuan dan mirip dengan silikon. Ia adalah sebuah metaloid yang berada dalam golongan karbon yang secara kimiawi mirip dengan tetangganya dalam golongannya, silikon dan timah. Seperti halnya silikon, germanium secara alami bereaksi dan membentuk kompleks dengan oksigen di alam.
Karena jarang muncul dalam konsentrasi tinggi, germanium ditemukan relatif terlambat dalam penemuan unsur. Germanium menempati urutan ke-50 dalam kelimpahan relatif unsur-unsur di kerak Bumi. Pada tahun 1869, Dmitri Mendeleev meramalkan keberadaannya dan beberapa sifatnya dari posisinya di tabel periodik buatannya, dan menyebut unsur ini sebagai ekasilikon. Pada tahun 1886, Clemens Winkler di Universitas Freiberg menemukan unsur baru ini, bersama dengan perak dan belerang, dalam mineral argirodit. Winkler menamai unsur ini dari nama negaranya, Jerman. Germanium ditambang terutama dari sfalerit (bijih utama seng), meskipun germanium juga diperoleh secara komersial dari bijih perak, timbal, dan tembaga.
Germanium elemental digunakan sebagai semikonduktor dalam transistor dan berbagai perangkat elektronik lainnya. Secara historis, dekade pertama dari elektronika semikonduktor seluruhnya didasarkan pada germanium. Saat ini, penggunaan akhir utama adalah sistem serat optik, optika inframerah, aplikasi sel surya, dan dioda pemancar cahaya (LED). Senyawa germanium juga digunakan untuk katalis polimerisasi dan baru-baru ini digunakan dalam produksi kawat nano. Unsur ini membentuk sejumlah besar senyawa organogermanium, seperti tetraetilgermanium, yang berguna dalam kimia organologam. Germanium dianggap sebagai salah satu unsur kritis teknologi.[6]
Germanium tidak dianggap sebagai unsur penting untuk setiap organisme hidup. Mirip dengan silikon dan aluminium, senyawa germanium yang terjadi secara alami cenderung tidak larut dalam air sehingga memiliki toksisitas oral yang kecil. Namun, garam germanium sintetis yang larut bersifat nefrotoksik, dan senyawa germanium sintetis yang reaktif secara kimia dengan halogen dan hidrogen bersifat iritan dan racun.
Remove ads
Sejarah
Ringkasan
Perspektif

Dalam laporannya berjudul The Periodic Law of the Chemical Elements pada tahun 1869, kimiawan Rusia Dmitri Mendeleev meramalkan adanya beberapa unsur kimia yang tidak diketahui, termasuk unsur yang akan mengisi celah dalam keluarga karbon, yang terletak di antara silikon dan timah.[7] Karena posisinya dalam tabel periodik buatannya, Mendeleev menyebutnya ekasilikon (Es), dan dia memperkirakan berat atomnya pada 70 (kemudian 72).
Pada pertengahan tahun 1885, di sebuah tambang dekat Freiberg, Sachsen, sebuah mineral baru ditemukan dan diberi nama argirodit karena kandungan peraknya yang tinggi.[catatan 1] Kimiawan Clemens Winkler menganalisis mineral baru ini, yang terbukti merupakan kombinasi dari perak, belerang, dan sebuah unsur baru. Winkler berhasil mengisolasi unsur baru tersebut pada tahun 1886 dan menemukannya mirip dengan antimon. Dia awalnya menganggap unsur baru itu merupakan eka-antimon, tetapi segera yakin bahwa itu merupakan eka-silikon.[9][10] Sebelum Winkler mempublikasikan hasilnya mengenai unsur baru itu, dia memutuskan bahwa dia akan menamai unsur itu sebagai neptunium, karena penemuan planet Neptunus yang baru ditemukan saat itu pada tahun 1846 juga telah didahului oleh prediksi matematis mengenai keberadaannya.[catatan 2] Namun, nama "neptunium" telah diberikan kepada unsur kimia lain yang diusulkan (meskipun bukan unsur yang sekarang menyandang nama neptunium, yang ditemukan pada tahun 1940).[catatan 3] Jadi sebagai gantinya, Winkler menamai unsur baru ini sebagai germanium (dari kata Latin, Germania, untuk Jerman) untuk menghormati tanah airnya.[10] Argirodit terbukti secara empiris menjadi Ag8GeS6. Karena unsur baru ini menunjukkan beberapa kemiripan dengan unsur arsen dan antimon, tempatnya yang tepat dalam tabel periodik sedang dipertimbangkan, tetapi kesamaannya dengan unsur "ekasilikon" yang diprediksi Dmitri Mendeleev memastikan tempatnya dalam tabel periodik.[10][17] Dengan bahan lebih lanjut dari 500 kg bijih dari tambang di Sachsen, Winkler mengonfirmasi sifat kimia unsur baru pada tahun itu 1887.[9][10][18] Dia juga menentukan berat atom unsur baru itu pada 72,32 dengan menganalisis germanium tetraklorida (GeCl4) murni, sementara Lecoq de Boisbaudran menyimpulkan nilai 72,3 dengan perbandingan garis-garis dalam spektrum percikan unsur ini.[19]
Winkler mampu menyiapkan beberapa senyawa germanium baru, meliputi fluorida, klorida, sulfida, dioksida, dan tetraetilgermana (Ge(C2H5)4), senyawa organogermana pertama.[9] Data fisik dari senyawa-senyawa tersebut—yang sesuai dengan prediksi Mendeleev—menjadikan penemuan ini sebagai konfirmasi penting dari gagasan Mendeleev mengenai periodisitas unsur. Berikut adalah perbandingan antara prediksi Mendeleev dan data Winkler:[9]
Hingga akhir tahun 1930-an, germanium dianggap sebagai logam dengan konduksi buruk.[20] Germanium tidak menjadi signifikan secara ekonomi hingga setelah tahun 1945 ketika sifat-sifatnya sebagai semikonduktor elektronik diakui. Selama Perang Dunia II, sejumlah kecil germanium digunakan pada beberapa perangkat perangkat elektronik khusus, kebanyakan dioda.[21][22] Penggunaan germanium besar pertama adalah titik-kontak dioda Schottky untuk deteksi pulsa radar selama Perang.[20] Paduan silikon–germanium pertama diperoleh pada tahun 1955.[23] Sebelum tahun 1945, hanya beberapa ratus kilogram germanium yang diproduksi pada pelebur setiap tahunnya, tetapi pada akhir tahun 1950-an, produksi tahunannya di seluruh dunia telah mencapai 40 ton metrik (44 ton pendek).[24]
Perkembangan transistor germanium pada tahun 1948[25] membuka pintu bagi berbagai aplikasi elektronika benda padat yang tak terhitung jumlahnya.[26] Dari tahun 1950 hingga awal 1970-an, area ini menyediakan pasar yang meningkat untuk germanium, tetapi kemudian silikon dengan kemurnian tinggi mulai menggantikan germanium dalam transistor, dioda, dan penyearah.[27] Misalnya, perusahaan yang menjadi Fairchild Semiconductor didirikan pada tahun 1957 dengan tujuan memproduksi transistor silikon. Silikon memiliki sifat kelistrikan yang unggul, tetapi membutuhkan kemurnian yang jauh lebih besar yang tidak dapat dicapai secara komersial pada tahun-tahun elektronika semikonduktor awal.[28]
Sementara itu, permintaan germanium untuk jaringan komunikasi serat optik, sistem penglihatan malam inframerah, dan katalis polimerisasi meningkat drastis.[24] Penggunaan akhir ini mewakili 85% dari konsumsi germanium di seluruh dunia pada tahun 2000.[27] Pemerintah Amerika Serikat bahkan menetapkan germanium sebagai bahan yang strategis dan penting, meminta pasokan sebesar 146 ton pendek (132 ton metrik) sebagai persediaan pertahanan nasional pada tahun 1987.[24]
Germanium berbeda dari silikon karena pasokannya dibatasi oleh ketersediaan sumber yang dapat dieksploitasi, sedangkan pasokan silikon hanya dibatasi oleh kapasitas produksi karena silikon berasal dari pasir dan kuarsa biasa. Harga germanium hampir mencapai AS$800 per kilogram pada tahun 1998,[24] sementara silikon dapat dibeli dengan harga kurang dari AS$10 per kilogram.[24]
Remove ads
Karakteristik
Ringkasan
Perspektif
Dalam kondisi standar, germanium adalah sebuah unsur semilogam yang rapuh dan berwarna putih keperakan.[29] Bentuk ini merupakan alotrop yang dikenal sebagai germanium-α, yang memiliki kilau logam dan struktur kristal kubus intan, sama seperti intan.[27] Sedangkan dalam bentuk kristal, germanium memiliki energi ambang perpindahan sebesar .[30] Pada tekanan di atas 120 kbar, germanium akan berubah menjadi alotrop germanium-β dengan struktur yang sama seperti timah-β.[31] Seperti silikon, galium, bismut, antimon, dan air, germanium adalah salah satu dari sedikit zat yang mengembang saat memadat (membeku) dari keadaan cair.[31]
Germanium adalah semikonduktor yang memiliki celah pita tidak langsung, seperti silikon kristalin. Teknik pemurnian zona telah menyebabkan produksi germanium kristalin untuk semikonduktor yang memiliki pengotor hanya satu bagian dalam 1010,[32] menjadikannya salah satu bahan paling murni yang pernah diperoleh.[33] Bahan metalik pertama yang ditemukan (pada tahun 2005) menjadi sebuah superkonduktor di hadapan medan elektromagnetik yang sangat kuat adalah paduan germanium, uranium, dan rodium.[34]
Germanium murni diketahui secara spontan mengeluarkan dislokasi ulir yang sangat panjang, disebut sebagai kumis germanium. Pertumbuhan kumis ini adalah salah satu alasan utama dari kegagalan dioda dan transistor lama yang terbuat dari germanium, karena, tergantung pada apa yang akhirnya disentuh, dapat menyebabkan korsleting listrik.[35]
Sifat kimia
Germanium elemental akan mulai teroksidasi perlahan di udara pada suhu sekitar 250 °C, membentuk GeO2.[36] Germanium tidak larut dalam asam dan alkali encer tetapi larut perlahan dalam asam sulfat dan nitrat pekat panas serta bereaksi hebat dengan alkali cair untuk menghasilkan germanat ([GeO3]2−). Germanium sebagian besar terjadi dalam keadaan oksidasi +4, meskipun banyak senyawa +2 yang diketahui.[37] Keadaan oksidasi lainnya jarang terlihat: +3 ditemukan dalam senyawa seperti Ge2Cl6, serta +3 dan +1 ditemukan pada permukaan germanium oksida,[38] atau keadaan oksidasi negatif dalam germanida, seperti −4 dalam Mg2Ge. Anion gugus germanium (ion Zintl) seperti Ge42−, Ge94−, Ge92−, [(Ge9)2]6− telah dibuat melalui ekstraksi dari paduan yang mengandung logam alkali dan germanium dalam amonia cair dengan adanya etilenadiamina atau sebuah kriptan.[37][39] Bilangan oksidasi germanium dalam ion ini bukanlah bilangan bulat—mirip dengan ozonida O3−.
Dua oksida germanium telah diketahui: germanium dioksida (GeO2, germania) dan germanium monoksida, (GeO).[31] Dioksida, GeO2 dapat diperoleh dengan memanggang germanium disulfida (GeS2), dan merupakan bubuk putih yang hanya sedikit larut dalam air tetapi bereaksi dengan alkali untuk membentuk germanat.[31] Monoksida, germanoksida, dapat diperoleh melalui reaksi GeO2 dengan logam Ge pada suhu tinggi.[31] Dioksida (dan oksida serta germanat terkait) menunjukkan sifat yang tidak biasa, yaitu memiliki indeks bias tinggi untuk cahaya tampak tetapi transparan terhadap cahaya inframerah.[40][41] Bismut germanat, Bi4Ge3O12, (BGO) digunakan sebagai sintilator.[42]
Senyawa biner dengan kalkogen lain juga dikenal, seperti disulfida (GeS2) dan diselenida (GeSe2), serta monosulfida (GeS), monoselenida (GeSe), dan monotelurida (GeTe).[37] GeS2 terbentuk sebagai endapan putih ketika hidrogen sulfida dialirkan melalui larutan asam kuat yang mengandung Ge(IV).[37] Disulfida cukup larut dalam air dan dalam larutan alkali kaustik atau sulfida alkali. Namun demikian, ia tidak larut dalam air asam, yang memungkinkan Winkler menemukan unsur ini.[43] Dengan memanaskan disulfida dalam arus hidrogen, monosulfida (GeS) akan terbentuk, yang menyublim dalam pelat tipis berwarna gelap dengan kilauan logam, dan larut dalam larutan alkali kaustik.[31] Setelah melebur dengan karbonat alkali dan belerang, senyawa germanium membentuk garam yang dikenal sebagai tiogermanat.[44]

Empat germanium tetrahalida telah diketahui. Dalam kondisi normal, GeI4 berwujud padat, GeF4 berwujud gas, dan dua sisanya berwujud cair yang bersifat volatil. Misalnya, germanium tetraklorida, GeCl4, diperoleh sebagai cairan berasap tak berwarna yang mendidih pada suhu 83,1 °C dengan memanaskan logam germanium dengan klorin.[31] Semua tetrahalida dapat dihidrolisis menjadi germanium dioksida terhidrasi.[31] GeCl4 digunakan dalam produksi senyawa organogermanium.[37] Keempat germanium dihalida telah diketahui dan berbeda dengan tetrahalida, mereka adalah padatan polimer.[37] Selain itu, Ge2Cl6 dan beberapa senyawa yang lebih tinggi dengan rumus GenCl2n+2 telah diketahui.[31] Senyawa yang tidak biasa, Ge6Cl16, telah dibuat dan ia mengandung unit Ge5Cl12 dengan struktur neopentana.[45]
Germana (GeH4) adalah senyawa yang strukturnya mirip dengan metana. Poligermana—senyawa yang mirip dengan alkana—dengan rumus GenH2n+2 yang mengandung hingga lima atom germanium telah diketahui.[37] Germana lebih tidak stabil dan kurang reaktif dibandingkan analog silikon yang sesuai.[37] GeH4 akan bereaksi dengan logam alkali dalam amonia cair untuk membentuk MGeH3 kristalin putih yang mengandung anion GeH3−.[37] Germanium hidrohalida dengan satu, dua, dan tiga atom halogen adalah cairan reaktif yang tidak berwarna.[37]

Senyawa organogermanium pertama disintesis oleh Winkler pada tahun 1887; reaksi germanium tetraklorida dengan dietilseng akan menghasilkan tetraetilgermana (Ge(C2H5)4).[9] Organogermana dengan tipe R4Ge (dengan R adalah sebuah alkil) seperti tetrametilgermana (Ge(CH3)4) dan tetraetilgermana diakses melalui prekursor germanium termurah yang tersedia, germanium tetraklorida dan alkil nukleofil. Germanium hidrida organik seperti isobutilgermana ((CH3)2CHCH2GeH3) ditemukan kurang berbahaya dan dapat digunakan sebagai pengganti cairan untuk gas germana beracun dalam aplikasi semikonduktor. Banyak perantara reaktif germanium yang diketahui: radikal bebas germil, germilena (mirip dengan karbena), dan germuna (mirip dengan karbuna).[46][47] Senyawa organogermanium 2-karboksietilgermaseskuioksana pertama kali dilaporkan pada tahun 1970-an, dan untuk sementara digunakan sebagai suplemen makanan dan diduga memiliki kualitas antitumor.[48]
Menggunakan sebuah ligan yang disebut Eind (1,1,3,3,5,5,7,7-oktaetil-s-hidrindasen-4-il), germanium mampu membentuk sebuah ikatan rangkap dengan oksigen (germanona). Germanium hidrida dan germanium tetrahidrida sangat mudah terbakar dan bahkan dapat meledak bila bercampur dengan udara.[49]
Isotop
Germanium terdapat dalam 5 isotop alami: 70Ge, 72Ge, 73Ge, 74Ge, dan 76Ge. Dari mereka, 76Ge sangat sedikit radioaktif, meluruh melalui peluruhan beta ganda dengan waktu paruh 1,78×1021 tahun. 74Ge adalah isotop yang paling umum, memiliki kelimpahan alami sekitar 36%. 76Ge adalah yang paling tidak umum dengan kelimpahan alami sekitar 7%.[50] Saat dibombardir dengan partikel alfa, isotop 72Ge akan menghasilkan 77Se yang stabil, melepaskan elektron berenergi tinggi dalam prosesnya.[51] Karena hal ini, ia digunakan dalam kombinasi dengan radon untuk baterai nuklir.[51]
Setidaknya, 27 radioisotop juga telah disintesis, dengan massa atom mulai dari 58 hingga 89. Yang paling stabil di antara mereka adalah 68Ge, yang meluruh melalui penangkapan elektron dengan waktu paruh 270,95 hari. Yang paling tidak stabil adalah 60Ge, dengan waktu paruh 30 milidetik. Sementara sebagian besar radioisotop germanium meluruh melalui peluruhan beta, 61Ge dan 64Ge meluruh melalui emisi proton tertunda-β+.[50] Isotop 84Ge hingga 87Ge juga menunjukkan jalur peluruhan minor, yaitu emisi neutron tertunda-β−.[50]
Remove ads
Keterjadian
Ringkasan
Perspektif
Lihat pula Kategori: Mineral germanium

Germanium dibuat dari nukleosintesis bintang, sebagian besar melalui proses-s di dalam bintang cabang raksasa asimtotik. Proses-s adalah penangkapan neutron lambat dari unsur-unsur yang lebih ringan di dalam bintang raksasa merah yang berdenyut.[52] Germanium telah terdeteksi pada beberapa bintang terjauh[53] dan di atmosfer Jupiter.[54]
Kelimpahan germanium di kerak Bumi kira-kira 1,6 ppm.[55] Hanya beberapa mineral seperti argirodit, briartit, germanit, renierit, dan sfalerit yang mengandung germanium dalam jumlah yang cukup banyak.[27][56] Hanya sedikit dari mereka (terutama germanit) yang, sangat jarang, ditemukan dalam jumlah yang dapat ditambang.[57][58][59] Beberapa badan bijih seng-tembaga-timbal mengandung cukup germanium untuk dapat dilakukan ekstraksi dari konsentrat bijih akhir.[55] Proses pengayaan alami yang tidak biasa menyebabkan kandungan germanium yang tinggi di beberapa lapisan batu bara, ditemukan oleh Victor M. Goldschmidt selama survei luas untuk endapan germanium.[60][61] Konsentrasi tertinggi yang pernah ditemukan terdapat pada abu batu bara Hartley sebanyak 1,6% germanium.[60][61] Endapan batu bara di dekat Xilinhaote, Mongolia Dalam, mengandung sekitar 1.600 ton germanium.[55]
Produksi
Ringkasan
Perspektif
Sekitar 118 ton germanium diproduksi pada tahun 2011 di seluruh dunia, sebagian besar di Tiongkok (80 t), Rusia (5 t), dan Amerika Serikat (3 t).[27] Germanium diperoleh kembali sebagai produk sampingan dari bijih seng sfalerit di mana ia terkonsentrasi dalam jumlah sebesar 0,3%,[62] terutama dari endapan Zn–Pb–Cu(–Ba) masif yang ditampung oleh sedimen bersuhu rendah dan endapan Zn–Pb yang ditampung oleh karbonat.[63] Sebuah penelitian baru-baru ini menemukan bahwa setidaknya 10.000 ton germanium yang dapat diekstraksi terkandung dalam cadangan seng yang diketahui, terutama yang ditampung oleh endapan tipe Lembah Mississippi, sementara setidaknya 112.000 ton akan ditemukan dalam cadangan batu bara.[64][65] Pada tahun 2007, 35% permintaan germanium dipenuhi oleh germanium daur ulang.[55]
Meskipun diproduksi terutama dari sfalerit, ia juga ditemukan dalam bijih perak, timbal, dan tembaga. Sumber germanium lainnya adalah abu terbang dari pembangkit listrik berbahan bakar endapan batu bara yang mengandung germanium. Rusia dan Tiongkok menggunakan ini sebagai sumber germanium.[67] Endapan di Rusia terletak di timur jauh Pulau Sakhalin, dan timur laut Vladivostok. Endapan di Tiongkok terletak terutama di tambang lignit dekat Lincang, Yunnan; batu bara juga ditambang di dekat Xilinhaote, Mongolia Dalam.[55]
Konsentrat bijihnya kebanyakan merupakan sulfida; mereka diubah menjadi germanium oksida melalui pemanasan di bawah udara dalam proses yang dikenal sebagai pemanggangan:
- GeS2 + 3 O2 → GeO2 + 2 SO2
Sebagian germanium tertinggal dalam debu yang dihasilkan, sedangkan sisanya diubah menjadi germanat, yang kemudian dilindi (bersama dengan seng) dari abu dengan asam sulfat. Setelah netralisasi, hanya seng yang tertinggal dalam larutan, sementara germanium dan logam lainnya mengendap. Setelah menghilangkan sebagian seng dalam endapan dengan proses Waelz, oksida Waelz yang tertinggal akan dilindi untuk kedua kalinya. Dioksida diperoleh sebagai endapan dan diubah dengan gas klorin atau asam klorida menjadi germanium tetraklorida, yang memiliki titik didih rendah dan dapat diisolasi melalui distilasi:[67]
- GeO2 + 4 HCl → GeCl4 + 2 H2O
- GeO2 + 2 Cl2 → GeCl4 + O2
Germanium tetraklorida dihidrolisis menjadi oksida (GeO2) atau dimurnikan dengan distilasi fraksional dan kemudian dihidrolisis.[67] GeO2 yang sangat murni sekarang cocok untuk produksi kaca germanium. Ia direduksi menjadi germanium dengan mereaksikannya dengan hidrogen, menghasilkan germanium yang cocok untuk optika inframerah dan produksi semikonduktor:
- GeO2 + 2 H2 → Ge + 2 H2O
Germanium untuk produksi baja dan proses industri lainnya biasanya direduksi menggunakan karbon:[68]
- GeO2 + C → Ge + CO2
Remove ads
Aplikasi
Ringkasan
Perspektif
Penggunaan akhir utama untuk germanium pada tahun 2007, di seluruh dunia, diperkirakan: 35% untuk serat optik, 30% optika inframerah, 15% katalis polimerisasi, dan 15% elektronika dan aplikasi listrik tenaga surya.[27] 5% sisanya digunakan untuk penggunaan seperti fosfor, metalurgi, dan kemoterapi.[27]
Optika
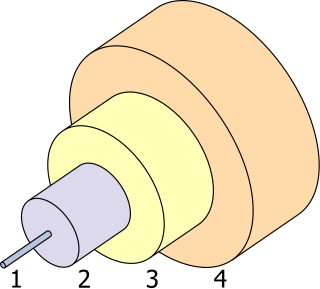
- Inti 8 µm
- Kelongsong 125 µm
- Penyangga 250 µm
- Pelindung 400 µm
Sifat penting germania (GeO2) adalah indeks refraksinya yang tinggi dan dispersi optiknya yang rendah. Dua sifat ini membuatnya sangat berguna untuk lensa kamera sudut lebar, mikroskopi, dan bagian inti dari serat optik.[69][70] Ia telah menggantikan titania sebagai dopan untuk serat silika, menghilangkan perlakuan panas berlebih yang membuat serat menjadi rapuh.[71] Pada akhir tahun 2002, industri serat optik mengonsumsi 60% penggunaan germanium tahunan di Amerika Serikat, tetapi ini kurang dari 10% konsumsi dunia.[70] GeSbTe adalah bahan perubahan fase yang digunakan untuk sifat optiknya, seperti yang digunakan dalam DVD-RW.[72]
Karena germanium transparan dalam panjang gelombang inframerah, ia adalah bahan optik inframerah penting yang dapat dengan mudah dipotong dan dipoles menjadi lensa dan jendela. Ia digunakan terutama sebagai optik depan dalam kamera pencitraan termal yang bekerja dalam kisaran 8 hingga 14 mikron untuk pencitraan termal pasif dan untuk deteksi titik panas pada militer, penglihatan malam yang mudah dibawa, dan aplikasi pemadam kebakaran.[68] Ia digunakan dalam spektroskop inframerah dan peralatan optik lainnya yang membutuhkan pendeteksi inframerah yang sangat sensitif.[70] Ia memiliki indeks bias yang sangat tinggi (4,0) dan harus dilapisi dengan bahan antirefleksi. Khususnya, lapisan antirefleksi khusus yang sangat keras dari karbon seperti intan (DLC), indeks bias 2,0, terbilang sangat cocok dan menghasilkan permukaan sekeras intan yang dapat menahan banyak penyalahgunaan lingkungan.[73][74]
Elektronika
Germanium dapat dipadukan dengan silikon, dan paduan silikon–germanium dengan cepat menjadi bahan semikonduktor penting untuk sirkuit terpadu berkecepatan tinggi. Sirkuit yang memanfaatkan sifat heterosambungan Si-SiGe bisa jauh lebih cepat daripada yang menggunakan silikon saja.[75] Cip SiGe, dengan sifat kecepatan tinggi, dapat dibuat dengan biaya rendah, teknik produksi industri cip silikon yang mapan.[27]
Panel surya efisiensi tinggi adalah penggunaan utama germanium. Karena germanium dan galium arsenida memiliki konstanta kisi yang hampir identik, substrat germanium dapat digunakan untuk membuat sel surya galium arsenida.[76] Germanium adalah substrat wafer untuk sel fotovoltaik multisambungan berefisiensi tinggi untuk aplikasi luar angkasa, seperti Mars Exploration Rover, yang menggunakan galium arsenida sambungan tripel pada sel germanium.[77] LED dengan kecerahan tinggi, digunakan untuk lampu depan mobil dan mem-backlight layar LCD, juga merupakan aplikasi penting.[27]
Substrat germanium-pada-insulator (GeOI) dipandang sebagai pengganti potensial untuk silikon pada cip mini.[27] Sirkuit CMOS berdasarkan substrat GeOI telah dilaporkan baru-baru ini.[78] Kegunaan lain dalam elektronika meliputi fosfor dalam lampu fluoresen[32] dan dioda pemancar cahaya (LED) benda padat.[27] Transistor germanium masih digunakan pada beberapa pedal efek oleh musisi yang ingin mereproduksi karakter tonal nada "fuzz" yang khas dari era rock and roll awal, terutama Dallas Arbiter Fuzz Face.[79]
Germanium telah dipelajari sebagai bahan potensial untuk sensor bioelektronik implan yang diserap dalam tubuh tanpa menghasilkan gas hidrogen yang berbahaya, menggantikan implementasi berbasis seng oksida dan indium galium seng oksida.[80]
Kegunaan lainnya

Germanium dioksida juga digunakan sebagai katalis untuk polimerisasi dalam produksi polietilena tereftalat (PET).[81] Kecemerlangan tinggi dari poliester ini sangat diminati untuk botol PET yang dipasarkan di Jepang.[81] Di Amerika Serikat, germanium tidak digunakan untuk katalis polimerisasi.[27]
Karena kesamaan antara silika (SiO2) dan germanium dioksida (GeO2), fase diam silika pada beberapa kolom kromatografi gas dapat digantikan oleh GeO2.[82]
Dalam beberapa tahun terakhir, germanium semakin banyak digunakan dalam paduan logam berharga. Dalam paduan perak sterling, misalnya, ia mengurangi kerak api, meningkatkan ketahanan noda, dan meningkatkan pengerasan presipitasi. Paduan perak tahan noda bermerek dagang Argentium mengandung 1,2% germanium.[27]
Pendeteksi semikonduktor yang terbuat dari kristal tunggal germanium dengan kemurnian tinggi dapat dengan tepat mengidentifikasi sumber radiasi—misalnya dalam keamanan bandara.[83] Germanium berguna sebagai monokromator untuk garis berkas yang digunakan dalam hamburan neutron kristal tunggal dan difraksi sinar-X sinkrotron. Reflektivitasnya memiliki keunggulan dibandingkan silikon dalam aplikasi neutron dan sinar-X berenergi tinggi.[84] Kristal germanium dengan kemurnian tinggi digunakan dalam pendeteksi untuk spektroskopi gama dan pencarian materi gelap.[85] Kristal germanium juga digunakan dalam spektrometer sinar-X untuk penentuan fosforus, klorin, dan belerang.[86]
Germanium muncul sebagai bahan penting dalam spintronika dan aplikasi komputasi kuantum berbasis spin. Pada tahun 2010, para peneliti mendemonstrasikan transpor spin suhu kamar[87] dan baru-baru ini spin elektron donor pada germanium telah terbukti memiliki waktu koherensi yang sangat lama.[88]
Remove ads
Kepentingan strategis
Ringkasan
Perspektif
Karena penggunaannya dalam elektronika dan optika canggih, germanium dianggap sebagai unsur kritis teknologi (misalnya oleh Uni Eropa), penting untuk memenuhi transisi hijau dan digital. Karena Tiongkok menguasai 60% produksi germanium global, Tiongkok memegang posisi dominan atas rantai pasokan dunia. Pada 3 Juli 2023, Tiongkok tiba-tiba memberlakukan pembatasan ekspor germanium (dan galium), meningkatkan ketegangan perdagangan dengan sekutu Barat. Meminta "kepentingan keamanan nasional", Kementerian Perdagangan Tiongkok menginformasikan bahwa perusahaan yang berniat menjual produk yang mengandung germanium memerlukan lisensi ekspor.[catatan 4] Tiongkok melihat produk seperti itu sebagai barang "penggunaan ganda" yang mungkin memiliki tujuan militer sehingga membutuhkan pengawasan ekstra. Perselisihan baru membuka babak baru dalam perlombaan teknologi yang semakin sengit yang mengadu Amerika Serikat, dan pada tingkat yang lebih rendah Eropa, melawan Tiongkok. A.S. ingin sekutunya untuk mengekang, atau benar-benar melarang, komponen elektronik canggih yang terikat ke pasar Tiongkok untuk mencegah Beijing mengamankan supremasi teknologi global dan menantang tatanan internasional yang dipimpin Barat. Tiongkok membantah niat tit-for-tat di balik pembatasan ekspor germanium.[89][90][91] Setelah pembatasan ekspor Tiongkok, perusahaan milik negara Rusia Rostec mengumumkan peningkatan produksi germanium untuk memenuhi permintaan domestik.[92]
Remove ads
Germanium dan kesehatan
Ringkasan
Perspektif
Germanium tidak dianggap penting untuk kesehatan tumbuhan atau hewan.[93] Germanium di lingkungan memiliki sedikit atau tidak ada dampak kesehatan. Hal ini dikarenakan terutama karena ia biasanya hanya terjadi sebagai unsur jejak dalam bijih dan bahan berkarbon, serta berbagai aplikasi industri dan elektronik melibatkan jumlah yang sangat kecil yang tidak mungkin tertelan.[27] Untuk alasan yang sama, penggunaan akhir germanium berdampak kecil terhadap lingkungan sebagai bahaya lingkungan. Beberapa senyawa perantara reaktif germanium bersifat racun (lihat tindakan pencegahan, di bawah).[94]
Suplemen germanium, yang terbuat dari germanium organik dan anorganik, telah dipasarkan sebagai obat alternatif yang mampu mengobati leukemia dan kanker paru-paru.[24] Namun, tidak ada bukti medis yang bermanfaat; beberapa bukti menunjukkan bahwa suplemen semacam itu secara aktif berbahaya.[93] Penelitian yang dilakukan Badan Pengawas Obat dan Makanan A.S. (FDA) telah menyimpulkan bahwa germanium anorganik, bila digunakan sebagai suplemen nutrisi, dapat "menghadirkan potensi bahaya kesehatan manusia".[48]
Beberapa senyawa germanium telah diberikan oleh praktisi medis alternatif sebagai larutan injeksi yang tidak diizinkan oleh FDA. Bentuk germanium anorganik terlarut yang digunakan pada awalnya, terutama garam sitrat-laktat, mengakibatkan beberapa kasus disfungsi ginjal, steatosis hati, dan neuropati periferal pada individu yang menggunakannya dalam jangka panjang. Konsentrasi germanium plasma dan urine pada orang-orang ini, beberapa di antaranya meninggal, beberapa kali lipat lebih besar daripada tingkat endogen. Bentuk organik yang lebih baru, beta-karboksietilgermanium sesquioksida (propagermanium), belum menunjukkan spektrum efek toksik yang sama.[95]
Senyawa germanium tertentu memiliki toksisitas rendah terhadap mamalia, tetapi memiliki efek toksik terhadap bakteri tertentu.[29]
Tindakan pencegahan untuk senyawa germanium yang reaktif secara kimia
Meskipun penggunaan germanium itu sendiri tidak memerlukan tindakan pencegahan, beberapa senyawa germanium buatan cukup reaktif dan menimbulkan bahaya langsung bagi kesehatan manusia jika terpapar. Misalnya, germanium klorida dan germana (GeH4), masing-masing berwujud cairan dan gas, dapat sangat mengiritasi mata, kulit, paru-paru, dan tenggorokan.[96]
Remove ads
Lihat pula
- Germanena
- Sejarah transistor
Catatan
Referensi
Pranala luar
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
Remove ads




