kémiai elem, rendszáma 43, vegyjele Tc From Wikipedia, the free encyclopedia
A technécium a legkisebb rendszámú kémiai elem, amelynek nincs stabil izotópja. Rendszáma 43, vegyjele Tc. Ezüstszürke átmenetifém. Kémiai tulajdonságait tekintve a mangán és a rénium között áll. A technécium nagy része szintetikusan előállított, és csak nagyon kis mennyiségben található meg a természetben, amely az urán spontán maghasadásából, vagy molibdénércek neutronbefogással történő átalakulásából származik.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Általános | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Név, vegyjel, rendszám | technécium, Tc, 43 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Latin megnevezés | technetium | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elemi sorozat | átmenetifémek | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Csoport, periódus, mező | 7, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Megjelenés | ezüstszürke | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomtömeg | (98) g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronszerkezet | [Kr] 4d5 5s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronok héjanként | 2, 8, 18, 13, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikai tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Halmazállapot | szilárd | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sűrűség (szobahőm.) | 11 g/cm³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáspont | 2430 K (2157 °C, 3915 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Forráspont | 4538 K (4265 °C, 7709 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Olvadáshő | 33,29 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Párolgáshő | 585,2 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moláris hőkapacitás | (25 °C) 24,27 J/(mol·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomi tulajdonságok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristályszerkezet | hexagonális | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidációs szám | 7 (erősen savas oxid) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitás | 1,9 (Pauling-skála) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronaffinitás | -53 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizációs energia | 1.: 702 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.: 1470 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.: 2850 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár | 135 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomsugár (számított) | 183 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalens sugár | 156 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Egyebek | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mágnesség | nincs adat | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hővezetési tényező | (300 K) 50,6W/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS-szám | 7440-26-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fontosabb izotópok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hivatkozások | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
A technécium sok tulajdonságát már Dmitrij Ivanovics Mengyelejev megjósolta, mielőtt azt felfedezték volna. Mengyelejev ekamangánként hivatkozott rá periódusos rendszerében. 1937-ben gyártottak először technéciumot (technécium-97-et), a név a görög τεχνητός (tekhnetosz), „mesterséges” szóból származik).
A metastabil gammasugárzó technécium-99-et orvosdiagnosztikai tesztek készítésére használják. A hosszú élettartamú technécium izotópok az urán-235 maghasadásának melléktermékei az atomreaktorokban, és a fűtőanyagrudakból nyerik őket.
1861-től egészen 1871-ig a Mengyelejev által javasolt korai periódusos rendszer egy rést tartalmazott a molibdén (Z=42) és a ruténium között (Z=44). 1871-ben Mengyelejev megjósolta, hogy ez a hiányzó elem foglalhatja el a mangán alatti üres helyet, így annak hasonló kémiai tulajdonságokkal kell rendelkeznie. Mengyelejev az ekamangán (Em) nevet adta neki a szanszkrit „eka” előtag után, mely itt arra utal, hogy a mangán alatt eggyel helyezkedik el a keresett elem.
Sok kutató versengett megtalálásáért a periódusos rendszer megalkotása előtt és után egyaránt, mivel periódusos rendszerbeli elhelyezkedése alapján feltételezték, hogy könnyebben detektálható, mint más még felfedezésre váró elemek. Először vélték 1828-ban, hogy a platina ércben találták meg, és a polinium nevet adták neki, de erről kiderült, hogy nem más, mint szennyezett irídium. 1846-ban ismét bejelentették a felfedezését ilmenium néven, de ez valójában szennyezett nióbium volt. Ugyanezt a hibát követték el 1847-ben, akkor pelopium néven hivatkoztak az új elemre.
1877-ben Szergej Kern orosz vegyész bejelentette, hogy a hiányzó elemet megtalálta a platinaércben. Kern az elemre davyum néven hivatkozott (Sir Humphry Davy angol kémikus után), de kiderült, hogy ez irídium, ródium és vas keveréke. Egy újabb lehetséges jelöltről, a luciumról bebizonyosodott, hogy ittrium. 1908-ban a japán tudós, Masataka Ogawa úgy vélte, bizonyítékot talált arra nézve, hogy a hiányzó 43-as rendszámú elem a thorianit nevű ásványban van jelen. Ogawa az elemet Japán után (mely japánul Nippon) nippóniumnak nevezte el. 2004-ben Yoshihara röntgenspektroszkópiával nem tudta kimutatni az Ogawa hagyatékában talált fotólemezen őrzött mintában a keresett elemet, helyette réniumot talált.
Walter Noddack, Otto Berg és Ida Noddack publikálták a 75-ös és a 43-as rendszámú elem felfedezését 1925-ben, utóbbit mazurium névre keresztelték, mivel Noddack családja a Mazuri-tóvidékről származott.[1] A kutatócsoport columbitot (niobit) bombázott elektronsugárral, és arra következtetett, hogy a 43-as rendszámú elem gyenge jele megtalálható a kiértékeléskor kapott röntgendiffrakciós spektrogramon. A hullámhosszak és a rendszám kapcsolatát Henry Moseley 1913-as összefüggése szolgáltatta. Későbbi kutatások nem tudták reprodukálni kísérletüket, így ma is viták tárgyát képezi, hogy valóban megtalálta-e a csoport a később technéciumnak nevezett elemet.

A 43-as rendszámú elem létezését hivatalosan 1936 decemberében erősítette meg a Palermói Egyetem két kutatója, Carlo Perrier és Emilio Segrè. Segrè az 1930-as évek közepén a Columbia Egyetemen és a Lawrence Berkeley National Laboratory-ban tett látogatása során rávette Ernest Lawrence amerikai Nobel-díjas fizikust, hogy az általa felfedezett ciklotronból származó radioaktív hulladékból kaphasson mintát. Lawrence molibdénfóliát bocsátott rendelkezésére a készülék deflektoráról.
Segrè rábeszélte palermói kollégáját, Perrier-t, hogy összehasonlító kémiai elemzés segítségével bizonyítsák be, hogy a molibdénnek tulajdonított aktivitás valójában a 43-as rendszámú elemtől származik. A mintából sikerült izolálniuk a technécium-95 és technécium-97 izotópokat. A technécium elnevezést 1947-ben kapta az elem. Segrè visszatérve Berkeley-be, találkozott Glenn T. Seaborg (kémiai) Nobel-díjas tudóssal, akivel sikerült izolálnia a technécium-99m-et (az „m” az elem fizikai kémiai metastabilitására utal). Segrè-t 1959-ben fizikai Nobel-díjjal jutalmazták az antiproton felfedezéséért, a technécium mellett még az asztácium (At) felfedezése is a nevéhez fűződik.
1959-ben Paul W. Merrill Kaliforniában vizsgálódva észlelte a technéciumra jellemző emissziós spektrumot az S típusú vörös óriásokból. Ezek a csillagok életük vége felé nagy mennyiségű technéciumot halmoznak fel, amelyek magreakciók jelenlétét bizonyítják. Ez a bizonyíték támasztotta alá a korábban feltételezett elméletet, miszerint a csillagokban nehéz elemek nukleoszintézise is végbemehet. Újabban bizonyították, hogy ez neutron befogásával valósul meg.
Hivatalos felfedezése után sok kutatást folytattak arra nézve, vajon megtalálható-e a Földön természetes forrású technécium. 1962-ben, Belga Kongóban sikerült izolálni rendkívül kis mennyiségben uránszurokércből (kb. 0,2 ng/kg), ahol valószínűleg urán-238 spontán hasadásával keletkezik. Arra vonatkozóan is találtak bizonyítékot, hogy az oklói természetes atomreaktor jelentős mennyiségű technécium-99-et termelt, amely azonban azóta ruténium-99-cé bomlott. Adott pillanatban a földkéregben az uránércben és tóriumércben végbemenő spontán hasadás, valamint a molibdén neutronbefogása következtében – figyelembe véve, hogy egy kilogramm urán kb. 1 nanogramm (10−9 g) technéciumot tartalmaz – mintegy 18 ezer tonna technécium található.[2][3][4]

A technécium ezüstszürkés, radioaktív, megjelenésében a platinához hasonlatos fém. Rendszerint szürke por formájában nyerhető ki. Az atomos technécium emissziós vonalai az alábbi hullámhosszakon található: 363,3 nm, 403,1 nm, 426,2 nm, 429,7 nm és 485,3 nm.[5]
A fém enyhén paramágneses tulajdonságú, mely azt jelenti, hogy külső mágneses tér hatására megfelelő irányba rendeződnek a mágneses dipólusok, de a mező megszűnése után véletlenszerűen állnak be. A tiszta egykristály technécium 2-es típusú szupravezetőként működik 7,46 K alatti hőmérsékleteken.[6] E hőmérséklet alatt a fém London-féle mágneses behatolási mélysége rendkívüli mértékben megnő, az elemek között a nióbium után a második legnagyobb értéket adja.[7]
A technécium a periódusos rendszer VII. B mellékcsoportjában található a rénium és a mangán között. A technécium a réniumhoz hasonlóan kémiailag inert (kevéssé reakcióképes), és kötései kovalens jellegűek.[8] A mangántól eltérően nem alkot készségesen kationokat (pozitív töltésű ionok). Jellemző oxidációs állapotok: +4, +5, +7.[9] A technécium oldódik királyvízben, salétromsavban és tömény kénsavban, de sósavban egyáltalán nem.[10]
A technécium hidrogénnel való reakciója során TcH2−9 [technéciumhidrid (II)-anion], melynek szerkezete ugyanaz, mint a ReH2−9-é. Bár a szerkezetet adó hidrogénatomok geometriai elrendeződése nem ekvivalens, az elektronszerkezet majdnem ugyanaz. A komplex ion két hidrogénatomja kicserélhető Na+ és K+-ionokra.
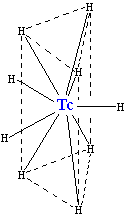
A fémtechnécium páradús levegőben könnyen korrodálódik,[9] por alakban oxigénnel egyesül. Kétféle oxidját sikerült előállítani eddig: TcO2 és Tc2O7. Oxidatív körülmények között technécium (VII)-kation keletkezhet, amely pertechnetátionként létezik (TcO−4).[9][11] 400-450 °C között halványsárga technécium-heptoxiddá alakul:
A technécium-heptoxid a nátrium-pertechnetát gyártásának kiindulási anyaga (prekurzora):
A fekete színű technécium-dioxid (TcO2) a heptoxid formából nyerhető fémtechnéciummal vagy hidrogénnel történő redukcióval.
A pertechnéciumsav (HTcO4) gyártása technécium-heptoxidból vízzel vagy más oxidáló savval, pl. salétromsavval, tömény kénsavval, királyvízzel vagy sósavas-salétromsavas eleggyel történik. A keletkező sötétvörös, higroszkópos (vízmegkötő tulajdonságú) anyag erős sav, így könnyen adja le protonját.
A pertechnetát (tetroxidotechnetát) anion (TcO−4) tetraéderes szerkezetű, a csúcsokban az oxigénatomok, a centrumban a Tc-atom helyezkedik el. A permanganátionnal ellentétben a pertechnetátion csak gyenge oxidáló reagens. A pertechnetátot gyakran használják katalizátorként, valamint a technéciumizotópok kényelmes vízoldható forrásaként.
A technécium többféle szulfidot képez. TcS2 előállítható fémtechnécium (Tc) és elemi kén (S8) direkt szintézisével (közvetlen reakciójával), míg a Tc2S7 az alábbi reakció alapján állítható elő:
Melegítés hatására a technécium-heptaszulfid diszulfidra és elemi kénre bomlik:
Szelénnel és tellúrral a fentiek analógiájára játszódnak le reakciók.

Számos technéciumklaszter ismert, például a Tc4, Tc6, Tc8 és Tc13.[13][14] Stabilabbak a Tc6, Tc8. Számos szerves technéciumkomplexet sikerült előállítani, amelyek szerkezete viszonylag jól ismert és behatóan tanulmányozott az orvostudományban való gyakorlati jelentősége miatt.
A ditechnécium-dekakarbonil (Tc2(CO)10) fehér szilárd anyag. Ebben a molekulában két technéciumatom kapcsolódik össze jóval gyengébben, mint az kovalens kötés esetében jellemző, amit a 303 pm-es viszonylag nagy kötéstávolság is igazol. A két technéciumatomot oktaéderes alakzatban veszi körül a 10 karbonilligandum, ily módon telítődnek a megfelelő s, p és d alhéjak (ehhez tehát összesen 18 elektron szükséges). A technéciumatom 7 db d-pályán tartózkodó elektront tartalmaz, ehhez hozzáadódik a karbonilligandumok 2*5 db elektronja. Mivel ebből összesen 17 elektron származik, ez pedig kedvezőtlen, ezért két technéciumatom összekapcsolódásával érhető el a héj telítettsége, így a komplex energiaminimuma.
Az ábrán látható szerves technéciumkomplexet szintén az orvostudományban hasznosítják.
Az orvostudományban a technécium-99m izotópot radioaktív nyomjelzőként használják. E célra jól megfelel, mivel 140 keV-os gamma-sugárzása az orvosdiagnosztikai eszközökkel könnyen észlelhető, és felezési ideje 6,01 óra, ami azt jelenti, hogy 24 órán belül 94%-a lebomlik az emberi testben. Legalább 31-féle széles körben használt technécium-99m alapú radiofarmakont használnak az agy, szívizom, pajzsmirigy, máj, tüdő, vese, epehólyag, a csontrendszer, a vér és tumorok funkcionális és képalkotó vizsgálatában.[15]
Az orvostudományon kívül felhasználják még a vegyiparban katalizátorként. Néhány esetben, pl. izopropanol dehidrogénezése során hatékonyabb, mint a rénium vagy a palládium.[16] A kálium-pertechnetát 55 ppm-nyi koncentrációban megakadályozza az acél korrózióját vízbe merítés esetén akár 250 °C-ig is.[17]
A hosszabb (61 nap) felezési idejű technécium-95m izotóp segítségével az állat- és növényvilágban a technécium mozgását tanulmányozzák, követik nyomon.[18]
A technéciumnak nincs természetes biológiai szerepe, és nem található meg az emberi testben.[10] Kémiai toxicitása csekély. Egy vizsgálatban, melynek során patkányokat több héten át akár 15 μg/g technécium-99 tartalmú táplálékkal etettek, nem tapasztaltak jelentős elváltozást a vérösszetételben, a test vagy szervek tömegében, valamint az étkezési szokásokban sem.[19]
A radiológiai toxicitás függ a szóban forgó vegyülettől, a felezési időtől és a sugárzás típusától.[20] Mindegyik izotópjával óvatosan kell bánni. A technécium-99 gyenge béta-sugárzó anyag, amelyet már a laboratóriumi üvegfal is elnyel. Az elsődleges kockázatot a technécium porának belélegzése okozza, amely jelentős mértékben járulhat hozzá rák kialakulásához. A biztonságos munkához többnyire elegendő az elszívófülke, kesztyűsbox használata nem szükséges.[21]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.