Ácido propiónico
composto químico From Wikipedia, the free encyclopedia
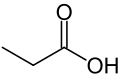
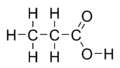
O ácido propiónico ou ácido propanoico é un ácido carboxílico que pode encontrarse naturalmente, coa fórmula molecular C3H6O2 e fórmula semidesenvolvida CH3-CH2-COOH. En estado puro, é un líquido incoloro, corrosivo de cheiro acre cunha densidade de 0.99 g/cm3 e unha masa molar de 74,08 g/mol.
| Ácido propiónico | |
|---|---|
 |
 |
 |
 |
Propanoic acid | |
Outros nomes Ácido etanocarboxílico | |
| Identificadores | |
| Número CAS | 79-09-4 |
| PubChem | 1032 |
| ChemSpider | 1005 |
| DrugBank | DB03766 |
| ChEBI | CHEBI:30768 |
| ChEMBL | CHEMBL14021 |
| Ligando IUPHAR | 1062 |
| Número RTECS | UE5950000 |
| Imaxes 3D Jmol | Image 1 Image 3 |
| |
| |
| Propiedades | |
| Fórmula molecular | C3H6O2 |
| Masa molar | 74,08 g mol−1 |
| Aspecto | Líquido aceitoso incoloro[1] |
| Olor | Picante, rancio, desagradable[1] |
| Densidade | 0,98797 g/cm3[2] |
| Punto de fusión | −205,0 °C; −337,0 °F; 68,1 K |
| Punto de ebulición | 14 115 °C; 25 439 °F; 14 388 K |
Condicións de sublimación |
Sublima a −48 °C ΔsublH |
| Solubilidade en auga | 8,19 g/g (−28,3 °C) 34,97 g/g (−23,9 °C) Miscible (≥ −19,3 °C)[4] |
| Solubilidade | Miscible en etanol, éter, cloroformo[5] |
| log P | 0,33[6] |
| Presión de vapor | 0,32 kPa (20 °C)[7] 0,47 kPa (25 °C)[6] 9,62 kPa (100 °C)[3] |
| kH | 4,45·10−4 L·atm/mol[6] |
| Acidez (pKa) | 4,88[6] |
| Estrutura | |
| Momento dipolar | 0,63 D (22 °C)[2] |
| Termoquímica | |
| Entalpía estándar de formación ΔfH |
−510,8 kJ/mol[3] |
| Entalpía estándar de combustión ΔcH |
1527,3 kJ/mol[2][3] |
| Entropía molar estándar S |
191 J/mol·K[3] |
| Capacidade calorífica, C | 152,8 J/mol·K[5][3] |
| Perigosidade | |
| Pictogramas GHS | 
|
| Palabra sinal GHS | Danger |
| declaración de perigosidade GHS | H314[7] |
| declaración de precaución GHS | P280, P305+351+338, P310[7] |
| Clasificación da UE | |
| Frases R | R10, R34 |
| Frases S | S1/2, S23, S36, S45 |
| Principais perigos | Corrosivo |
| NFPA 704 | |
| Punto de inflamabilidade | 54 °C; 129 °F; 327 K |
| LD50 | 1370 mg/kg (oral, rato branco)[5] |
| Compostos relacionados | |
| Outros anións | Propanoato |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O seu anión (CH3-CH2-COO-), ésteres e sales reciben o nome de propionatos ou propanoatos.
Historia
O ácido propiónico foi descrito inicialmente en 1844 por Johann Gottlieb, que o encontrou entre os produtos da degradación do azucre. Nos anos sucesivos outros químicos sintetizárono con outros métodos, mais sen decatárense que estaban obtendo a mesma substancia. En 1847 o químico francés Jean-Baptiste Dumas estableceu que todos os ácidos obtidos eran o mesmo composto. El chamouno ácido propiónico, das palabras gregas protos (primeiro) e pion (graxa) porque era o ácido carboxílico máis pequeno (de fórmula H (CH2)nCOOH) que mostraba as características típicas dos ácidos graxos, como producir unha capa aceitosa cando se saliniza a auga, e ter un sal potásico xabonoso.
Propiedades
O ácido propiónico ou propanoico ten características físicas intermedias entre as dos ácidos carboxílicos máis pequenos (como o ácido fórmico e acético), e os ácidos graxos máis grandes. É miscible con auga, pero pode ser retirado da auga engadindo sal. Como os ácidos acético e fórmico, o seu vapor non consiste en moléculas separadas do ácido, senón en pares de moléculas unidas por enlaces de hidróxeno. Tamén mostra este emparellamento de moléculas en estado líquido.
Quimicamente, mostra as características xerais dos ácidos carboxílicos, e como a maioría, pode formar derivados de tipo amida (propanamida), éster, anhídrido, e derivados do cloro. Pode experimentar a alfa-haloxenación con bromo en presenza de PBr3 como catalizador (a reacción de HVZ) para formar CH3-CHBr-COOH.
Síntese
Na industria pode producirse por hidrocarboxilación do etileno, segundo a reacción:[8]
- H2C=CH2 + H2O + CO → CH3CH2CO2H
Outro modo de produción industrial é a partir da oxidación aeróbica de propanal. En presenza de catións de cobalto ou manganeso, esta reacción procede rapidamente mesmo a temperaturas baixas. Normalmente este proceso realízase a temperaturas entre 40 °C e 50 °C, segundo a seguinte ecuación:
- H3C-CH2-CHO (propanal) + ½ O2 → H3C-CH2-COOH
Antigamente producíanse grandes cantidades de ácido propiónico como subproduto do ácido acético. Pero os cambios no método de produción do acético, fixeron que na actualidade esta sexa unha fonte menor. O maior produtor do mundo é BASF, cunha capacidade de produción anual de aproximadamente 80.000 toneladas.
Metabolismo
O ácido propiónico prodúcese bioloxicamente pola degradación metabólica de ácidos graxos de número de carbonos impar, e dos aminoácidos isoleucina, metionina e valina. Nestas reaccións fórmase o tioéster propionil-CoA.
O metabolismo do ácido propiónico comeza coa súa conversión en propionil-CoA. Como ten tres carbonos (número impar) non pode entrar directamente na beta oxidación ou no ciclo do ácido cítrico. Na maioría dos vertebrados, o propionil-CoA é carboxilado a D-metilmalonil-CoA, que se isomeriza a L-metilmalonil-CoA. Un encima dependente da vitamina B12 cataliza a conversión do L-metilmalonil-CoA a succinil-CoA, que é un intermediario do ciclo do ácido cítrico e pode incorporarse a el doadamente.
As bacterias do xénero Propionibacterium prodúceno como produto final do seu metabolsimo anaeróbico (fermentacións). Estas bacterias atópanse comunmente nos estómagos de ruminantes e na pel humana, e a súa actividade é parcialmente responsable do cheiro do queixo suízo e da suor.
Acidemia propiónica
Na acidemia propiónica (ou aciduria propiónica), un trastorno hereditario raro, o propionato actúa como unha toxina metabólica para os hepatocitos do fígado, acumulándose nas mitocondrias como propionil-CoA e o seu derivado, metilcitrato, que son inhibidores do ciclo do ácido cítrico. O propanoato é metabolizado oxidativamente polas células da glía, o cal suxire que os astrocitos son vulnerables na acidemia propiónica cando se acumula propionil-CoA. A acidemia proipiónica pode alterar a expresión xénica neuronal e glial ao afectar á acetilación das histonas.[9][10] Cando se infunde ácido propiónico directamente no cerebro de roedores orixina neles cambios de comportamento e cerebrais (neuroinflamación, depleción dos niveis de glutatión) que poden utilizarse como un medio para modelar o autismo en ratas.[9]
Acne
Na pel humana viven moitas propionibacterias, que producen ácido propiónico. A máis salientable é a Propionibacterium acnes, que vive principalmente nas glándulas sebáceas e é unha das principais causantes da acne.
Aplicacións
Utilízase moito como conservante. O ácido propiónico inhibe o crecemento de balores e dalgunhas bacterias. Por iso a maioría do que se produce utilízase como conservante para o penso e para alimentos de consumo humano. Para o penso utilízase directamente, ou como o seu sal de amonio. Favorece o crecemento das bacterias propiónicas no rume dos herbívoros e mellora o procesamento da comida.
Nos alimentos humanos, especialmente o pan e outros produtos cocidos ao forno, utilízase o seu sal de sodio ou de calcio [8]. Como aditivo alimentario o seu uso está aprobado na Unión Europea,[11] EEUU [12] e Australia e Nova Zelandia [13]. O seu número E é o E280.
Tamén se utilizaba de maneira similar nalgúns dos antigos pos antimicóticos para os pés. Tamén se emprega para modificar fibras sintéticas de polímeros, en pesticidas, produtos farmacéuticos, e os seus ésteres como solventes ou saborizantes artificiais [8].
Seguridade
O principal perigo que ten son as queimaduras químicas que poden producirse ao contacto co líquido concentrado. En estudos en animais de laboratorio, o único efecto de saúde adverso asociado á exposición a longo prazo con cantidades pequenas deste ácido foi a formación de ulceracións de esófago e estómago por consumo. Non se observaron efectos tóxicos, mutaxénicos, carcinóxenos ou reprodutivos.
No corpo é rapidamente oxidado, metabolizado, e eliminado do corpo como dióxido de carbono no ciclo de Krebs (vía propionil-CoA → metilmalonil-CoA → succinil-CoA), e por iso non é bioacumulable.
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.

