proteína presente no núcleo celular dos eucariotas que empaqueta e ordena o ADN en nucleosomas From Wikipedia, the free encyclopedia
As histonas son proteínas con moitos residuos alcalinos ou básicos presentes no núcleo celular dos eucariotas que empaquetan e ordenan o ADN en unidades estruturais chamadas nucleosomas.[1][2] Son os principais compoñentes proteicos da cromatina, actúan como unha especie de carretes aredor dos cales se enrola o ADN, e xogan un papel importante na regulación xénica. Sen histonas o ADN estaría desenrolado nos cromosomas e sería moi longo (a razón lonxitude/largura sería de máis de 10 millóns a 1 no ADN humano). Por exemplo, cada célula humana ten uns 1,8 metros de ADN, pero se están enrolados sobre as histonas formando cromatina ten só uns 90 milímetros (0,09 m), e, máis tarde, cando se duplica e condensa a cromosomas durante a mitose, ocupa unha lonxitude de só 120 micrómetros.[3]
| Histona | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||
| Identificadores | |||||||||||
| Símbolo | Core histone | ||||||||||
| Pfam | PF00125 | ||||||||||
| Pfam clan | CL0012 | ||||||||||
| InterPro | IPR007125 | ||||||||||
| SCOPe | 1hio / SUPFAM | ||||||||||
| |||||||||||
A secuencia de aminoácidos das histonas está moi conservada evolutivamente e poden ser agrupadas en cinco clases principais: H1/H5, H2A, H2B, H3, e H4.[2][4][5] Estes 5 tipos están agrupados nas dúas superclases seguintes:
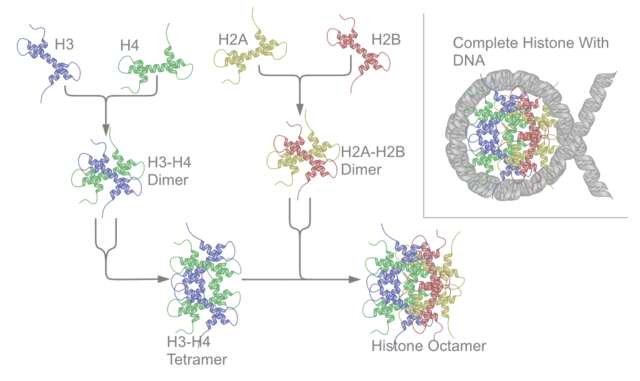
Cada unha das histonas core ensámblase con outra igual, e despois ensámblanse todas xuntas para formar os octámeros dos nucleosomas, orixinando unha especie de carrete no que se enrolan 147 pares de bases de ADN formando unha superhélice que se enrola á esquerda e dá 1,65 voltas ao carrete.[6] As histonas de unión H1 únense ao nucleosoma e aos puntos de entrada e saída do ADN do octámero, de maneira que fixan o ADN no seu lugar[7] o que permite a formación dunha estrutura de orde superior. A máis básica de tales estruturas é a fibra de 10 nm da cromatina ou conformación en colar de doas. Isto implica o enrolamento do ADN arredor dos nucleosomas deixando un tramo de ADN de aproximadamente 50 pares de bases que separa cada dous nucleosomas, chamado ADN espazador. O conxunto das histonas ensambladas e o ADN chámase cromatina. As estruturas de orde superior que pode formar a cromatina son a fibra cromatínica de 30 nm (que forma un zigzag irregular) e a fibra de 100 nm, que se poden atopar en células interfásicas. Durante a mitose e a meiose, unha maior condensación da cromatina orixina os cromosomas, formados polas interaccións entre os nucleosomas e outras proteínas reguladoras.
A seguinte é unha lista das proteínas histonas humanas:
| Superfamilia | Familia | Subfamilia | Membros |
|---|---|---|---|
| Histonas de unión ou enlace (linker) | |||
| H1 | |||
| H1F | H1F0, H1FNT, H1FOO, H1FX | ||
| H1H1 | HIST1H1A, HIST1H1B, HIST1H1C, HIST1H1D, HIST1H1E, HIST1H1T | ||
| Histonas do octámero (core) | |||
| H2A | |||
| H2AF | H2AFB1, H2AFB2, H2AFB3, H2AFJ, H2AFV, H2AFX, H2AFY, H2AFY2, H2AFZ | ||
| H2A1 | HIST1H2AA, HIST1H2AB, HIST1H2AC, HIST1H2AD, HIST1H2AE, HIST1H2AG, HIST1H2AI, HIST1H2AJ, HIST1H2AK, HIST1H2AL, HIST1H2AM | ||
| H2A2 | HIST2H2AA3, HIST2H2AC | ||
| H2B | |||
| H2BF | H2BFM, H2BFO, H2BFS, H2BFWT | ||
| H2B1 | HIST1H2BA, HIST1H2BB, HIST1H2BC, HIST1H2BD, HIST1H2BE, HIST1H2BF, HIST1H2BG, HIST1H2BH, HIST1H2BI, HIST1H2BJ, HIST1H2BK, HIST1H2BL, HIST1H2BM, HIST1H2BN, HIST1H2BO | ||
| H2B2 | HIST2H2BE | ||
| H3 | |||
| H3A1 | HIST1H3A, HIST1H3B, HIST1H3C, HIST1H3D, HIST1H3E, HIST1H3F, HIST1H3G, HIST1H3H, HIST1H3I, HIST1H3J | ||
| H3A2 | HIST2H3C | ||
| H3A3 | HIST3H3 | ||
| H4 | |||
| H41 | HIST1H4A, HIST1H4B, HIST1H4C, HIST1H4D, HIST1H4E, HIST1H4F, HIST1H4G, HIST1H4H, HIST1H4I, HIST1H4J, HIST1H4K, HIST1H4L | ||
| H44 | HIST4H4 |

O octámero ou core do nucleosoma está formado por dous dímeros das proteínas H2A-H2B e un tetrámero H3-H4, que forman dúas metades case simétricas na estrutura terciaria (simetría C2; unha macromolécula é a imaxe especular da outra).[6] Os dímeros H2A-H2B e o tetrámero H3-H4 tamén mostran unha simetría pseudodíada. As 4 histonas core (H2A, H2B, H3 e H4) son relativamente semellantes en estrutura e a súa secuencia está moi conservada na evolución, e todas presentan un motivo estrutural "hélice xiro hélice xiro hélice" (que permite unha fácil formación do dímero). Tamén comparten a característica de teren longas "colas" nun extremo da súa cadea de aminoácidos, que é a parte na que se producen as modificacións postraducionais (véxase máis adiante).
Tense proposto que as proteínas histonas están relacionadas evolutivamente coa parte helicoidal do dominio AAA+ ATPase estendido, co dominio C, e co dominio de recoñecemento de substrato N-terminal das proteínas Clp/Hsp100. Malia as diferenzas na súa topoloxía, estes tres pregamentos comparten un motivo homólogo hélice-cadea-hélice.[8]
A distancia entre nucleosomas foi medida por investigadores británicos usando a técnica da resonancia magnética de electróns, e variaba de 59 a 70 Å.[9]
As histonas poden establecer cinco tipos de interaccións co ADN:
A natureza moi básica das histonas, ademais de facilitar as interaccións ADN-histonas, contribúe á súa solubilidade en auga.
As histonas están suxeitas a modificacións postraducionais realizadas por encimas, fundamentalmente nas colas N-terminais, mais tamén nos dominios globulares .[10] Estas modificacións afectan á súa función de regulación xénica (ver funcións). Tales modificacións inclúen:
As histonas actúan como carretes arredor dos cales se enrola o ADN. Isto permite a compactación necesaria para acomodar os grandes xenomas eucarióticos dentro do núcleo celular. A molécula compactada é 40.000 veces máis curta ca a molécula sen compactar.
As histonas sofren modificacións postraducionais que alteran a súa interacción co ADN e as proteínas nucleares. As histonas H3 e H4 teñen longas colas que saen do nucleosoma, que poden ser modificadas covalentemente en varios puntos. Estas modificacións inclúen metilación, acetilación, fosforilación, ubiquitinación, SUMOilación, citrulinación, e ADP-ribosilación. Ademais das colas, a parte central das the histonas H2A, H2B, e H3 pode tamén modificarse. Pénsase que certas combinacións de modificacións constitúen un código, o chamado "código de histonas".[11][12] A modificación de histonas intervén en diversos procesos bioloxicos como a regulación xénica, a reparación do ADN e a condensación cromosómica (mitose) e espermatoxénese (meiose).[13]
A nomenclatura normal para indicar as modificacións nas histonas consta de varias parte, e é:
Así H3K4me1 significa monometilación do 4º residuo (unha lisina) empezando polo principio (extremo N-terminal) da proteína H3.
Exemplos de modificacións de histonas na regulación da transcrición son:
| Tipo de modificación |
Histona | ||||||
|---|---|---|---|---|---|---|---|
| H3K4 | H3K9 | H3K14 | H3K27 | H3K79 | H4K20 | H2BK5 | |
| mono-metilación | activación[14] | activación[15] | activación[15] | activación[15][16] | activación[15] | activación[15] | |
| di-metilación | represión[17] | represión[17] | activación[16] | ||||
| tri-metilación | activación[18] | represión[15] | represión[15] | activación,[16] represión[15] |
represión[17] | ||
| acetilación | activación[18] | activación[18] | |||||
As histonas foron descubertas en 1884 por Albrecht Kossel. O nome histona data de finais do século XIX e procede do alemán Histon, de orixe incerta: quizais vén do grego histanai ou de histos. Ata principios da década de 1990, as histonas eran consideradas por moitos investigadores como un material de recheo para o ADN nuclear eucariótico, baseándose en parte nos modelos da "bóla e pau" de Mark Ptashne e outros que crían que a transcrición estaba activada por interaccións proteína-ADN e proteína-proteína sobre moldes de ADN basicamente espidos, como é o caso das bacterias. Durante a década de 1980s, os traballos de Michael Grunstein[19] demostraron que as histonas eucarióticas reprimían a transcrición xénica, e que a función dos activadores transcricionais é superar esta represión. Sabemos agora que as histonas xogan un papel tanto positivo coma negativo na regulación da expresión dos xenes, o que constitúe as bases do código de histonas.
O descubrimento da histona H5 parece datar da década de 1970,[20][21] e na clasificación foi agrupada coa histona H1.[2][4][5]
As histonas atopáronse no núcleo das células eucariotas e en certas Archaea, concretamente as euriarqueas, pero non en bacterias. As histonas das arqueas poden ser parecidas aos precursores das histonas eucarióticas. As histonas están entre as proteínas coa secuencia máis conservada entre os eucariotas, o que indica o seu importante papel na bioloxía do núcleo.[2] Polo contrario, as células espermáticas maduras usan en gran medida protaminas para empaquetar o seu ADN xenómico (en vez de histonas), moi probablemente porque isto lles permite acadar un grao de empaquetamento aínda maior.[22]
As histonas do octámero (core) están tan conservadas, que presentan moi poucas diferenzas entre as súas secuencias de aminoácidos en diferentes especies. As histonas de unión (linker) xeralmente presentan máis dunha forma dentro dunha especie e están menos conservadas ca as outras.[23]
Hai algunhas formas variantes nalgunhas das principais clases. Estas variante comparten homoloxía na secuencia de aminoácidos e semellanza estrutural na parte central con algunha clase específica das histonas principais, pero tamén teñen as súas propias características que as distinguen das histonas principais. Estas histonas secundarias normalmente levan a cabo funcións específicas no metabolismo da cromatina. Por exemplo, a histona CenpA (similar á H3) é unha histona que está asociada exclusivamente coa rexión do centrómero do cromosoma. A variante H2A.Z da histona H2 está asociada cos promotores dos xenes que están en activa transcrición e tamén está implicada na prevención da propagación da heterocromatina silenciosa. Outra variante da H2, a H2A.X únese ao ADN que ten roturas na dobre cadea e marca a zona do ADN que está sometida a reparación. A histona H3.3 está asociada con xenes transcritos activamente.[24]
Seamless Wikipedia browsing. On steroids.
Every time you click a link to Wikipedia, Wiktionary or Wikiquote in your browser's search results, it will show the modern Wikiwand interface.
Wikiwand extension is a five stars, simple, with minimum permission required to keep your browsing private, safe and transparent.