Luciferase
clase de enzimas oxidativos que os seres vivos utilizan para produciren bioluminescencia From Wikipedia, the free encyclopedia
A luciferase é o termo xenérico co que se denomina unha clase de encimas oxidativos que os seres vivos utilizan para producir bioluminescencia e que son distintos da fotoproteína. O exemplo de máis sona é a luciferase dos vagalumes (número EC 1.13.12.7).[2] A "luciferase de vagalume" usada como reactivo de laboratorio xeralmente é a luciferase da especie Photinus pyralis, aínda que existen tamén luciferases recombinantes doutras especies de vagalumes dispoñibles comercialmente. O nome deriva do latín lucem ferre, "levar luz", coa terminación ase propia dos encimas.
| Monooxixenase similar á luciferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estrutura da flavoproteína non fluorescente de Photobacterium leiognathi.[1] | |||||||||
| Identificadores | |||||||||
| Símbolo | Bac_luciferase | ||||||||
| Pfam | PF00296 | ||||||||
| InterPro | IPR016048 | ||||||||
| PROSITE | PDOC00397 | ||||||||
| SCOPe | 1nfp / SUPFAM | ||||||||
| |||||||||
 | |
| Estrutura da luciferase do vagalume Photinus pyralis. | |
Luciferase do vagalume | |
| Identificadores | |
| Símbolo | ? |
| PDB | 1LCI Máis estruturas |
| UniProt | P08659 |
| Outros datos | |
| Número EC | 1.13.12.7 |
| Dominio catalítico da luciferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
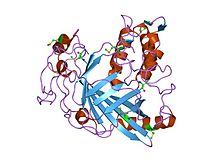 Estrutura cristalina dun dominio da luciferase do dinoflaxelado Lingulodinium polyedrum. | |||||||||
| Identificadores | |||||||||
| Símbolo | Luciferase_cat | ||||||||
| Pfam | PF10285 | ||||||||
| InterPro | IPR018804 | ||||||||
| |||||||||
Reacción química
A reacción química catalizada pola luciferase do vagalume ten lugar en dous pasos:
- luciferina + ATP → luciferil adenilato + PPi
- luciferil adenilato + O2 → oxiluciferina + AMP + luz
Emítese luz porque a reacción forma oxiluciferina nun estado excitado electrónico. A reacción libera un fotón de luz cando a oxiluciferina volve ao estado fundamental.
O luciferil adenilato pode participar adicionalmente nunha reacción co O2 na que se forma peróxido de hidróxeno e deshidroluciferil-AMP. Aproximadamente o 20% do intermediato luciferil adenilato é oxidado por esta vía.[3]
A reacción catalizada pola luciferase bacteriana é tamén un proceso oxidativo:
Na reacción un flavín mononucleótido reducido oxida un aldehido alifático de cadea longa a un ácido carboxílico alifático. A reacción forma un intermediato hidroxiflavina excitado, que é deshidratado para producir FMN e emitir luz verde-azulada.[4]
Case toda a entrada de enerxía na reacción transfórmase en luz. A reacción ten unha eficiencia entre o 80% [5] e o 90% [6]. Como comparación, unha lámpada de incandescencia corrente só converte un 10% da súa enerxía en luz,[7] e unha lámpada LED de 150 lumen por Watt (lm/W) converte o 20% da enerxía que consome en luz visible.[6]
Mecanismo
A luciferase do vagalume xera luz a partir do seu substrato a luciferina nun proceso de múltiples fases. Primeiro, a D-luciferina é adenilada polo MgATP para formar luciferil adenilato e pirofosfato. Despois da activación polo ATP, o luciferil adenilato é oxidado polo oxíxeno molecular para formar un anel de dioxetanona. Unha reacción de descarboxilación orixina un estado excitado da oxiluciferina, que se tautomeriza entre as súas formas ceto e enol. A reacción finalmente emite luz cando a oxiluciferina torna ao seu estado fundamental.[8]

Estrutura da luciferase
A estrutura proteica da luciferase de vagalume consta de dous dominios proteicos compactos: o dominio N-terminal e o C-terminal. O dominio N-terminal está composto de dúas follas β nunha estrutura αβαβα e un barril β. As dúas follas β están unha enriba da outra, e o barril β cobre a parte final das follas.[8]
O dominio C-terminal está conectado co N-terminal por unha zona bisagra flexible, que pode separar os dous dominios. A secuencia de aminoácidos da superficie de ambos os dominios que están un enfronte do outro é unha secuencia conservada nas luciferasas bacteriana e de vagalume, o que indica claramente que o sitio activo está localizado na fenda entre os dous dominios.[9]
Durante a reacción, a luciferase sofre un cambio conformacional e pasa á súa forma "pechada" na que os dous dominios se achegan e encerran entre eles o substrato. Isto asegura que a auga quedará excluída da reacción e non se hidrolizará o ATP ou o produto excitado electronicamente.[9]

Diferenzas espectrais en bioluminescencia
A cor da bioluminescencia da luciferase pode variar entre o amarelo verdoso (λmax = 550 nm) ao vermello (λmax = 620).[10] Describíronse varios mecanismos que poden explicar como a estrutura da luciferase afecta ao espectro de emisión do fotón e á cor da luz emitida.
Un mecanismo proposto supón que a cor da luz emitida depende de se o produto está en forma ceto ou enol. O mecanismo suxire que a luz vermella a emite a forma ceto da oxiluciferina, e que a luz verdosa a emite a súa forma enol.[11][12] Porén, a 5,5-dimetiloxiluciferina emite luz verde mesmo cando está restrinxida á forma ceto porque non pode tautomerizarse.[13]
Outro mecanismo propón que a torsión do ángulo entre os aneis de benzotiazol e tiazol na oxiluciferina determina a cor da bioluminescencia. Esta explicación propón que unha forma planar cun ángulo de 0° entre os dous aneis corresponde a un estado de maior enerxía e emite unha luz verde de maior enerxía; pero cun ángulo de 90° a estrutura está nun estado de menor enerxía e emite unha luz vermella de menor enerxía.[14]
A explicación máis recente da cor de bioluminescencia examina o microambiente da oxiluciferina excitada. Os estudos realizados suxiren que as interaccións entre o produto no estado excitado e os residuos de aminoácidos das proximidades poden forzar á oxiluciferina a pasar a unha forma de maior enerxía, o que dá lugar á emisión de luz verde. Por exemplo, a Arg 218 establece interaccións electrostáticas con outros residuos próximos, impedindo a tautomerización á forma enol.[15] Igualmente, outros resultados indicaron que o microambiente da luciferase pode forzar á oxiluciferina a unha estrutura máis ríxida de alta enerxía, forzándoa a emitir unha luz verde de alta enerxía.[16]
Bifuncionalidade da luciferase
A luciferase pode funcionar por dúas rutas diferentes: a vía bioluminescente e vía do CoA-ligase.[17] En ambas as dúas, a luciferase cataliza inicialmente unha reacción de adenilación con MgATP. Porén, na vía da CoA-ligase, o CoA pode desprazar o AMP para formar luciferil-CoA.
Dun modo similar a acilo graxo-CoA sintetase activa os ácidos graxos con ATP, o que vai seguido do desprazamento do AMP por CoA. Debido a estas actividades similares, a luciferase pode substituír a acilo graxo-CoA sintetase e converter ácidos graxos de cadea longa en acilos graxos-CoA por beta oxidación.[17]

Regulación
A D-luciferina é o substrato da reacción de bioluminescencia da luciferase, entanto que a L-luciferina é o substrato para a actividade de luciferil-CoA sintetase. Ambas as reaccións son inhibidas polo enantiómero do substrato: a L-luciferina inhibe a vía da bioluminescencia e a D-luciferina inhibe a vía da CoA-ligase.[18] Isto mostra que a luciferase pode diferenciar perfectamente entre os dous isómeros D e L da luciferina.
A L-luciferina pode emitir unha luz feble mesmo se é un inhibidor competitivo da D-luciferina e da vía da bioluminescencia.[19] A luz emítese porque a vía da CoA sintase pode ser convertida á reacción bioluminescente ao hidrolizar por medio dunha esterase o produto final de novo a D-luciferina.[20]
A actividade de luciferase é inhibida adicionalmente pola oxiluciferina [21] e é activada alostericamente polo ATP. Cando o ATP se une aos dous sitios alostéricos do encima, increméntase a afinidade da luciferase para unirse ao ATP no seu sitio activo.[10]
Exemplos
Varios organismos regulan a súa produción de luz utilizando diferentes luciferases en diversas reaccións emisoras de luz. A de maior sona é a dos vagalumes,[8] aínda que o encima existe en organismos tan diferentes como o cogomelo Omphalotus olearius e en moitas criaturas mariñas. Nos vagalumes requírese oxíxeno, que é subministrado por un tubo do abdome do aminal chamado traquea abdominal. As luciferases dos vagalumes (dos cales hai unhas 2000 especies) e dos insectos Elateroidea en xeral son o suficientemente diversas como para que sexan útiles en estudos de filoxenia molecular. A máis intensamente estudada é a luciferase do vagalume norteamericano Photinus pyralis, que funciona optimamente a un pH de 7,8.[22]
Tamén foi ben estudada a luciferase do cnidario Renilla reniformis. Neste organismo a luciferase (luciferina de Renilla 2-monooxixenase) está intimamente asociada coa proteína de unión á luciferina e cunha proteína fluorescente verde (GFP). O calcio desencadea a liberación da luciferina destes animais (coelenterazina) que estaba unida á proteína de unión á luciferina. O substrato queda despois dispoñible para a oxidación pola luciferase, onde será degradada a coelenteramida dando como resultado a liberación de enerxía. En ausencia de GFP, esta enerxía sería liberada como fotóns de luz azul (cun pico de emisión a unha lonxitude de onda de 482 nm). Porén, en vez diso, debido á GFP intimamente asociada, a emisión de enerxía pola luciferase combínase por medio de transferencia de enerxía de resonancia co fluoróforo da GFP, e é despois liberada como un fotón de luz verde (cun pico de emisión de 510 nm). A reacción catalizada é:[23]
- coelenterazina + O2 → coelenteramida + CO2 + fotón de luz
Foron identificadas recentemente novas luciferases que, a diferenza das de Renilla e do vagalume, son moléculas que se segregan fóra da célula de forma natural. Un deses exemplos é a luciferase de Metridia (MetLuc) que deriva do copépodo mariño Metridia longa. Este copépodo segrega unha luciferase codificada xeneticamente que é unha proteína de 24 kDa que contén un péptido sinal secretor N-terminal de 17 residuos de aminoácidos. Algúns dos beneficios de utilizar en diversos tipos de estudos unha molécula como a MetLuc son o seu protocolo que non prescisa a lise das células, que permite levar a cabo ensaios con células vivas e ensaios múltiples na mesma célula.[24]
Luciferase de dinoflaxelados
A luciferase de dinoflaxelados é unha proteína multidominio específica dos dinoflaxelados, que consta dun dominio N-terminal, e tres dominios catalíticos, cada un dos cales está precedido dun dominio en feixe helicoidal. A estrutura do dominio catalítico da luciferase de dinoflaxelados xa foi resolto.[25] A parte central do dominio é un barril beta de 10 cadeas que é estruturalmente similar ás lipocalinas e á FABP.[25] O dominio N-terminal está conservado entre a luciferase dos dinoflaxelados e as proteínas de unión á luciferina (LBPs). Suxeriuse que esta rexión pode mediar unha interacción entre a LBP e a luciferase ou a súa asociación coa membrana vacuolar.[26] O dominio en feixe helicoidal ten unha estrutura con tres feixes helicoidais que leva catro importantes residuos de histidina que se cre xogan un papel na regulación por pH do encima.[25]
Aplicacións
A luciferase pode producirse no laboratorio por técnicas de enxeñaría xenética para diversos propósitos. Os xenes das luciferases poden ser sintetizados e inseridos en organismos ou transfectados en células. O rato, o verme da seda, e as patacas son só algúns dos organismos que foron xa tratados con enxeñaría xenética para producir esta proteína.[27]
Na reacción da luciferase, emítese luz cando a luciferase actúa sobre o substrato luciferina apropiado. A emisión de fotóns pode detectarse por aparellos sensibles á luz como un luminómetro ou microscopios ópticos modificados. Isto permite a observación de procesos biolóxicos.[28]
En investigacións biolóxicas, a luciferase úsase frecuentemente como un reporter en ensaios da actividade transcricional en células que foron transfectadas cun material xenético preparado que contiña o xene da luciferase baixo o control dunha secuencia dun promotor xénico de interese.[29] Ademais, moléculas proluminescentes que son convertidas en luciferina coa actividade dun determinada encima poden urilizarse para detectar a actividade encimática en ensaios combinados ou de dous pasos da luciferase. Ditos substratos foron usados para detectar a actividade da caspase e o citocromo P450, entre outros.[28][29]
A luciferase pode tamén utilizarse para detectar o nivel de ATP celular en ensaios de viabilidade celular ou en ensaios de actividade de quinases.[29][30] A luciferase pode actuar como unha proteína sensora do ATP por medio da biotinilación. A biotinilación inmobiliza a luciferase na superficie celular ao unila a un complexo estreptavidina-biotina. Isto permite que a luciferase detecte o fluxo de ATP das células e indicará efectivamente a liberación en tempo real de ATP por medio da produción de bioluminescencia.[31] A luciferase pode ademais facerse máis sensible para a detección do ATP incrementando a intensidada da súa bioluminescencia por medio de modificacións xenéticas.[32]
A técnica de obtención de imaxes do animal completo (tanto in vivo coma, menos frecuentemente, ex vivo) é unha potente técnica para estudar poboacións celulares nos animais vivos, como nos ratos.[33] Poden prepararse por enxeñaría xenética diferentes tipos de células (por exemplo, células nai ou troncais da medula ósea ou células T) para que expresen unha luciferase, o que permitirá a súa visualización non invasiva no interior do animal vivo usando unha cámara CCD (charge-couple device). Esta técnica foi utilizada para seguir a evolución da tumoroxénese e a resposta dos tumores ao tratamento en modelos animais.[34][35] Porén, diversos factores ambientais e interferencias terapéuticas poden causar algunhas discrepancias entre a carga tumoral e a intensidade da bioluminescencia producida en relación cos cambios na actividade proliferativa. A intensidade do sinal medido por esta técnica in vivo pode depender de varios factores, como a absorción de D-luciferina a través do peritoneo, fluxo sanguíneo, permeabilidade da membrana celular, dispoñibilidade de cofactores, pH intracelular e transparencia do tecido supraxacente, ademais de da cantidade de luciferase.[36]
A luciferase pode utilizarse nos bancos de sangue para determinar se os glóbulos vermellos están empezando a descompoñerse. A luciferase é unha proteína sensible á calor que se usa en estudos sobre a desnaturalización de proteínas, comprobando as capacidades protectoras das proteínas de shock térmico. Os usos da polimerase continúan ampliándose cada ano.[37]
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
