Ligando de Fas
From Wikipedia, the free encyclopedia
O ligando de Fas (tamén ligando Fas ou FasL ou CD95L ou CD178) é unha proteína transmembrana de tipo II que pertence á familia do factor de necrose tumoral (TNF). Cando se une ao seu receptor (FasR ou Fas) induce a apoptose da célula. As interaccións ligando de Fas/receptor desempeñan un importante papel na regulación do sistema inmunitario e a progresión do cancro. O ligando de Fas está codificado no xene FASLG do cromosoma 1 humano.
| FASLG | |||
|---|---|---|---|
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB
Lista de códigos PDB
| ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Símbolo | FASLG (HGNC: 11936) | ||
| Identificadores externos | |||
| Locus | Cr. 1 q24.3 | ||
| Padrón de expresión de ARNm | |||
 | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
Estrutura
O ligando de Fas ou FasL é unha proteína transmembrana homotrímera de tipo II expresada en linfocitos T citotóxicos. Realiza a súa sinalización por trimerización do FasR, que está situado na membrana da célula diana, atravesándoa. Esta trimerización causa a apoptose ou morte celular.
Xérase tamén un ligando Fas soluble ao clivar o ligando Fas unido a membrana en sitios de clivaxe conservados por acción da metaloproteinase de matriz externa MMP-7.
Receptores
- FasR: O receptor Fas (FasR), ou CD95, é o membro máis estudado da familia do receptor de morte. O seu xene está situado no cromosoma 10 humano. Os informes iniciais identificaran oito variantes de empalme e sete isoformas proteicas, moitas das cales son haplotipos raros xeralmente asociados a doenzas. O receptor Fas indutor da apoptose é a isoforma 1 e trátase dun tipo de proteína transmembrana de tipo 1. Consta de tres pseudorrepeticións ricas en cisteína, un dominio transmembrana e un dominio de morte intracelular.
- DcR3: O receptor reclamo 3 (ou decoy receptor 3, DcR3) é un receptor reclamo recentemente descuberto da superfamilia do factor de necrose tumoral ao que se unen FasL, LIGHT e TL1A. O DcR3 é un receptor soluble que non ten capacidades de transdución de sinais (de aí o seu nome de "reclamo" ou, en inglés, "decoy") e funciona impedindo as interaccións FasR-FasL ao unirse competitivamente ao ligando Fas unido a membrana, o que o fai inactivo.[1]
Sinalización celular
O receptor Fas forma o complexo de sinalización indutor de morte (DISC) ao unirse o seu ligando. O ligando de Fas trímero ancorado a membrana situado na superficie de células adxacentes causa a trimerización do receptor Fas. Este evento pode ser imitado tamén coa unión dun anticorpo agonista de Fas, aínda que algunhas evidencias suxiren que o sinal apoptótico inducido polo anticorpo non é fiable no estudo da sinalizaión de Fas. Para este fin utilízanse en investigación varias maneiras intelixentes de trimerizar o anticorpo in vitro.
Ao ocorrer a agregación do dominio de morte (DD, death domain), o complexo receptor é internalizado pola maquinaria celular de endosomas. Isto permite que a molécula adaptadora chamada dominio de morte asociado a Fas (FADD, Fas-associated death domain) se una ao dominio de morte de Fas por medio do seu propio dominio de morte. FADD tamén contén un dominio efector de morte (DED) preto do seu amino terminal, que facilita a unión do DED do encima FLICE (FADD-like ICE), máis habitualmente denominado caspase-8. FLICE pode despois autoactivarse por clivaxe proteolítica nas subunidades p10 e p18, das cales ambas forman o encima activo heterotetrámero. A caspase-8 activa é despois liberada de DISC ao citosol, onde cliva outras caspases efectoras, o que finalmente causa a degradación do ADN, a formación de ampolas na membrana e outros indicadores de apoptose.

Algúns informes indican que a vía de Fas extrínseca é suficiente para inducir unha apoptose completa en certos tipos de células por medio da ensamblaxe de DISC e a subseguinte activación da caspase-8. Estas células denomínanse células tipo 1 e caracterízanse porque non poden ser protexidas da apoptose mediada por Fas polos membros anitiapoptóticos da familia Bcl-2 (concretamente Bcl-2 e Bcl-xL). Son células de tipo 1 as H9, CH1, SKW6.4 e SW480, todas as cales son liñaxes de linfocitos, agás a última que é unha liñaxe de adenocarcinoma de colon.
Hai evidencias de interferencias entre as vías extrínseca e intrínseca na fervenza de sinais de Fas. Na maioría dos tipos celulares, a caspase-8 cataliza a clivaxe da proteína proapoptótica de tipo só BH3 Bid á súa forma truncada, tBid. Os membros de tipo só BH-3 da familia Bcl-2 interaccionan exclusivamente con membros antiapoptóticos da familia (Bcl-2, Bcl-xL), o que permite que Bak e Bax se transloquen á membrana mitocondrial externa, o que causa a súa permeabilización e facilita a liberación de proteínas como o citocromo c e Smac/DIABLO, un antagonista de inhibidores de proteínas apoptóticas (IAPs).
O FasL soluble é menos activo que o unido a membranas e non induce a trimerización do receptor e a formación de DISC.
Funcións
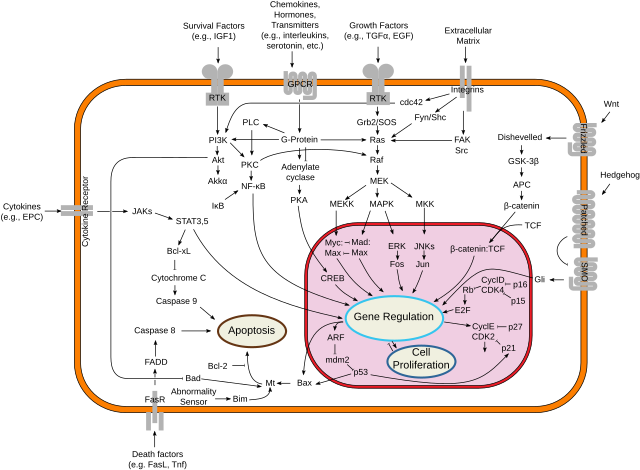
A apoptose orixinada pola unión do ligando de Fas ao receptor Fas exerce un papel fundamental na regulación do sistema inmunitario. As súas funcións inclúen:
- Homeostase de células T: a activación de células T fai que expresen o ligando de Fas. As células T son inicialmente resistentes á apoptose mediada por Fas durante a súa expansión clonal, pero fanse progresivamene máis sensibles conforme levan máis tempo activadas, o que finalmente ten como resultado a súa morte celular inducida por activación (AICD). Este proceso é necesario para impedir unha resposta inmune excesiva e eliminar células T autorreactivas. Os humanos e ratos con mutacións deletéreas de Fas ou do ligando de Fas desenvolven unha acumulación de células T aberrantes, que causan linfoadenopatía, esplenomegalia e lupus eritematoso.
- Actividade de células T citotóxicas: a apoptose inducida por Fas e a vía das perforinas son os dous grandes mecanismos polos calses os linfocitos T citotóxicos inducen a morte celular nas células que expresan antíxenos alleos.[2]
- Privilexio inmunitario: as células en áreas privilexiadas inmunitariamente como a córnea ou o testículo expresan o ligando de Fas e inducen a apoptose de linfocitos que se infiltran. É un dos moitos mecanismos que o corpo emprega no establecemento e mantemento do privilexio inmunitario.
- Tolerancia materna: o ligando de Fas pode ser instrumental na prevención do tráfico de leucocitos entre a nai e o feto durante o embarazo, aínda que polo momento non se atribuíron defectos no embarazo a un sistema defectuoso FasR-FasL.
- Contraataque de tumores: os tumores poden sobreexpresar o ligando de Fas e inducir a apoptose de linfocitos infiltrantes, o que permite que o tumor escape aos efectos dunha resposta inmunitaria.[3] A regulación á alza do ligando de Fas ocorre a miúdo despois dunha quimioterapia, da cal as células tumorais adquiriron resistencia á apoptose.
Papel en enfermidades
A apoptose defectiva mediada por Fas pode orixinar oncoxénese e resistencia a fármacos en tumores existentes. Unha mutación de liña xerminal de Fas está asociada coa síndrome linfoproliferativa autoinmune (ALPS), un trastorno da apoptose infantil.
O incremento da sinalización mediada por Fas foi implicada na patoloxía das síndromes mielodisplásticas de baixo risco[4] e no glioblastoma.[5]
Máis recentemente, tamén se suxeriu que a apoptose mediada por FasL de células T é un mecanismo inmunoevasivo polo cal os tumores poden suprimir a infiltración de células T similar aos puntos de control inmunes inhibitorios como PD-1 e CTLA-4.[6][7][8]
Importancia clínica
As razóns terapéuticas para a supresión da sinalización de Fas no contexto do glioblastoma e síndromes mielodisplásticas levaron ao desenvolvemento da proteína que bloquea FasL asunercept (APG101), que está actualmente en desenvolvemento clínico para estas aplicacións.[9]
Interaccións
FasL presenta interaccións con:
Notas
Véxase tamén
Wikiwand - on
Seamless Wikipedia browsing. On steroids.
